Феррицианид калия

| |
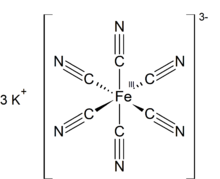
| |
| Имена | |
|---|---|
| Название ИЮПАК
Гексацианоферрат(III) калия
| |
| Другие имена
Красный прусат Поташа,
прусский красный, Феррицианид калия | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.033.916 |
| Номер ЕС |
|
| 21683 | |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| К 3 [Fe(CN) 6 ] | |
| Молярная масса | 329.24 g/mol |
| Появление | кристаллы темно-красного цвета, иногда мелкие гранулы, порошок от оранжевого до темно-красного цвета. |
| Плотность | 1,89 г/см 3 , твердый |
| Температура плавления | 300 ° С (572 ° F; 573 К) |
| Точка кипения | разлагается |
| 330 г/л («холодная вода») 464 г/л (20 °С) 775 г/л («горячая вода») [ 1 ] | |
| Растворимость | мало растворим в спирте растворим в кислоте растворим в воде |
| +2290.0·10 −6 см 3 /моль | |
| Структура | |
| моноклинический | |
| октаэдрический в Fe | |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| Х302 , Х315 , Х319 , Х332 , Х335 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P312 , P304+P340 , P305+P351+P338 , P312 , P321 , P330 , P332+P313 , P337 +P313 , P362 , P403+ П233 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
2970 мг/кг (мыши, перорально) |
| Паспорт безопасности (SDS) | Паспорт безопасности |
| Родственные соединения | |
Другие анионы
|
Ферроцианид калия |
Другие катионы
|
берлинская лазурь |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |

Феррицианид калия представляет собой химическое соединение с формулой K 3 [Fe(CN) 6 ]. Эта ярко-красная соль содержит октаэдрически координированный [Fe(CN) 6 ] 3− ион. [ 2 ] Он растворим в воде, и его раствор демонстрирует некоторую зелено-желтую флуоресценцию . Его открыл в 1822 году Леопольд Гмелин . [ 3 ] [ 4 ]
Подготовка
[ редактировать ]Феррицианид калия получают путем пропускания хлора через раствор калия ферроцианида . Феррицианид калия выделяется из раствора:
- 2 K 4 [Fe(CN) 6 ] + Cl 2 → 2 K 3 [Fe(CN) 6 ] + 2 KCl
Структура
[ редактировать ]Как и другие цианиды металлов, твердый феррицианид калия имеет сложную полимерную структуру. Полимер состоит из октаэдрических [Fe(CN) 6 ] 3− центры, сшитые K + ионы, связанные с лигандами CN . [ 5 ] К + ---Связи NCFe разрываются при растворении твердого вещества в воде.
Приложения
[ редактировать ]Это соединение также используется для закалки железа и стали , при гальванике , окраске шерсти , в качестве лабораторного реагента и в качестве мягкого окислителя в органической химии .
Фотография
[ редактировать ]Чертеж, цианотипия, тонер
[ редактировать ]Соединение широко используется в чертежах и фотографии ( процесс цианотипии ). Некоторые процессы тонирования фотоотпечатков включают использование феррицианида калия. Его часто используют в качестве мягкого отбеливателя в концентрации 10 г/л для уменьшения плотности пленки или печати.
Отбеливание
[ редактировать ]Феррицианид калия использовался в качестве окислителя для удаления серебра с цветных негативов и позитивов во время обработки (процесс, называемый отбеливанием). Поскольку отбеливатели на основе феррицианида калия вредны для окружающей среды, недолговечны и способны выделять газообразный цианистый водород при смешивании с высокими концентрациями и объемами кислоты, отбеливатели с использованием ЭДТА железа использовались при обработке цвета с момента внедрения в 1972 году процесса Kodak C-41. . В цветной литографии феррицианид калия используется для уменьшения размера цветных точек без уменьшения их количества, как своего рода ручная цветокоррекция, называемая точечным травлением.
Редуктор фермера
[ редактировать ]Феррицианид также используется в черно-белой фотографии вместе с тиосульфатом натрия (гипо) для уменьшения плотности негатива или серебряно-желатинового отпечатка , где смесь известна как восстановитель Фармера; это может помочь компенсировать проблемы, связанные с переэкспонированием негатива, или сделать светлые участки отпечатка ярче. [ 6 ]
Реагент в органическом синтезе
[ редактировать ]Феррицианид калия используется в качестве окислителя в органической химии. [ 7 ] [ 8 ] Это окислитель для регенерации катализатора в дигидроксилировании по Шарплессу . [ 9 ] [ 10 ]
Датчики и индикаторы
[ редактировать ]Феррицианид калия также является одним из двух соединений, присутствующих в индикаторном растворе ферроксила (наряду с фенолфталеином ), которое становится синим ( берлинская лазурь ) в присутствии Fe. 2+ ионы, и поэтому их можно использовать для обнаружения окисления металлов, которое приводит к ржавчине. Можно подсчитать количество молей Fe 2+ ионы с помощью колориметра из-за очень интенсивного цвета берлинской лазури .
В физиологических экспериментах феррицианид калия позволяет повысить окислительно-восстановительный потенциал раствора (Е°' ~ 436 мВ при рН 7). По существу, он может окислять восстановленный цитохром с (Е°' ~ 247 мВ при рН 7) в изолированных митохондриях. дитионит натрия В таких экспериментах в качестве восстановителя обычно используется (E ° '~ -420 мВ при pH 7).
Феррицианид калия используется для определения потенциала восстановительной способности образца (экстракта, химического соединения и т. д.). [ 11 ] Такое измерение используется для определения антиоксидантных свойств образца.
Феррицианид калия является компонентом амперометрических биосенсоров в качестве агента переноса электронов , заменяющего естественный агент переноса электронов фермента, такой как кислород , например, на фермент глюкозооксидазу . Он входит в состав имеющихся в продаже глюкометров , предназначенных для диабетиков .
Другой
[ редактировать ]Феррицианид калия смешивают с гидроксидом калия (или гидроксидом натрия в качестве заменителя) и водой для получения травителя Мураками. Этот травитель используется металлографами для обеспечения контраста между фазами связующего и карбида в твердых сплавах.
берлинская лазурь
[ редактировать ]Берлинская лазурь , темно-синий пигмент в синей печати, образуется в результате реакции K 3 [Fe(CN) 6 ] с железом (Fe 2+ ) ионы, а также K 4 [Fe(CN) 6 ] с солями железа. [ 12 ]
В гистологии феррицианид калия используется для обнаружения двухвалентного железа в биологических тканях. Феррицианид калия реагирует с двухвалентным железом в кислом растворе с образованием нерастворимого синего пигмента, обычно называемого синим Тернбулла или берлинской лазурью . Для обнаружения железа (Fe 3+ ) вместо железа ферроцианид используется в методе окрашивания берлинской лазурью калия . [ 13 ] Материал, образующийся в реакции Тернбулла с синим, и соединение, образующееся в реакции берлинской лазури, одинаковы. [ 14 ] [ 15 ]
Безопасность
[ редактировать ]Феррицианид калия малотоксичен, его основная опасность заключается в том, что он вызывает легкое раздражение глаз и кожи. Однако в очень сильнокислых условиях выделяется высокотоксичный газообразный цианистый водород согласно уравнению:
- 6 ч. + + [Fe(CN) 6 ] 3− → 6 HCN + Fe 3+ [ 16 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Квонг, Х.-Л. (2004). «Феррицианид калия» . В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X . hdl : 10261/236866 . ISBN 9780471936237 .
- ^ Шарп, AG (1976). Химия цианокомплексов переходных металлов . Лондон: Академическая пресса.
- ^ Гмелин, Леопольд (1822). «Об особом цианате калия-железа и о новом ряду солей железа циановой кислоты». Журнал химии и физики (на немецком языке). 34 : 325–346.
- ^ Иде, AJ (1984). Развитие современной химии (2-е изд.). Нью-Йорк: Dover Publications. п. 153.
- ^ Фиггис, Б.Н.; Герлох, М.; Мейсон, Р. (1969). «Кристаллография и парамагнитная анизотропия феррицианида калия». Труды Лондонского королевского общества. А. Математические и физические науки . 309 (1496): 91–118. Бибкод : 1969RSPSA.309...91F . дои : 10.1098/rspa.1969.0031 . S2CID 96689342 .
- ^ Штребель, Л.; Закиа, Р.Д. (1993). «Фермерский редуктор» . Фокальная энциклопедия фотографии . Фокальная пресса. п. 297. ИСБН 978-0-240-51417-8 .
- ^ Прилл, Э.А.; МакЭлвейн, С.М. (1935). «1-Метил-2-Пиридон». Органические синтезы . 15:41 . дои : 10.15227/orgsyn.015.0041 .
- ^ Вюрфель, Хендрик; Якоби, Дёрте (2018). «Синтез замещенных 2-цианобензотиазолов» . Органические синтезы . 95 : 177–191. дои : 10.15227/orgsyn.095.0177 .
- ^ Гонсалес, Хавьер; Ауригемма, Кристина; Трусдейл, Ларри (2002). «Синтез (+)-(1S,2R)- и (-)-(1R,2S) -транс -2-фенилциклогексанола посредством асимметричного дигидроксилирования Шарплесса (AD)». Органические синтезы . 79 : 93. дои : 10.15227/orgsyn.079.0093 .
- ^ Эй, Рю; Шарплесс, К. Барри (1996). «3-[(1S)-1,2-Дигидроксиэтил]-1,5-Дигидро-3H-2,4-бензодиоксепин». Органические синтезы . 73 : 1. дои : 10.15227/orgsyn.073.0001 .
- ^ Накадзима, Ю., Сато, Ю., и Кониси, Т. (2007). Антиоксидантные малые фенольные ингредиенты в Inonotus obliquus (человек) Пилат (Чага). Химический и фармацевтический бюллетень, 55 (8), 1222–1276.
- ^ Данбар, КР; Хайнц, Р.А. (1997). «Химия цианистых соединений переходных металлов: современные перспективы». Прогресс неорганической химии . Прогресс неорганической химии. Том. 45. стр. 283–391. дои : 10.1002/9780470166468.ch4 . ISBN 9780470166468 .
- ^ Карсон, Флорида (1997). Гистотехнология: текст для самообучения (2-е изд.). Чикаго: Американское общество клинических патологов. стр. 209–211. ISBN 978-0-89189-411-7 .
- ^ Тафесс, Ф. (2003). «Сравнительные исследования берлинской лазури или диакватетраамина-кобальта (III), способствующих гидролизу 4-нитрофенилфосфата в микроэмульсиях» (PDF) . Международный журнал молекулярных наук . 4 (6): 362–370. дои : 10.3390/i4060362 .
- ^ Вердагер, М.; Гальвез, Н.; Гард, Р.; Депланш, К. (2002). «Электроны за работой в аналогах берлинской голубой» (PDF) . Интерфейс электрохимического общества . 11 (3): 28–32. дои : 10.1002/chin.200304218 .
- ^ «Паспорт безопасности для феррицианида калия» (PDF) .
Дальнейшее чтение
[ редактировать ]- Изучение окислительно-восстановительной реакции феррицианида с помощью потенциостата. Влияние различных параметров с помощью циклической вольтамперометрии.
