Эндоплазматический ретикулум
| Клеточная биология | |
|---|---|
| Диаграмма животных | |
 Компоненты типичной животной клетки:
|

Эндоплазматический ретикулум ( ER ) является частью транспортной системы эукариотической клетки и имеет много других важных функций, таких как складывание белка . Это тип органелл, состоящей из двух субъединиц - грубой эндоплазматический ретикулум ( RER ) и гладкий эндоплазматический ретикулум ( SER ). Эндоплазматический ретикулум обнаруживается в большинстве эукариотических клеток и образует взаимосвязанную сеть сплющенных мембранных мешков, известных как цистерна (в RER), и трубчатые структуры в Ser. Мембраны ER непрерывны с внешней ядерной мембраной . Эндоплазматический ретикулум не обнаружен в эритроцитах или сперматозоиде .
Два типа ER имеют много одинаковых белков и участвуют в определенных общих активности, таких как синтез определенных липидов и холестерин . Различные типы клеток содержат различные отношения двух типов ER в зависимости от активности клетки. RER находится в основном в направлении ядра клетки и Ser по направлению к клеточной мембране или плазматической мембране клетки.
Внешняя ( цитозольная ) лицо RER усеяна рибосомами , которые являются местами синтеза белка . RER особенно заметен в таких клетках, как гепатоциты . У SER отсутствует рибосомы и функции в липидов синтезе , но не метаболизм , выработку стероидных гормонов и детоксикацию . [ 1 ] SER особенно распространен в клетках печени млекопитающих и гонады .
ER наблюдал с помощью световой микроскопии Гарнье в 1897 году, который придумал термин эргастоплазму . [ 2 ] [ 3 ] Кругинистые мембраны эндоплазматической ретикулумы впервые были замечены с помощью электронной микроскопии в 1945 году Кейтом Р. Портером , Альбертом Клодом и Эрнестом Ф. Фулэмом. [ 4 ] Позже слово «ретикулум », что означает «сеть», было применено Портером в 1953 году для описания этой ткани мембран. [ 5 ]
Структура
[ редактировать ]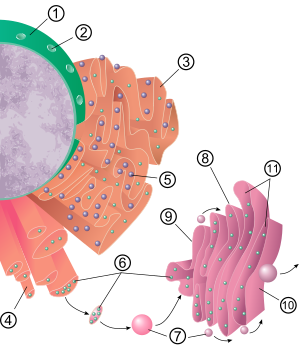

Общая структура эндоплазматической ретикулумы представляет собой сеть мембран, называемых цистернами . Эти мешкоподобные структуры удерживаются вместе цитоскелетом . Мембрана фосфолипидов охватывает цистернальное пространство (или просвет), которое непрерывно с перинуклеарным пространством , но отделено от цитозоля . Функции эндоплазматической ретикулумы можно обобщить как синтез и экспорт белков и мембранных липидов, но варьируются между ER и клеточным типом и функцией клеток. Количество как шероховатого, так и гладкого эндоплазматического ретикулума в клетке может медленно обменять от одного типа к другому, в зависимости от изменяющейся метаболической активности клетки. Трансформация может включать введение новых белков в мембрану, а также структурные изменения. Изменения в содержании белка могут произойти без заметных структурных изменений. [ 6 ] [ 7 ]
Грубая эндоплазматическая ретикулума
[ редактировать ]
Поверхность грубой эндоплазматической ретикулумы (часто сокращенного RER или грубых ER ; также называемый гранулированным эндоплазматическим ретикулумом ) оснащены белковыми рибосомами, которые придают ему «грубый» внешний вид (отсюда и его название). [ 8 ] Сайт связывания рибосомы на шероховатой эндоплазматической ретикулуме является транс -транконом . [ 9 ] Тем не менее, рибосомы не являются стабильной частью структуры этой органеллы, поскольку они постоянно связаны и высвобождаются из мембраны. Рибосома связывается с RER только когда-то, когда в цитозоле образуется специфический комплекс белковой нуклеиновой кислоты. Этот специальный комплекс формирует, когда свободная рибосома начинает транслировать мРНК секреторного белка, предназначенного для пути . [ 10 ] Первые 5–30 аминокислотных полимеризованных кодируют сигнальный пептид , молекулярное послание, которое распознается и связано с частицей распознавания сигнала (SRP). Перевод пауза, а рибосомный комплекс связывается с транс -транкозоном RER , где трансляция продолжается с зарождающимся (новым) белком, образующимся в просвет RER и/или мембрану. Белок обрабатывается в просвете ER ферментом (сигнальной пептидазой ), которая удаляет сигнальный пептид. Рибосомы в этот момент могут быть высвобождены обратно в цитозоль; Однако, как известно, не трансляционные рибосомы остаются связанными с транкосонами. [ 11 ]
Мембрана грубой эндоплазматической ретикулумы в форме больших двойных мембранных листов, которые расположены рядом и непрерывно с внешним слоем ядерной оболочки . [ 12 ] Двойные мембранные листы сложены и соединены через несколько правых или левша спиральных рампов, «пандусов Terasaki», что дает структуру, напоминающую гараж . [ 13 ] [ 14 ] Хотя непрерывной мембраны между эндоплазматическим ретикулумом и аппаратом Гольджи , мембрановые транспортные пузырьковые белки между этими двумя компартментами. [ 15 ] Везикулы окружены белками покрытия, называемых Copi и Copii. COPII нацелен на везикул в аппарат Гольджи, а COPI отмечает их, чтобы они были возвращены к грубой эндоплазматической ретикулуме. Грубая эндоплазматическая ретикулума работает совместно с комплексом Гольджи, чтобы нацелиться на новые белки на их правильные направления. Второй метод транспортировки из эндоплазматической ретикулума включает в себя области, называемые мембранными сайтами контактов , где мембраны эндоплазматического ретикулума и других органеллов находятся близко друг к другу, что позволяет переносить липиды и другие мелкие молекулы. [ 16 ] [ 17 ]
Грубая эндоплазматическая ретикулума является ключом в нескольких функциях:
- Производство лизосомальных ферментов с маннозо-6-фосфатным маркером, добавленным в сети цис -Гольджи. [ 18 ]
- Производство секретируемых белков, либо секретируемые конститутивно без метки, либо секретируемое регуляторным образом с участием клатрина и парных основных аминокислот в пептиде сигнала .
- Интегральные мембранные белки , которые остаются встроенными в мембрану, когда везикулы выходят и связываются с новыми мембранами. Rab -белки являются ключевыми в нацеливании на мембрану; Белки Snap и Snare являются ключевыми в событии Fusion.
- Первоначальное гликозилирование в качестве сборки продолжается. Это n-связанного (O-связывание происходит в Гольджи).
Гладкая эндоплазматическая ретикулума
[ редактировать ]
В большинстве клеток гладкий эндоплазматический ретикулум (сокращенно Ser ) мало. Вместо этого есть области, где ER частично гладкий и частично грубый, эта область называется переходной ER. Переходной ER получает свое название, потому что он содержит ER выхода. Это области, где транспортные везикулы, которые содержат липиды и белки, сделанные в ER, отсоединяются от ER и начинают перемещаться в аппарат Гольджи . Специализированные клетки могут иметь много гладкого эндоплазматического ретикулума, и в этих клетках гладкий ER имеет много функций. [ 6 ] Он синтезирует липиды , фосфолипиды , [ 19 ] [ 20 ] [ 21 ] и стероиды . Клетки, которые выделяют эти продукты, такие как в яичках , яичниках и сальных железах , имеют обилие гладкого эндоплазматического ретикулума. [ 22 ] Он также проводит метаболизм углеводов, детоксикацию естественных продуктов метаболизма и алкоголя и лекарств, прикрепление рецепторов к белкам клеточной мембраны и метаболизм стероидов . [ 23 ] В мышечных клетках он регулирует ионов кальция концентрацию . Гладкий эндоплазматический ретикулум обнаруживается в различных типах клеток (как животных, так и растений), и он выполняет различные функции в каждом. Гладкий эндоплазматический ретикулум также содержит фермент глюкозо-6-фосфатазу , которая преобразует глюкозо-6-фосфат в глюкозу, этап глюконеогенеза . Он связан с ядерной оболочкой и состоит из канальцев, расположенных рядом с периферией клеток. Эти трубки иногда образуют сеть, которая по внешнему виду. [ 12 ] В некоторых клетках существуют расширенные области, такие как мешки грубой эндоплазматической ретикулумы. Сеть гладкой эндоплазматической ретикулумы позволяет посвятить увеличенную площадь поверхности действию или хранение ключевых ферментов и продуктов этих ферментов. [ Цитация необходима ]
Саркоплазматический ретикулум
[ редактировать ]
Саркоплазматический ретикулум (SR), от греческого σάρξ SARX («плоть»), гладкий ER встречается в мышечных клетках . Единственная структурная разница между этой органеллой и гладкой эндоплазматической ретикулумом - это состав белков, которые они имеют, как связаны с их мембранами, так и дрейфы в пределах их люменов. Это фундаментальное различие указывает на их функции: эндоплазматический ретикулум синтезирует молекулы, в то время как саркоплазматический ретикулум хранит ионы кальция и выкачивает их в саркоплазму, когда стимулируется мышечное волокно. [ 24 ] [ 25 ] После их освобождения от саркоплазматической ретикулумы ионы кальция взаимодействуют с сократимыми белками, которые используют АТФ для сокращения мышечного волокна. Саркоплазматический ретикулум играет важную роль в соединении по борьбе с возбуждением . [ 26 ]
Функции
[ редактировать ]Эндоплазматический ретикулум выполняет много общих функций, включая складывание белковых молекул в мешках, называемых цистернами , и транспортировку синтезированных белков в везикулах в аппарат Гольджи . Грубая эндоплазматическая ретикулума также участвует в синтезе белка. Правильное складывание вновь изготовленных белков стало возможным благодаря нескольким эндоплазматическим шаперона белкам ретикулума, включая белковую дисульфидную изомеразу (PDI), ERP29, HSP70 член члена семейства , BIP/GRP78 , кальнексин , кальретикулин и семейство пептидилпролила изомерезы. Только правильно сложенные белки транспортируются из шероховатого ER в аппарат Гольджи - развернутые белки вызывают развернутый белковый ответ в качестве стрессового ответа в ER. Нарушения при окислительно -восстановительной регуляции, регуляции кальция, депривации глюкозы и вирусной инфекции [ 27 ] или чрезмерная экспрессия белков [ 28 ] может привести к реакции на стресс -эндоплазматического ретикулума (ER стресс), состояние, в котором складывание белков замедляется, что приводит к увеличению развернутых белков . Этот стресс становится потенциальной причиной повреждения при гипоксии/ишемии, резистентности к инсулину и другим расстройствам. [ 29 ]
Протеиновый транспорт
[ редактировать ]Секреторные белки, в основном гликопротеины , перемещаются через мембрану эндоплазматической ретикулумы. Белки, которые транспортируются эндоплазматической ретикулумом по всей клетке, отмечены меткой адреса, называемой сигнальной последовательности . N-конце (один конец) полипептидной цепи (то есть белка) содержит несколько аминокислот , которые работают в качестве тега адреса, которые удаляются, когда полипептид достигает своего пункта назначения. Зарождающиеся пептиды достигают ER через транспортный , встроенный мембрана мультипротеиновый комплекс. Белки, которые предназначены для мест за пределами эндоплазматической ретикулумы, упакованы в транспортные везикулы и перемещаются вдоль цитоскелета к месту назначения. В фибробластах человека ER всегда совместно распределен с микротрубочками, а деполимеризация последних вызывает его совместную агрегацию с митохондриями, которые также связаны с ER. [ 30 ]
Эндоплазматический ретикулум также является частью пути сортировки белка. По сути, это транспортная система эукариотической клетки. Большинство его резидентных белков сохраняются в нем с помощью мотива удержания . Этот мотив состоит из четырех аминокислот в конце белковой последовательности. Наиболее распространенными последовательностями удерживания являются KDEL для белков, расположенных на просвете и KKXX для трансмембранных белков. [ 31 ] Тем не менее, различия KDEL и KKXX действительно происходят, а другие последовательности также могут привести к удержанию эндоплазматической ретикулумы. Неизвестно, может ли такой вариант привести к подэразациям. В клетках млекопитающих имеется три KDEL ( 1 , 2 и 3 ) рецепторы, и они имеют очень высокую степень идентичности последовательности. Функциональные различия между этими рецепторами еще предстоит установить. [ 32 ]
Биоэнергетика регулирование ER ATP -поставки с помощью механизма Caatier
[ редактировать ]
Эндоплазматический ретикулум не содержит механизма АТФ-регистрации и, следовательно, требует импорта АТФ из митохондрий. Импортированный АТФ имеет жизненно важное значение для ER для выполнения своего дома, поддерживающего клеточные функции, например, для складывания белка и переноса. [ 33 ]
ER ATP Transporter, SLC35B1/Axer, был недавно клонирован и охарактеризован, [ 34 ] и митохондрии поставляют ATP в ER через CA 2+ -Оангонизированный транспорт в механизм ER ( Caatier ). [ 35 ] Механизм каатери показывает чувствительность к цитозольной CA 2+ в диапазоне от высокого NM до низкого диапазона мкм, с CA 2+ -Ссенсирующий элемент еще предстоит идентифицировать и подтвердить. [ 36 ]
Клиническое значение
[ редактировать ]Увеличение и супрафизиологический ER -стресс в β -клетках поджелудочной железы нарушает нормальную секрецию инсулина, что приводит к гиперинсулинемии [ 37 ] и, следовательно, периферическая резистентность к инсулину, связанную с ожирением у людей. [ 38 ] Клинические испытания на людях также предположили причинно-следственную связь между индуцированным ожирением увеличения секреции инсулина и периферической резистентности к инсулину. [ 39 ]
Аномалии в XBP1 приводят к повышенной реакции на стресс с ретикулумом и впоследствии вызывает более высокую чувствительность к воспалительным процессам, которые могут даже способствовать болезни Альцгеймера . [ 40 ] В толстой кишке аномалии XBP1 были связаны с воспалительными заболеваниями кишечника, включая болезнь Крона . [ 41 ]
Развернутый белковый ответ (UPR) представляет собой реакцию клеточного стресса, связанную с эндоплазматической ретикулумом. [ 42 ] UPR активируется в ответ на накопление развернутых или неправильно свернутых белков в просвете эндоплазматической ретикулумы. UPR функционирует, чтобы восстановить нормальную функцию клетки, останавливая трансляцию белка , разлагая неправильно свернутые белки и активируя сигнальные пути, которые приводят к увеличению продукции молекулярных шаперонов , участвующих в складывании белка . Устойчивая перегрузка UPR была вовлечена в прионные заболевания, а также в нескольких других нейродегенеративных заболеваниях , и ингибирование UPR может стать лечением для этих заболеваний. [ 43 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Эндоплазматический ретикулум (грубая и гладкая)» . Британское общество клеточной биологии. Архивировано с оригинала 24 ноября 2015 года . Получено 21 ноября 2015 года .
- ^ Garnier, C. (1897). «Базальные филаменты железистых клеток. Предварительная заметка» . Анатомическая библиография . 5 : 278–289. OCLC 493441682 .
- ^ Буват Р. (1963). «Электронная микроскопия протоплазмы растений». Международный обзор цитологии Том 14 . Тол. 14. С. 41–155. doi : 10.1016/s0074-7696 (08) 60021-2 . ISBN 978-0-12-364314-8 Полем PMID 14283576 .
- ^ Портер К.Р., Клод А., Фулм Эф (март 1945 г.). «Изучение клеток культуры тканей с помощью электронной микроскопии: методы и предварительные наблюдения» . Журнал экспериментальной медицины . 81 (3): 233–46. doi : 10.1084/jem.81.3.233 . PMC 2135493 . PMID 19871454 .
- ^ Портер КР (май 1953). «Наблюдения на субмикроскопическом базофильном компоненте цитоплазмы» . Журнал экспериментальной медицины . 97 (5): 727–50. doi : 10.1084/jem.97.5.727 . PMC 2136295 . PMID 13052830 .
- ^ Jump up to: а беременный Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки (4 -е изд.). Нью -Йорк: Гарлендская наука. ISBN 978-0-8153-3218-3 Полем Архивировано из оригинала 2017-10-03.
- ^ Купер Г.М. (2000). Клетка: молекулярный подход (2 -е изд.). Вашингтон (округ Колумбия): ASM Press. ISBN 978-0-87893-106-4 .
- ^ "Reticulum" . Свободный словарь .
- ^ Görlich D, Prehn S, Hartmann E, Kalies Ku, Rapoport TA (октябрь 1992). «Гомолог млекопитающих SEC61P и SECYP связан с рибосомами и зарождающимися полипептидами во время транслокации». Клетка . 71 (3): 489–503. doi : 10.1016/0092-8674 (92) 90517-g . PMID 1423609 . S2CID 19078317 .
- ^ Lodish H, et al. (2003). Молекулярная клеточная биология (5 -е изд.). WH Freeman. С. 659–666 . ISBN 978-0-7167-4366-8 .
- ^ Seiser RM, Nickitta CV (октябрь 2000 г.). «Судьба мембранных рибосомов после завершения синтеза белка» . Журнал биологической химии . 275 (43): 33820–7. doi : 10.1074/jbc.m004462200 . PMID 10931837 .
- ^ Jump up to: а беременный Shibata Y, Voeltz GK, Rapoport TA (август 2006 г.). «Грубые листы и гладкие канальцы» . Клетка . 126 (3): 435–9. doi : 10.1016/j.cell.2006.07.019 . PMID 16901774 . S2CID 16107069 .
- ^ Terasaki M, Shemesh T, Kasthuri N, Klemm RW, Schalek R, Hayworth KJ, Hand AR, Yankova M, Huber G, Lichtman JW, Rapoport TA, Kozlov MM (июль 2013 г.). «Сложные листы эндоплазматической ретикулумы соединены с помощью геликоидальных мембранных мотивов» . Клетка . 154 (2): 285–96. doi : 10.1016/j.cell.2013.06.031 . PMC 3767119 . PMID 23870120 .
- ^ Guven J, Huber G, Valencia DM (октябрь 2014 г.). «Спиральные пандусы Terasaki в грубой эндоплазматической ретикулуме». Письма о физическом обзоре . 113 (18): 188101. Bibcode : 2014phrvl.113r8101g . doi : 10.1103/physrevlett.113.188101 . PMID 25396396 .
- ^ Эндоплазматический ретикулум. (ND). МакГроу-Хилл Энциклопедия науки и техники . Получено 13 сентября 2006 г. с веб -сайта Answers.com: «Ответы - самое надежное место для ответа на вопросы жизни» . Ответы.com . Архивировано из оригинала 2006-11-16 . Получено 2006-09-13 .
- ^ Левин Т (сентябрь 2004 г.). «Краткое диапазон внутриклеточного переноса мелких молекул через соединения эндоплазматической ретикулум». Тенденции в клеточной биологии . 14 (9): 483–90. doi : 10.1016/j.tcb.2004.07.017 . PMID 15350976 .
- ^ Левин Т., Лоуэн С (август 2006 г.). «Мембраны межорганелле мембранные сайты: через стекло, мрачно». Современное мнение в клеточной биологии . 18 (4): 371–8. doi : 10.1016/j.ceb.2006.06.011 . PMID 16806880 .
- ^ Чавал, Томислав; Чжу, Цзин; Тянь, Вейхуа; Реммельцвал, Санне; Ян, Чжан; Клаузен, Хенрик; Хек, Альберт-младший (2019-01-01). «Целевой анализ лизосомальных направленных белков и их сайтов маннозы-6-фосфатной модификации*[s]» . Молекулярная и клеточная протеомика . 18 (1): 16–27. doi : 10.1074/mcp.ra118.000967 . ISSN 1535-9476 . PMC 6317476 . PMID 30237200 .
- ^ Канан, Мутукумар; Лахири, Сужой; Лю, Ли-Ка; Чоудхари, винет; Принц, Уильям А. (март 2017 г.). «Синтез фосфатидилсерина на участках контакта мембраны способствует его транспортировке из ER» . Журнал липидных исследований . 58 (3): 553–562. doi : 10.1194/jlr.m072959 . PMC 5335585 . PMID 28119445 .
- ^ Канан, Мутукумар; Riekhof, Wayne R.; Волькер, Деннис Р. (февраль 2015 г.). «Транспорт фосфатидилсерина из эндоплазматической ретикулумы в местопоточное место фосфатидилсериновой декарбоксилазы2 у дрожжей: перенос фосфатидилсерина в локус PSD2P». Трафик . 16 (2): 123–134. doi : 10.1111/tra.12236 . PMID 25355612 . S2CID 34302 .
- ^ Фридман, Джонатан Р.; Канан, Мутукумар; Тулмей, Александр; Ян, Кэлвин Х.; Вайсман, Джонатан С.; Принц, Уильям А.; Нуннари, Джоди (январь 2018 г.). «Липидный гомеостаз поддерживается двойным нацеливанием фермента биосинтеза митохондриального биосинтеза PE в ER» . Ячейка развития . 44 (2): 261–270.e6. doi : 10.1016/j.devcel.2017.11.023 . PMC 5975648 . PMID 29290583 .
- ^ «Функции гладкого ER». Университет Миннесоты Дулут.
- ^ Maxfield FR, Wüstner D (октябрь 2002 г.). «Внутриклеточный транспорт холестерина» . Журнал клинических исследований . 110 (7): 891–8. doi : 10.1172/jci16500 . PMC 151159 . PMID 12370264 .
- ^ Toyoshima C, Nakasako M, Nomura H, Ogawa H (июнь 2000 г.). «Кристаллическая структура кальциевого насоса саркоплазматического ретикулума при 2,6 разрешении». Природа . 405 (6787): 647–55. Bibcode : 2000natur.405..647t . doi : 10.1038/35015017 . PMID 10864315 . S2CID 4316039 .
- ^ Гудман С.Р. (2007-11-26). Медицинская клеточная биология (3 -е изд.). Академическая пресса. п. 69. ISBN 9780080919317 .
- ^ Martini F, Nath J, Bartholomew E (2014). Основы анатомии и физиологии (10 -е изд.). Пирсон. ISBN 978-0321909077 .
- ^ Xu C, Bailly-Maitre B, Reed JC (октябрь 2005 г.). «Стресс эндоплазматического ретикулума: решения клеточной жизни и смерти» . Журнал клинических исследований . 115 (10): 2656–64. doi : 10.1172/jci26373 . PMC 1236697 . PMID 16200199 .
- ^ Kober L, Zehe C, Bode J (октябрь 2012 г.). «Разработка новой системы отбора на основе стресса для выделения высокопродуктивных клонов». Биотехнология и биоинженерия . 109 (10): 2599–611. doi : 10.1002/bit.24527 . PMID 22510960 . S2CID 25858120 .
- ^ Ozcan U, Cao Q, Yilmaz E, Lee AH, Iwakoshi NN, Ozdelen E, Tuncman G, Görgün C, Glimcher LH, Hotamisligil GS (октябрь 2004 г.). «Стресс эндоплазматического ретикулума связывает ожирение, действие инсулина и диабет 2 типа». Наука . 306 (5695): 457–61. Bibcode : 2004sci ... 306..457o . doi : 10.1126/science.1103160 . PMID 15486293 . S2CID 22517395 .
- ^ Soltys BJ, Gupta RS (1992). «Взаимосвязи эндоплазматического ретикулума, митохондрий, промежуточных филаментов и микротрубочек-исследование на четырехкратном флуоресцентном маркировке». Биохимия и клеточная биология . 70 (10–11): 1174–86. doi : 10.1139/O92-163 . PMID 1363623 .
- ^ Stornaiuolo M, Lotti LV, Borgese N, Torrisi MR, Mottola G, Martire G, Bonatti S (март 2003 г.). «Поиска KDEL и KKXX, добавленные к одному и тому же репортерному белке, определяют различные переносы между эндоплазматической ретикулумом, промежуточным компартментом и комплексом Гольджи» . Молекулярная биология клетки . 14 (3): 889–902. doi : 10.1091/mbc.e02-08-0468 . PMC 151567 . PMID 12631711 .
- ^ Raykhel I, Alanen H, Salo K, Jurvansuu J, Nguyen VD, Latva-Ranta M, Ruddock L (декабрь 2007 г.). «Код молекулярной специфичности для трех рецепторов KDEL млекопитающих» . Журнал клеточной биологии . 179 (6): 1193–204. doi : 10.1083/jcb.200705180 . PMC 2140024 . PMID 18086916 .
- ^ Клэрмонт, Калифорния; De Maio, a; Хиршберг, CB (25 февраля 1992 г.). «Передачация АТФ в просвет грубых везикул, полученных из эндоплазматической ретикулумы, и его связывание с просветными белками, включая BIP (GRP 78) и GRP 94» . Журнал биологической химии . 267 (6): 3983–90. doi : 10.1016/s0021-9258 (19) 50622-6 . PMID 1740446 .
- ^ Klein, Marie-Christine; Zimmermann, Katharina; Schorr, Stefan; Landini, Martina; Klemens, Patrick A. W.; Altensell, Jacqueline; Jung, Martin; Krause, Elmar; Nguyen, Duy; Helms, Volkhard; Rettig, Jens; Fecher-Trost, Claudia; Cavalié, Adolfo; Hoth, Markus; Bogeski, Ivan; Neuhaus, H. Ekkehard; Zimmermann, Richard; Lang, Sven; Haferkamp, Ilka (28 August 2018). "AXER is an ATP/ADP exchanger in the membrane of the endoplasmic reticulum". Nature Communications. 9 (1): 3489. Bibcode:2018NatCo...9.3489K. doi:10.1038/s41467-018-06003-9. PMC 6113206. PMID 30154480.
- ^ Юн, Цзин; Бишоф, Гельмут; Бургсталлер, Сандра; Сирин, Марина; Мерфи, Энн; Малли, Роланд; Кауфман, Рэндал Дж. (9 сентября 2019 г.). "Митохондрии поставляют АТФ в ER через механизм, антагонизированный цитозольным CA 2+ " . Elife . 8. . doi : 10.7554 . PMC 6763289. / PMID 31498082 elife.49682
- ^ Юн, Цзин; Бишоф, Гельмут; Бургсталлер, Сандра; Сирин, Марина; Мерфи, Энн; Малли, Роланд; Кауфман, Рэндал Дж. (2019). «Митохондрии поставляют АТФ в ER через механизм, противоречащий цитозольным Ca2+» . элиф . 8 : E49682. doi : 10.7554/elife.49682 . ISSN 2050-084X . PMC 6763289 . PMID 31498082 .
- ^ Юн, Цзин; Джонсон, Джеймс Д.; Арван, Петр; Хан, Ясеок; Кауфман, Рэндал Дж. (Август 2021 г.). «Терапевтические возможности для стресса ER поджелудочной железы при сахарном диабете» . Природа обзоры эндокринологии . 17 (8): 455–467. doi : 10.1038/s41574-021-00510-4 . PMC 8765009 . PMID 34163039 .
- ^ Ван Влиет, Стефан; Ко, Хан-Чоу Э.; Паттерсон, Брюс В.; Йошино, Михоко; Лафрест, Ричард; Гроплер, Роберт Дж.; Кляйн, Самуил; Миттендорфер, Беттина (1 октября 2020 г.). «Ожирение связано с увеличением базальной и постпрандиальной секреции β-клеток β-клеток даже при отсутствии резистентности к инсулину» . Диабет . 69 (10): 2112–2119. doi : 10.2337/db20-0377 . PMC 7506835 . PMID 32651241 .
- ^ Миттендорфер, Беттина; Паттерсон, Брюс В.; Смит, Гордон I.; Йошино, Михоко; Кляйн, Самуил (1 февраля 2022 г.). «Функция β -клеток и клиренс инсулина в плазме у людей с ожирением и различным гликемическим статусом» . Журнал клинических исследований . 132 (3): E154068. doi : 10.1172/JCI154068 . PMC 8803344 . PMID 34905513 .
- ^ Casas-Tinto S, Zhang Y, Sanchez-Garcia J, Gomez-Velazquez M, Rincon-Limas DE, Fernandez-Funez P (июнь 2011 г.). «Фактор стресса ER XBP1s предотвращает нейротоксичность амилоид-бета» . Молекулярная генетика человека . 20 (11): 2144–60. doi : 10.1093/hmg/ddr100 . PMC 3090193 . PMID 21389082 .
- ^ Казер А., Ли А.Х., Франке А., Гликман Дж.Н., Зейссиг С., Тилг Х., Ниувенхуис Э.Е., Хиггинс Д.Е., Шрайбер С., Глимчер Л.Х., Блумберг Р.С. (сентябрь 2008 г.). «XBP1 связывает ER стресс с воспалением кишечника и обеспечивает генетический риск воспалительного заболевания кишечника человека» . Клетка . 134 (5): 743–56. doi : 10.1016/j.cell.2008.07.021 . PMC 2586148 . PMID 18775308 .
- ^ Уолтер, Питер. «Короткий разговор Питера Уолтера: развернуть UPR» . ибиология.
- ^ Moreno JA, Halliday M, Molloy C, Radford H, Verity N, Axten JM, Ortori CA, Willis AE, Fischer PM, Barrett DA, Mallucci GR (октябрь 2013 г.). «Пероральное лечение, нацеленное на развернутый белковый ответ, предотвращает нейродегенерацию и клиническое заболевание у мышей, инфицированных прион». Научная трансляционная медицина . 5 (206): 206RA138. doi : 10.1126/scitranslmed.3006767 . PMID 24107777 . S2CID 25570626 .