Прокариотический цитоскелет
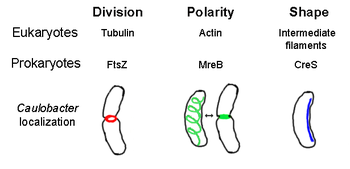
Прокариотический цитоскелет — собирательное название всех структурных нитей у прокариот . Когда-то считалось, что прокариотические клетки не обладают цитоскелетом , но достижения в области технологий визуализации и определения структуры привели к открытию нитей в этих клетках в начале 1990-х годов. [2] Мало того, что аналоги всех основных цитоскелетных белков эукариот цитоскелетные белки, не имеющие известных эукариотических гомологов . были обнаружены у прокариот, также были обнаружены [3] [4] [5] [6] Элементы цитоскелета играют важную роль в делении клеток , защите, определении формы и определении полярности у различных прокариот. [7] [8]
Надсемейство тубулинов
[ редактировать ]ФтсЗ
[ редактировать ]FtsZ, первый идентифицированный элемент цитоскелета прокариот, образует нитевидную кольцевую структуру, расположенную в середине клетки, называемую Z-кольцом, которая сужается во время клеточного деления , подобно актин-миозиновому сократительному кольцу у эукариот. [2] Z-кольцо представляет собой высокодинамическую структуру, состоящую из многочисленных пучков протофиламентов, которые расширяются и сжимаются, хотя механизм сжатия Z-кольца и количество задействованных протофиламентов неясны. [1] FtsZ действует как белок-организатор и необходим для деления клеток. Это первый компонент перегородки во время цитокинеза , и он привлекает к месту деления все другие известные белки клеточного деления. [9]
Несмотря на это функциональное сходство с актином , FtsZ гомологичен эукариальному тубулину . Хотя сравнение первичных структур FtsZ и тубулина обнаруживает слабую взаимосвязь, их трехмерные структуры удивительно схожи. Кроме того, как и тубулин, мономерный FtsZ связан с GTP и полимеризуется с другими мономерами FtsZ с гидролизом GTP по механизму, аналогичному димеризации тубулина . [10] Поскольку FtsZ необходим для деления клеток бактерий, этот белок является мишенью для разработки новых антибиотиков . [11] В настоящее время существует несколько моделей и механизмов, регулирующих образование Z-колец, но эти механизмы зависят от вида. Некоторые палочковидные виды, включая Escherichia coli и Caulobacter crescentus , используют один или несколько ингибиторов сборки FtsZ, которые образуют биполярный градиент в клетке, усиливая полимеризацию FtsZ в центре клетки. [12] Одной из таких градиентообразующих систем являются белки MinCDE (см. ниже).
Суперсемейство актинов
[ редактировать ]МРЭБ
[ редактировать ]MreB представляет собой бактериальный белок, гомологичный эукариальному актину . MreB и актин имеют слабое совпадение первичной структуры , но очень похожи с точки зрения трехмерной структуры и полимеризации нитей.
Почти все несферические бактерии полагаются на MreB для определения своей формы. MreB собирается в спиральную сеть нитевидных структур непосредственно под цитоплазматической мембраной , покрывающую всю длину клетки. [13] MreB определяет форму клеток, опосредуя положение и активность ферментов, синтезирующих пептидогликан , и действуя как жесткая нить под клеточной мембраной, которая оказывает внешнее давление, формируя и укрепляя клетку. [1] MreB конденсируется из своей нормальной спиральной сети и образует плотное кольцо на перегородке у Caulobacter crescentus непосредственно перед делением клетки - механизм, который, как полагают, помогает определить местонахождение его смещенной от центра перегородки. [14] MreB также важен для определения полярности у полярных бактерий, поскольку он отвечает за правильное расположение по крайней мере четырех различных полярных белков у C. crescentus . [14]
ПарМ и СОПА
[ редактировать ]ParM представляет собой элемент цитоскелета, который имеет структуру, аналогичную актину , хотя функционально ведет себя как тубулин . Кроме того, он полимеризуется в двух направлениях и проявляет динамическую нестабильность , которые являются характерными для полимеризации тубулина. [4] [15] Он образует систему с ParR и parC , которая отвечает за разделение плазмиды R1 . ParM прикрепляется к ParR, ДНК-связывающему белку , который специфически связывается с 10 прямыми повторами в области parC на плазмиде R1. Это связывание происходит на обоих концах нити ParM. Затем эта нить удлиняется, разделяя плазмиды. [16] Система аналогична сегрегации эукариотических хромосом, поскольку ParM действует как эукариотический в митотическом веретене , ParR действует как кинетохорный комплекс, а parC действует как центромера хромосомы тубулин . [17]
Сегрегация F-плазмиды происходит в аналогичной системе, где SopA действует как филамент цитоскелета, а SopB связывается с последовательностью sopC в F-плазмиде, как кинетохор и центромера соответственно. [17] был обнаружен актиноподобный гомолог ParM Недавно у грамположительной бактерии Bacillus thuringiensis , который собирается в структуру, подобную микротрубочкам, и участвует в сегрегации плазмид . [18]
Архейный актин
[ редактировать ]Кренактин является гомологом актина, уникальным для архейного царства Thermoproteota (ранее Crenarchaeota), который был обнаружен в отрядах Thermoproteales и Candidatus Korarchaeum . [19] На момент открытия в 2009 году он имел наибольшее сходство последовательности с эукариотическими актинами среди всех известных гомологов актина. [20] Кренактин хорошо охарактеризован у Pyryobaculumcalidifontis ( A3MWN5 ) и обладает высокой специфичностью к АТФ и ГТФ. [19] Все виды, содержащие кренактин, имеют палочковидную или игольчатую форму. Было показано, что у P.calidifontis кренактин образует спиральные структуры, охватывающие всю длину клетки, что указывает на роль кренактина в определении формы, аналогичную роли MreB у других прокариот. [19] [21]
Еще ближе к эукариотической актиновой системе находится предполагаемый супертип Asgardarchaeota . Они используют примитивные версии профилина , гельзолина и кофилина для регуляции цитоскелета. [22]
Уникальные группы
[ редактировать ]Кресентин
[ редактировать ]Кресцентин (кодируемый геном creS ) является аналогом эукариотических промежуточных филаментов (ПФ). В отличие от других аналогичных связей, обсуждаемых здесь, кресцентин имеет довольно большую первичную гомологию с белками IF в дополнение к трехмерному сходству - последовательность creS имеет 25% совпадение идентичности и 40% сходство с цитокератином 19 и 24% совпадение идентичности и 40% сходство с ядерным ламином А. Более того, нити кресцентина имеют диаметр примерно 10 нм и, таким образом, попадают в диапазон диаметров эукариальных IF (8-15 нм). [23] Кресцентин образует непрерывную нить от полюса к полюсу вдоль внутренней, вогнутой стороны серповидной бактерии Caulobacter crescentus . И MreB, и кресцентин необходимы для C. crescentus существования в его характерной форме; считается, что MreB придает клетке форму палочки, а крецентин изгибает эту форму в полумесяц. [1]
система МинКДЕ
[ редактировать ]Система MinCDE представляет собой систему нитей, которая правильно позиционирует перегородку в середине клетки Escherichia coli . По данным Shih et al., MinC ингибирует образование перегородки, запрещая полимеризацию Z-кольца. MinC, MinD и MinE образуют спиральную структуру, которая обвивает клетку и связана с мембраной MinD. Спираль MinCDE занимает полюс и заканчивается нитевидной структурой, называемой E-кольцом, состоящей из MinE, на самом среднем краю полярной зоны. В этой конфигурации E-кольцо будет сжиматься и двигаться к этому полюсу, разбирая спираль MinCDE по мере ее движения. Одновременно разобранные фрагменты снова соберутся на противоположном полярном конце, реформируя катушку MinCDE на противоположном полюсе, в то время как текущая спираль MinCDE разрушается. Затем этот процесс повторяется, при этом спираль MinCDE колеблется от полюса к полюсу. Это колебание происходит неоднократно в течение клеточного цикла, тем самым сохраняя MinC (и его эффект ингибирования перегородки) на более низкой, усредненной по времени концентрации в середине клетки, чем на концах клетки. [24]
Динамическое поведение белков Min было восстановлено in vitro с использованием искусственного липидного бислоя в качестве имитатора клеточной мембраны. MinE и MinD самоорганизуются в параллельные и спиральные белковые волны по механизму, подобному реакции-диффузии. [25]
Бактофилин
[ редактировать ]Бактофилин ( InterPro : IPR007607 ) представляет собой β-спиральный элемент цитоскелета, который образует нити по всей длине клеток палочковидной протеобактерии Myxococcus xanthus . [26] Белок бактофилин BacM необходим для поддержания правильной формы клеток и целостности клеточной стенки. Клетки M. xanthus , лишенные BacM, имеют деформированную морфологию, характеризующуюся изогнутым телом клетки, а мутанты bacM имеют пониженную устойчивость к антибиотикам, воздействующим на клеточную стенку бактерий. Белок BacM M. xanthus отщепляется от полноразмерной формы, чтобы обеспечить возможность полимеризации. Бактофилины участвуют в регуляции формы клеток у других бактерий, включая кривизну клеток Proteus mirabilis . [27] образование стеблей Caulobacter crescentus , [28] и спиральная форма Helicobacter pylori . [29]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Гитай З. (март 2005 г.). «Новая биология бактериальных клеток: движущиеся части и субклеточная архитектура» . Клетка . 120 (5): 577–86. дои : 10.1016/j.cell.2005.02.026 . ПМИД 15766522 . S2CID 8894304 .
- ^ Jump up to: а б Би Э.Ф., Луткенхаус Дж (ноябрь 1991 г.). «Кольцевая структура FtsZ, связанная с делением Escherichia coli». Природа . 354 (6349): 161–4. Бибкод : 1991Natur.354..161B . дои : 10.1038/354161a0 . ПМИД 1944597 . S2CID 4329947 .
- ^ Ганнинг П.В., Гошдастидер Ю., Уитакер С., Попп Д., Робинсон Р.К. (июнь 2015 г.). «Эволюция композиционно и функционально различных актиновых нитей» . Журнал клеточной науки . 128 (11): 2009–19. дои : 10.1242/jcs.165563 . ПМИД 25788699 .
- ^ Jump up to: а б Попп Д., Нарита А., Ли Л.Дж., Гошдастидер У., Сюэ Б., Шринивасан Р., Баласубраманиан М.К., Танака Т., Робинсон Р.К. (июнь 2012 г.). «Новая актиноподобная структура нитей Clostridium tetani» . Журнал биологической химии . 287 (25): 21121–9. дои : 10.1074/jbc.M112.341016 . ПМЦ 3375535 . ПМИД 22514279 .
- ^ Попп Д., Нарита А., Гошдастидер У., Маэда К., Маэда Ю., Ода Т., Фудзисава Т., Ониши Х., Ито К., Робинсон Р.К. (апрель 2010 г.). «Полимерные структуры и динамические свойства бактериального актина AlfA». Журнал молекулярной биологии . 397 (4): 1031–41. дои : 10.1016/j.jmb.2010.02.010 . ПМИД 20156449 .
- ^ Уикстед Б., Галл К. (август 2011 г.). «Эволюция цитоскелета» . Журнал клеточной биологии . 194 (4): 513–25. дои : 10.1083/jcb.201102065 . ПМК 3160578 . ПМИД 21859859 .
- ^ Ши Ю.Л., Ротфилд Л. (сентябрь 2006 г.). «Бактериальный цитоскелет» . Обзоры микробиологии и молекулярной биологии . 70 (3): 729–54. дои : 10.1128/MMBR.00017-06 . ПМЦ 1594594 . ПМИД 16959967 .
- ^ Мичи К.А., Лёве Дж (2006). «Динамические нити бактериального цитоскелета» (PDF) . Ежегодный обзор биохимии . 75 : 467–92. doi : 10.1146/annurev.biochem.75.103004.142452 . ПМИД 16756499 . Архивировано из оригинала (PDF) 17 ноября 2006 г.
- ^ Грауманн П.Л. (декабрь 2004 г.). «Элементы цитоскелета бактерий». Современное мнение в микробиологии . 7 (6): 565–71. дои : 10.1016/j.mib.2004.10.010 . ПМИД 15556027 .
- ^ Десаи А., Митчисон Т.Дж. (июль 1998 г.). «Структуры тубулина и FtsZ: функциональные и терапевтические значения». Биоэссе . 20 (7): 523–7. doi : 10.1002/(SICI)1521-1878(199807)20:7<523::AID-BIES1>3.0.CO;2-L . ПМИД 9722999 .
- ^ Хейдон Д.Д., Стоукс Н.Р., Юр Р., Гэлбрейт Дж., Беннетт Дж.М., Браун Д.Р., Бейкер П.Дж., Барынин В.В., Райс Д.В., Седельникова С.Е., Хил Дж.Р., Шеридан Дж.М., Айвале С.Т., Чаухан П.К., Шривастава А., Танеджа А., Коллинз И. , Эррингтон Дж., Чаплевски Л.Г. (сентябрь 2008 г.). «Ингибитор FtsZ с мощной и селективной антистафилококковой активностью». Наука . 321 (5896): 1673–5. Бибкод : 2008Sci...321.1673H . дои : 10.1126/science.1159961 . ПМИД 18801997 . S2CID 7878853 .
- ^ Хойссер Д.П., Марголин В. (апрель 2016 г.). «Сплитсвилль: структурное и функциональное понимание динамического бактериального Z-кольца» . Обзоры природы. Микробиология . 14 (5): 305–19. дои : 10.1038/nrmicro.2016.26 . ПМК 5290750 . ПМИД 27040757 .
- ^ Кюрнер Дж., Медалия О., Линарудис А.А., Баумайстер В. (ноябрь 2004 г.). «Новое понимание структурной организации эукариотического и прокариотического цитоскелета с помощью криоэлектронной томографии». Экспериментальные исследования клеток . 301 (1): 38–42. doi : 10.1016/j.yexcr.2004.08.005 . ПМИД 15501443 .
- ^ Jump up to: а б Гитай З., Дай Н., Шапиро Л. (июнь 2004 г.). «Актиноподобный ген может определять полярность клеток у бактерий» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (23): 8643–8. дои : 10.1073/pnas.0402638101 . ПМК 423248 . ПМИД 15159537 .
- ^ Гарнер ЕС, Кэмпбелл К.С., Маллинз Р.Д. (ноябрь 2004 г.). «Динамическая нестабильность гомолога прокариотического актина, разделяющего ДНК». Наука . 306 (5698): 1021–5. Бибкод : 2004Sci...306.1021G . дои : 10.1126/science.1101313 . ПМИД 15528442 . S2CID 14032209 .
- ^ Мёллер-Йенсен Дж, Йенсен РБ, Лёве Дж, Гердес К (июнь 2002 г.). «Расщепление ДНК прокариот актиноподобной нитью» . Журнал ЭМБО . 21 (12): 3119–27. дои : 10.1093/emboj/cdf320 . ПМК 126073 . ПМИД 12065424 .
- ^ Jump up to: а б Гитай З. (февраль 2006 г.). «Сегрегация плазмиды: появляется новый класс цитоскелетных белков» . Современная биология . 16 (4): Р133-6. Бибкод : 2006CBio...16.R133G . дои : 10.1016/j.cub.2006.02.007 . ПМИД 16488865 .
- ^ Цзян С., Нарита А., Попп Д., Гошдастидер У., Ли Л.Дж., Шринивасан Р., Баласубраманиан М.К., Ода Т., Ко Ф., Ларссон М., Робинсон Р.К. (март 2016 г.). «Новые актиновые нити Bacillus thuringiensis образуют нанотрубочки для разделения плазмидной ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (9): Е1200-5. Бибкод : 2016PNAS..113E1200J . дои : 10.1073/pnas.1600129113 . ПМЦ 4780641 . ПМИД 26873105 .
- ^ Jump up to: а б с Эттема Т.Дж., Линдос А.С., Бернандер Р. (май 2011 г.). «Цитоскелет на основе актина у архей» . Молекулярная микробиология . 80 (4): 1052–61. дои : 10.1111/j.1365-2958.2011.07635.x . ПМИД 21414041 .
- ^ Ютин Н., Вольф М.Ю., Вольф Ю.И., Кунин Е.В. (февраль 2009 г.). «Происхождение фагоцитоза и эукариогенеза» . Биология Директ . 4 :9. дои : 10.1186/1745-6150-4-9 . ПМК 2651865 . ПМИД 19245710 .
- ^ Гошдастидер У., Цзян С., Попп Д., Робинсон Р.К. (июль 2015 г.). «В поисках первичной актиновой нити» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (30): 9150–1. дои : 10.1073/pnas.1511568112 . ПМЦ 4522752 . ПМИД 26178194 .
- ^ Акыл, Джанер; Тран, Линь Т.; Оран-Приу, Магали; Баскаран, Йохендран; Мансер, Эдвард; Бланшуан, Лоран; Робинсон, Роберт К. (18 августа 2020 г.). «Понимание эволюции регулируемой динамики актина посредством характеристики примитивных белков гельзолина / кофилина из архей Асгарда» . ПНАС . 117 (33): 19904–19913. Бибкод : 2020PNAS..11719904A . bioRxiv 10.1101/768580 . дои : 10.1073/pnas.2009167117 . ПМЦ 7444086 . ПМИД 32747565 .
- ^ Аусмис Н., Кун Дж.Р., Джейкобс-Вагнер С. (декабрь 2003 г.). «Бактериальный цитоскелет: промежуточная филаментоподобная функция в форме клетки» . Клетка . 115 (6): 705–13. дои : 10.1016/S0092-8674(03)00935-8 . ПМИД 14675535 . S2CID 14459851 .
- ^ Ши Ю.Л., Ле Т., Ротфилд Л. (июнь 2003 г.). «Выбор места деления у Escherichia coli включает динамическое перераспределение белков Min внутри спиральных структур, которые простираются между двумя полюсами клетки» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (13): 7865–70. Бибкод : 2003PNAS..100.7865S . дои : 10.1073/pnas.1232225100 . ПМЦ 164679 . ПМИД 12766229 .
- ^ Лоуз М., Фишер-Фридрих Э., Рис Дж., Крузе К., Швилле П. (май 2008 г.). «Пространственные регуляторы деления бактериальных клеток самоорганизуются в поверхностные волны in vitro». Наука . 320 (5877): 789–92. Бибкод : 2008Sci...320..789L . дои : 10.1126/science.1154413 . ПМИД 18467587 . S2CID 27134918 .
- ^ Кох М.К., МакХью К.А., Хойчик Э. (май 2011 г.). «BacM, бактофилин Myxococcus xanthus, процессированный на N-конце, имеет решающее значение для правильной формы клеток» . Молекулярная микробиология . 80 (4): 1031–51. дои : 10.1111/j.1365-2958.2011.07629.x . ПМК 3091990 . ПМИД 21414039 .
- ^ Hay NA, Tipper DJ, Gygi D, Hughes C (апрель 1999 г.). «Новый мембранный белок, влияющий на форму клеток и многоклеточное скопление Proteus mirabilis» . Журнал бактериологии . 181 (7): 2008–16. дои : 10.1128/JB.181.7.2008-2016.1999 . ПМК 93611 . ПМИД 10094676 .
- ^ Кюн Дж., Бригель А., Мёршель Э., Кант Дж., Лезер К., Вик С., Йенсен Г.Дж., Танбихлер М. (январь 2010 г.). «Бактофилины, вездесущий класс цитоскелетных белков, опосредующих полярную локализацию синтазы клеточной стенки у Caulobacter crescentus» . Журнал ЭМБО . 29 (2): 327–39. дои : 10.1038/emboj.2009.358 . ПМЦ 2824468 . ПМИД 19959992 .
- ^ Сикуро Л.К., Пинкус З., Гутьеррес К.Д., Бибой Дж., Стерн К.А., Фоллмер В., Салама Н.Р. (май 2010 г.). «Релаксация сшивки пептидогликана способствует спиральной форме Helicobacter pylori и колонизации желудка» . Клетка . 141 (5): 822–33. дои : 10.1016/j.cell.2010.03.046 . ПМЦ 2920535 . ПМИД 20510929 .