Семейство АДФ/кофилинов

ADF/кофилин представляет собой семейство актин-связывающих белков, связанных с быстрой деполимеризацией актиновых микрофиламентов , которые придают актину его характерную динамическую нестабильность . [1] Эта динамическая нестабильность играет центральную роль в мышечном сокращении, подвижности клеток и регуляции транскрипции. [2]
У человека и мышей описаны три высококонсервативных и высоко (70–82%) идентичных гена, принадлежащих к этому семейству: [3]
- CFL1 , кодирующий кофилин 1 (немышечный или н-кофилин)
- CFL2 , кодирующий кофилин 2 (обнаружен в мышцах: м-кофилин)
- DSTN , кодирующий дестрин , также известный как ADF или фактор деполимеризации актина.
Актин -связывающие белки регулируют сборку и разборку актиновых нитей. [4] Кофилин , член семейства ADF/кофилинов, на самом деле представляет собой белок, последовательность которого на 70% идентична дестрину , что делает его частью семейства ADF/кофилинов небольших АДФ-связывающих белков. [5] [6] Белок связывается с мономерами и нитями актина, G-актином и F-актином соответственно. [7] Кофилин вызывает деполимеризацию минусового конца нитей, тем самым предотвращая их повторную сборку. Известно, что белок разрывает актиновые нити, создавая более положительные концы на фрагментах нитей. [4] Кофилин/ADF (дестрин), вероятно, разрушает F-актин без его кэпирования. [6] и предпочитает АДФ-актин. Эти мономеры могут быть переработаны профилином , активируя мономеры и снова возвращаясь в форму нитей путем обмена АДФ на АТФ . АТФ-актин затем доступен для сборки. [4]
Структура
[ редактировать ]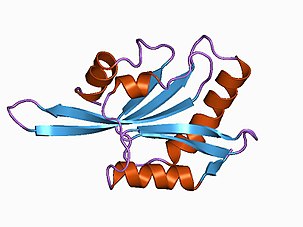
Структура факторов деполимеризации актина высоко консервативна во многих организмах из-за важности актина во многих клеточных процессах. [8] Белки семейства факторов деполимеризации актина обычно состоят из пяти бета-листов, четырех антипараллельных и одной параллельной, а также четырех альфа-спиралей с центральной альфа-спиралью, обеспечивающей структуру и стабильность белков. [8] Домен гомологичности фактора деполимеризации актина (домен ADF-H) обеспечивает связывание с субъединицами актина и включает центральную альфа-спираль, N-концевой участок и С-концевую спираль. [9] [8]
- Расширение N-конца состоит из наклонной петли, которая облегчает связывание с G-актином, но не с F-актином из-за стерических препятствий, присутствующих в F-актине. [8]
- С-конец может образовывать водородные связи с F-актином через его амидный остов и серин в положении S274. Этот серин особенно эволюционно консервативен из-за его важности в связывании актина. [8]
- Центральная альфа-спираль вставляется в гидрофобную щель между первой и третьей субъединицами актина во время связывания актина. [8]
Кофилин связывает мономерный (G-актин) и нитевидный актин (F-актин). Его аффинность связывания с АДФ-актином выше, чем с АДФ-Пи и АТФ-актином. Его связывание меняет поворот F-актина. Структура ADF была впервые охарактеризована в 1980 году Джеймсом Бамбургом. [10] Для взаимодействия кофилин/актин могут потребоваться четыре актиновых гистидина рядом с сайтом связывания кофилина, но одной чувствительности к pH может быть недостаточно для объяснения наблюдаемых уровней взаимодействия. Кофилин размещается в актине ADP-F из-за повышенной гибкости этой формы актина. Связывание как кофилином, так и ADF (дестрином) приводит к уменьшению длины кроссовера нити. Следовательно, напряжения увеличивают динамику нитей и наблюдаемый уровень фрагментации нитей. [6]
Функция
[ редактировать ]Кофилин является вездесущим актин-связывающим фактором, необходимым для реорганизации актиновых филаментов. Члены семейства ADF/Кофилинов связывают мономеры G-актина и деполимеризуют актиновые нити посредством двух механизмов: разрыва [11] и увеличение скорости отклонения мономеров актина от заостренного конца. [12] Для эффективного функционирования кофилина необходимы «старые» актиновые нити ADP/ADP-Pi, свободные от тропомиозина и соответствующий pH. В присутствии легкодоступного АТФ-G-актина кофилин ускоряет полимеризацию актина за счет своей активности по расщеплению актина (обеспечивая свободные зазубренные концы для дальнейшей полимеризации и зарождения комплекса Arp2/3). [13] Благодаря длительному эффекту in vivo кофилин перерабатывает старый ADP-F-актин, помогая клеткам поддерживать пул АТФ-G-актина для устойчивой подвижности. pH, фосфорилирование и фосфоинозитиды регулируют связывание кофилина и его связывающую активность с актином. [7]
Комплекс Arp2/3 и кофилин работают вместе, реорганизуя актиновые нити в цитоскелете . Arp 2/3, комплекс актин-связывающих белков, связывается со стороной АТФ-F-актина вблизи растущего зазубренного конца филамента, вызывая зарождение новой ветви F-актина. [13] в то время как деполимеризация под действием кофилина происходит после диссоциации от комплекса Arp2/3. [4] Они также работают вместе над реорганизацией актиновых нитей, чтобы транспортировать больше белков через везикулы и продолжать рост нитей. [14]
Кофилин также связывается с другими белками, такими как миозин , тропомиозин , α-актинин , гельзолин и скруин . Эти белки конкурируют с кофилином за связывание актина. [6] Кофилин также играет роль во врожденном иммунном ответе. [ нужна ссылка ] .
В модельном организме
[ редактировать ]ADF/кофилин обнаруживается в взъерошенных мембранах и на переднем крае мобильных клеток. [12] В частности, ADF/кофилин способствует разборке нити в задней части кисти у Xenopus laevis lamellipodia , выпячивания из клеток фибробластов, характеризующегося актиновыми сетями. Субъединицы добавляются к зазубренным концам и теряются на обращенных назад заостренных концах. Было обнаружено, что увеличение константы скорости k диссоциации актина от заостренных концов приводит к разрыву актиновых нитей. В ходе этого эксперимента было обнаружено, что АТФ или АДФ-Пи, вероятно, участвуют в связывании с актиновыми нитями. [14]
Механизм действия
[ редактировать ]F-актин (нитчатый актин) стабилизируется, когда он связан с АТФ, благодаря наличию серина на второй субъединице актина, который способен образовывать водородные связи с последней фосфатной группой АТФ и близлежащим гистидином, присоединенным к основной субъединице. петля. Это взаимодействие стабилизирует структуру внутри за счет взаимодействий между основной петлей и второй субъединицей. Когда АТФ гидролизуется до АДФ, серин больше не может образовывать водородную связь с АДФ из-за потери неорганического фосфата, который вызывает скручивание боковой цепи серина, вызывая конформационные изменения во второй субъединице. [15] [12] Это конформационное изменение также приводит к тому, что серин больше не может образовывать водородную связь с гистидином, прикрепленным к основной петле, и это ослабляет связь между первой и третьей субъединицами, вызывая скручивание всей молекулы. Это скручивание создает нагрузку на молекулу и дестабилизирует ее. [2]
Фактор деполимеризации актина способен связываться с дестабилизированным F-актином, вставляя центральную спираль в щель между первой и третьей субъединицами актина. Фактор деполимеризации актина кооперативно связывает F-актин и вызывает конформационные изменения F-актина, которые заставляют его еще больше скручиваться и становиться более дестабилизированным. Это скручивание вызывает разрыв связи между мономерами актина, деполимеризуя нить. [2]
Регулирование
[ редактировать ]фосфорилирование
[ редактировать ]Фактор деполимеризации актина регулируется фосфорилированием серина на С-конце киназами LIM . [16] Фактор деполимеризации актина активируется при его дефосфорилировании и ингибируется при его фосфорилировании. [17]
рН
[ редактировать ]
Щелочная среда стабилизирует неорганический фосфат, высвобождаемый при гидролизе АТФ до АДФ, поэтому более высокий pH увеличивает способность АТФ, связанного с F-актином, гидролизоваться до АДФ, что приводит к дестабилизации актина. [18]
Связывание тропомиозина
[ редактировать ]связывает белок тропомиозин F-актин конкурентно и взаимоисключающе и фактор деполимеризации актина. Связывание тропомиозина с F-актином является некооперативным, поэтому связывание тропомиозина не вызывает конформационных изменений F-актина и не приводит к его дестабилизации. [17] Однако, поскольку F-актин не может связывать одновременно тропомиозин и фактор деполимеризации актина из-за того, что тропомиозин блокирует сайт связывания фактора деполимеризации актина, когда он связан с актином, тропомиозин действует как защитник актина от деполимеризации. [19]
Ссылки
[ редактировать ]- ^ Актин + деполимеризующие + факторы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- ^ Jump up to: а б с Домингес Р., Холмс К.К. (2011). «Структура и функции актина» . Ежегодный обзор биофизики . 40 : 169–86. doi : 10.1146/annurev-biophys-042910-155359 . ПМК 3130349 . ПМИД 21314430 .
- ^ Менон С., Гуптон С.Л. (1 января 2016 г.). «Строительные блоки функционирующего мозга: цитоскелетная динамика в развитии нейронов» . Международное обозрение клеточной и молекулярной биологии . 322 : 183–245. дои : 10.1016/bs.ircmb.2015.10.002 . ISBN 9780128048092 . ПМЦ 4809367 . ПМИД 26940519 .
- ^ Jump up to: а б с д Купер, GM и Р.Э. Хаусман. Клетка: молекулярный подход, 3-е изд. Вашингтон, округ Колумбия: ASM Press 2004, стр. 436–440.
- ^ Ганнинг П.В., Гошдастидер Ю., Уитакер С., Попп Д., Робинсон Р.К. (2015). «Эволюция композиционно и функционально различных актиновых нитей» . Журнал клеточной науки . 128 (11): 2009–19. дои : 10.1242/jcs.165563 . ПМИД 25788699 .
- ^ Jump up to: а б с д Макгоф А., Поуп Б., Чиу В., Уидс А. (август 1997 г.). «Кофилин меняет структуру F-актина: последствия для динамики актиновых нитей и клеточных функций» . Дж. Клеточная Биол . 138 (4): 771–81. дои : 10.1083/jcb.138.4.771 . ПМК 2138052 . ПМИД 9265645 .
- ^ Jump up to: а б Лаппалайнен П., Друбин Д.Г. (июль 1997 г.). «Кофилин способствует быстрому обновлению актиновых нитей in vivo» . Природа . 388 (6637): 78–82. Бибкод : 1997Natur.388R..78L . дои : 10.1038/40418 . ПМИД 9214506 . S2CID 205027806 .
- ^ Jump up to: а б с д и ж Инада Н. (март 2017 г.). «Фактор деполимеризации растительного актина: разборка актиновых микрофиламентов и многое другое» . Журнал исследований растений . 130 (2): 227–238. Бибкод : 2017JPlR..130..227I . дои : 10.1007/s10265-016-0899-8 . ПМЦ 5897475 . ПМИД 28044231 .
- ^ Паавилайнен В.О., Оксанен Э., Гольдман А., Лаппалайнен П. (июль 2008 г.). «Структура домена гомологии фактора деполимеризации актина в комплексе с актином» . Журнал клеточной биологии . 182 (1): 51–9. дои : 10.1083/jcb.200803100 . ПМЦ 2447895 . ПМИД 18625842 .
- ^ Бамбург-младший; Харрис, HE; Уидс, AG (17 ноября 1980 г.). «Частичная очистка и характеристика фактора деполимеризации актина из мозга» . ФЭБС Летт . 121 (1): 178–82. дои : 10.1016/0014-5793(80)81292-0 . ПМИД 6893966 . S2CID 42641895 .
- ^ Ичетовкин И., Хан Дж., Панг К.М., Кнехт Д.А., Кондилис Дж.С. (апрель 2000 г.). «Актиновые нити разрываются как нативным, так и рекомбинантным кофилином диктиостелия, но в разной степени». Сотовый Мотиль. Цитоскелет . 45 (4): 293–306. doi : 10.1002/(SICI)1097-0169(200004)45:4<293::AID-CM5>3.0.CO;2-1 . ПМИД 10744862 .
- ^ Jump up to: а б с Карлье М.Ф., Лоран В., Сантолини Дж. и др. (март 1997 г.). «Фактор деполимеризации актина (ADF/кофилин) увеличивает скорость обновления филаментов: влияние на подвижность актина» . Дж. Клеточная Биол . 136 (6): 1307–22. дои : 10.1083/jcb.136.6.1307 . ПМК 2132522 . ПМИД 9087445 .
- ^ Jump up to: а б Ичетовкин И., Грант В., Кондилис Дж. (январь 2002 г.). «Кофилин производит новые полимеризованные актиновые нити, которые предпочтительны для дендритной нуклеации комплекса Arp2/3» . Курс. Биол . 12 (1): 79–84. дои : 10.1016/s0960-9822(01)00629-7 . ПМИД 11790308 . S2CID 15747359 .
- ^ Jump up to: а б Свиткина Т.М., Борисий Г.Г. (май 1999 г.). «Комплекс Arp2/3 и фактор деполимеризации актина/кофилин в дендритной организации и беговая дорожка массива актиновых филаментов в ламеллиподиях» . Дж. Клеточная Биол . 145 (5): 1009–26. дои : 10.1083/jcb.145.5.1009 . ПМК 2133125 . ПМИД 10352018 .
- ^ «Как деполимеризуются актиновые нити?» . МБИнфо . Проверено 16 июня 2018 г.
- ^ Прюнье С., Прюдент Р., Капур Р., Садул К., Лафанешер Л. (июнь 2017 г.). «LIM-киназы: кофилин и не только» . Онкотаргет . 8 (25): 41749–41763. дои : 10.18632/oncotarget.16978 . ПМК 5522193 . ПМИД 28445157 .
- ^ Jump up to: а б Бамбург-младший, Макгоф А., Оно С. (сентябрь 1999 г.). «Новый взгляд на актин: ADF/кофилины модулируют динамику актина». Тенденции в клеточной биологии . 9 (9): 364–70. дои : 10.1016/S0962-8924(99)01619-0 . ПМИД 10461190 .
- ^ Поуп Б.Дж., Цирлер-Гульд К.М., Кюне Р., Weeds AG, Ball LJ (февраль 2004 г.). «Структура раствора кофилина человека: связывание актина, чувствительность к pH и связь с фактором деполимеризации актина» . Журнал биологической химии . 279 (6): 4840–8. дои : 10.1074/jbc.M310148200 . ПМИД 14627701 .
- ^ Бернштейн Б.В., Бамбург-младший (1982). «Связывание тропомиозина с F-актином защищает F-актин от разборки фактором деполимеризации актина мозга (ADF)». Подвижность клеток . 2 (1): 1–8. дои : 10.1002/см.970020102 . ПМИД 6890875 .