Актинин
Актинин представляет собой белок микрофиламентов . Функциональный белок представляет собой антипараллельный димер , который сшивает тонкие нити соседних саркомеров и, следовательно, координирует сокращения между саркомерами по горизонтальной оси. Альфа-актинин является частью суперсемейства спектринов . Это суперсемейство состоит из спектрина, дистрофина и их гомологичных и изоформ. В немышечных клетках он обнаруживается в актиновых нитях и в местах адгезии. [1] .Решетчатое расположение обеспечивает стабильность сократительного аппарата мышц. [1] В частности, он помогает связывать актиновые нити с клеточной мембраной. [2] На каждом конце палочки имеется место связывания с пучками актиновых нитей. [1]
Несаркомерные альфа-актинины, кодируемые ACTN1 и ACTN4 , широко экспрессируются. Экспрессия ACTN2 обнаруживается как в сердечной , так и в скелетных мышцах, тогда как ACTN3 ограничивается последней. Оба конца палочковидного димера альфа-актинина содержат актин-связывающие домены. Шесть различных белков производятся из четырех генов, кодирующих альфа-актинин. Эти шесть белков можно далее разделить на две разные группы: мышечные (нечувствительные к кальцию) и немышечные цитоскелетные (чувствительные к кальцию) изоформы. [1]
Эволюция
[ редактировать ]Существует мнение, что существует общий предковый ген, подобный альфа-актинину, если посмотреть на особенности альфа-актинина и спектрина. [3] Изучение последовательностей повторов спектрина предоставляет доказательства двухэтапной модели, описывающей эволюцию суперсемейства спектринов. Если посмотреть на их общего предка, то альфа-актинин и спектрин имеют четыре гомологичных повтора. [3] Дупликация генов привела к появлению стабильной линии, которая привела к появлению современных генов альфа-актинина. Одновременно другой дуплицированный ген приобрел дополнительные повторы в результате серии неравных событий кроссинговера. Это создало предка субъединицы спектрина, который представляет собой антипараллельный гомодимер, способный сшивать актиновые нити. [3] Альфа-актинин 1 (ACTN1) был открыт сорок лет назад благодаря тому, что он в больших количествах присутствует в сократительном аппарате поперечнополосатых мышц. [4] Альфа-актинин-1 необходим для прикрепления актиновых миофиламентов к Z-линиям в клетках скелетных мышц . [5] и плотным телам гладкомышечных клеток . [6] Альфа-актинин 2 (ACTN2) в основном содержится в сердечных и окислительных мышечных волокнах. Некоторая часть ACTN2 обнаруживается в мозге. Альфа-актинин 3 (ACTN3) обычно содержится в мышечных волокнах типа II, широко известных как быстросокращающиеся мышечные волокна. [4]
Структура
[ редактировать ]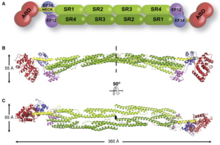
Он имеет N-конец, который есть у всех членов суперсемейства. Он состоит из двух последовательных гомологий кальпонина (CH), где сразу за ним идут повторы спектрина. Это позволяет определить длину и гибкость актинсвязывающего белка. Поперечные связи актин-филамент включают альфа-актинин, который представляет собой функциональный антипараллельный димер. [1] Он состоит из актин-связывающего домена (ABD), соединенного с четырьмя повторами спектрина, образующими центральный стержень через гибкую область шейки. Эти повторы состоят из 122 аминокислотных повторов. [8] Затем следует С-концевой кальмодулин-подобный домен (CaM), который содержит два кальцийсвязывающих мотива EF-hand. [8] [1] Это формирует сайт связывания на каждом конце белка, в результате чего образуется палочковидная молекула с пучками актиновых нитей. [1] Стержнеобразный вид обусловлен тем, что область СИ имеет цилиндрическую форму. [7] На каждом конце есть функциональный домен (ABD и CaM). [1] Связывание кальция присутствует только в ACTN1 и ACTN4, тогда как ACTN2 и ACTN3 утратили способность связывать кальций. [9]
Актин-связывающий домен
[ редактировать ]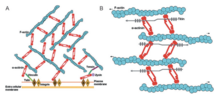
Альфа-актинин и актин являются высококонсервативными белками, причем альфа-актинин является наиболее консервативным во всем домене семейства белков. Это связано с тем, что ABD связывается с доменами CH типа 1 и типа 2 (CH1 и CH2). Домен CH1-CH2 имеет гидрофильную стабилизирующую часть и гидрофобную часть. Ядро каждого домена CH состоит из четырех спиралей (A, C, E и G). Спирали C и G параллельны друг другу, а N-концевые спирали A и E окружают их. У человека кристаллическая структура ABD определялась по альфа-актинину 1,3 и 4. [1] ABD образует закрытую конформацию. ЯМР показал, что существует три основных ABD. Эти три сайта представляют собой N-конец A-спирали CH1, C-конец G-спирали CH1 и междоменный линкер, граничащий с N-концевым сегментом домена CH2. [1] Они имеют высокое сродство к актиновым нитям. Однако для достижения максимального сродства они должны работать вместе, поскольку CH2 не может связывать актиновые нити. При этом актин-связывающий домен расположен в N-концевой области молекулы альфа-актинина. [8]
Метаболизм
[ редактировать ]Альфа-актинина 3 (ACTN3) не хватает примерно у шестнадцати процентов людей, и он играет значительную роль в мышечном метаболизме. [10] Этот дефицит обусловлен преждевременным полиморфизмом стоп-кодонов (R577X). [11] Ген R577X был выше у спортсменов, занимающихся выносливостью, чем у спринтеров. [12] Среди четырех альфа-актининов млекопитающих ACTN3 выделяется как наиболее узкоспециализированный, экспрессирующийся преимущественно в быстрых гликолитических волокнах скелетных мышц. [11] У людей, у которых есть ACTN3, ученые наблюдали лучшие результаты в спринте и силовых показателях у спортсменов и населения в целом. [10] Несмотря на то, что это было обнаружено, недавний положительный отбор, по-видимому, повлиял на нулевой генотип XX, возможно, из-за его новой роли в регуляции мышечного метаболизма, о чем свидетельствуют имеющиеся данные. [10] Отсутствие ACTN3 приводит к использованию более окислительных путей использования энергии, поскольку активность гликогенфосфорилазы снижается. Отсутствие ACTN3 не приводит к явной причине заболеваний мышц. [10] но наблюдалось изменение мышечной функции. [12]
Рак
[ редактировать ]Альфа-актинин 4 (ACTN4) экспрессируется в немышечных клетках. Это важно, поскольку является связующим звеном между двумя компонентами опухоли. ACTN4 управляет связью между актиновым цитоскелетом внутри клетки и интегринами, которые напрямую взаимодействуют со стромальным ЕСМ. Кроме того, он может чувствовать и реагировать на внешнюю силу. [9] Этот процесс имеет решающее значение для формирования и продолжения развития рака молочной железы, колоректального рака, рака яичников и поджелудочной железы. Объяснение того, почему ACTN4 способствует образованию рака, до сих пор неизвестно. В раковых клетках меланомы ACTN4 играет роль в клеточной морфологии. Он превращает клетку из клетки более мезенхимального типа в клетку амебоидного типа за счет уменьшения места фокальной адгезии. [9] Изменение места фокальной адгезии важно, поскольку места фокальной адгезии имеют решающее значение для создания сборки актиновых стрессовых волокон и миграционного поведения клеток. [9] Переход от клеток мезенхимального типа к клеткам амебоидного типа обеспечивает более высокую скорость инвазии через коллаген. В клетках мезенхимального типа они зависят от точки фокальной адгезии и интегрина. Это позволяет им проникнуть через коллаген. В клетках амебоидного типа отсутствуют стрессовые волокна, и они используют сильное сокращение, опосредованное миозином II, что позволяет ему вторгаться в механизм пузырения. [9] Именно этот процесс ученые изучают в дальнейшем, поскольку он может прояснить значительный рост инвазии и метастазирования, наблюдаемый при прохождении через плотную строму опухолей. [9] Мутации в ACTN4 при заболевании почек . могут вызывать фокально-сегментарный гломерулосклероз (ФСГС) [13]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к Сьёблом Б., Салмазо А., Джинович-Каруго К. (сентябрь 2008 г.). «Структура и регуляция альфа-актинина» . Клеточные и молекулярные науки о жизни . 65 (17): 2688–2701. дои : 10.1007/s00018-008-8080-8 . ПМЦ 11131806 . ПМИД 18488141 . S2CID 26321210 .
- ^ Бродерик М.Дж., Уиндер С.Дж. (январь 2005 г.). «Спектрин, альфа-актинин и дистрофин» . Достижения в области химии белков . Волокнистые белки: спиральные спирали, коллаген и эластомеры. 70 . Академическая пресса: 203–246. дои : 10.1016/S0065-3233(05)70007-3 . ISBN 9780120342709 . ПМИД 15837517 . Проверено 6 ноября 2023 г.
- ^ Jump up to: а б с Виэль А (ноябрь 1999 г.). «Структуры альфа-актинина и спектрина: разворачивающаяся семейная история». Письма ФЭБС . 460 (3): 391–394. дои : 10.1016/S0014-5793(99)01372-1 . ПМИД 10556504 . S2CID 20832269 .
- ^ Jump up to: а б Сюй КС, Као ХИ (2013). «Альфа-актинин 4 и онкогенез рака молочной железы» . Витамины и гормоны . 93 : 323–351. дои : 10.1016/B978-0-12-416673-8.00005-8 . ISBN 9780124166738 . ПМК 4143506 . ПМИД 23810014 .
- ^ Обзор медицинской физиологии Ганонга, 24-е издание . Ланге (Тата МакГроу Хилл). 2012. с. 100.
- ^ Габелла Дж. (6 декабря 2012 г.). «Строение гладких мышц» . В Секерес Л., Папп Дж.Г. (ред.). Фармакология гладких мышц . Springer Science & Business Media. стр. 17–18. ISBN 978-3-642-78920-5 .
- ^ Jump up to: а б Рибейро Э., Пиноцис Н., Гислени А., Салмазо А., Конарев П.В., Костан Дж. и др. (декабрь 2014 г.). «Структура и регуляция мышечного α-актинина человека» . Клетка . 159 (6): 1447–1460. дои : 10.1016/j.cell.2014.10.056 . ПМК 4259493 . ПМИД 25433700 .
- ^ Jump up to: а б с Бланшар А., Оганян В., Кричли Д. (август 1989 г.). «Структура и функция альфа-актинина». Журнал исследований мышц и подвижности клеток . 10 (4): 280–289. дои : 10.1007/BF01758424 . ПМИД 2671039 . S2CID 22230767 .
- ^ Jump up to: а б с д и ж Томас Д.Г., Робинсон Д.Н. (ноябрь 2017 г.). «Пятое чувство: механосенсорная регуляция альфа-актинина-4 и ее значение для метастазирования рака» . Семинары по клеточной биологии и биологии развития . Механосенсорика: от молекул к тканям. 71 : 68–74. дои : 10.1016/j.semcdb.2017.05.024 . ПМК 5659936 . ПМИД 28579451 .
- ^ Jump up to: а б с д Берман Ю., Норт КН (август 2010 г.). «Ген скорости: новая роль альфа-актинина-3 в мышечном метаболизме». Физиология . 25 (4): 250–259. дои : 10.1152/физиолог.00008.2010 . ПМИД 20699471 .
- ^ Jump up to: а б Макартур Д.Г., Норт-КН (июль 2004 г.). «Ген скорости? Эволюция и функция альфа-актинина-3». Биоэссе . 26 (7): 786–795. doi : 10.1002/bies.20061 . ПМИД 15221860 . S2CID 19761762 .
- ^ Jump up to: а б Ли FX, Хаувелинг П.Дж., Норт К.Н., Куинлан К.Г. (апрель 2016 г.). «Как дефицит α-актинина-3 меняет функцию мышц? Механистическое понимание ACTN3, «гена скорости» ». Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1863 (4): 686–693. дои : 10.1016/j.bbamcr.2016.01.013 . ПМИД 26802899 .
- ^ Полу К.Р., Поллак М.Р. (25 февраля 2009 г.). «Фокально-сегментарный гломерулосклероз» . В Лифтоне Р.П., Сомло С., Гибиш Г.Х., Селдин Д.В. (ред.). Генетические заболевания почек . Академическая пресса. стр. 117–118. ISBN 978-0-08-092427-4 .
Внешние ссылки
[ редактировать ]- Актинин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)