Цитокератин
Эта статья нуждается в дополнительных цитатах для проверки . ( август 2019 г. ) |

Цитокератины представляют собой кератиновые белки, обнаруженные во внутрицитоплазматическом цитоскелете эпителиальной ткани . Они являются важным компонентом промежуточных филаментов , которые помогают клеткам противостоять механическому стрессу. [1] Экспрессия этих цитокератинов в эпителиальных клетках в значительной степени специфична для конкретных органов или тканей. Таким образом, они используются в клинической практике для идентификации клеток-источников различных опухолей человека.
Мы
[ редактировать ]Термин цитокератин начал использоваться в конце 1970-х годов, когда белковые субъединицы кератина промежуточных филаментов внутри клеток . впервые были идентифицированы и охарактеризованы [2] В 2006 году была создана новая систематическая номенклатура кератинов млекопитающих, а белки, ранее называвшиеся цитокератинами, теперь называются просто кератинами (категория эпителия человека). Например, цитокератин-4 (СК-4) был переименован в кератин-4 (К4). [3] Однако в клинической практике их до сих пор часто называют цитокератинами.
Типы
[ редактировать ]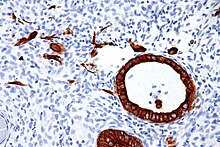
Существует две категории цитокератинов: кислые цитокератины I типа и основные или нейтральные цитокератины II типа . Внутри каждой категории цитокератины пронумерованы в порядке убывания размера: от высокомолекулярных (HMWCK) до низкомолекулярных (LMWCK). Цитокератины обычно встречаются в гетеродимерных парах кислых и основных субъединиц одинакового размера. [4]
| Базовый СК (Тип B / Класс II) | Кислый СК (Тип А/Класс I) | |
|---|---|---|
| ХМВКК « плоские кератины » | СК-1 СК-2 СК-3 СК-4 СК-5 СК-6 | СК-9 СК-10 СК-11 СК-12 СК-13 СК-14 СК-15 СК-16 СК-17 |
| ЛМВКК « простые кератины » | СК-7 СК-8 | СК-18 СК-19 СК-20 |
Экспрессия этих цитокератинов в значительной степени специфична для органа или ткани. Подмножества цитокератинов, экспрессируемые эпителиальной клеткой, зависят главным образом от типа эпителия, момента терминальной дифференцировки и стадии развития. Таким образом, специфический профиль экспрессии цитокератина позволяет идентифицировать эпителиальные клетки. Кроме того, это относится и к злокачественным аналогам эпителия ( карциномам ), поскольку профиль цитокератина обычно сохраняется. Таким образом, изучение экспрессии цитокератина методами иммуногистохимии является инструментом огромной ценности, широко используемым для диагностики и характеристики опухолей при хирургической патологии . [5]
| Цитокератин | Сайты |
|---|---|
| Цитокератин 4 |
|
| Цитокератин 7 |
|
| Цитокератин 8 |
|
| Цитокератин 10 |
|
| Цитокератин 13 |
|
| Цитокератин 14 |
|
| Цитокератин 18 |
|
| Цитокератин 19 | Не реагирует с гепатоцитами и гепатоцеллюлярной карциномой. [6] |
| Цитокератин 20 |
|
Молекулярная биология
[ редактировать ]Цитокератины кодируются семейством, включающим 30 генов. Среди них 20 являются эпителиальными генами, а остальные 10 специфичны для трихоцитов.
Все цепи цитокератина состоят из центрального домена, богатого α-спиралью (с идентичностью последовательностей от 50 до 90% среди цитокератинов одного типа и около 30% между цитокератинами разных типов) с неα-спиральными N- и C- терминальные домены. α-спиральный домен содержит 310–150 аминокислот и состоит из четырех сегментов, в которых повторяется рисунок из семи остатков. В этом повторяющемся паттерне первый и четвертый остатки являются гидрофобными, а заряженные остатки демонстрируют чередующуюся положительную и отрицательную полярность, в результате чего полярные остатки располагаются на одной стороне спирали. Этот центральный домен цепи обеспечивает молекулярное выравнивание в структуре кератина и заставляет цепи образовывать спиральные димеры в растворе.
Последовательности концевых доменов цепей цитокератина типов I и II содержат на обеих сторонах стержневого домена субдомены V1 и V2, которые имеют переменный размер и последовательность. Тип II также представляет консервативные субдомены H1 и H2, содержащие 36 и 20 остатков соответственно. Субдомены V1 и V2 содержат остатки, обогащенные глицинами и/или серинами, причем первые придают цепи цитокератина сильный нерастворимый характер и облегчают взаимодействие с другими молекулами. Эти терминальные домены также важны для определения функции цитокератиновой цепи, характерной для определенного типа эпителиальных клеток.
Два димера цитокератиновой группы превращаются в тетрамер кератина путем антипараллельного связывания. Этот тетрамер цитокератина считается основным строительным блоком цепи цитокератина. Путем соединения тетрамеров цитокератина «голова-хвост» образуются протофиламенты, которые, в свою очередь, попарно переплетаются, образуя протофибриллы. Четыре протофибриллы сменяются одной цитокератиновой нитью.
Клеточная биология
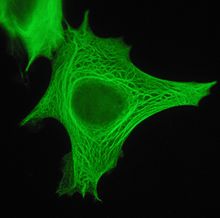
[ редактировать ]В цитоплазме кератиновые нити соединяются латерально друг с другом, образуя пучки радиусом ~50 нм. Радиус этих пучков определяется взаимодействием между электростатическим отталкиванием на больших расстояниях и гидрофобным притяжением на малых расстояниях. [7] Эти пучки кератина охватывают сложную сеть, которая простирается от поверхности ядра до клеточной мембраны. В возникновении и поддержании такой структуры участвуют многочисленные вспомогательные белки.
Эта ассоциация между плазматической мембраной и поверхностью ядра имеет важное значение для организации цитоплазмы и механизмов клеточной коммуникации. Помимо относительно статических функций, обеспечиваемых поддержкой ядра и обеспечением прочности клетки на растяжение, цитокератиновые сети подвергаются быстрой деполимеризации, опосредованной фосфатным обменом, что имеет важные последствия для более динамичных клеточных процессов, таких как митоз и постмитотический период, клеточный период. движение и дифференциация .
Цитокератины взаимодействуют с десмосомами и гемидесмосомами, тем самым участвуя в межклеточной адгезии и соединении базальных клеток с подлежащей соединительной тканью.
основе клеточной . мембраны Было исследовано, что промежуточные нити цитоскелета эукариот, одним из трех компонентов которых являются цитокератины, также связаны с белковой сетью комплекса анкирина и спектрина, лежащей в [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Херрманн Х, Бэр Х, Креплак Л, Стрелков СВ, Эби У (июль 2007 г.). «Промежуточные нити: от клеточной архитектуры к наномеханике». Нат. Преподобный мол. Клеточная Биол . 8 (7): 562–73. дои : 10.1038/nrm2197 . ПМИД 17551517 . S2CID 27115011 .
- ^ Франке В.В., Шмид Э., Осборн М., Вебер К. (июнь 1979 г.). «Нити эндотелиальных клеток человека среднего размера» . Журнал клеточной биологии . 81 (3): 570–80. дои : 10.1083/jcb.81.3.570 . ПМК 2110384 . ПМИД 379021 .
- ^ Швейцер Дж., Боуден П.Е., Куломб П.А. и др. (июль 2006 г.). «Новая консенсусная номенклатура кератинов млекопитающих» . Журнал клеточной биологии . 174 (2): 169–74. дои : 10.1083/jcb.200603161 . ПМК 2064177 . ПМИД 16831889 .
- ^ Рехтман, Наташа; Бишоп, Джастин А. (2011). Краткий справочник для хирургических патологов . Гейдельберг: Спрингер . стр. 4–8. ISBN 978-3-642-20085-4 .
- ^ Даббс, диджей (2010). Диагностическая иммуногистохимия: тераностические и геномные приложения (3-е изд.). Нью-Йорк: Сондерс.
- ^ Jump up to: а б с д и ж г час я дж к л м Мубио > МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ЦИТОКЕРАТИНАМ [ постоянная мертвая ссылка ] Проверено в октябре 2010 г.
- ^ Хаимов, Эхуд (июль 2020 г.). «Модель объединения кератиновых промежуточных нитей» . Биофизический журнал . 119 (1): 65–74. дои : 10.1016/j.bpj.2020.05.024 . ПМЦ 7335914 . ПМИД 32533940 .
Внешние ссылки
[ редактировать ]- Цитокератин Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)