Кубическая кристаллическая система



В кристаллографии кубическая . (или изометрическая ) кристаллическая система — это кристаллическая система которой элементарная ячейка имеет форму куба , Это одна из самых распространенных и простых форм, встречающихся в кристаллах и минералах .
Существует три основные разновидности этих кристаллов:
- Примитивная кубическая (сокращенно cP и альтернативно называемая простой кубической )
- Объемноцентрированная кубическая (сокращенно cI или bcc )
- Гранецентрированная кубическая (сокращенно cF или fcc )
Примечание: термин ГЦК часто используется как синоним кубической плотноупакованной или ГЦК- структуры, встречающейся в металлах. Однако fcc означает кубическую гранецентрированную решетку Браве, которая не обязательно является плотноупакованной, когда мотив устанавливается на точки решетки. Например, решетки алмаза и цинковой обманки являются ГЦК , но не плотноупакованы.Каждый подразделяется на другие варианты, перечисленные ниже. Хотя элементарные ячейки в этих кристаллах традиционно считаются кубами, примитивные элементарные ячейки часто таковыми не являются.
Решетки Браве
[ редактировать ]Три латекса Браве в кубической кристаллической системе:
| Решетка Браве | Примитивный кубический | Телоцентрированное кубический | Лицоцентрированное кубический |
|---|---|---|---|
| Символ Пирсона | КП | Там | CF |
| Элементарная ячейка | 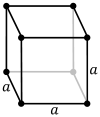 | 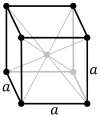 | 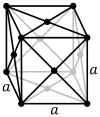 |
Примитивная кубическая решетка (cP) состоит из одной точки решетки в каждом углу куба; это означает, что каждая простая кубическая элементарная ячейка имеет всего одну точку решетки. Затем каждый атом в точке решетки поровну распределяется между восемью соседними кубами, и поэтому элементарная ячейка содержит всего один атом ( 1 ⁄ 8 × 8). [1]
Объемноцентрированная кубическая решетка (cI) имеет одну точку решетки в центре элементарной ячейки в дополнение к восьми угловым точкам. В общей сложности он имеет две точки решетки на элементарную ячейку ( 1 ⁄ 8 × 8 + 1). [1]
Гробоцентрированная кубическая решетка (cF) имеет точки решетки на гранях куба, каждая из которых дает ровно половину вклада в дополнение к угловым точкам решетки, что дает в общей сложности 4 точки решетки на элементарную ячейку ( 1 ⁄ 8 × 8 от углов плюс 1 ⁄ 2 ×6 от граней).
ГЦП-решетка тесно связана с гексагональной плотноупакованной (ГПУ) системой, где две системы отличаются только относительным расположением их гексагональных слоев. Плоскость [111] гранецентрированной кубической решетки представляет собой гексагональную сетку.
Попытка создать кубическую решетку с центром в основании (т. е. поместить дополнительную точку решетки в центр каждой горизонтальной грани) приводит к простой тетрагональной решетке Браве .
Координационное число (КЧ) — это количество ближайших соседей центрального атома в структуре. [1] Каждая сфера в решетке cP имеет координационное число 6, в решетке cI — 8, в решетке cF — 12.
Фактор упаковки атомов (APF) — это доля объема, занимаемая атомами. Решетка cP имеет APF около 0,524, решетка cI — APF около 0,680, а решетка cF — APF около 0,740.
Классы кристаллов
[ редактировать ]Названия классов изометрических кристаллических систем , точечные группы (в обозначениях Шенфлиса , обозначениях Германа-Могена , орбифолде и обозначениях Кокстера ), тип, примеры, международные таблицы для числа кристаллографических пространственных групп, [2] и пространственные группы перечислены в таблице ниже. Всего существует 36 кубических пространственных групп.
| Нет. | Группа точек | Тип | Пример | Космические группы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Имя [3] | Хороший. | Международный | Орб. | Кокс. | Примитивный | Лицоцентрированное | Телоцентрированное | |||
| 195–197 | Тетартоидный | Т | 23 | 332 | [3,3] + | энантиоморфный | Ульманнит , Хлорат натрия | P23 | F23 | I23 |
| 198–199 | П2 1 3 | И2 1 3 | ||||||||
| 200–204 | Диплоидный | Т ч | 2/m 3 (m 3 ) | 3*2 | [3 + ,4] | центросимметричный | Пирит | Пм3 , Пн3 | Фм3 , Фд3 | я 3 |
| 205–206 | PaПа3 | Я 3 | ||||||||
| 207–211 | Гироидальный | ТО | 432 | 432 | [3,4] + | энантиоморфный | Петцит | П432 , П4 2 32 | Ф432, Ф4 1 32 | I432 |
| 212–214 | П4 3 32, П4 1 32 | я4 1 32 | ||||||||
| 215–217 | Шеститраэдрический | Т д | 4 3м | *332 | [3,3] | Сфалерит | Р4 3м | Ф 4 3м | я 4 3 мес. | |
| 218–220 | П 4 3н | Ф 4 3с | я 4 3д | |||||||
| 221–230 | шестиоктаэдрический | Ой | 4/м 3 2/м (м 3 м) | *432 | [3,4] | центросимметричный | Галена , Халит | Пм 3 м, Пн 3 н, Пм 3 н , Пн 3 м | Фм 3 м , Фм 3 в, Фд 3 м, Фд 3 в | мне 3 м, мне 3 д |
Другими терминами для гексоктаэдра являются: нормальный класс, голоэдрический , дитессеральный центральный класс, галенитовый тип.
Одноэлементные конструкции
[ редактировать ]
Как правило, поскольку атомы в твердом теле притягиваются друг к другу, более плотно упакованные расположения атомов встречаются чаще. (Однако слабоупакованные структуры действительно встречаются, например, если орбитальная гибридизация требует определенных валентных углов .) Соответственно, примитивная кубическая структура с особенно низким коэффициентом упаковки атомов редко встречается в природе, но встречается в полонии . [4] [5] ОЦК с и ГЦК их более высокой плотностью довольно распространены в природе. Примеры ОЦК включают железо , хром , вольфрам и ниобий . Примеры FCC включают алюминий , медь , золото и серебро .
Другой важной кубической кристаллической структурой является кубическая структура алмаза, которая может встречаться в углероде , кремнии , германии и олове . В отличие от ГЦК и ОЦК, эта структура не является решеткой, поскольку содержит несколько атомов в своей примитивной ячейке . Другие кубические элементарные структуры включают структуру A15, обнаруженную в вольфраме , и чрезвычайно сложную структуру марганца .
Многоэлементные конструкции
[ редактировать ]Соединения, состоящие из более чем одного элемента (например, бинарные соединения ), часто имеют кристаллическую структуру, основанную на кубической кристаллической системе. Некоторые из наиболее распространенных из них перечислены здесь. Эти структуры можно рассматривать как две или более взаимопроникающие подрешетки, где каждая подрешетка занимает междоузлия других .
Строение хлорида цезия
[ редактировать ]
Одной из структур является «взаимопроникающая примитивная кубическая» структура, также называемая «хлоридом цезия» или структурой B2. Эту структуру часто путают с объемноцентрированной кубической структурой, поскольку расположение атомов такое же. Однако структура хлорида цезия имеет основу, состоящую из двух разных видов атомов. В объемноцентрированной кубической структуре будет существовать трансляционная симметрия вдоль направления [111]. В структуре хлорида цезия трансляция в направлении [111] приводит к смене частиц. Структуру также можно рассматривать как две отдельные простые кубические структуры, по одной каждого вида, которые накладываются друг на друга. Угол куба хлорида является центром куба цезия, и наоборот. [6]

То же самое происходит и со структурой NaCl, описанной в следующем разделе. Если вы удалите атомы Cl, оставшиеся атомы Na по-прежнему образуют структуру FCC, а не простую кубическую структуру.
В элементарной ячейке CsCl каждый ион находится в центре куба ионов противоположного сорта, поэтому координационное число равно восьми. Центральный катион координирован с 8 анионами в углах куба, как показано, и аналогичным образом центральный анион координирован с 8 катионами в углах куба. С другой стороны, можно рассматривать эту решетку как простую кубическую структуру со вторичным атомом в кубической пустоте .
Помимо самого хлорида цезия, эта структура проявляется и в некоторых других галогенидах щелочных металлов , полученных при низких температурах или высоких давлениях. [7] Как правило, такая структура, скорее всего, образована из двух элементов, ионы которых имеют примерно одинаковый размер (например, ионный радиус Cs + = 167 ч., и Cl − = 181 вечера).
Пространственная группа структуры хлорида цезия (CsCl) называется Pm 3 m (в обозначениях Германа – Могена ) или «221» (в Международных таблицах кристаллографии). Обозначение Strukturbericht - «B2». [8]
Существует около сотни редкоземельных интерметаллидов , кристаллизующихся в структуре CsCl, в том числе множество бинарных соединений редких земель с магнием , [9] и с элементами групп 11 , 12 , [10] [11] и 13 . Другими соединениями, имеющими структуру, подобную хлориду цезия, являются CsBr , CsI , высокотемпературный RbCl , AlCo, AgZn, BeCu, MgCe, RuAl и SrTl. [ нужна ссылка ]
Структура каменной соли
[ редактировать ]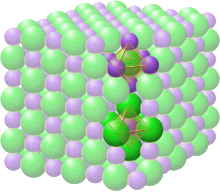
Пространственная группа структуры каменной соли или галита (хлорида натрия) обозначается как Fm 3 m (в обозначениях Германа – Могена ) или «225» (в Международных таблицах кристаллографии). Обозначение Strukturbericht - «B1». [12]
В структуре каменной соли каждый из двух типов атомов образует отдельную гранецентрированную кубическую решетку, причем две решетки взаимопроникают, образуя трехмерный шахматный узор. Структура каменной соли имеет октаэдрическую координацию : ближайшие соседи каждого атома состоят из шести атомов противоположного типа, расположенных как шесть вершин правильного октаэдра . В хлориде натрия соотношение атомов натрия и хлора составляет 1:1. Структуру также можно описать как ГЦК-решетку натрия с хлором, занимающим каждую октаэдрическую пустоту , или наоборот. [6]
Примеры соединений с такой структурой включают сам хлорид натрия, а также почти все другие галогениды щелочных металлов, а также «многие оксиды, сульфиды, селениды и теллуриды двухвалентных металлов». [7] Согласно правилу соотношения радиусов , такая структура с большей вероятностью образуется, если катион несколько меньше аниона (отношение радиусов катион/анион от 0,414 до 0,732).
Межатомное расстояние (расстояние между катионом и анионом, или половина длины элементарной ячейки a ) в некоторых кристаллах структуры каменной соли составляет: 2,3 Å (2,3 × 10 −10 м) для НаФ, [13] 2,8 Å для NaCl, [14] и 3,2 Å для SnTe. [15] Большинство щелочных металлов гидридов и галогенидов имеют структуру каменной соли, хотя некоторые вместо нее имеют структуру хлорида цезия .
Многие монооксиды переходных металлов также имеют структуру каменной соли ( TiO , VO , CrO , MnO , FeO , CoO , NiO , CdO ). Такую структуру имеют и ранние актиноидные монокарбиды ( ThC , PaC , UC , NpC , PuC ). [37]
Структура флюорита
[ редактировать ]Подобно структуре каменной соли, структура флюорита (AB 2 ) также представляет собой структуру Fm 3 m, но имеет соотношение ионов 1:2. Структура антифлюорита практически идентична, за исключением того, что в структуре поменяны положения анионов и катионов. Они обозначены позициями Вайкоффа 4a и 8c, тогда как позиции структур каменной соли — 4a и 4b. [48] [49]
Структура цинковой обманки
[ редактировать ]
Пространственная группа структуры Цин обманки называется F 4 3m (в обозначениях Германа–Могена ), или 216. [50] [51] Обозначение Strukturbericht - «B3». [52]
Структура цинковой обманки (также называемая «цинковой обманкой») названа в честь минерала цинковой обманки ( сфалерита ), одной из форм сульфида цинка (β-ZnS). Как и в структуре каменной соли, два типа атомов образуют две взаимопроникающие гранецентрированные кубические решетки. Однако она отличается от структуры каменной соли тем, как расположены две решетки относительно друг друга. Структура цинковой обманки имеет тетраэдрическую координацию : ближайшие соседи каждого атома состоят из четырех атомов противоположного типа, расположенных как четыре вершины правильного тетраэдра . В сульфиде цинка соотношение цинка и серы составляет 1:1. [6] В целом расположение атомов в структуре цинковой обманки такое же, как и в кубической структуре алмаза, но с чередованием типов атомов в разных узлах решетки. Структуру также можно описать как ГЦК-решетку цинка, в которой атомы серы занимают половину тетраэдрических пустот или наоборот. [6]
Примеры соединений с такой структурой включают саму цинковую обманку, нитрат свинца (II) , многие сложные полупроводники (такие как арсенид галлия и теллурид кадмия ) и широкий спектр других бинарных соединений. [ нужна ссылка ] Пниктогениды группы бора , а их цинкобманковые формы являются обычно имеют структуру цинковой обманки, хотя нитриды чаще встречаются в структуре вюрцита менее известными полиморфами . [53] [54]
| Фториды | Хлориды | Бромиды | Йодиды | |
|---|---|---|---|---|
| Медь | Фторид меди(I) | Хлорид меди(I) | Бромид меди(I) | Йодид меди(I) |
| Сульфиды | Селениды | Теллуриды | Полониды | |
|---|---|---|---|---|
| Бериллий | Сульфид бериллия | Селенид бериллия | Теллурид бериллия | Полонид бериллия [55] [56] |
| Цинк | Сульфид цинка | Селенид цинка | Теллурид цинка | Полонид цинка |
| Кадмий | Сульфид кадмия | Селенид кадмия | Теллурид кадмия | Полонид кадмия |
| Меркурий | Сульфид ртути | Селенид ртути | Теллурид ртути | – |
Эта группа также известна как II-VI семейство соединений , большинство из которых могут быть выполнены как в форме цинковой обманки (кубической), так и в вюрцитовой (гексагональной) форме.
| Нитриды | Фосфиды | Арсениды | Антимонид | |
|---|---|---|---|---|
| Бор | Нитрид бора * | Фосфид бора | Арсенид бора | Антимонид бора |
| Алюминий | Нитрид алюминия * | Фосфид алюминия | Арсенид алюминия | Антимонид алюминия |
| Галлий | Нитрид галлия * | Фосфид галлия | арсенид галлия | Антимонид галлия |
| Индий | Нитрид индия * | Фосфид индия | Арсенид индия | Антимонид индия |
Эта группа также известна как III-V семейство соединений .

Структура Гейслера
[ редактировать ]Структура Гейслера, основанная на структуре Cu 2 MnAl, является обычной структурой для тройных соединений с участием переходных металлов . Он имеет пространственную группу Fm 3 m (№ 225), а обозначение Strukturbericht — L2 1 . Вместе с близкородственными соединениями полугейслера и обратными соединениями гейслера существуют сотни примеров.
Структура моносилицида железа
[ редактировать ]
Пространственная группа структуры моносилицида железа — P2 1 3 (№ 198), а обозначение Strukturbericht — B20. Это киральная структура, иногда связанная с гелимагнитными свойствами. Всего в элементарной ячейке имеется четыре атома каждого элемента, всего восемь атомов.
Примеры встречаются среди силицидов и германидов переходных металлов, а также некоторых других соединений, таких как палладид галлия .
| Силициды | Германиды | |
|---|---|---|
| Марганец | Моносилицид марганца | Германид марганца |
| Железо | Моносилицид железа | Германид железа |
| Кобальт | Моносилицид кобальта | Германид кобальта |
| Хром | Силицид хрома(IV) | Германид хрома(IV) |
Структура Вейра – Фелана
[ редактировать ]
Структура Вейра–Фелана имеет симметрию Pm 3 n (223).
Он имеет три ориентации сложенных друг на друга тетрадекаэдров с пиритоэдрическими ячейками в промежутках. он встречается как кристаллическая структура В химии , где его обычно называют « клатратной структурой типа I». Газогидраты, образующиеся при низких температурах метаном, пропаном и углекислым газом, имеют структуру, в которой молекулы воды лежат в узлах структуры Вейра-Фелана и связаны между собой водородными связями , а более крупные молекулы газа заперты в полиэдрических клетках.
См. также
[ редактировать ]- Атомиум : здание, представляющее собой модель элементарной ячейки ОЦК с вертикальной диагональю тела.
- Плотная упаковка
- Дислокации
- Обратная решетка
Ссылки
[ редактировать ]- ^ Jump up to: а б с Де Вольф, премьер-министр; Белов, Н.В.; Берто, ЭФ; Бюргер, MJ; Донней, JDH; Фишер, В.; Хан, Т.; Копцик, В.А.; Маккей, Алабама; Вондратчек, Х.; Уилсон, AJC; Абрахамс, Южная Каролина (1985). «Номенклатура кристаллических семейств, типов решеток Браве и арифметических классов. Отчет Специального комитета Международного союза кристаллографии по номенклатуре симметрии» . Acta Crystallographica Раздел А. 41 (3): 278. doi : 10.1107/S0108767385000587 .
- ^ Принс, Э., изд. (2006). Международные таблицы по кристаллографии . дои : 10.1107/97809553602060000001 . ISBN 978-1-4020-4969-9 . S2CID 146060934 .
- ^ Кристаллография и минералы, упорядоченные по кристаллическим формам , Webmineral
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Первоначальное открытие было сделано в журнале J. Chem. Физ. 14 , 569 (1946).
- ^ Jump up to: а б с д «Кубические решетки и плотная упаковка» . 3 октября 2013 г. Архивировано из оригинала 01 ноября 2020 г.
- ^ Jump up to: а б Зейтц, Современная теория твердого тела (1940), стр.49.
- ^ Структура CsCl (B2), заархивировано 15 сентября 2008 г. в Wayback Machine.
- ^ Сакконе, А.; Дельфино, С.; Маччио, Д.; Ферро, Р. (1993). «Фазовые диаграммы магний-редкоземельные элементы: экспериментальное исследование системы Ho-Mg». Журнал фазовых равновесий . 14 (3): 280–287. дои : 10.1007/bf02668225 . S2CID 95011597 .
- ^ Канемату, К; Т. Альфиери, Г.; Бэнкс, Э. (1969). «Магнитные исследования редкоземельных соединений цинка со структурой CsCl». Журнал Физического общества Японии . 26 (2): 244–248. Бибкод : 1969JPSJ...26..244K . дои : 10.1143/jpsj.26.244 .
- ^ Бушоу, KHJ (1974). «Магнитные свойства редкоземельных соединений кадмия типа CsCl». Журнал химической физики . 61 (11): 4666–4670. Бибкод : 1974JChPh..61.4666B . дои : 10.1063/1.1681788 .
- ^ Структура NaCl (B1), заархивировано 19 октября 2008 г. в Wayback Machine.
- ^ Сандквист, Джей Джей; Лин, CC (1981). «Электронное строение F-центра в кристалле фторида натрия». Журнал физики C: Физика твердого тела . 14 (32): 4797–4805. Бибкод : 1981JPhC...14.4797S . дои : 10.1088/0022-3719/14/32/016 .
- ^ Абрахамс, Южная Каролина; Бернштейн, Дж. Л. (1965). «Точность автоматического дифрактометра. Измерение структурных факторов хлорида натрия». Акта Кристаллогр. 18 (5): 926–932. дои : 10.1107/S0365110X65002244 .
- ^ Као, В.; Перетти, Э. (1970). «Тройная подсистема Sn4As3-SnAs-SnTe». Журнал менее распространенных металлов . 22 :39–50. дои : 10.1016/0022-5088(70)90174-8 .
- ^ Jump up to: а б с Ж. Эгеперс, П. Моллард, Д. Девильерс, М. Чемла, Р. Фарон, Р. Романо, Дж. П. Куэр, «Неорганические соединения фтора» (раздел 4) в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Weinheim, 2005. два : 10.1002/14356007.a11_307 .
- ^ Брох, Эйнар (1 июня 1927 г.). «Прецизионное определение постоянной решетки соединений MgO, MgS, MgSe, MnO и MnSe». Журнал физической химии (на немецком языке). 127У (1): 446-454. дои : 10.1515/zpch-1927-12724 . S2CID 100227546 .
- ^ Мир, Шоукат Х.; Джа, Пракаш С.; Дабхи, Света; Джа, Прафулла К. (2016). « Ab initio исследование фазовой стабильности, динамики решетки и термодинамических свойств халькогенидов магния». Химия и физика материалов . 175 : 54–61. doi : 10.1016/j.matchemphys.2016.02.066 .
- ^ Луай, Л.; Хаддади, К.; Мауш, Д.; Али Сахрауи, Ф.; Хачеми, А. (2008). «Электронная зонная структура селенида кальция под давлением». Физика Б: Конденсированное вещество . 403 (18): 3022–3026. Бибкод : 2008PhyB..403.3022L . дои : 10.1016/j.physb.2008.03.009 .
- ^ Jump up to: а б с Браун, ЮАР; Браун, Польша (2019). Водная химия полония и практическое применение его термохимии . Эльзевир Наука. п. 25. ISBN 978-0-12-819309-9 .
- ^ Халлигер, Ф. (1979). «Глава 33 Редкоземельные пниктиды». Справочник по физике и химии редких земель . Том. 4. Эльзевир. стр. 153–236. дои : 10.1016/s0168-1273(79)04006-x . ISBN 9780444852168 .
- ^ Гшнейднер, К.А.; Колдервуд, ФРВ (1986). «Система As-Sc (мышьяк-скандий)». Бюллетень фазовых диаграмм сплавов . 7 (4): 348–349. дои : 10.1007/bf02873011 .
- ^ Хаяши, Дж; Широтани, я; Хирано, К; Ишимацу, Н; Шимомура, О; Кикегава, Т. (2003). «Структурный фазовый переход ScSb и YSb со структурой типа NaCl при высоких давлениях». Твердотельные коммуникации . 125 (10): 543–546. Бибкод : 2003SSCom.125..543H . дои : 10.1016/s0038-1098(02)00889-x .
- ^ Горовиц, Коннектикут (2012). Скандий. Его появление, химия, физика, металлургия, биология и технология . Эльзевир Наука. п. 273. ИСБН 978-0-323-14451-3 .
- ^ Jump up to: а б с д и ж г час я дж к Оно, С.; Деспо, Дж.Г.; Калверт, LD; Тейлор, Дж. Б. (1970). «Редкоземельные арсениды». Журнал менее распространенных металлов . 22 (1): 51–59. дои : 10.1016/0022-5088(70)90175-х .
- ^ Шмидт, Ф.А.; МакМастерс, О.Д.; Лихтенберг, Р.Р. (1969). «Система сплава иттрий-висмут». Журнал менее распространенных металлов . 18 (3): 215–220. дои : 10.1016/0022-5088(69)90159-3 .
- ^ Jump up to: а б с д и ж г час я дж к л м н Натали, Ф.; Рак, Би Джей; Планк, НОЯБРЬ; Тродал, Х.Дж.; Гранвилл, С.; Мейер, К.; Ламбрехт, WRL (2013). «Редкоземельные мононитриды». Прогресс в материаловедении . 58 (8): 1316–1360. arXiv : 1208.2410 . дои : 10.1016/j.pmatsci.2013.06.002 . S2CID 118566136 .
- ^ Jump up to: а б с д и Оно, С.; Номура, К.; Хаякава, Х. (1974). «Синтез новых редкоземельных фосфидов». Журнал менее распространенных металлов . 38 (2–3): 119–130. дои : 10.1016/0022-5088(74)90055-1 .
- ^ Jump up to: а б с д и ж г час я дж к Ёшихара, К.; Тейлор, Дж. Б.; Калверт, LD; Деспо, JG (1975). «Редкоземельные висмутиды». Журнал менее распространенных металлов . 41 (2): 329–337. дои : 10.1016/0022-5088(75)90038-7 .
- ^ Jump up to: а б с д и Хаяши, Дж.; Широтани, И.; Танака, Ю.; Адачи, Т.; Шимомура, О.; Кикегава, Т. (2000). «Фазовые переходы LnSb (Ln = лантаноид) со структурой типа NaCl при высоких давлениях». Твердотельные коммуникации . 114 (11): 561–565. Бибкод : 2000SSCom.114..561H . дои : 10.1016/s0038-1098(00)00113-7 .
- ^ Гшнейднер, К.А.; Колдервуд, ФРВ (1986). «Система As-Eu (Мышьяк-Европий)». Бюллетень фазовых диаграмм сплавов . 7 (3): 279–283. дои : 10.1007/bf02869009 .
- ^ Тейлор, Дж. Б.; Калверт, LD; Ван, Ю. (1979). «Данные о порошках некоторых новых антимонидов и висмутидов европия». Журнал прикладной кристаллографии . 12 (2): 249–251. дои : 10.1107/s0021889879012309 .
- ^ Окамото, Х. (1999). «Би-Yb (висмут-иттербий)». Журнал фазовых равновесий . 20 (4): 453. дои : 10.1361/105497199770335640 .
- ^ Дуань, Сюй; Ву, Фан; Чен, Цзя; Чжан, Пейран; Лю, Ян; Юань, Хуэйцю; Цао, Чао (2018). «Перестраиваемая электронная структура и топологические свойства LnPn (Ln=Ce, Pr, Sm, Gd, Yb; Pn=Sb, Bi)» . Физика связи . 1 (1): 71. arXiv : 1802.04554 . Бибкод : 2018CmPhy...1...71D . дои : 10.1038/s42005-018-0074-8 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т Крюгер, Огайо; Мозер, Дж. Б. (1967). «Константы решетки и температуры плавления соединений актинидной группы IVA-VIA со структурой типа NaCl». Журнал физики и химии твердого тела . 28 (11): 2321–2325. Бибкод : 1967JPCS...28.2321K . дои : 10.1016/0022-3697(67)90257-0 .
- ^ Jump up to: а б с д и ж г час я дж к Фогт, О.; Маттенбергер, К. (1995). «Магнетизм локализованных или почти локализованных оболочек 4f и 5f». Журнал сплавов и соединений . 223 (2): 226–236. дои : 10.1016/0925-8388(94)09005-х .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот Бенедикт, У.; Хользапфель, ВБ (1993). «Глава 113 Исследования высокого давления. Структурные аспекты». Лантаниды/актиниды: Физика I. Справочник по физике и химии редких земель. Том. 17. Эльзевир. стр. 245–300. дои : 10.1016/s0168-1273(05)80030-3 . ISBN 9780444815026 .
- ^ Jump up to: а б с Леже, Дж. М.; Якуби, Н.; Лорье, Дж. (1981). «Синтез монооксидов редкоземельных элементов». Журнал химии твердого тела . 36 (3): 261–270. Бибкод : 1981JSSCh..36..261L . дои : 10.1016/0022-4596(81)90436-9 .
- ^ Родхаммер, П.; Райхардт, В.; Хольцберг, Ф. (1978). «Поведение мягкого режима при фононной дисперсии YS». Письма о физических отзывах . 40 (7): 465–468. Бибкод : 1978PhRvL..40..465R . дои : 10.1103/physrevlett.40.465 .
- ^ Jump up to: а б с д и ж г час я дж к л м н Дидченко Р.; Горцема, Ф.П. (1963). «Некоторые электрические и магнитные свойства моносульфидов и нитридов редкоземельных элементов». Журнал физики и химии твердого тела . 24 (7): 863–870. Бибкод : 1963JPCS...24..863D . дои : 10.1016/0022-3697(63)90062-3 .
- ^ Jump up to: а б с д и ж Смоленский, Г.А.; Адамян, В.Е.; Логинов, Г.М. (1968). «Антиферромагнитные свойства легких монохалькогенидов редкоземельных элементов». Журнал прикладной физики . 39 (2): 786–790. Бибкод : 1968JAP....39..786S . дои : 10.1063/1.2163619 .
- ^ Jump up to: а б с д и ж г час Кершнер, CJ; ДеСандо, Р.Дж.; Гейдельберг, РФ; Штайнмейер, Р.Х. (1966). «Редкоземельные полониды». Журнал неорганической и ядерной химии . 28 (8): 1581–1588. дои : 10.1016/0022-1902(66)80054-4 .
- ^ Jump up to: а б Вахтер, П. (1972). «Оптико-электрические и магнитные свойства халькогенидов европия и пниктидов редкоземельных элементов». Критические обзоры CRC в области наук о твердом теле . 3 (2): 189–241. дои : 10.1080/10408437208244865 .
- ^ Мейер, Дж. (1991). Синтез соединений лантаноидов и актинидов . Дордрехт: Springer Нидерланды. п. 237. ИСБН 978-94-011-3758-4 . OCLC 840310000 .
- ^ Д'Ай, RWM; Селлман, П.Г. (1954). «Система торий-теллур». Дж. Хим. Соц. : 3760–3766. дои : 10.1039/jr9540003760 .
- ^ Фридрих, Александра; Винклер, Бьёрн; Хуарес-Арельяно, Эрик А.; Баяржаргал, Лхамсурен (2011). «Синтез бинарных нитридов, карбидов и боридов переходных металлов из элементов в нагретой лазером ячейке с алмазными наковальнями и их соотношение структура-свойство» . Материалы . 4 (10): 1648–1692. Бибкод : 2011Mate....4.1648F . дои : 10.3390/ma4101648 . ПМЦ 5448873 . ПМИД 28824101 .
- ^ Венкатраман, М.; Нойманн, JP (1990). «Система C-Cr (углерод-хром)». Бюллетень фазовых диаграмм сплавов . 11 (2): 152–159. дои : 10.1007/bf02841701 .
- ^ «Флюорит» . aflow.org . Проверено 22 мая 2020 г.
- ^ «Каменная соль» . aflow.org . Проверено 22 мая 2020 г.
- ^ Канторович, Л. (2004). Квантовая теория твердого тела . Спрингер. п. 32. ISBN 1-4020-2153-4 .
- ^ Биркбек-Колледж, Лондонский университет
- ^ Структура цинковой обманки (B3) . Лаборатория военно-морских исследований, США. Архивировано 19 октября 2008 г., в Wayback Machine.
- ^ Ван, Л.Д.; Квок, HS (2000). «Тонкие пленки кубического нитрида алюминия и нитрида галлия, полученные методом импульсного лазерного осаждения». Прикладная наука о поверхности . 154–155 (1–4): 439–443. Бибкод : 2000ApSS..154..439W . дои : 10.1016/s0169-4332(99)00372-4 .
- ^ Осеки, Масааки; Окубо, Кана; Кобаяши, Ацуши; Охта, Джитсуо; Фудзиока, Хироши (2014). «Полевые транзисторы на основе кубического нитрида индия» . Научные отчеты . 4 (1): 3951. Бибкод : 2014NatSR...4E3951O . дои : 10.1038/srep03951 . ПМЦ 3912472 . ПМИД 24492240 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Пергамон Пресс . п. 899. ИСБН 978-0-08-022057-4 . .
- ^ Мойер, Харви В. (1956). «Химические свойства полония». В Мойер, Харви В. (ред.). Полоний (Отчет). Ок-Ридж, Теннесси: Комиссия по атомной энергии США. стр. 33–96. дои : 10.2172/4367751 . ТИД-5221. .
Дальнейшее чтение
[ редактировать ]- Херлбат, Корнелиус С.; Кляйн, Корнелис, 1985, Руководство по минералогии , 20-е изд., Wiley, ISBN 0-471-80580-7
Внешние ссылки
[ редактировать ]- JMol Моделирование Университета Граца :
- Создание кристаллической структуры с помощью Molview