Галактоза оксидаза
| Галактоза оксидаза | |||
|---|---|---|---|
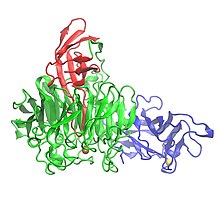 Кристаллическая структура галактозно оксидазы, показывающая три домена: домен 1 (синий), домен 2 (зеленый) и домен 3 (красный) | |||
| Идентификаторы | |||
| ЕС №. | 1.1.3.9 | ||
| CAS №. | 9028-79-9 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
Галактозе оксидаза ( D-галактоза: кислород 6-окиконкуктаза , d-галактоза оксидаза , бетагалактозе оксидаза ; сокращенная GAO , Gaox , Goase ; EC 1.1.3.9 ) является ферментом , который катализирует окисление у D-галактозы некоторых видов грибов грибов Полем [ 1 ] [ 2 ]
Галактозе оксидаза относится к семейству оксидоредуктаз . Медный ион требуется в качестве кофактора для галактозосидазы. Замечательной особенностью галактозносисидазы является то, что она является ферментом свободного радикала . [ 3 ] [ 4 ] Его каталитический сайт содержит свободный радикальный лиганд, координирующий в медном центре. [ 4 ] Этот свободный радикальный лиганд представляет собой ковалентно сшитые сшитые цистеиновые и тирозинные боковые цепи, которые образуются во время посттрансляционной модификации . [ 3 ] [ 4 ]
Фон
[ редактировать ]Обнаружено у нескольких видов грибов, таких как Fusarium graminearum nrrl 2903 (ранее неверно идентифицирован как Dactylium dendroides ), [ 5 ] и другие виды Fusarium и Aspergillus родов , [ 1 ] Галактозаксидаза была первой изолирована в 1959 году. [ 6 ] Этот фермент секретируется грибами для функционирования во внеклеточном пространстве. [ 1 ] [ 3 ] [ 7 ] Хотя реакция окисления D-галактозы дает галактозозсидазу его название, связанное снижение диоксина до перекиси водорода , как полагают, имеет большее физиологическое значение в дрожах. [ 3 ] [ 4 ] Перекись водорода, которая может быть получена в дрожжах таким образом, возможно, является бактериостатическим агентом . [ 3 ]
Белковая структура
[ редактировать ]Галактоза оксидаза содержит 639 аминокислот . [ 1 ] Это единственный пептидный мономер , который имеет три β-структурные домены . [ 1 ] [ 7 ] Домен 1 (остатки 1-155) представляет собой β-сандвич, состоящий из восьми антипараллельных β-нитей . [ 3 ] Он содержит возможный сайт связывания для NA + или 2+ , которые могут служить структурной роли в белке. [ 3 ] Другой особенностью домена 1 является присутствие сайта связывания углеводов, который направляет фермент связываться с внеклеточными углеводами. [ 3 ] Домен 2 (остатки 156-552) содержит сайт связывания меди. [ 1 ] Β-цепи в домене 2 организованы в виде семикратного винта, [ 1 ] и каждый из семи структурных единиц является поддоменом, состоящим из четырех антипараллельных β-нитей. [ 3 ] Домен 3 (остатки 553-639) состоит из семи антипараллельных β-цепи и образует «кепку» над доменом 2. Один гистидин (HIS581) домена 3 служит лигандом для меди, способствуя металлоконфессиональному активному сайту фермента. [ 1 ]
Активный сайт
[ редактировать ]
Галактозаксидаза является медным белком типа II . [ 1 ] [ 8 ] Он содержит единый медный центр, который принимает квадратную плоскую или квадратную пирамидальную координационную геометрию . [ 3 ] [ 4 ] [ 9 ] Медный центр имеет пять координационных лигандов: два тирозина (TYR272 и TYR495), два гистидина (HIS496 и HIS581) и молекула растворителя, которая обычно представляет собой воду. [ 3 ] [ 4 ] Медь в активном сайте галактозно оксидазы описывается как имеет «искаженную квадратную пирамидальную» координационную геометрию. [ 3 ] [ 4 ] Tyr495 - это осевой лиганд, остальные четыре лиганда лежат примерно в плоскости. Оба гистидина координируются с медью через 3-азот . [ 3 ] Copper-H 2 O Связь-самая длинная координатная связь ; [ 3 ] [ 4 ] Он лабильный и может быть заменен молекулой субстрата. Tyr272 образует димер с цистеином (Cys228) через орто-углерод тирозина и атомом серы цистеина, который подтверждается исследованиями рентгеновской кристаллографии . [ 1 ] [ 3 ] [ 4 ] [ 10 ] Поперечная связь Tyr-Cys уменьшает структурную гибкость Tyr272. [ 3 ] Этот сшитый тирозинат также является свободным радикалом. В полностью окисленной форме галактозно оксидазы пары свободных радикалов в центр меди (II) центрально , поддерживаемых спектроскопическими исследованиями EPR . [ 4 ] [ 6 ] Более того, формирование сшивающей связывания тиоэфиров , как полагают, снижает потенциал окисления Tyr272 феноксида , что делает этот феноксил более легко окисленным, образуя радикал в посттрансляционной модификации. [ 1 ] [ 3 ] [ 8 ]
Свободный радикал в галактозе оксидазе является необычно стабильным по сравнению со многими другими белками, свободными от белка. [ 2 ] [ 3 ] Свободный радикальный лиганд стабилизируется в основном двумя способами. Во-первых, как выявилось в области вычислительной химии , непарный электрон стабилизируется посредством делокализации ароматическим кольцом тирозина и сшитого цистеинового серы, при этом атомом кислорода Tyr272 обладает высокой неспаренной электронной плотностью . [ 1 ] [ 4 ] [ 9 ] Некоторые экспериментальные данные также свидетельствуют о том, что Axial Tyr495 также участвует в непарной электронной делокализации. [ 3 ] Во-вторых, индольное кольцо триптофана ( TRP290) находится выше и параллельно тирозин-цистеину, ведя себя как щит, защищающий радикал от внешней среды растворителя. [ 1 ] [ 3 ] [ 4 ] Поддерживающие доказательства исходят из этой мутации этого триптофана, приводит к более низкой стабильности активной формы галактозно оксидазы. [ 3 ] Кроме того, внешняя сфера активного участка состоит из многих ароматических остатков, которые придают активному сайту гидрофобный характер. [ 3 ] Существуют также обширные водородные сети, окружающие активное участие. [ 3 ]
Реакция
[ редактировать ]В дрожжах галактоза оксидаза катализирует следующую реакцию: [ 1 ] [ 4 ]
- D-галактоза + O 2 D-галакто-гексодиалдоза + H 2 O 2
Эта реакция по существу является окислением первичного спирта с использованием диоксигена с образованием соответствующего альдегида и перекиси водорода . [ 1 ] [ 4 ] Было показано, что галактозаксидаза также способна катализировать различные первичные спирты, кроме галактозы. [ 2 ] [ 3 ] Фактически, галактоза оксидаза катализирует дигидроксиацетон в три раза быстрее, чем до галактозы. [ 3 ] Реакция является региоселективной , поскольку она не может окислять вторичный алкоголь. [ 3 ]
Это двухэлектронное окисление достигается двойным восстановлением сайта: металлический центр меди (II) и свободный радикал, каждый из которых способен принимать один электрон от подложки. [ 4 ] Этот двойной центр Redox имеет три доступных уровня окисления. [ 4 ] В каталитическом цикле галактозно оксидазы фермент шаттлы между полностью окисленной формой и полностью восстановленной формой. [ 4 ] Полуоксидизированная форма является неактивной формой.

Каталитический механизм
[ редактировать ]Принятый каталитический механизм, называемый «механизм пинг-понга», состоит из четырех основных этапов. [ 1 ] [ 4 ] [ 9 ] [ 11 ] Первая стадия-это окисление субстрата двойным центром с двойным восстановлением. После того, как гидроксильная группа субстратного спирта занимает место координации растворителя, гидроксильная группа депротонируется TYR495, за которым следует высвобождение TYR495. [ 12 ] [ 1 ] Этот шаг делает алкоголь более подверженным окислению. [ 4 ] Протон на углероде, к которому была прикреплена гидроксильная группа, затем переносится в TYR272 (в качестве акцептора водорода) в сочетании с окислением субстрата. Один электрон идет к радикальному лиганду, другой электрон идет в центр меди (II), который затем превращается в медь (i) в результате. Между тем, радикал Tyr272 также уменьшается. [ 4 ] Стадия вычитания протона является определяющим и стереоспецифическим, поскольку только Pro- водород на спиртовом углероде удаляется (подтверждается исследованиями его кинетического изотопного эффекта). [ 1 ] [ 3 ] [ 4 ] Общим результатом стадии 1 является удаление двух атомов водорода и удаление двух электронов из субстрата, однако, порядок неясно. [ 1 ] [ 4 ] Второй этап - высвобождение окисленного субстрата (в этом случае альдегид) и координация диоксигена на сайте координации субстрата. На третьем этапе диоксиген быстро уменьшается на медь (i) с образованием супероксида . Супероксид-это реактивный вид, который вычитает протон и электрон из Tyr272 и переформирует радикал тирозина. На четвертой стадии гидропероксид депротонирует TYR496 и высвобождается как H 2 O 2 . Последующая осевая координация TYR496 и экваториальная координация новой молекулы субстрата в медный центр завершает оборот фермента.
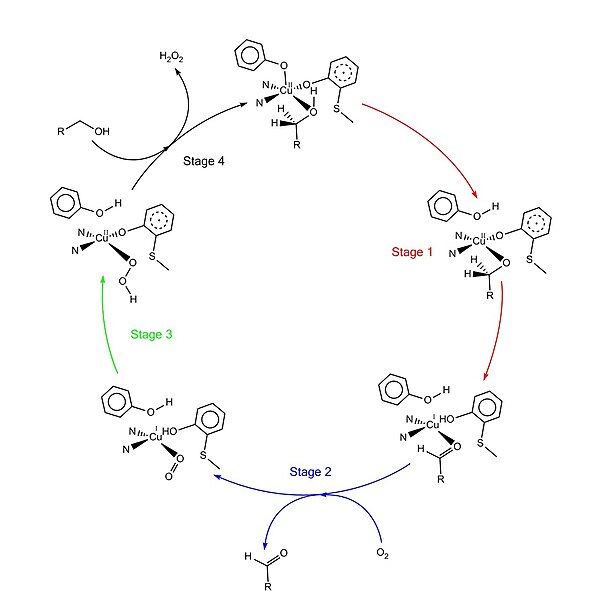
Посттрансляционная модификация
[ редактировать ]PREFRO -GAOX (галактоза оксидаза с сигнальной последовательности) дважды обрабатывается протеолитическим расщеплением в последовательности лидеров с образованием зрелого пептида GAOX (Pro -GAOX). [ 3 ] Первое расщепление удаляет последовательность из 24 аминокислот сигнальной пептидазой . [ 3 ] Второе расщепление удаляет другую последовательность из 17 аминокислот. [ 3 ]
Ковалентная связь между формами TYR272 и Cys228 после Pro -GAOX. проделана [ 4 ] Похоже, что возникновение этой модификации не требует никаких других «помощников» белков. [ 3 ] [ 10 ] Текущий механизм формирования этой ковалентной связи предполагает требование меди (i) и диоксигена. [ 3 ] [ 4 ] Механизм этой тирозин-цистеиновой связи не полностью понят, но было предсказано несколько ключевых событий: [ 1 ] Медь (i) координирует с Tyr272 и гистидинами на (будущем) активном сайте. Реакция Dioxygen с активным комплексом сайта генерирует промежуточное соединение свободных радикалов . две возможные формы свободного радикала, тийл и феноксила ; Возможны [ 3 ] Добавление тиельного радикала к фенолу или добавление феноксильного радикала к тиолу генерирует ковалентную связь между атомом серы цистеина и ароматическим кольцом тирозина; [ 2 ] Вторая молекула диоксигена реагирует с медным центром, координируемым с сшитым тирозином-цистеином для генерации комплекса радикала-коппера. [ 3 ] [ 4 ]
Приложения
[ редактировать ]Биоанализ
[ редактировать ]Биомолекулы в образцах, таких как галактоза, могут быть количественно определены с использованием метода обнаружения кислорода, поскольку одно эквивалентное потребление кислорода соответствует одному эквивалентному первичной гидроксильной группе, окисленной. [ 3 ] Образование перекиси водорода во время окисления субстрата также может использоваться для колориметрического обнаружения галактозы с использованием красителей, которые окисляются перекисью водорода. [ 3 ] Поскольку углеводы обычно могут иметь первичные гидроксильные группы, галактозосидаза может использоваться для модификации гликопротеинов клеточной поверхности для достижения маркировки клеток. [ 3 ]
Органический синтез
[ редактировать ]Галактозосидаза была использована в качестве биокатализатора в синтезе альдегидов и карбоновых кислот из первичных спиртов. [ 3 ]
Биомиметические соединения
[ редактировать ]Наше понимание механизма галактозосидазы вдохновляет исследователей разработать модельные соединения, которые имитируют структуру и функцию галактозозсидазы. [ 4 ] Похоже, что разделение электронов между медью и свободным радикалом является важным элементом успеха синтеза этих соединений. [ 4 ] Первым модельным соединением изготовленного GAOX является [Cu (II) (DNC)], который использует дункамин ( DNC ) в качестве хелатирующего лиганда . [ 3 ] Другие модельные соединения были изучены и зарегистрированы в литературе. [ 6 ] [ 8 ] [ 9 ] [ 13 ] [ 14 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т Bertini I, Sigel A, Sigel H, Eds. (2001). Справочник по металлопротеинам . Нью -Йорк, Нью -Йорк [UA]: Dekker. ISBN 978-0824705206 .
- ^ Jump up to: а беременный в дюймовый Tkac J, Vostiar I, Gemeiner P, Sturdik E (май 2002). «Косвенные доказательства прямой электронной связи между активным сайтом галактозно оксидазы и графитовым электродом». Биоэлектрохимия . 56 (1–2): 23–5. doi : 10.1016/s1567-5394 (02) 00043-9 . PMID 12009437 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь Whittaker JW (2002). "Галактозаксидаза". Достижения в химии белка . 60 : 1–49. doi : 10.1016/s0065-3233 (02) 60050-6 . ISBN 9780120342600 Полем PMID 12418174 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Bertini I, Grey HB, Stiefel EI, Valentine JS, Eds. (2006). Биологическая неорганическая химия: структура и реакционная способность . Sausalito, CA: Университетские научные книги. ISBN 978-1891389436 .
- ^ Ögel Z (апрель 1994 г.). «Споруляция, вызванная целлюлозой в грибке, продуцирующей галактозу оксидазу, Cladobotryum (dactylium) dendroides nrrl 2903 и его повторная идентификация как вид фусария». Микологические исследования . 98 (4): 474–480. doi : 10.1016/s0953-7562 (09) 81207-0 .
- ^ Jump up to: а беременный в Wang Y, Stack TD (январь 1996 г.). «Модель галактоз оксидазы: каталитическая реактивность». Журнал Американского химического общества . 118 (51): 13097–13098. doi : 10.1021/ja9621354 .
- ^ Jump up to: а беременный Барон А.Дж., Стивенс С., Уилмот С., Сеневиратне К.Д., Блейкли В., Дули Д.М., Филлипс С.Е., Ноулз П.Ф., МакФерсон М.Дж. (октябрь 1994). «Структура и механизм галактозносисидазы. Место свободного радикала» . Журнал биологической химии . 269 (40): 25095–105. doi : 10.1016/s0021-9258 (17) 31504-1 . PMID 7929198 .
- ^ Jump up to: а беременный в Вендт Ф., Рольф М., Тимм В., Натер С., Тучек Ф. (ноябрь 2013). «Маленькая модельная система галактозно оксидазы: геометрия, реакционная способность и электронная структура». Журнал неорганической и общей химии . 639 (14): 2502–2509. Doi : 10.1002/Zaac.201300475 .
- ^ Jump up to: а беременный в дюймовый Gamez P, Koval IA, Reedijk J (декабрь 2004 г.). «Био-имитирующая галактозосидазу и гемоцианин, два медных белка-обработки диоксигенов». Dalton Transactions (24): 4079–88. doi : 10.1039/b413535k . PMID 15573156 .
- ^ Jump up to: а беременный Ито Н., Филлипс С.Е., Стивенс С., Огель З.Б., МакФерсон М.Дж., Кин Дж. Н., Ядав К.Д., Ноулз П.Ф. (март 1991 г.). «Новая тиоэфирная связь, выявленная 1,7 кристаллической структурой галактозно оксидазы». Природа . 350 (6313): 87–90. doi : 10.1038/350087A0 . PMID 2002850 . S2CID 4345713 .
- ^ Himo F, Siegbahn PE (июнь 2003 г.). «Квантовые химические исследования радикалосодержащих ферментов». Химические обзоры . 103 (6): 2421–56. doi : 10.1021/cr020436s . PMID 12797836 .
- ^ Whittaker JW (июнь 2003 г.). «Свободный радикальный катализ галактозосидазой». Химические обзоры . 103 (6): 2347–63. doi : 10.1021/cr020425z . PMID 12797833 .
- ^ Таки М., Кумеи Х, Нагатомо С., Китагава Т., Ито С., Фукузуми С. (апрель 2000 г.). «Активные модели сайтов для галактозосидазы, содержащей две разные фенольные группы». Inorganica chimica acta . 300–302: 622–632. doi : 10.1016/s0020-1693 (99) 00579-4 .
- ^ Wang Y, Dubois JL, Hedman B, Hodgson KO, Stack TD (январь 1998 г.). «КАТАЛИТИЧЕСКАЯ МОДЕЛИ Галактозы оксидазы: биомиметическая Cu (II) -феноксилрадикальная реактивность». Наука . 279 (5350): 537–40. Bibcode : 1998sci ... 279..537W . doi : 10.1126/science.279.5350.537 . PMID 9438841 .
