Изотермический процесс
| Термодинамика |
|---|
 |
Изотермический процесс — это тип термодинамического процесса , при котором температура T системы чтобы остается постоянной: Δ T = 0. Обычно это происходит, когда система находится в контакте с внешним тепловым резервуаром , и изменения в системе происходят достаточно медленно, позволяют системе непрерывно подстраиваться под температуру резервуара посредством теплообмена (см. квазиравновесие ). Напротив, адиабатический процесс – это когда система не обменивается теплом с окружающей средой ( Q = 0).
Проще говоря, можно сказать, что в изотермическом процессе
- для идеальных газов Только внутренняя энергия
а в адиабатических процессах:
Этимология
[ редактировать ]Существительное «изотерма» происходит от древнегреческих слов ἴσος ( isos ), что означает «равный», и θέρμη ( thérmē ), что означает «тепло».
Примеры
[ редактировать ]Изотермические процессы могут происходить в любой системе, имеющей некоторые средства регулирования температуры, включая высокоструктурированные машины и даже живые клетки. Некоторые части циклов некоторых тепловых двигателей осуществляются изотермически (например, в цикле Карно ). [1] При термодинамическом анализе химических реакций обычно сначала анализируют то, что происходит в изотермических условиях, а затем рассматривают влияние температуры. [2] Фазовые изменения , такие как плавление или испарение , также являются изотермическими процессами, когда, как это обычно бывает, они происходят при постоянном давлении. [3] Изотермические процессы часто используются в качестве отправной точки при анализе более сложных неизотермических процессов.
Изотермические процессы представляют особый интерес для идеальных газов. Это следствие второго закона Джоуля , который гласит, что внутренняя энергия фиксированного количества идеального газа зависит только от его температуры. [4] Таким образом, в изотермическом процессе внутренняя энергия идеального газа постоянна. Это результат того, что в идеальном газе нет межмолекулярных сил . [4] Обратите внимание, что это верно только для идеальных газов; внутренняя энергия зависит от давления, а также от температуры для жидкостей, твердых тел и реальных газов. [5]
При изотермическом сжатии газа в системе совершается работа по уменьшению объема и увеличению давления. [4] Совершение работы над газом увеличивает внутреннюю энергию и будет иметь тенденцию к повышению температуры. Для поддержания постоянной температуры энергия должна покинуть систему в виде тепла и попасть в окружающую среду. Если газ идеальный, то количество энергии, поступающей в окружающую среду, равно работе, совершаемой над газом, поскольку внутренняя энергия не меняется. При изотермическом расширении энергия, подаваемая в систему, действует на окружающую среду. В любом случае, с помощью подходящего соединения изменение объема газа может совершить полезную механическую работу. Подробности расчетов см. в разделе Расчет работ .
Для адиабатического процесса , при котором тепло не поступает в газ и не выходит из него, поскольку его контейнер хорошо изолирован, Q = 0. Если также не совершается работа, т. е. происходит свободное расширение , внутренняя энергия не изменяется. Для идеального газа это означает, что процесс также изотермичен. [4] Таким образом, указания того, что процесс является изотермическим, недостаточно для определения уникального процесса.
Детали идеального газа
[ редактировать ]
Для частного случая газа, для которого действует закон Бойля [4] Если применимо, произведение pV ( p для давления газа и V для объема газа) является константой, если газ содержится в изотермических условиях. Значение константы равно nRT , где n — количество молей текущего газа, а R — постоянная идеального газа . Другими словами, действует закон идеального газа pV = nRT . [4] Поэтому:
держит. Семейство кривых, порожденных этим уравнением, показано на графике на рисунке 1. Каждая кривая называется изотермой, что означает кривую при одной и той же температуре T . Такие графики называются индикаторными диаграммами и впервые были использованы Джеймсом Уоттом и другими для мониторинга эффективности двигателей. Температура, соответствующая каждой кривой на рисунке, увеличивается слева направо вверх.
Расчет работы
[ редактировать ]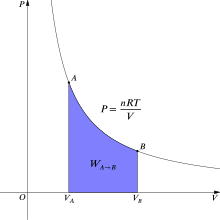
В термодинамике обратимая работа, совершаемая при переходе газа из состояния А в состояние В, равна [6]
где p — давление газа, а V — объем газа. Для изотермического (постоянная температура T ) обратимого процесса этот интеграл равен площади под соответствующей изотермой PV (давление-объем) и для идеального газа обозначен фиолетовым цветом на рисунке 2. Опять же, р = nRT / V Применяется , и при постоянном значении T (поскольку это изотермический процесс) выражение для работы принимает вид:
В конвенции ИЮПАК работа определяется как работа над системой в ее окружении. Если, например, система сжимается, то работа над системой совершается окружающей средой, поэтому работа положительна, а внутренняя энергия системы увеличивается. И наоборот, если система расширяется (т. е. расширяется вокруг системы, поэтому свободное расширение не имеет места), то работа отрицательна, поскольку система совершает работу с окружающей средой, и внутренняя энергия системы уменьшается.
Также стоит отметить, что для идеальных газов, если температура поддерживается постоянной, внутренняя энергия системы U также постоянна, и поэтому Δ U = 0. Поскольку Первый закон термодинамики гласит, что Δ U = Q + W в Согласно соглашению ИЮПАК , из этого следует, что Q = − W для изотермического сжатия или расширения идеальных газов.
Пример изотермического процесса
[ редактировать ]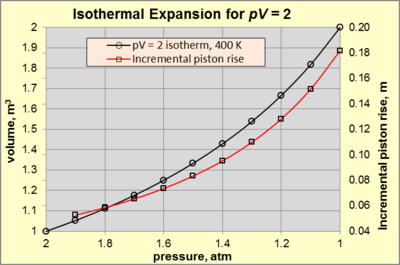
Обратимое расширение идеального газа можно использовать как пример работы, совершаемой в результате изотермического процесса. Особый интерес представляет степень, в которой тепло преобразуется в полезную работу, а также взаимосвязь между удерживающей силой и степенью расширения.
Во время изотермического расширения идеального газа и p , и V изменяются вдоль изотермы с постоянным произведением pV (т. е. постоянным T ). Рассмотрим рабочий газ в цилиндрической камере высотой 1 м и высотой 1 м. 2 площадь (так 1м 3 объём) при 400 К в статическом равновесии . Окружающая среда состоит из воздуха с температурой 300 К и давлением 1 атм (обозначается p surr ). Рабочий газ удерживается поршнем, соединенным с механическим устройством, оказывающим силу, достаточную для создания давления рабочего газа 2 атм (состояние А ). При любом изменении состояния А , вызывающем уменьшение силы, газ будет расширяться и совершать работу с окружающей средой. Изотермическое расширение продолжается до тех пор, пока приложенная сила уменьшается и добавляется соответствующее тепло, чтобы поддерживать pV = 2 [атм·м 3 ] (= 2 атм × 1 м 3 ). Расширение называется внутренне обратимым, если движение поршня достаточно медленное, так что в каждый момент расширения температура и давление газа однородны и соответствуют закону идеального газа . На рис. 3 показана зависимость p – V для pV = 2 [атм·м 3 ] для изотермического расширения от 2 атм (состояние А ) до 1 атм (состояние Б ).
Выполненная работа (обозначена ) состоит из двух компонентов. Во-первых, это работа расширения против давления окружающей атмосферы (обозначается как W p Δ V ), а во-вторых, полезная механическая работа (обозначается как W mech ). Выходным W механизмом здесь может быть движение поршня, используемого для поворота кривошипа, который затем поворачивает шкив, способный поднимать воду из затопленных соляных шахт .
Система достигает состояния B ( pV = 2 [атм·м 3 ] с p = 1 атм и V = 2 м 3 ), когда приложенная сила достигает нуля. В этот момент равен –140,5 кДж, а W p Δ V – –101,3 кДж. По разнице W мех = –39,1 кДж, что составляет 27,9% от тепла, подаваемого в процесс (- 39,1 кДж / – 140,5 кДж). Это максимальное количество полезной механической работы, которую можно получить в результате процесса при указанных условиях. Процент W mech является функцией pV и p surr и приближается к 100%, когда p surr приближается к нулю.
Чтобы понять природу изотермического расширения, обратите внимание на красную линию на рисунке 3. Фиксированное значение pV вызывает экспоненциальное увеличение подъема поршня по сравнению с уменьшением давления. Например, снижение давления с 2 до 1,9 атм вызывает подъем поршня на 0,0526 м. Для сравнения, снижение давления с 1,1 до 1 атм вызывает подъем поршня на 0,1818 м.
Изменения энтропии
[ редактировать ]Изотермические процессы особенно удобны для расчета изменения энтропии , поскольку в этом случае формула изменения энтропии Δ S имеет простой вид:
где Q rev — тепло, передаваемое (внутренне обратимое) системе, а T — абсолютная температура . [7] Эта формула справедлива только для гипотетического обратимого процесса ; то есть процесс, в котором равновесие поддерживается все время.
Простым примером является равновесный фазовый переход (такой как плавление или испарение), происходящий при постоянной температуре и давлении. При фазовом переходе при постоянном давлении переданное системе тепло равно энтальпии превращения Δ H tr , таким образом Q = Δ H tr . [3] При любом заданном давлении будет температура перехода T tr , при которой две фазы находятся в равновесии (например, нормальная температура кипения жидкости при давлении в одну атмосферу). Если переход происходит в таких условиях равновесия, приведенную выше формулу можно использовать для непосредственного расчета изменения энтропии. [7]
- .
Другим примером является обратимое изотермическое расширение (или сжатие) идеального газа от начального объема V A и давления P A до конечного объема V B и давления P B . Как показано в расчете работы , теплота, переданная газу, равна
- .
Этот результат относится к обратимому процессу, поэтому его можно подставить в формулу изменения энтропии, чтобы получить [7]
- .
Поскольку идеальный газ подчиняется закону Бойля , его при желании можно переписать в виде
- .
После получения эти формулы можно применить к необратимому процессу , например к свободному расширению идеального газа. Такое расширение также является изотермическим и может иметь те же начальное и конечное состояния, что и при обратимом расширении. Поскольку энтропия является функцией состояния (зависящей от состояния равновесия, а не от пути, по которому система достигает этого состояния), изменение энтропии системы такое же, как и в обратимом процессе, и определяется формулами выше. Обратите внимание, что результат Q = 0 для свободного расширения не может быть использован в формуле изменения энтропии, поскольку процесс необратим.
Разница между обратимым и необратимым заключается в энтропии окружающей среды. В обоих случаях окружающая среда имеет постоянную температуру T , так что Δ S sur = − К / Т ; знак минус используется, поскольку тепло, передаваемое в окружающую среду, равно по величине и противоположно по знаку теплу Q , передаваемому системе. В обратимом случае изменение энтропии окружающей среды равно и противоположно изменению системы, поэтому изменение энтропии Вселенной равно нулю. В необратимом случае Q = 0, поэтому энтропия окружающей среды не меняется и изменение энтропии Вселенной равно ΔS для системы.
См. также
[ редактировать ]- Эффект Джоуля – Томсона
- Джоулево расширение (также называемое свободным расширением )
- Адиабатический процесс
- Циклический процесс
- Изобарный процесс
- Изохорный процесс
- Политропный процесс
- Спонтанный процесс
Ссылки
[ редактировать ]- ^ Кинан, Дж. Х. (1970). «Глава 12: Циклы тепловых двигателей». Термодинамика . Кембридж, Массачусетс: MIT Press.
- ^ Рок, Пенсильвания (1983). «Глава 11: Термодинамика химических реакций». Химическая термодинамика . Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 0-935702-12-1 .
- ^ Jump up to: а б Петруччи, Р.Х.; Харвуд, Вашингтон; Херринг, ФГ; Мадура, JD (2007). «Глава 12». Общая химия . Река Аппер-Седл, Нью-Джерси: Пирсон. ISBN 978-0-13-149330-8 .
- ^ Jump up to: а б с д и ж Клотц, И.М.; Розенберг, Р.М. (1991). «Глава 6. Применение первого закона к газам». Химическая термодинамика . Мено-Парк, Калифорния: Бенджамин. [ ISBN отсутствует ]
- ^ Адкинс, CJ (1983). Равновесная термодинамика . Кембридж: Издательство Кембриджского университета. [ ISBN отсутствует ]
- ^ Аткинс, Питер (1997). «Глава 2: Первый закон: понятия». Физическая химия (6-е изд.). Нью-Йорк, штат Нью-Йорк: ISBN WH Freeman and Co. 0-7167-2871-0 .
- ^ Jump up to: а б с Аткинс, Питер (1997). «Глава 4: Второй закон: понятия». Физическая химия (6-е изд.). Нью-Йорк, штат Нью-Йорк: ISBN WH Freeman and Co. 0-7167-2871-0 .





























