Аполипопротеин Б
| АПОБ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | APOB , FLDB, LDLCQ4, апоВ-100, апоВ-48, аполипопротеин В, FCHL2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 107730 ; МГИ : 88052 ; Гомологен : 328 ; GeneCards : APOB ; ОМА : АПОБ – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Аполипопротеин B ( ApoB ) представляет собой белок , который у человека кодируется APOB геном . Его измерение обычно используется для выявления риска атеросклеротических сердечно-сосудистых заболеваний. [ 5 ] [ 6 ]
Функция
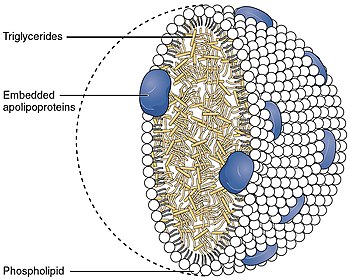
[ редактировать ]Аполипопротеин B является основным аполипопротеином хиломикронов ( ЛПНП , ЛПОНП , ЛП(а) , ЛПНП и частиц ЛПНП — широко известный как «плохой холестерин », когда речь идет как о болезнях сердца , так и о сосудистых заболеваниях в целом), который отвечает за перенос жира Молекулы ( липиды ), включая холестерин , распространяются по всему телу во все клетки всех тканей . Хотя все функциональные роли АпоВ в частицах ЛПНП (и во всех более крупных) остаются несколько неясными, он является основным организующим белком (всей сложной оболочки, заключающей/переносящей молекулы жира внутри) компонент частиц и абсолютно необходим для формирования этих частиц. Также ясно, что АпоВ на частице ЛПНП действует как лиганд для рецепторов ЛПНП в различных клетках по всему организму (т.е., менее формально, АпоВ указывает на то, что частицы, несущие жир, готовы проникнуть в любые клетки с рецепторами АпоВ и доставить жиры переносимые ). внутри клеток).
Благодаря лишь частично понятным механизмам, высокие уровни АпоВ, особенно связанные с более высокими концентрациями частиц ЛПНП, являются основным фактором образования бляшек , вызывающих сосудистые заболевания ( атеросклероз ), которые обычно сначала становятся очевидными симптомами в виде болезней сердца , инсульта и многих других осложнений, распространяющихся на весь организм. после десятилетий прогресса. Имеются убедительные доказательства того, что концентрации ApoB [ 7 ] [ 8 ] и особенно анализ ЯМР [ 9 ] (специфичные для концентраций частиц ЛПНП) являются лучшими индикаторами физиологии сосудистых/сердечных заболеваний, чем общий холестерин или холестерин ЛПНП (которые долгое время пропагандировались НИЗ, начиная с начала 1970-х годов). Однако, в первую очередь по историческим причинам стоимости/сложности, уровень холестерина и расчетный уровень ЛПНП холестерина остаются наиболее широко рекламируемым липидным тестом на фактор риска атеросклероза. ApoB обычно измеряют с помощью иммуноанализа, такого как ELISA или нефелометрии . Усовершенствованные и автоматизированные методы ЯМР позволяют различать измерения между множеством различных частиц ApoB.
Генетические нарушения
[ редактировать ]Высокие уровни АпоВ связаны с сердечно-сосудистыми заболеваниями. Гипобеталипопротеинемия — генетическое заболевание , которое может быть вызвано мутацией гена ApoB, APOB . [ 10 ] Абеталипопротеинемия обычно [ нечеткий ] вызвано мутацией гена MTP, MTP . [ 11 ]
Мутации в гене APOB100 также могут вызывать семейную гиперхолестеринемию . [ 12 ] наследственная (аутосомно-доминантная) форма метаболического нарушения – гиперхолестеринемия .
Исследования на мышах
[ редактировать ]Мышей использовали в качестве модельных организмов в исследовании ApoB, поскольку они экспрессируют эквивалентный белок, известный как мышиный ApoB (mApoB). У мышей со сверхэкспрессией мАпоВ повышены уровни ЛПНП и снижены уровни ЛПВП . [ 13 ] Мыши, содержащие только одну функциональную копию гена mApoB, демонстрируют противоположный эффект, будучи устойчивыми к гиперхолестеринемии . Мыши, не содержащие функциональных копий гена, нежизнеспособны. [ 14 ]
Молекулярная биология
[ редактировать ]Белок . встречается в плазме в двух основных изоформах: ApoB48 и ApoB100 Первый синтезируется исключительно тонким кишечником , второй — печенью . [ 15 ] ApoB-100 — самый крупный из белков группы апоВ, состоящий из 4563 аминокислот. [ 15 ] Обе изоформы кодируются APOB и одним транскриптом мРНК размером более 16 т.п.н. ApoB48 генерируется, когда стоп-кодон (UAA) в остатке 2153 создается путем редактирования РНК . По-видимому, существует транс -действующий тканеспецифичный ген сплайсинга, который определяет, какая изоформа в конечном итоге будет получена. [ нужна ссылка ] С другой стороны, есть некоторые свидетельства того, что цис -действующий элемент на несколько тысяч пар оснований выше определяет, какая изоформа образуется. [ нужна ссылка ]
В результате редактирования РНК ApoB48 и ApoB100 имеют общую N-концевую последовательность, но у ApoB48 отсутствует C-концевая область связывания рецептора ЛПНП ApoB100 . Фактически, ApoB48 назван так потому, что он составляет 48% последовательности ApoB100.
ApoB 48 представляет собой уникальный белок хиломикронов тонкого кишечника. После того как большая часть липидов хиломикрона абсорбируется, ApoB48 возвращается в печень как часть остатка хиломикрона, где подвергается эндоцитозу и расщеплению.
Клиническое значение
[ редактировать ]Преимущества
[ редактировать ]Роль во врожденной иммунной системе
[ редактировать ]Липопротеины очень низкой плотности и липопротеины низкой плотности мешают системе восприятия кворума , которая активирует гены, необходимые для инвазивной инфекции Staphylococcus aureus . Механизм антагонизма заключается в связывании ApoB с S. aureus феромоном аутоиндуктора , предотвращая передачу сигнала через его рецептор. Мыши с дефицитом ApoB более восприимчивы к инвазивной бактериальной инфекции. [ 16 ]
Побочные эффекты
[ редактировать ]Роль в инсулинорезистентности
[ редактировать ]Перепроизводство аполипопротеина B может привести к липид-индуцированному стрессу эндоплазматического ретикулума и резистентности к инсулину в печени. [ 17 ]
Роль в липопротеинах и атеросклерозе
[ редактировать ]ApoB100 обнаруживается в липопротеинах, происходящих из печени ( ЛПОНП , ЛПНП , ЛПНП). [ 18 ] ). Важно отметить, что на один липопротеин печеночного происхождения приходится одна молекула ApoB100. Следовательно, используя этот факт, можно количественно оценить количество частиц липопротеина, отметив общую концентрацию ApoB100 в кровообращении. Поскольку на частицу приходится один и только один ApoB100, количество частиц отражается концентрацией ApoB100. Тот же метод можно применить к отдельным классам липопротеинов (например, ЛПНП) и тем самым дать возможность их подсчитать .
Хорошо известно, что уровни ApoB100 связаны с ишемической болезнью сердца , они являются гораздо лучшим предиктором этого заболевания, чем концентрации LDL-C. [ 19 ] [ 20 ] [ 21 ] Причина: уровень холестерина ЛПНП не отражает фактическую концентрацию частиц, а холестерин не может растворяться или перемещаться (в воде) без частиц, переносящих его. Простой способ понять это наблюдение состоит в том, что ApoB100, один на частицу, отражает фактическую концентрацию частиц липопротеинов (независимо от содержания в них холестерина или других липидов). Таким образом, можно понять, что количество липопротеиновых частиц, содержащих ApoB100, которые могут переносить липиды в стенки артерий, является ключевым фактором, способствующим развитию атеросклероза и заболеваний сердца.
Один из способов объяснить вышеизложенное состоит в том, чтобы принять во внимание, что большое количество липопротеиновых частиц и, в частности, большое количество частиц ЛПНП приводит к конкуренции за рецептор АроВ100 (т.е. рецептор ЛПНП) периферических клеток. Поскольку такая конкуренция продлит время пребывания частиц ЛПНП в кровообращении, это может привести к увеличению возможностей их окисления и/или других химических модификаций. Такие модификации могут снизить способность частиц очищаться классическим рецептором ЛПНП и/или повысить их способность взаимодействовать с так называемыми рецепторами «мусорщиков». Конечным результатом является шунтирование частиц ЛПНП к этим рецепторам-мусорщикам. Рецепторы-мусорщики обычно обнаруживаются на макрофагах , причем макрофаги, нагруженные холестерином, более известны как « пенистые клетки ». Пенистые клетки характеризуют атеросклеротические поражения. Помимо этого возможного механизма образования пенных клеток, увеличение содержания химически модифицированных частиц ЛПНП может также приводить к увеличению эндотелия повреждение . Это происходит в результате токсического воздействия модифицированных ЛПНП на сосудистый эндотелий, а также их способности рекрутировать иммунные эффекторные клетки и способствовать активации тромбоцитов .
Исследование INTERHEART показало, что соотношение ApoB100/ApoA1 более эффективно для прогнозирования риска сердечного приступа у пациентов, перенесших острый инфаркт миокарда, чем измерение ApoB100 или ApoA1 по отдельности. [ 22 ] ( АпоА1 является основным белком ЛПВП. [ 23 ] ) В общей популяции это остается неясным, хотя в недавнем исследовании ApoB был самым сильным маркером риска сердечно-сосудистых событий. [ 24 ]
Средиземноморская диета рекомендуется как средство снижения уровня аполипопротеина B. [ 25 ]
Взаимодействия
[ редактировать ]Было показано, что ApoB взаимодействует с apo(a) , [ 26 ] ППИБ , [ 27 ] Рецептор кальцитонина [ 27 ] [ 28 ] и HSP90B1 . [ 27 ] [ 28 ] взаимодействие АпоВ с протеогликанами , коллагеном и фибронектином Считается, что вызывает атеросклероз . [ 29 ] [ 30 ]
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [ § 1 ]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Statin_Pathway_WP430» .
Регулирование
[ редактировать ]Экспрессия и APOB цис регулируется -регуляторными элементами в 5'-UTR 3'-UTR APOB. [ 31 ]
Редактирование РНК
[ редактировать ]мРНК , кодирующая этот белок, подвергается с превращением цитидина в уридин (C-U) сайт-специфическому редактированию РНК . ApoB100 и ApoB48 кодируются одним и тем же геном, однако различия в транслируемых белках обусловлены не альтернативным сплайсингом, а тканеспецифичным редактированием РНК. Редактирование мРНК ApoB было первым примером редактирования, наблюдаемым у позвоночных. [ 32 ] Редактирование мРНК ApoB происходит у всех плацентарных млекопитающих . [ 33 ] Редактирование происходит посттранскрипционно, поскольку образующиеся полинуклеотиды не содержат редактируемых нуклеозидов. [ 34 ]
Тип
[ редактировать ]Редактирование мРНК ApoB от C до U требует комплекса редактирования или голофермента (эдитосомы), состоящего из фермента редактирования C к U, фермента редактирования мРНК аполипопротеина B, каталитического полипептида 1 (ApoBEC-1), а также других вспомогательных факторов. ApoBEC-1 — это белок, который у человека кодируется геном APOBEC1 . [ 35 ] [1] Он принадлежит к семейству цитидиндезаминаз . Одного ApoBEC-1 недостаточно для редактирования мРНК ApoB. [ 36 ] и требует по крайней мере одного из этих вспомогательных факторов, фактора комплементации APOBEC1 (A1CF). [ 37 ] для редактирования. A1CF содержит 3 неидентичных повтора. Он действует как РНК-связывающая субъединица и направляет ApoBEC-1 к мРНК ApoB ниже отредактированного цитидина. [ 38 ] Известно, что в состав холофермента входят и другие вспомогательные факторы. Некоторые из этих белков были идентифицированы. это CUG-связывающий белок 2 ( CUGBP2 ), [ 39 ] SYNCRIP (РНК-связывающий белок, богатый глицином-аргинином-тирозином, GRY-RBP), [ 40 ] гетерогенный ядерный рибонуклеопротеин (hnRNP)-C1 ( HNRNPC ), [ 41 ] ApoBEC-1-связывающий белок ABBP1 ( HNRNPAB ), ABBP2, [ 42 ] Регуляторный связывающий белок сплайсинга KH-типа ( KHSRP ), Bcl-2-ассоциированный атаноген 4 ( BAG4 ), [ 43 ] и вспомогательный коэффициент (AUX)240. [ 44 ] Все эти белки были идентифицированы с помощью анализов обнаружения, и было продемонстрировано, что все они взаимодействуют с РНК ApoBEC-1, A1CF или ApoB. Функция этих вспомогательных белков в комплексе редактирования неизвестна. Помимо редактирования мРНК ApoB, редактома ApoBEC-1 также редактирует мРНК NF1 . Редактирование мРНК мРНК ApoB является наиболее ярким примером редактирования этого типа C в U РНК у людей.
Расположение
[ редактировать ]Несмотря на то, что длина транскрипта составляет 14 000 остатков, одиночный цитидин предназначен для редактирования. В составе мРНК АроВ обнаружена необходимая для редактирования последовательность, состоящая из 26 нуклеотидов. Это известно как мотив редактирования. Эти нуклеотиды (6662–6687) были признаны незаменимыми в ходе экспериментов по сайт-специфическому мутагенезу. [ 45 ] Часть этой последовательности, состоящая из 11 нуклеотидов и находящаяся на 4–5 нуклеотидов ниже сайта редактирования, представляет собой важную область, известную как швартовочная последовательность. [ 46 ] Область, называемая спейсерным элементом, находится на расстоянии 2–8 нуклеотидов между отредактированным нуклеозидом и этой прикрепляемой последовательностью. [ 47 ] Также имеется регуляторная последовательность 3' от сайта редактирования. Считается, что активный сайт ApoBEC-1, каталитического компонента редактирующего голофермента, связывается с богатой AU областью прикрепляемой последовательности с помощью ACF при связывании комплекса с мРНК. [ 48 ] Отредактированный остаток цитидина расположен в нуклеотиде 6666, расположенном в экзоне 26 гена. Редактирование на этом сайте приводит к замене кодона глутамина (CAA) на стоп-кодон внутрифрейма (UAA). [ 32 ] Компьютерное моделирование выявило возможность редактирования, отредактированный Цитидин расположен в петле. [ 46 ] Выбор отредактированного цитидина также сильно зависит от этой вторичной структуры окружающей РНК. Есть также некоторые указания на то, что эта петлевая область образуется между прикрепляемой последовательностью и 3'-регуляторной областью мРНК АроВ. [ 49 ] Предполагается, что предсказанная вторичная структура, образованная мРНК ApoB, обеспечивает контакт между редактируемым остатком и активным сайтом APOBEC1, а также связывание ACF и других вспомогательных факторов, связанных с эдитосомой.
Регулирование
[ редактировать ]Редактирование мРНК ApoB у человека регулируется тканями, при этом ApoB48 является основным белком ApoB тонкого кишечника у человека. В меньших количествах он встречается в толстой кишке, почках и желудке, а также в неотредактированной версии. [ 50 ] Редактирование также регулируется развитием: нередактированная версия транслируется только на ранних стадиях развития, но отредактированная форма увеличивается во время развития в тканях, где может происходить редактирование. [ 51 ] [ 52 ] Было показано, что уровни редактирования мРНК ApoB варьируются в зависимости от изменений в диете. воздействие алкоголя и гормональный фон. [ 53 ] [ 54 ] [ 55 ]
Сохранение
[ редактировать ]Редактирование мРНК ApoB также происходит у мышей и крыс. В отличие от человека редактирование происходит в печени мышей и крыс с частотой до 65%. [ 56 ] У птиц и более мелких видов он не наблюдался. [ 57 ]
Последствия
[ редактировать ]Структура
[ редактировать ]Редактирование приводит к изменению кодона, создавая стоп-кодон в кадре, что приводит к трансляции усеченного белка ApoB48. Этот стоп-кодон приводит к трансляции белка, у которого отсутствует карбоксильный конец, содержащий домен связывания LDLR белка. Полный белок ApoB100, содержащий около 4500 аминокислот, присутствует в ЛПОНП и ЛПНП. Поскольку многие части ApoB100 находятся в амфипатическом состоянии, структура некоторых его доменов зависит от основных липидных состояний. Однако известно, что ЛПНП имеют одинаковую общую структуру с пятью основными доменами. Недавно с помощью криоэлектронной микроскопии с разрешением 16 Ангстрем была обнаружена первая структура ЛПНП при температуре тела человека в нативном состоянии. [ 58 ] Была подтверждена общая укладка ApoB-100 и картирована некоторая гетерогенность в локальной структуре его доменов. [ нужна ссылка ]
Функция
[ редактировать ]Редактирование ограничивается теми транскриптами, которые экспрессируются в тонком кишечнике . Эта более короткая версия белка выполняет функцию, специфичную для тонкой кишки. Основная функция полноразмерной печени, экспрессирующей ApoB100, заключается в качестве лиганда для активации LDL-R. Однако в результате редактирования в белке отсутствует эта область связывания LDL-R белка. Это изменяет функцию белка и более короткого белка ApoB48 как специфические функции по отношению к тонкому кишечнику. ApoB48 идентичен 48% аминоконцевых ApoB100. [ 59 ] Функция этой изоформы заключается в всасывании жиров в тонкой кишке и участвует в синтезе, сборке и секреции хиломикронов . Эти хиломикроны транспортируют пищевые липиды к тканям, в то время как оставшиеся хиломикроны вместе с соответствующими остаточными липидами через 2–3 часа поглощаются печенью посредством взаимодействия аполипопротеина Е (АроЕ) с липопротеиновыми рецепторами. Это доминирующий белок ApoB в тонком кишечнике большинства млекопитающих. Это ключевой белок экзогенного пути метаболизма липопротеинов. Кишечные белки, содержащие ApoB48, метаболизируются до остатков хиломикронов, которые поглощаются остаточными рецепторами.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000084674 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000020609 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Главанович Т., Танасулис Г., де Грааф Дж., Кутюр П., Хегеле Р.А., Снайдерман А.Д. (октябрь 2022 г.). «Физиологические основы превосходства аполипопротеина B над холестерином липопротеинов низкой плотности и холестерином липопротеинов низкой плотности как маркера сердечно-сосудистого риска» . Журнал Американской кардиологической ассоциации . 11 (20): e025858. дои : 10.1161/JAHA.122.025858 . ПМЦ 9673669 . ПМИД 36216435 .
- ^ Бехбодиха Дж., Ахмед С., Элиаси А., Кассельман Л.Дж., Де Леон Дж., Гласс А.Д., Рейсс А.Б. (октябрь 2021 г.). «Аполипопротеин B и сердечно-сосудистые заболевания: биомаркер и потенциальная терапевтическая мишень» . Метаболиты . 11 (10): 690. дои : 10.3390/metabo11100690 . ПМК 8540246 . ПМИД 34677405 .
- ^ Лим Дж.С., Ли Д.Х., Пак Дж.И., Джин Ш., Джейкобс Д.Р. (2011). «Надежность измерения холестерина липопротеинов низкой плотности, холестерина липопротеинов низкой плотности и аполипопротеина B». Журнал клинической липидологии . 5 (4): 264–272. дои : 10.1016/j.jacl.2011.05.004 . ПМИД 21784371 .
- ^ Джейкобсон Т.А. (2011). «Открытие новой липидной «аптеки»: включение аполипопротеинов в качестве потенциальных факторов риска и целей лечения для снижения сердечно-сосудистого риска» . Труды клиники Мэйо . 86 (8): 762–780. дои : 10.4065/mcp.2011.0128 . ПМК 3146376 . ПМИД 21803958 .
- ^ Кармена Р., Дюрье П., Фрюшар Дж. К. (2004). «Атеросклероз: развитие сосудистой биологии и клинические последствия» . Тираж . 109 (23): III–2. дои : 10.1161/01.CIR.0000131511.50734.44 . ПМИД 15198959 .
- ^ Янг, Стивен Г.; Хабл, Сьюзен Т.; Чаппелл, Дэвид А.; Смит, Ричард С.; Клэйборн, Фредерика; Снайдер, Стивен М.; Тердиман, Джозеф Ф. (15 июня 1989 г.). «Семейная гипобеталипопротеинемия, связанная с мутантным видом аполипопротеина B (B-46)» . Медицинский журнал Новой Англии . 320 (24): 1604–1610. дои : 10.1056/NEJM198906153202407 . ISSN 0028-4793 . ПМИД 2725600 .
- ^ «Микросомальный белок-переносчик триглицеридов MTTP [Homo sapiens (человек)] - Ген - NCBI» . www.ncbi.nlm.nih.gov . Проверено 28 марта 2024 г.
- ^ Андерсен, Ларс Х.; Мисерес, Андре Р.; Ахмад, Захид; Андерсен, Рольф Л. (ноябрь 2016 г.). «Семейный дефектный аполипопротеин B-100: обзор» . Журнал клинической липидологии . 10 (6): 1297–1302. дои : 10.1016/j.jacl.2016.09.009 . ПМИД 27919345 .
- ^
 Маккормик С.П., Нг Дж.К., Вениант М., Борен Дж., Пьеротти В., Флинн Л.М. и др. (май 1996 г.). «Трансгенные мыши, которые сверхэкспрессируют мышиный аполипопротеин B. Доказательства того, что последовательности ДНК, контролирующие кишечную экспрессию гена аполипопротеина B, далеки от структурного гена» . Журнал биологической химии . 271 (20): 11963–11970. дои : 10.1074/jbc.271.20.11963 . ПМИД 8662599 .
Маккормик С.П., Нг Дж.К., Вениант М., Борен Дж., Пьеротти В., Флинн Л.М. и др. (май 1996 г.). «Трансгенные мыши, которые сверхэкспрессируют мышиный аполипопротеин B. Доказательства того, что последовательности ДНК, контролирующие кишечную экспрессию гена аполипопротеина B, далеки от структурного гена» . Журнал биологической химии . 271 (20): 11963–11970. дои : 10.1074/jbc.271.20.11963 . ПМИД 8662599 .
- ^
 Фарезе Р.В., Руланд С.Л., Флинн Л.М., Стоковски Р.П., Янг С.Г. (февраль 1995 г.). «Нокаут гена аполипопротеина B мыши приводит к эмбриональной смертности у гомозигот и защите от вызванной диетой гиперхолестеринемии у гетерозигот» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (5): 1774–1778. Бибкод : 1995PNAS...92.1774F . дои : 10.1073/pnas.92.5.1774 . ПМК 42602 . ПМИД 7878058 .
Фарезе Р.В., Руланд С.Л., Флинн Л.М., Стоковски Р.П., Янг С.Г. (февраль 1995 г.). «Нокаут гена аполипопротеина B мыши приводит к эмбриональной смертности у гомозигот и защите от вызванной диетой гиперхолестеринемии у гетерозигот» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (5): 1774–1778. Бибкод : 1995PNAS...92.1774F . дои : 10.1073/pnas.92.5.1774 . ПМК 42602 . ПМИД 7878058 .
- ^ Перейти обратно: а б Чен С.Х., Ян С.И., Чен П.Ф., Сетцер Д., Танимура М., Ли В.Х., Готто А.М. младший, Чан Л. (1986). «Полная кДНК и аминокислотная последовательность человеческого аполипопротеина B-100» . Журнал биологической химии . 261 (28): 12918–12921. дои : 10.1016/S0021-9258(18)69248-8 . ПМИД 3759943 .
- ^ Петерсон М.М., Мак Дж.Л., Холл П.Р., Алсуп А.А., Александр С.М., Салли Е.К., Савирес Ю.С., Ченг А.Л., Отто М., Грешам Х.Д. (2008). «Аполипопротеин B является врожденным барьером против инвазивной инфекции Staphylococcus aureus» . Клетка-хозяин и микроб . 4 (6): 507–509. дои : 10.1016/j.chom.2008.10.001 . ПМЦ 2639768 . ПМИД 19064256 .
- ^ Су Q, Цай Дж, Сюй Э, Цю В, Беречки Э, Санта М, Адели К (2009). «Аполипопротеин B100 действует как молекулярное звено между липид-индуцированным стрессом эндоплазматического ретикулума и печеночной резистентностью к инсулину» . Гепатология . 50 (1): 77–84. дои : 10.1002/hep.22960 . ПМИД 19434737 . S2CID 205869807 .
- ^ Энциклопедия MedlinePlus : Аполипопротеин B100
- ^ Кромвель В.К., Отвос Дж.Д., Киз М.Дж., Пенчина М.Дж., Салливан Л., Васан Р.С., Уилсон П.В., Д'Агостино Р.Б. (декабрь 2007 г.). «Количество частиц ЛПНП и риск будущих сердечно-сосудистых заболеваний в исследовании потомства во Фрамингеме - последствия для управления ЛПНП» . Журнал клинической липидологии . 1 (6): 583–592. дои : 10.1016/j.jacl.2007.10.001 . ПМЦ 2720529 . ПМИД 19657464 .
- ^ Снайдерман А.Д., Ламарш Б., Контуа Дж.Х., де Грааф Дж. (декабрь 2014 г.). «Анализ дискордантности и гордиев узел холестерина ЛПНП и не-ЛПВП по сравнению с апоВ». Современное мнение в липидологии . 25 (6): 461–467. дои : 10.1097/MOL.0000000000000127 . ПМИД 25340478 . S2CID 23464159 .
- ^ Главанович Т., Танасулис Г., Снайдерман А.Д. (2022). «Физиологические основы превосходства аполипопротеина B над холестерином липопротеинов низкой плотности и холестерином липопротеинов низкой плотности как маркера сердечно-сосудистого риска» . Журнал Американской кардиологической ассоциации . 11 (20): e025858. дои : 10.1161/JAHA.122.025858 . ПМЦ 9673669 . ПМИД 36216435 .
- ^ МакКуин М.Дж., Хокен С., Ван Х., Оунпуу С., Снайдерман А., Пробстфилд Дж., Стейн К., Сандерсон Дж.Е., Хасани М., Волкова Е., Казми К., Юсуф С. (июль 2008 г.). «Липиды, липопротеины и аполипопротеины как маркеры риска инфаркта миокарда в 52 странах (исследование INTERHEART): исследование случай-контроль». Ланцет . 372 (9634): 224–233. дои : 10.1016/S0140-6736(08)61076-4 . ПМИД 18640459 . S2CID 26567691 .
- ^ EP Ван дер Ворста (2020). «Липопротеины высокой плотности и аполипопротеин А1». Дыхательные белки, липопротеины и другие белки телесных жидкостей позвоночных и беспозвоночных . Субклеточная биохимия. Том. 94. стр. 399–420. дои : 10.1007/978-3-030-41769-7_16 . ISBN 978-3-030-41768-0 . ПМИД 32189309 . S2CID 213180689 .
- ^ Бенн М., Нордестгаард Б.Г., Йенсен ГБ, Тибьерг-Хансен А (2007). «Улучшение прогнозирования ишемических сердечно-сосудистых заболеваний у населения в целом с использованием аполипопротеина B: исследование сердца в Копенгагене» . Артериосклеры Тромб Васк Биол . 27 (3): 661–670. doi : 10.1161/01.ATV.0000255580.73689.8e . ПМИД 17170368 .
- ^ Ламантия В., Снайдерман А., Фарадж М. (2016). «Питательное управление гиперапоБ». Обзоры исследований в области питания . 29 (2): 202–233. дои : 10.1017/S0954422416000147 . ПМИД 27821191 .
- ^ Малагуарнера М, Ваканте М, Руссо С, Малагуарнера Г, Антич Т, Малагуарнера Л, Белла Р, Пенниси Дж, Гальвано Ф, Фриджиола А (2013). «Липопротеин(а) при сердечно-сосудистых заболеваниях» . БиоМед Исследования Интернэшнл . 2013 (650989): 1–9. дои : 10.1155/2013/650989 . ПМК 3591100 . ПМИД 23484137 .
- ^ Перейти обратно: а б с Чжан Дж., Херсковиц Х. (февраль 2003 г.). «Нарождающийся липидный аполипопротеин B транспортируется в аппарат Гольджи в виде неполностью свернутого промежуточного продукта, что подтверждается его ассоциацией с сетью молекулярных шаперонов эндоплазматического ретикулума, GRP94, ERp72, BiP, кальретикулином и циклофилином B» . Ж. Биол. Хим . 278 (9): 7459–7468. дои : 10.1074/jbc.M207976200 . ПМИД 12397072 .
- ^ Перейти обратно: а б Линник К.М., Герсковиц Х. (август 1998 г.). «Множественные молекулярные шапероны взаимодействуют с аполипопротеином B во время его созревания. Сеть резидентных шаперонов эндоплазматического ретикулума (ERp72, GRP94, кальретикулин и BiP) взаимодействует с аполипопротеином b независимо от его состояния липидации» . Ж. Биол. Хим . 273 (33): 21368–21373. дои : 10.1074/jbc.273.33.21368 . ПМИД 9694898 .
- ^ Халил М.Ф., Вагнер В.Д., Голдберг И.Дж. (2004). «Липопротеин(а) при сердечно-сосудистых заболеваниях» . Атеросклероз, тромбоз и сосудистая биология . 24 (12): 2211–2218. дои : 10.1161/01.ATV.0000147163.54024.70 . ПМИД 15472124 .
- ^ Табас I, Уильямс К.Дж., Борен Дж. (2007). «Субэндотелиальная задержка липопротеинов как инициирующий процесс атеросклероза: обновленная информация и терапевтические последствия» . Тираж . 116 (16): 1832–1844. дои : 10.1161/circulationaha.106.676890 . ПМИД 17938300 .
- ^ Понтрелли Л., Сидиропулос К.Г., Адели К. (2004). «Трансляционный контроль мРНК аполипопротеина B: регуляция с помощью цис-элементов в 5'- и 3'-нетранслируемых областях». Биохимия . 43 (21): 6734–6744. дои : 10.1021/bi049887s . ПМИД 15157107 .
- ^ Перейти обратно: а б Пауэлл Л.М., Уоллис С.К., Пиз Р.Дж., Эдвардс Ю.Х., Нотт Т.Дж., Скотт Дж. (сентябрь 1987 г.). «Новая форма тканеспецифической обработки РНК производит аполипопротеин-B48 в кишечнике». Клетка . 50 (6): 831–840. дои : 10.1016/0092-8674(87)90510-1 . ПМИД 3621347 . S2CID 37938313 .
- ^ Фуджино Т., Наваратнам Н., Джармуз А., фон Хэзелер А., Скотт Дж. (июль 1999 г.). «C → U редактирование мРНК аполипопротеина B у сумчатых: идентификация и характеристика APOBEC-1 американского опоссума Monodelphus Domestica» . Нуклеиновые кислоты Рез. 27 (13): 2662–2671. дои : 10.1093/нар/27.13.2662 . ПМК 148475 . ПМИД 10373583 .
- ^ Лау П.П., Сюн В.Дж., Чжу Х.Дж., Чен Ш., Чан Л. (октябрь 1991 г.). «Редактирование мРНК аполипопротеина B — это внутриядерное событие, которое происходит посттранскрипционно и совпадает со сплайсингом и полиаденилированием» . Ж. Биол. Хим . 266 (30): 20550–20554. дои : 10.1016/S0021-9258(18)54960-7 . ПМИД 1939106 .
- ^ «Ген APOBEC1 - GeneCards | Белок ABEC1 | Антитело ABEC1» . Архивировано из оригинала 26 июля 2011 г. Проверено 24 февраля 2011 г.
- ^ Наваратнам Н., Фуджино Т., Бейлисс Дж., Джармуз А., Хоу А., Ричардсон Н., Сомасекарам А., Бхаттачарья С., Картер С., Скотт Дж. (январь 1998 г.). «Цитидиндезаминаза Escherichia coli обеспечивает молекулярную модель редактирования РНК ApoB и механизм распознавания субстрата РНК». Дж. Мол. Биол. 275 (4): 695–714. дои : 10.1006/jmbi.1997.1506 . ПМИД 9466941 .
- ^ «Ген A1CF - GeneCards | Белок A1CF | Антитело A1CF» . Архивировано из оригинала 26 июля 2011 г. Проверено 24 февраля 2011 г.
- ^ Блан В., Кеннеди С., Дэвидсон Н.О. (октябрь 2003 г.). «Новый сигнал ядерной локализации во вспомогательном домене фактора комплементации апобек-1 регулирует ядерно-цитоплазматический импорт и передвижение» . Ж. Биол. Хим . 278 (42): 41198–41204. дои : 10.1074/jbc.M302951200 . ПМИД 12896982 .
- ^ Анант С., Хендерсон Дж.О., Мукхопадьяй Д., Наваратнам Н., Кеннеди С., Мин Дж., Дэвидсон Н.О. (декабрь 2001 г.). «Новая роль РНК-связывающего белка CUGBP2 в редактировании РНК млекопитающих. CUGBP2 модулирует редактирование мРНК аполипопротеина B от C до U путем взаимодействия с апобек-1 и A1CF, фактором комплементации апобек-1» . Ж. Биол. Хим . 276 (50): 47338–47351. дои : 10.1074/jbc.M104911200 . ПМИД 11577082 .
- ^ Блан В., Наваратнам Н., Хендерсон Д.О., Анант С., Кеннеди С., Джармуз А., Скотт Дж., Дэвидсон Н.О. (март 2001 г.). «Идентификация GRY-RBP как РНК-связывающего белка аполипопротеина B, который взаимодействует как с апобек-1, так и с фактором комплементации апобек-1, модулируя редактирование C в U» . Ж. Биол. Хим . 276 (13): 10272–10283. дои : 10.1074/jbc.M006435200 . ПМИД 11134005 .
- ^ Грив Дж., Леллек Х., Раутенберг П., Гретен Х. (1998). «Ингибирование ферментного комплекса редактирования мРНК аполипопротеина B с помощью белка hnRNP C1 и комплексов 40S hnRNP». Биол. хим. 379 (8–9): 1063–1073. дои : 10.1515/bchm.1998.379.8-9.1063 . ПМИД 9792439 . S2CID 25911416 .
- ^ Лау П.П., Вильянуэва Х., Кобаяши К., Накамута М., Чанг Б.Х., Чан Л. (декабрь 2001 г.). «Белок DnaJ, белок-2, связывающий апобек-1, модулирует редактирование мРНК аполипопротеина B» . Ж. Биол. Хим . 276 (49): 46445–46452. дои : 10.1074/jbc.M109215200 . ПМИД 11584023 .
- ^ Лау П.П., Чан Л. (декабрь 2003 г.). «Участие регулятора-шаперона, Bcl2-ассоциированного атаногена-4, в редактировании мРНК аполипопротеина B» . Ж. Биол. Хим . 278 (52): 52988–52996. дои : 10.1074/jbc.M310153200 . ПМИД 14559896 .
- ^ Шок Д., Куо С.Р., Стейнбург М.Ф., Болоньино М., Спаркс Дж.Д., Спаркс К.Э., Смит Х.К. (февраль 1996 г.). «В редактировании РНК аполипопротеина B участвует вспомогательный фактор, содержащий белковый комплекс массой 240 кДа» . Учеб. Натл. акад. наук. США 93 (3): 1097–1102. Бибкод : 1996PNAS...93.1097S . дои : 10.1073/pnas.93.3.1097 . ПМК 40037 . ПМИД 8577721 .
- ^ Дэвис М.С., Уоллис С.К., Дрисколл Д.М., Винн Дж.К., Уильямс Г.В., Пауэлл Л.М., Скотт Дж. (август 1989 г.). «Требования к последовательности для редактирования РНК аполипопротеина B в трансфицированных клетках гепатомы крысы» . Ж. Биол. Хим . 264 (23): 13395–13398. дои : 10.1016/S0021-9258(18)80008-4 . ПМИД 2760026 .
- ^ Перейти обратно: а б Шах Р.Р., Нотт Т.Дж., Легрос Дж.Е., Наваратнам Н., Грив Дж.К., Скотт Дж. (сентябрь 1991 г.). «Требования к последовательности для редактирования мРНК аполипопротеина B» . Ж. Биол. Хим . 266 (25): 16301–16304. дои : 10.1016/S0021-9258(18)55296-0 . ПМИД 1885564 .
- ^ Дрисколл Д.М., Лакхе-Редди С., Олекса Л.М., Мартинес Д. (декабрь 1993 г.). «Индукция редактирования РНК в гетерологичных сайтах с помощью последовательностей мРНК аполипопротеина B» . Мол. Клетка. Биол. 13 (12): 7288–7294. дои : 10.1128/MCB.13.12.7288 . ПМЦ 364799 . ПМИД 8246950 .
- ^ Грив Дж., Наваратнам Н., Скотт Дж. (июль 1991 г.). «Характеристика фермента редактирования мРНК аполипопротеина B: нет сходства с предполагаемым механизмом редактирования РНК у простейших кинетопластид» . Нуклеиновые кислоты Рез. 19 (13): 3569–3576. дои : 10.1093/нар/19.13.3569 . ПМЦ 328381 . ПМИД 1649450 .
- ^ Ричардсон Н., Наваратнам Н., Скотт Дж. (ноябрь 1998 г.). «Вторичная структура сайта редактирования мРНК аполипопротеина B. Au-связывающие белки взаимодействуют со стволовой петлей» . Ж. Биол. Хим . 273 (48): 31707–31717. дои : 10.1074/jbc.273.48.31707 . ПМИД 9822632 .
- ^ Тенг Б., Верп М., Саломон Дж., Дэвидсон Н.О. (ноябрь 1990 г.). «Редактирование информационной РНК аполипопротеина B регулируется в процессе развития и широко экспрессируется в тканях человека» . Ж. Биол. Хим . 265 (33): 20616–20620. дои : 10.1016/S0021-9258(17)30547-1 . ПМИД 2243107 .
- ^ Ву Дж.Х., Семенкович К.Ф., Чен Ш., Ли В.Х., Чан Л. (июль 1990 г.). «Редактирование мРНК аполипопротеина B. Проверка чувствительного анализа и биологии развития редактирования РНК у крыс» . Ж. Биол. Хим . 265 (21): 12312–12316. дои : 10.1016/S0021-9258(19)38347-4 . ПМИД 2373694 .
- ^ Гликман Р.М., Роджерс М., Гликман Дж.Н. (июль 1986 г.). «Синтез аполипопротеина B в печени и кишечнике человека in vitro» . Учеб. Натл. акад. наук. США 83 (14): 5296–5300. Бибкод : 1986PNAS...83.5296G . дои : 10.1073/pnas.83.14.5296 . ПМК 323938 . ПМИД 3460091 .
- ^ Баум К.Л., Тенг Б.Б., Дэвидсон Н.О. (ноябрь 1990 г.). «Редактирование информационной РНК аполипопротеина B в печени крыс. Модуляция с помощью голодания и возобновления диеты с высоким содержанием углеводов» . Ж. Биол. Хим . 265 (31): 19263–19270. дои : 10.1016/S0021-9258(17)30653-1 . ПМИД 2229075 .
- ^ Лау П.П., Кэхилл DJ, Чжу Х.Дж., Чан Л. (октябрь 1995 г.). «Этанол модулирует редактирование мРНК аполипопротеина B у крыс» . Дж. Липид Рез. 36 (10): 2069–2078. дои : 10.1016/S0022-2275(20)39192-6 . ПМИД 8576634 .
- ^ Чан Л., Чанг Б.Х., Накамута М., Ли В.Х., Смит Л.К. (март 1997 г.). «Редактирование мРНК Apobec-1 и аполипопротеина B». Биохим. Биофиз. Акта . 1345 (1): 11–26. дои : 10.1016/S0005-2760(96)00156-7 . ПМИД 9084497 .
- ^ Чан Л. (январь 1993 г.). «Редактирование РНК: изучение одного режима мРНК аполипопротеина B». Биоэссе . 15 (1): 33–41. дои : 10.1002/bies.950150106 . PMID 8466474 . S2CID 314984 .
- ^ Таруги П., Альбертацци Л., Николини С., Каландра С. (март 1990 г.). «Отсутствие аполипопротеина В-48 у цыпленка Gallus Domesticus» . Дж. Липид Рез. 31 (3): 417–427. дои : 10.1016/S0022-2275(20)43164-5 . hdl : 11380/742118 . ПМИД 2341807 .
- ^ Кумар В., Батчер С.Дж., Эрни К., Энгельхардт П., Хейкконен Дж., Каски К., Ала-Корпела М., Кованен П.Т. (май 2011 г.). «Трехмерная криоЭМ-реконструкция нативных частиц ЛПНП с разрешением 16 Å при физиологической температуре тела» . ПЛОС ОДИН . 6 (5): e18841. Бибкод : 2011PLoSO...618841K . дои : 10.1371/journal.pone.0018841 . ПМК 3090388 . ПМИД 21573056 .
- ^ Нотт Т.Дж., Пиз Р.Дж., Пауэлл Л.М., Уоллис С.К., Ралл С.С., Иннерарити Т.Л., Блэкхарт Б., Тейлор В.Х., Марсель Ю., Милн Р. (1986). «Полная белковая последовательность и идентификация структурных доменов аполипопротеина B человека». Природа . 323 (6090): 734–738. Бибкод : 1986Natur.323..734K . дои : 10.1038/323734a0 . ПМИД 3773997 . S2CID 536926 .
Дальнейшее чтение
[ редактировать ]- Махли Р.В., Иннерарити Т.Л., Ралл СК, Вайсграбер К.Х. (1985). «Липопротеины плазмы: структура и функция аполипопротеина» . Дж. Липид Рес . 25 (12): 1277–1294. дои : 10.1016/S0022-2275(20)34443-6 . ПМИД 6099394 .
- Итакура Х, Мацумото А (1995). «[Аполипопротеин B] Ниппонские исследования . 52 (12): 3113–3118. ПМИД 7853698 .
- Чумакова О.С., Затейщиков Д.А., Сидоренко Б.А. (2006). «[Аполипопротеин B: структура, функция, полиморфизм генов и связь с атеросклерозом]». Кардиология . 45 (6): 43–55. ПМИД 16007035 .
- Йе Дж (2007). «Зависимость метаболических путей холестерина хозяина от жизненного цикла вируса гепатита С» . ПЛОС Патог . 3 (8): е108. дои : 10.1371/journal.ppat.0030108 . ЧВК 1959368 . ПМИД 17784784 .