Модельный липидный бислой
Модельный липидный бислой представляет собой любой бислой, собранный in vitro , в отличие от бислоя естественных клеточных мембран или покрытия различных субклеточных структур, таких как ядро . Они используются для изучения фундаментальных свойств биологических мембран в упрощенной и хорошо контролируемой среде, а также все чаще в восходящей синтетической биологии для создания искусственных клеток . [1] Модельный бислой может быть изготовлен как из синтетических, так и из натуральных липидов . Простейшие модельные системы содержат только один чистый синтетический липид. Более физиологически релевантные модельные бислои можно создать из смесей нескольких синтетических или природных липидов.
Существует множество различных типов модельных бислоев, каждый из которых имеет экспериментальные преимущества и недостатки. Первой разработанной системой была черная липидная мембрана или «окрашенный» бислой, которая позволяет легко определять электрические характеристики бислоев, но недолговечна и с ней может быть трудно работать. Поддерживаемые бислои прикреплены к твердой подложке, что повышает стабильность и позволяет использовать инструменты определения характеристик, которые невозможно использовать в объемном растворе. Эти преимущества достигаются за счет нежелательных взаимодействий с субстратами, которые могут денатурировать мембранные белки .
Черные липидные мембраны (BLM)
[ редактировать ]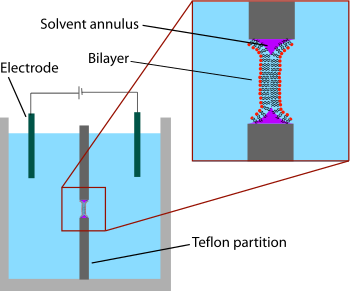
Самой ранней моделью двухслойной системы был «окрашенный» бислой, также известный как «черная липидная мембрана». Термин «окрашенный» относится к процессу изготовления этих бислоев. , создается небольшое отверстие Сначала в тонком слое гидрофобного материала, такого как тефлон . Обычно диаметр этого отверстия составляет от нескольких десятков до сотен микрометров. Для формирования БЛМ область вокруг отверстия сначала «предварительно окрашивают» раствором липидов, растворенных в гидрофобном растворителе, нанося этот раствор поперек отверстия кистью, шприцем или стеклянным аппликатором. [2] Используемый растворитель должен иметь очень высокий коэффициент разделения и быть относительно вязким, чтобы предотвратить немедленный разрыв. Наиболее распространенным растворителем является смесь декана и сквалена .
После высыхания отверстия в обе стороны камеры добавляют раствор соли (водную фазу). Затем отверстие «окрашивается» липидным раствором (обычно тем же раствором, который использовался для предварительного окрашивания). Липидный монослой самопроизвольно образуется на границе раздела органической и водной фаз по обе стороны от капли липид/растворитель. Поскольку стенки отверстия гидрофобны, раствор липид/растворитель смачивает эту границу раздела, утончая каплю в центре. Как только две стороны капли подходят достаточно близко друг к другу, липидные монослои сливаются, быстро исключая небольшой оставшийся объем раствора. В этот момент в центре отверстия образуется бислой, но по периметру остается значительное кольцо растворителя. Это кольцо необходимо для поддержания стабильности, действуя как мост между бислоем ~ 5 нм и листом толщиной в десятки микрометров, в котором сделано отверстие. [3]
Термин «черный» бислой относится к тому факту, что они темны в отраженном свете, поскольку толщина мембраны составляет всего несколько нанометров, поэтому свет, отражающийся от задней поверхности, деструктивно мешает свету, отражающемуся от передней поверхности. Действительно, это был один из первых признаков того, что этот метод позволяет получить мембрану толщиной молекулярного масштаба. [4] Черные липидные мембраны также хорошо подходят для определения электрических характеристик, поскольку обе камеры, разделенные бислоем, доступны, что позволяет легко размещать большие электроды. По этой причине электрическая характеристика является одним из наиболее важных методов, используемых в сочетании с окрашенными липидными бислоями. Простые измерения показывают, когда формируется бислой, а когда он разрушается, поскольку неповрежденный бислой имеет большое сопротивление (> ГОм) и большую емкость (~ 2 мкФ/см). 2 ). Более продвинутые электрические характеристики были особенно важны при изучении потенциалзависимых ионных каналов . Мембранные белки, такие как ионные каналы, обычно не могут быть включены непосредственно в окрашенный бислой во время формирования, поскольку погружение в органический растворитель приведет к денатурации белка. Вместо этого белок растворяют с помощью детергента и добавляют в водный раствор после образования бислоя. Покрытие из детергента позволяет этим белкам спонтанно внедряться в бислой в течение нескольких минут. Кроме того, проведены первоначальные эксперименты, сочетающие электрофизиологические и структурные исследования черных липидных мембран. [5] В другом варианте техники BLM, называемом бислойным перфоратором, стеклянная пипетка (внутренний диаметр ~ 10-40 мкм) используется в качестве электрода на одной стороне бислоя, чтобы изолировать небольшой участок мембраны. [6] [7] Эта модификация метода патч-клампа обеспечивает запись с низким уровнем шума даже при высоких потенциалах (до 600 мВ) за счет дополнительного времени на подготовку.
Основными проблемами, связанными с окрашенными бислоями, являются остатки растворителя и ограниченный срок службы. Некоторые исследователи полагают, что карманы растворителя, попавшие между двумя двухслойными листками, могут нарушить нормальную функцию белка. Чтобы преодолеть это ограничение, Монтал и Мюллер разработали модифицированную технику осаждения, которая исключает использование тяжелого нелетучего растворителя. В этом методе отверстие начинается над поверхностью воды, полностью разделяя две камеры с жидкостью. На поверхности каждой камеры монослой формируется путем нанесения липидов в летучий растворитель, такой как хлороформ , и ожидания испарения растворителя. Затем отверстие опускается через границу раздела воздух-вода, и два монослоя из отдельных камер складываются друг против друга, образуя бислой поперек отверстия. [8] Проблему стабильности оказалось решить труднее. Обычно черная липидная мембрана сохраняется менее часа, что исключает долгосрочные эксперименты . Этот срок службы можно продлить за счет точной конструкции опорного отверстия. [9] химическое сшивание липидов или гелеобразование окружающего раствора для механической поддержки бислоя. [10] Работа в этой области продолжается, и время жизни в несколько часов станет возможным.
Поддерживаемые липидные бислои (SLB)
[ редактировать ]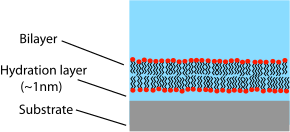
В отличие от пузырька или клеточной мембраны, в которых липидный бислой свернут в закрытую оболочку, поддерживаемый бислой представляет собой плоскую структуру, сидящую на твердой основе. Из-за этого воздействию свободного раствора подвергается только верхняя грань бислоя. Эта схема имеет преимущества и недостатки, связанные с изучением липидных бислоев. Одним из величайших преимуществ поддерживаемого бислоя является его стабильность. SLB остаются в значительной степени неповрежденными даже при воздействии высоких скоростей потока или вибрации и, в отличие от черных липидных мембран, наличие отверстий не разрушает весь бислой. Благодаря этой стабильности с поддерживаемыми бислоями возможны эксперименты продолжительностью несколько недель и даже месяцев, тогда как эксперименты BLM обычно ограничиваются часами. [11] Еще одним преимуществом поддерживаемого двухслойного слоя является то, что, поскольку он расположен на плоской твердой поверхности, его можно использовать с помощью ряда инструментов определения характеристик, которые были бы невозможны или обеспечивали бы более низкое разрешение, если бы они выполнялись на свободно плавающем образце.
Одним из наиболее ярких примеров этого преимущества является использование методов механического зондирования, требующих прямого физического взаимодействия с образцом. Атомно-силовая микроскопия (АСМ) использовалась для визуализации разделения фаз липидов . [12] образование трансмембранных нанопор с последующей адсорбцией одиночной молекулы белка, [13] и сборка белка [14] с точностью до субнанометра без необходимости использования красителя для маркировки. Совсем недавно АСМ также стала использоваться для прямого исследования механических свойств одиночных бислоев. [15] и для проведения силовой спектроскопии отдельных мембранных белков. [16] Эти исследования были бы трудными или невозможными без использования поддерживаемых бислоев, поскольку поверхность клетки или пузырька относительно мягкая и со временем будет дрейфовать и колебаться. Другим примером физического зонда является использование кварцевых микровесов (QCM) для изучения кинетики связывания на поверхности бислоя. [17] Интерферометрия с двойной поляризацией — это оптический инструмент высокого разрешения для характеристики порядка и нарушений в липидных бислоях во время взаимодействий или фазовых переходов , предоставляющий дополнительные данные для измерений QCM. [18]
Многие современные методы флуоресцентной микроскопии также требуют жестко закрепленной плоской поверхности. Методы эванесцентного поля, такие как флуоресцентная микроскопия полного внутреннего отражения (TIRF) и поверхностный плазмонный резонанс (SPR), могут предложить чрезвычайно чувствительные измерения связывания аналита и оптических свойств двухслойных материалов, но могут работать только тогда, когда образец поддерживается на специализированных оптически функциональных материалах. Другой класс методов, применимых только к поддерживаемым бислоям, - это методы, основанные на оптической интерференции, такие как флуоресцентная интерференционно-контрастная микроскопия (FLIC) и отражательная интерференционно-контрастная микроскопия (RICM) или интерферометрическая рассеивающая микроскопия (iSCAT). [19] [20] Когда бислой поддерживается поверх отражающей поверхности, изменения интенсивности из-за деструктивных помех от этой границы раздела можно использовать для расчета с ангстремной точностью положения флуорофоров внутри бислоя. [21] И эванесцентный, и интерференционный методы обеспечивают субволновое разрешение только в одном измерении (z или по вертикали). Во многих случаях эта резолюция — это все, что необходимо. В конце концов, бислои очень малы только в одном измерении. В латеральном направлении бислой может простираться на многие микрометры или даже миллиметры. Но некоторые явления, такие как динамическая фазовая перестройка, действительно происходят в бислоях на латеральном субмикрометровом масштабе длины. Перспективным подходом к изучению этих структур является сканирующая оптическая микроскопия ближнего поля (НСОМ). [22] Как и АСМ, NSOM основан на сканировании микрообработанного наконечника для получения четко локализованного сигнала. Но в отличие от АСМ, NSOM использует оптическое, а не физическое взаимодействие с образцом, потенциально воздействуя на тонкие структуры в меньшей степени.
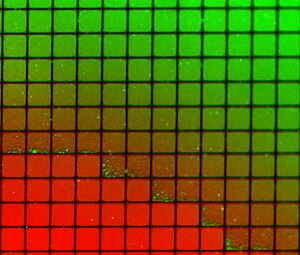
Еще одной важной особенностью поддерживаемых бислоев является способность формировать на поверхности рисунок для создания нескольких изолированных областей на одной подложке. Это явление было впервые продемонстрировано с использованием царапин или металлических «загонов», чтобы предотвратить смешивание между соседними областями, но при этом обеспечить свободную диффузию внутри любой одной области. [23] [24] Более поздние работы расширили эту концепцию за счет интеграции микрофлюидики, чтобы продемонстрировать, что стабильные градиенты состава могут формироваться в бислоях. [25] потенциально позволяющий проводить массовые параллельные исследования разделения фаз, молекулярного связывания и клеточного ответа на искусственные липидные мембраны. Творческое использование концепции загона также позволило изучить динамическую реорганизацию мембранных белков на синаптическом интерфейсе. [26]
Одним из основных ограничений поддерживаемых бислоев является возможность нежелательного взаимодействия с подложкой. Хотя поддерживаемые бислои обычно не соприкасаются напрямую с поверхностью подложки, они разделены лишь очень тонким водным зазором. Размер и характер этого зазора зависит от материала подложки. [27] и виды липидов, но обычно составляет около 1 нм для цвиттер-ионных липидов, нанесенных на кремнезем , наиболее распространенную экспериментальную систему. [28] [29] Поскольку этот слой настолько тонкий, между бислоем и подложкой существует сильная гидродинамическая связь, что приводит к более низкому коэффициенту диффузии в нанесенных бислоях, чем в свободных бислоях того же состава. [30] Определенный процент поддерживаемых бислоев также будет полностью неподвижен, хотя точная природа и причина этих «закрепленных» сайтов все еще неясны. Для высококачественных бислоев, поддерживаемых жидкой фазой, доля неподвижной фракции обычно составляет около 1-5%. Для количественной оценки коэффициента диффузии и подвижной фракции исследователи, изучающие поддерживаемые бислои, часто сообщают данные FRAP .
Нежелательные взаимодействия с субстратом представляют собой гораздо более серьезную проблему при включении интегральных мембранных белков, особенно тех, у которых большие домены выходят за пределы ядра бислоя. Поскольку зазор между бислоем и подложкой очень тонкий, эти белки часто денатурируют на поверхности подложки и, следовательно, теряют всю функциональность. [31] Одним из способов обойти эту проблему является использование связанных полимером бислоев. В этих системах бислой поддерживается рыхлой сеткой гидратированных полимеров или гидрогеля , которая действует как спейсер и теоретически предотвращает денатурирующие взаимодействия субстрата. [32] На практике некоторый процент белков все равно потеряет подвижность и функциональность, вероятно, из-за взаимодействия с полимерными/липидными якорями. [30] Исследования в этой области продолжаются.
Связанные двухслойные липидные мембраны (t-BLM)
[ редактировать ]Использование связанной двухслойной липидной мембраны (t-BLM) еще больше увеличивает стабильность поддерживаемых мембран за счет химического закрепления липидов на твердом субстрате. [33]

Золото можно использовать в качестве субстрата из-за его инертного химического состава и тиолипидов для ковалентного связывания с золотом. Тиолипиды состоят из производных липидов, полярные головные группы которых расширены гидрофильными спейсерами, оканчивающимися тиоловой или дисульфидной группой, которая образует ковалентную связь с золотом, образуя самособирающиеся монослои (SAM).
Ограничение внутримембранной подвижности поддерживаемых липидных бислоев можно преодолеть путем введения полумембранных связующих липидов. [34] с бензилдисульфидом (DPL) и синтетическим аналогом архей, полномембранными липидами с фитанольными цепями для стабилизации структуры и звеньями полиэтиленгликоля в качестве гидрофильного спейсера. Формирование бислоя достигается путем воздействия на покрытый липидами золотой субстрат липидам внешнего слоя либо в растворе этанола, либо в липосомах. [35]
Преимущество этого подхода заключается в том, что из-за гидрофильного пространства размером около 4 нм взаимодействие с подложкой минимально, а дополнительное пространство позволяет внедрять ионные каналы белка в бислой. Кроме того, разделительный слой создает ионный резервуар. [36] это легко позволяет измерять электрический импеданс переменного тока поперек бислоя.
Везикулы
[ редактировать ]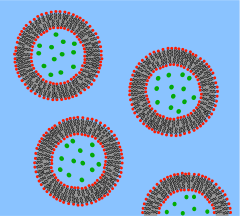
Везикула представляет собой липидный бислой, свернутый в сферическую оболочку, заключающую в себе небольшое количество воды и отделяющую ее от воды снаружи везикулы. Из-за этого фундаментального сходства с клеточной мембраной везикулы широко использовались для изучения свойств липидных бислоев. Другая причина, по которой везикулы используются так часто, заключается в том, что их относительно легко изготовить. Если образец обезвоженного липида подвергнуться воздействию воды, он спонтанно образует везикулы. [37] Эти начальные везикулы обычно многослойные (многостенные) и имеют широкий диапазон размеров от десятков нанометров до нескольких микрометров. [38] Чтобы разбить эти начальные везикулы на более мелкие одностенные везикулы одинакового диаметра, известные как маленькие однослойные везикулы (SUV), необходимы такие методы, как обработка ультразвуком или экструзия через мембрану. Внедорожники обычно имеют диаметр от 50 до 200 нм. [39] Альтернативно, вместо синтеза везикул можно просто изолировать их из клеточных культур или образцов тканей. [40] Везикулы используются для транспортировки липидов, белков и многих других молекул внутри клетки, а также в клетку или из нее. Эти естественно изолированные везикулы состоят из сложной смеси различных липидов и белков, поэтому, хотя они обеспечивают больший реализм для изучения конкретных биологических явлений, простые искусственные везикулы предпочтительнее для изучения фундаментальных свойств липидов.
Поскольку искусственные внедорожники можно производить в больших количествах, они подходят для исследований сыпучих материалов, таких как дифракция рентгеновских лучей, для определения шага решетки. [41] и дифференциальная сканирующая калориметрия для определения фазовых переходов. [42] Интерферометрия с двойной поляризацией позволяет измерять одноламелярные и многоламелярные структуры, а также встраивание в везикулы и их разрушение в формате анализа без меток. [43] Везикулы также можно пометить флуоресцентными красителями, чтобы обеспечить чувствительные FRET на основе анализы слияния . [44]
Несмотря на флуоресцентную маркировку, часто бывает сложно выполнить детальную визуализацию внедорожников просто потому, что они настолько малы. Для борьбы с этой проблемой исследователи используют гигантские однослойные везикулы (ГУВ). GUV достаточно велики (1–200 мкм), чтобы их можно было изучать с помощью традиционной флуоресцентной микроскопии, и находятся в том же диапазоне размеров, что и большинство биологических клеток. Таким образом, они используются в качестве имитации клеточных мембран для исследований in vitro в области молекулярной и клеточной биологии. По этой причине многие исследования липидных рафтов в искусственных липидных системах проводились с использованием GUV. [45] По сравнению с поддерживаемыми бислоями, GUV представляют собой более «естественную» среду, поскольку здесь нет жесткой поверхности, которая могла бы вызвать дефекты, повлиять на свойства мембраны или денатурировать белки. Поэтому GUV часто используются для изучения ремоделирования мембран и других взаимодействий белок-мембрана in vitro. Существует множество методов инкапсуляции белков или других биологических реагентов внутри таких везикул, что делает GUV идеальной системой для воссоздания (и исследования) in vitro клеточных функций в клеточноподобной модельной мембранной среде. [46] Эти методы включают микрофлюидные методы, которые позволяют высокопроизводительно получать везикулы одинакового размера. [47]
Двухслойные интерфейсы капель
[ редактировать ]Бислои интерфейса капель (DIB) представляют собой капли, заключенные в фосфолипидную оболочку, которые при контакте образуют бислои. [48] [49] Капли окружены маслом, а фосфолипиды диспергированы либо в воде, либо в масле. [48] В результате фосфолипиды самопроизвольно образуют монослой на каждой границе раздела масло-вода. [48] DIB можно формировать для создания тканеподобного материала со способностью образовывать асимметричные бислои, восстанавливать белки и белковые каналы или использовать в изучении электрофизиологии. [50] [51] [52] [53] [54] Расширенные сети DIB могут быть сформированы либо с использованием капельных микрофлюидных устройств, либо с использованием капельных принтеров. [54] [55]
Мицеллы, бицеллы и нанодиски
[ редактировать ]Моющие мицеллы [56] представляют собой еще один класс модельных мембран, которые обычно используются для очистки и изучения мембранных белков , хотя у них отсутствует липидный бислой. В водных растворах мицеллы представляют собой совокупности амфипатических молекул, гидрофильные головки которых подвергаются воздействию растворителя, а гидрофобные хвосты находятся в центре. Мицеллы могут солюбилизировать мембранные белки, частично инкапсулируя их и защищая их гидрофобные поверхности от растворителя.
Бицеллы представляют собой родственный класс модельных мембран. [57] обычно состоит из двух липидов, один из которых образует липидный бислой, а другой образует амфипатическую мицеллоподобную сборку, защищающую центр бислоя от окружающих молекул растворителя. Бицеллы можно рассматривать как сегмент бислоя, инкапсулированный и солюбилизированный мицеллой. Бицеллы намного меньше липосом, поэтому их можно использовать в таких экспериментах, как ЯМР- спектроскопия, где более крупные везикулы не подходят.
Нанодиски [58] состоят из сегмента бислоя, инкапсулированного амфипатической белковой оболочкой, а не липидным или детергентным слоем. Нанодиски более стабильны, чем бицеллы и мицеллы при низких концентрациях, и имеют очень четко выраженный размер (в зависимости от типа белковой оболочки, от 10 до 20 нм ). Мембранные белки, включенные в нанодиски и солюбилизированные ими, можно изучать с помощью широкого спектра биофизических методов. [59] [60]
Ссылки
[ редактировать ]- ^ Салехи-Рейхани А, Сес О, Элани Ю (июль 2017 г.). «Искусственные имитации клеток как упрощенные модели для изучения клеточной биологии» . Экспериментальная биология и медицина . 242 (13): 1309–1317. дои : 10.1177/1535370217711441 . ПМК 5528198 . ПМИД 28580796 .
- ^ Мюллер П., Рудин Д.О., Тьен Х.Т., Уэскотт У.К. (июнь 1962 г.). «Восстановление структуры клеточной мембраны in vitro и превращение ее в возбудимую систему». Природа . 194 (4832): 979–80. Бибкод : 1962Natur.194..979M . дои : 10.1038/194979a0 . ПМИД 14476933 . S2CID 2110051 .
- ^ Белый СХ (апрель 1972 г.). «Анализ тора, окружающего плоские двухслойные липидные мембраны» . Биофизический журнал . 12 (4): 432–45. Бибкод : 1972BpJ....12..432W . дои : 10.1016/s0006-3495(72)86095-8 . ПМЦ 1484121 . ПМИД 5019479 .
- ^ Тьен Х.Т., Карбоне С., Давидович Е.А. (1966). «Образование «черных» липидных мембран продуктами окисления холестерина». Природа . 212 (5063): 718–719. Бибкод : 1966Natur.212..718T . дои : 10.1038/212718a0 . S2CID 34363724 .
- ^ Бирлинк А., Мелл М., Толкин М., Салдитт Т. (ноябрь 2009 г.). «Жесткая рентгеновская фазово-контрастная визуализация черных липидных мембран» . Письма по прикладной физике . 95 (20): 203703. Бибкод : 2009ApPhL..95t3703B . дои : 10.1063/1.3263946 .
- ^ Андерсен ОС (февраль 1983 г.). «Движение ионов через каналы грамицидина А. Одноканальные измерения при очень высоких потенциалах» . Биофизический журнал . 41 (2): 119–33. Бибкод : 1983BpJ....41..119A . дои : 10.1016/S0006-3495(83)84414-2 . ПМЦ 1329161 . ПМИД 6188500 .
- ^ Ингольфсон Х., Капур Р., Коллингвуд С.А., Андерсен О.С. (ноябрь 2008 г.). «Одномолекулярные методы мониторинга изменений упругих свойств бислоя» . Журнал визуализированных экспериментов . 21 (21): е1032. дои : 10.3791/1032 . ПМЦ 2954507 . ПМИД 19066527 .
- ^ Монталь М., Мюллер П. (декабрь 1972 г.). «Формирование бимолекулярных мембран из липидных монослоев и исследование их электрических свойств» . Труды Национальной академии наук Соединенных Штатов Америки . 69 (12): 3561–6. Бибкод : 1972PNAS...69.3561M . дои : 10.1073/pnas.69.12.3561 . ПМК 389821 . ПМИД 4509315 .
- ^ Бирлинк А., Уилбрандт П.Дж., Циглер Э., Карбоне Д., Мецгер Т.Х., Салдитт Т. (май 2008 г.). «Рентгеноструктурный анализ отдельно стоящих липидных мембран, облегченный микромеханическими отверстиями». Ленгмюр: Журнал поверхностей и коллоидов ACS . 24 (9): 4952–8. дои : 10.1021/la703704x . ПМИД 18370435 .
- ^ Мальмштадт Н., Чон Т.Дж., Шмидт Дж.Дж. (январь 2008 г.). «Долгоживущие плоские липидные двухслойные мембраны, прикрепленные к полимеризованному in situ гидрогелю». Продвинутые материалы . 20 (1): 84–9. Бибкод : 2008АдМ....20...84М . дои : 10.1002/adma.200700810 .
- ^ Пуррукер О., Хиллебрандт Х., Адлкофер К., Танака М. (2001). «Отложение высокорезистивного липидного бислоя на электроде из диоксида кремния и диоксида кремния и включение грамицидина, изученное методом импедансной спектроскопии переменного тока». Электрохимика Акта . 47 (5): 791–798. дои : 10.1016/s0013-4686(01)00759-9 .
- ^ Lin WC, Blanchette CD, Ratto TV, Longo ML (январь 2006 г.). «Липидная асимметрия в липидных бислоях, поддерживаемых DLPC/DSPC: комбинированное исследование АСМ и флуоресцентной микроскопии» . Биофизический журнал . 90 (1): 228–37. Бибкод : 2006BpJ....90..228L . дои : 10.1529/biophysj.105.067066 . ПМК 1367021 . ПМИД 16214871 .
- ^ Ройтер Ю., Орнатска М., Раммохан А.Р., Балакришнан Дж., Хейне Д.Р., Минко С. (март 2008 г.). «Взаимодействие наночастиц с липидной мембраной». Нано-буквы . 8 (3): 941–4. Бибкод : 2008NanoL...8..941R . дои : 10.1021/nl080080l . ПМИД 18254602 .
- ^ Энгель А., Мюллер DJ (сентябрь 2000 г.). «Наблюдение за работой отдельных биомолекул с помощью атомно-силового микроскопа». Структурная биология природы . 7 (9): 715–8. дои : 10.1038/78929 . ПМИД 10966636 . S2CID 20571172 .
- ^ Стелтенкамп С., Мюллер М.М., Дезерно М., Хеннестал С., Стейнем С., Яншофф А. (июль 2006 г.). «Механические свойства перекрывающих поры липидных бислоев, исследованные с помощью атомно-силовой микроскопии» . Биофизический журнал . 91 (1): 217–26. Бибкод : 2006BpJ....91..217S . doi : 10.1529/biophysj.106.081398 . ПМК 1479081 . ПМИД 16617084 .
- ^ Остерхельт Ф., Остерхельт Д., Пфайффер М., Энгель А., Гауб Х.Е., Мюллер DJ (апрель 2000 г.). «Пути развития отдельных бактериородопсинов». Наука . 288 (5463): 143–6. Бибкод : 2000Sci...288..143O . дои : 10.1126/science.288.5463.143 . ПМИД 10753119 .
- ^ Эбара И., Окахата (декабрь 1994 г.). «Кинетическое исследование связывания конканавалина А с монослоями гликолипида с использованием микровесов на кристаллах кварца». Журнал Американского химического общества . 116 (25): 11209–12. дои : 10.1021/ja00104a001 .
- ^ Машаги А., Суонн М., Попплуэлл Дж., Текстор М., Реймхульт Э. (май 2008 г.). «Оптическая анизотропия нанесенных липидных структур, исследованная с помощью волноводной спектроскопии, и ее применение для изучения кинетики формирования нанесенного липидного бислоя». Аналитическая химия . 80 (10): 3666–76. дои : 10.1021/ac800027s . ПМИД 18422336 .
- ^ Андрека Дж., Спиллейн К.М., Ортега-Арройо Дж., Кукура П. (декабрь 2013 г.). «Прямое наблюдение и контроль образования поддерживаемого липидного бислоя с помощью микроскопии интерферометрического рассеяния» . АСУ Нано . 7 (12): 10662–70. дои : 10.1021/nn403367c . ПМИД 24251388 .
- ^ де Вит Дж., Даниал Дж. С., Кукура П., Уоллес М. И. (октябрь 2015 г.). «Динамическая визуализация липидных нанодоменов без меток» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (40): 12299–303. Бибкод : 2015PNAS..11212299D . дои : 10.1073/pnas.1508483112 . ПМК 4603517 . ПМИД 26401022 .
- ^ Крейн Дж. М., Кисслинг В., Тамм Л. К. (февраль 2005 г.). «Измерение липидной асимметрии в плоских поддерживаемых бислоях с помощью флуоресцентной интерференционной контрастной микроскопии». Ленгмюр: Журнал поверхностей и коллоидов ACS . 21 (4): 1377–88. дои : 10.1021/la047654w . ПМИД 15697284 .
- ^ Холларс CW, Данн RC (июль 1998 г.). «Субмикронная структура в монослоях и бислоях L-альфа-дипальмитоилфосфатидилхолина, исследованная с помощью конфокальной, атомно-силовой и ближнепольной микроскопии» . Биофизический журнал . 75 (1): 342–53. Бибкод : 1998BpJ....75..342H . дои : 10.1016/s0006-3495(98)77518-6 . ПМК 1299703 . ПМИД 9649391 .
- ^ Гровс Дж.Т., Ульман Н., Боксер С.Г. (январь 1997 г.). «Микроструктурирование жидких липидных бислоев на твердых носителях». Наука . 275 (5300). Нью-Йорк, штат Нью-Йорк: 651–3. дои : 10.1126/science.275.5300.651 . ПМИД 9005848 . S2CID 30939780 .
- ^ Гроувс Дж.Т., Ульман Н., Кремер П.С., Боксер С.Г. (1998). «Взаимодействие субстрат-мембрана: механизмы наложения узоров на жидкую двухслойную мембрану». Ленгмюр . 14 (12): 3347–50. дои : 10.1021/la9711701 .
- ^ Кам Л., боксер SG (2003). «Пространственно-селективное манипулирование поддерживаемыми липидными бислоями с помощью ламинарного потока: шаги на пути к биомембранной микрофлюидике». Ленгмюр . 19 (5): 1624–1631. дои : 10.1021/la0263413 .
- ^ Партасарати Р., Джексон Б.Л., Лоури Т.Дж., Вонг А.П. (2004). «Картины неравновесной адгезии на стыках липидных бислоев». Журнал физической химии Б. 108 (2): 649–57. дои : 10.1021/jp035543k .
- ^ Магер, доктор медицинских наук, Алмквист Б., Мелош Н.А. (ноябрь 2008 г.). «Формирование и характеристика жидких липидных бислоев на оксиде алюминия». Ленгмюр . 24 (22): 12734–7. дои : 10.1021/la802726u . ПМИД 18942863 .
- ^ Кениг Б.В., Крюгер С., Ортс В.Дж., Майкшак К.Ф., Берк Н.Ф., Сильвертон Дж.В., Гавриш К. (1996). «Исследование нейтронной отражательной способности и атомно-силовой микроскопии липидного бислоя в воде, адсорбированной на поверхности монокристалла кремния». Ленгмюр . 12 (5): 1343–1350. дои : 10.1021/la950580r .
- ^ Джонсон С.Дж., Байерл Т.М., Макдермотт, округ Колумбия, Адам Г.В., Ренни А.Р., Томас Р.К., Сакманн Э. (февраль 1991 г.). «Структура адсорбированного бислоя димиристоилфосфатидилхолина, измеренная с помощью зеркального отражения нейтронов» . Биофизический журнал . 59 (2): 289–94. Бибкод : 1991BpJ....59..289J . дои : 10.1016/S0006-3495(91)82222-6 . ПМЦ 1281145 . ПМИД 2009353 .
- ^ Перейти обратно: а б Кюнер М., Тампе Р., Сакманн Э. (июль 1994 г.). «Липидный моно- и бислой, нанесенный на полимерные пленки: композитные полимерно-липидные пленки на твердых подложках» . Биофизический журнал . 67 (1): 217–26. Бибкод : 1994BpJ....67..217K . дои : 10.1016/s0006-3495(94)80472-2 . ПМЦ 1225352 . ПМИД 7918990 .
- ^ Кастеллана Э.Т., Кремер П.С. (ноябрь 2006 г.). «Липидные бислои на твердой основе: от биофизических исследований к конструкции датчиков» . Отчеты о поверхностной науке . 61 (10): 429–444. Бибкод : 2006SurSR..61..429C . дои : 10.1016/j.surfrep.2006.06.001 . ПМЦ 7114318 . ПМИД 32287559 .
- ^ Вонг Дж.И., Пак К.К., Зейтц М., Исраелачвили Дж. (сентябрь 1999 г.). «Бислои с полимерной подушкой. II. Исследование сил взаимодействия и плавления с помощью аппарата поверхностных сил» . Биофизический журнал . 77 (3): 1458–68. Бибкод : 1999BpJ....77.1458W . дои : 10.1016/s0006-3495(99)76993-6 . ПМЦ 1300433 . ПМИД 10465756 .
- ^ Науманн Р., Йончик А., Копп Р., ван Эш Дж., Рингсдорф Х., Нолл В., Гребер П. (1995). «Включение мембранных белков в липидные слои, поддерживаемые твердыми частицами». Энджью. Хим . 34 (18): 2056–2058. дои : 10.1002/anie.199520561 .
- ^ Корнелл Б.А., Браах-Максвитис В.Л., Кинг Л.Г., Осман П.Д., Рагузе Б., Вечорек Л., Пейс Р.Дж. (июнь 1997 г.). «Биосенсор, использующий переключатели ионных каналов». Природа . 387 (6633): 580–3. Бибкод : 1997Natur.387..580C . дои : 10.1038/42432 . ПМИД 9177344 . S2CID 4348659 .
- ^ Ланг Х., Душл С., Фогель Х. (1994). «Новый класс тиолипидов для прикрепления липидных бислоев к золотым поверхностям». Ленгмюр . 10 : 197–210. дои : 10.1021/la00013a029 .
- ^ Корнелл Б.А., Кришна Г., Осман П.Д., Пейс Р.Д., Вичорек Л. (август 2001 г.). «Связанные двухслойные липидные мембраны как поддержка мембраноактивных пептидов». Труды Биохимического общества . 29 (Часть 4): 613–7. дои : 10.1042/BST0290613 . ПМИД 11498038 .
- ^ Бангэм AD, Хорн RW (январь 1964 г.). «Отрицательное окрашивание фосфолипидов и их структурная модификация поверхностно-активными веществами, наблюдаемая в электронном микроскопе». Журнал молекулярной биологии . 8 (5): 660–668. дои : 10.1016/S0022-2836(64)80115-7 . ПМИД 14187392 .
- ^ Ласич Д.Д. (ноябрь 1988 г.). «Механизм образования пузырьков» . Биохимический журнал . 256 (1): 1–11. дои : 10.1042/bj2560001 . ПМЦ 1135360 . ПМИД 3066342 .
- ^ Ф. Сока и Д. Папахаджопулос. «Сравнительные свойства и методы приготовления липидных везикул (липосом)». Ежегодный обзор биофизики и биоинженерии. 9. (1980) 467-508.
- ^ Тримбл В.С., Коуэн Д.М., Шеллер Р.Х. (июнь 1988 г.). «VAMP-1: интегральный мембранный белок, связанный с синаптическими пузырьками» . Труды Национальной академии наук Соединенных Штатов Америки . 85 (12): 4538–42. Бибкод : 1988PNAS...85.4538T . дои : 10.1073/pnas.85.12.4538 . ПМК 280466 . ПМИД 3380805 .
- ^ Папахаджопулос Д., Миллер Н. (сентябрь 1967 г.). «Фосфолипидные модельные мембраны. I. Структурные характеристики гидратированных жидких кристаллов». Biochimica et Biophysical Acta (BBA) – Биомембраны . 135 (4): 624–38. дои : 10.1016/0005-2736(67)90094-6 . ПМИД 4167394 .
- ^ Траубле Х., Хейнс Д.Х. (декабрь 1971 г.). «Изменение объема липидных бислойных ламелей при фазовом переходе кристалл-жидкость-кристалл». Химия и физика липидов . 7 (4): 324–35. дои : 10.1016/0009-3084(71)90010-7 .
- ^ Попплуэлл Дж. Ф., Суонн М. Дж., Фриман Н. Дж., Макдоннелл С., Форд Р. К. (январь 2007 г.). «Количественная оценка воздействия мелиттина на липосомы» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1768 (1): 13–20. дои : 10.1016/j.bbamem.2006.05.016 . ПМИД 17092481 .
- ^ Лей Дж., Макдональд RC (сентябрь 2003 г.). «Слияние липидных двухслойных пузырьков: промежуточные соединения, улавливаемые с помощью высокоскоростной микрофлуоресцентной спектроскопии» . Биофизический журнал . 85 (3): 1585–99. Бибкод : 2003BpJ....85.1585L . дои : 10.1016/S0006-3495(03)74590-1 . ПМЦ 1303334 . ПМИД 12944275 .
- ^ Дитрих С., Багатолли Л.А., Воловик З.Н., Томпсон Н.Л., Леви М., Джейкобсон К., Граттон Э. (март 2001 г.). «Липидные рафты, восстановленные в модельных мембранах» . Биофизический журнал . 80 (3): 1417–28. Бибкод : 2001BpJ....80.1417D . дои : 10.1016/S0006-3495(01)76114-0 . ПМЦ 1301333 . ПМИД 11222302 .
- ^ Литчел Т., Швилле П. (март 2021 г.). «Восстановление белка внутри гигантских однослойных везикул». Ежегодный обзор биофизики . 50 : 525–548. doi : 10.1146/annurev-biophys-100620-114132 . ПМИД 33667121 . S2CID 232131463 .
- ^ Матошевич С., Пагель Б.М. (март 2011 г.). «Пошаговый синтез гигантских однослойных везикул на микрофлюидной сборочной линии» . Журнал Американского химического общества . 133 (9): 2798–800. дои : 10.1021/ja109137s . ПМК 3048828 . ПМИД 21309555 .
- ^ Перейти обратно: а б с Бэйли Х., Кронин Б., Херон А., Холден М.А., Хван В.Л., Сайеда Р. и др. (декабрь 2008 г.). «Двуслойные интерфейсы капель» . Молекулярные биосистемы . 4 (12): 1191–208. дои : 10.1039/b808893d . ПМК 2763081 . ПМИД 19396383 .
- ^ Фунакоси К., Сузуки Х., Такеучи С. (декабрь 2006 г.). «Формирование липидного бислоя путем контакта монослоев в микрофлюидном устройстве для анализа мембранных белков». Аналитическая химия . 78 (24): 8169–74. дои : 10.1021/ac0613479 . ПМИД 17165804 .
- ^ Хван В.Л., Чен М., Кронин Б., Холден М.А., Бэйли Х. (май 2008 г.). «Асимметричные бислои интерфейса капель». Журнал Американского химического общества . 130 (18): 5878–9. дои : 10.1021/ja802089s . ПМИД 18407631 .
- ^ Лептин С., Томпсон-младший, Эллори Дж.С., Такер С.Дж., Уоллес М.И. (июнь 2011 г.). «Восстановление in vitro ионных каналов эукариот с использованием бислоев интерфейса капель». Журнал Американского химического общества . 133 (24): 9370–5. дои : 10.1021/ja200128n . ПМИД 21591742 .
- ^ Наджем Дж.С., Данлэп, доктор медицинских наук, Роу И.Д., Фриман Э.К., Грант Дж.В., Сухарев С., Лео DJ (сентябрь 2015 г.). «Активация бактериального канала MscL в механически стимулированных бислоях интерфейса капель» . Научные отчеты . 5 : 13726. Бибкод : 2015NatSR...513726N . дои : 10.1038/srep13726 . ПМЦ 4562232 . ПМИД 26348441 .
- ^ Гросс Л.К., Херон А.Дж., Бака СК, Уоллес М.И. (декабрь 2011 г.). «Определение емкости мембраны путем динамического контроля площади бислоя на границе раздела капель». Ленгмюр . 27 (23): 14335–42. дои : 10.1021/la203081v . ПМИД 21978255 .
- ^ Перейти обратно: а б Вильяр Дж., Грэм А.Д., Бэйли Х. (апрель 2013 г.). «Печатный материал, похожий на ткань» . Наука . 340 (6128): 48–52. Бибкод : 2013Sci...340...48V . дои : 10.1126/science.1229495 . ПМЦ 3750497 . ПМИД 23559243 .
- ^ Рестрепо Шильд В., Бут М.Дж., Бокс С.Дж., Олоф С.Н., Махендран К.Р., Бэйли Х. (апрель 2017 г.). «Генерация светового тока в двухслойной матрице капель» . Научные отчеты . 7 : 46585. Бибкод : 2017NatSR...746585R . дои : 10.1038/srep46585 . ПМЦ 5394532 . ПМИД 28417964 .
- ^ Седдон А.М., Керноу П., Бут П.Дж. (ноябрь 2004 г.). «Мембранные белки, липиды и детергенты: не просто мыльная опера» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1666 (1–2): 105–17. дои : 10.1016/j.bbamem.2004.04.011 . ПМИД 15519311 .
- ^ Каваньеро С., Дайсон Х.Дж. , Райт П.Е. (апрель 1999 г.). «Улучшенная бицелльная система с низким pH для ориентации макромолекул в широком диапазоне температур». Журнал биомолекулярного ЯМР . 13 (4): 387–91. дои : 10.1023/а:1008360022444 . ПМИД 10353198 . S2CID 22774774 .
- ^ Ричи Т.К., Гринькова Ю.В., Байбурт Т.Х., Денисов И.Г., Зольнерцикс Ю.К., Аткинс В.М., Слигар С.Г. (2009). «Восстановление мембранных белков в фосфолипидных двухслойных нанодисках». Глава 11. Восстановление мембранных белков в фосфолипидных бислойных нанодисках . Методы энзимологии. Том. 464. стр. 211–31. дои : 10.1016/s0076-6879(09)64011-8 . ISBN 9780123749697 . ПМК 4196316 . ПМИД 19903557 .
- ^ Роос С., Кай Л., Хаберсток С., Провербио Д., Гошдастидер У., Ма Ю. и др. (2014). «Высокоуровневое бесклеточное производство мембранных белков с помощью нанодисков». Бесклеточный синтез белка . Методы молекулярной биологии. Том. 1118. стр. 109–30. дои : 10.1007/978-1-62703-782-2_7 . ISBN 978-1-62703-781-5 . ПМИД 24395412 .
- ^ Роос С, Кай Л, Провербио Д, Гошдастидер У, Филипек С, Дётш В, Бернхард Ф (февраль 2013 г.). «Котрансляционная ассоциация внеклеточных экспрессируемых мембранных белков с снабженными липидными бислоями». Молекулярная мембранная биология . 30 (1): 75–89. дои : 10.3109/09687688.2012.693212 . ПМИД 22716775 . S2CID 207503256 .