правило 18 электронов
Правило 18 электронов — это химическое эмпирическое правило , используемое в первую очередь для предсказания и рационализации формул стабильных комплексов переходных металлов , особенно металлоорганических соединений . [1] Правило основано на том, что валентные орбитали в электронной конфигурации переходных металлов состоят из пяти ( n −1)d-орбиталей, одной ns -орбитали и трёх np -орбиталей, где n — главное квантовое число . На этих орбиталях могут вместе разместиться 18 электронов в виде связывающих или несвязывающих электронных пар. Это означает, что комбинация этих девяти атомных орбиталей с лигандными орбиталями создает девять молекулярных орбиталей , которые либо связывают металл-лиганд, либо несвязывают. Когда комплекс металла имеет 18 валентных электронов, говорят, что он достиг той же электронной конфигурации, что и благородный газ в период , что придает комплексу стабильность. Комплексы переходных металлов, отклоняющиеся от этого правила, часто интересны или полезны, поскольку они имеют тенденцию быть более реакционноспособными. Это правило бесполезно для комплексов металлов, не являющихся переходными металлами. Это правило было впервые предложено американским химиком Ирвингом Ленгмюром в 1921 году. [1] [2]
Применимость
[ редактировать ]Это правило с пользой предсказывает формулы для низкоспиновых комплексов триад Cr, Mn, Fe и Co. Хорошо известные примеры включают ферроцен , пентакарбонил железа , карбонил хрома и карбонил никеля .
Лиганды в комплексе определяют применимость правила 18 электронов. В общем, комплексы, подчиняющиеся этому правилу, по крайней мере частично состоят из π-акцепторных лигандов (также известных как π-кислоты). Этот тип лиганда создает очень сильное лигандное поле , которое снижает энергию образующихся молекулярных орбиталей так, что они занимают благоприятное положение. Типичные лиганды включают олефины , фосфины и CO . Комплексы π-кислот обычно содержат металл в степени низкого окисления. Связь между степенью окисления и природой лигандов рационализируется в рамках π-связывания .
Последствия для реактивности
[ редактировать ]Соединения, подчиняющиеся правилу 18 электронов, обычно «обменно инертны». Примеры включают [Co(NH 3 ) 6 ]Cl 3 , Mo(CO) 6 и [Fe(CN) 6 ] 4− . В таких случаях обмен лигандами обычно происходит посредством механизмов диссоциативного замещения , при этом скорость реакции определяется скоростью диссоциации лиганда. С другой стороны, 18-электронные соединения могут быть высокореактивными по отношению к электрофилам, таким как протоны, и такие реакции имеют ассоциативный механизм и представляют собой кислотно-основные реакции.
Комплексы с числом валентных электронов менее 18 имеют тенденцию проявлять повышенную реакционную способность. Таким образом, правило 18 электронов часто является рецептом инертности как в стехиометрическом , так и в каталитическом смысле.
Правило двенадцати
[ редактировать ]Результаты расчетов показывают, что валентные p-орбитали металла участвуют в связывании металл-лиганд, хотя и слабо. [3] Однако Вайнхольд и Лэндис в контексте естественных орбиталей связи не учитывают p-орбитали металла в связи металл-лиганд. [4] хотя эти орбитали все еще включены в качестве функций поляризации . Это приводит к правилу дуодектета (12 электронов) только для пяти d-орбиталей и одной s-орбитали.
Текущий консенсус в общем химическом сообществе заключается в том, что в отличие от правила сингулярного октета для элементов основной группы, переходные металлы не строго подчиняются ни правилу 12, ни 18 электронов, но эти правила описывают нижнюю и верхнюю границы валентности. количество электронов соответственно. [5] [6] Таким образом, хотя связывание d-орбиталей и s-орбиталей переходного металла легко происходит, участие в связывании более высокоэнергетических и более пространственно диффузных p-орбиталей зависит от центрального атома и координационного окружения. [7] [8]
Исключения
[ редактировать ]π-донорные или σ-донорные лиганды с небольшими взаимодействиями с металлическими орбиталями приводят к слабому полю лигандов , которое увеличивает энергии t 2g- орбиталей. Эти молекулярные орбитали становятся несвязывающими или слабо разрыхляющими орбиталями (малое Δ окт ). Следовательно, добавление или удаление электрона мало влияет на стабильность комплекса. В этом случае нет ограничения на количество d-электронов и возможны комплексы с 12–22 электронами. Маленькое Δoct делает возможным заполнение e g * (>18 e − ) и π-донорные лиганды могут вызывать разрыхление t 2g (<18 e − ). Эти типы лигандов расположены в низкой и средней части спектрохимического ряда. Например: [ТиФ 6 ] 2− (Ti(IV), д 0 , 12 и − ), [Co(NH 3 ) 6 ] 3+ (Co(III), д 6 , 18 и − ), [Cu(OH 2 ) 6 ] 2+ (Cu(II), д 9 , 21 и − ).
В пересчете на ионы металлов Δокт увеличивается по группе, а также с увеличением степени окисления . Сильные поля лигандов приводят к образованию низкоспиновых комплексов, что приводит к некоторым исключениям из правила 18 электронов.
16-электронные комплексы
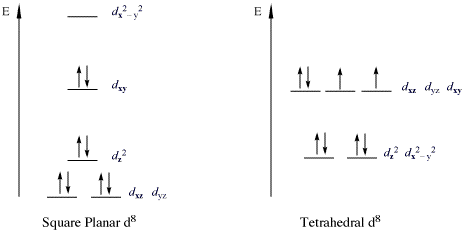
[ редактировать ]Важным классом комплексов, нарушающих правило 18e, являются 16-электронные комплексы с металлом d 8 конфигурации. Все высокоспиновые d 8 ионы металлов имеют октаэдрическую (или тетраэдрическую ) форму, но низкоспиновые d 8 Ионы металлов все имеют плоскую квадратную форму. Важные примеры плоско-квадратных низкоспиновых d 8 Ионы металлов: Rh(I), Ir(I), Ni(II), Pd(II) и Pt(II). На рисунке ниже показано расщепление подоболочки d в низкоспиновых плоско-квадратных комплексах. Примеры особенно распространены для производных триад кобальта и никеля. Такие соединения обычно имеют плоско-квадратную форму . Самый известный пример – комплекс Васки (IrCl(CO)(PPh 3 ) 2 ), [PtCl 4 ] 2− и соль Цейзе [PtCl 3 ( η 2 -С 2 Н 4 )] − . В таких комплексах d z 2 орбиталь дважды занята и несвязывающая.
Многие каталитические циклы действуют через комплексы, которые чередуются между 18-электронной и плоскоквадратной 16-электронной конфигурациями. Примеры включают синтез уксусной кислоты Monsanto , гидрирование , гидроформилирование , изомеризацию олефинов и полимеризацию некоторых алкенов.
Другие нарушения можно классифицировать по видам лигандов на металлоцентре.
Объемные лиганды
[ редактировать ]Громоздкие лиганды могут препятствовать подходу полного набора лигандов, который позволил бы металлу достичь 18-электронной конфигурации.Примеры:
- Ти( неопентил ) 4 (8 е − )
- Cp* 2 Ti(C 2 H 4 ) (16 е − )
- В(СО) 6 (17 е − )
- Cp*Cr(CO) 3 (17 е − )
- Пт(П т Бу 3 ) 2 (14 е − )
- Со(норборнил) 4 (13 е − )
- [ФеЦп 2 ] + (17 и − )
Иногда такие комплексы вступают в агостические взаимодействия с углеводородным каркасом объемистого лиганда. Например:
- W(CO) 3 [P(C 6 H 11 ) 3 ] 2 имеет 16 e − но имеет короткий связывающий контакт между одной связью C–H и центром W.
- Cp (PMe 3 )V(CHCMe 3 ) (14 е − , диамагнитный) имеет короткую связь V–H с «алкилиден-H», поэтому описание соединения находится где-то между Cp(PMe 3 )V(CHCMe 3 ) и Cp(PMe 3 )V(H)(CCMe 3 ).
Высокоспиновые комплексы
[ редактировать ]Высокоспиновые металлокомплексы имеют однозанятые орбитали и могут не иметь пустых орбиталей, которым лиганды могли бы отдавать электронную плотность. Обычно в комплексе мало или вообще отсутствуют π-кислотные лиганды. Эти однократно занятые орбитали могут объединяться с однократно занятыми орбиталями радикальных лигандов (например, кислорода ), или добавление лиганда с сильным полем может вызвать образование электронных пар, создавая таким образом вакантную орбиталь, в которую он может отдавать деньги.Примеры:
- CrCl 3 ( ТГФ ) 3 (15 е − )
- [Mn(H 2 O) 6 ] 2+ (17 и − )
- [Си(Н 2 О) 6 ] 2+ (21 и − , смотрите комментарии ниже)
Комплексы, содержащие сильно π-донорные лиганды, часто нарушают правило 18 электронов. К числу таких лигандов относятся фторид (F − ), оксид (О 2− ), нитрид (N 3− ), алкоксиды (RO − ) и имиды (RN 2− ). Примеры:
- [ КрО4 ] 2− (16 и − )
- Мо(=NR) 2 Cl 2 (12 е − )
В последнем случае происходит значительная передача неподеленных пар азота Мо (поэтому соединение также можно описать как 16 e − сложный). Это видно по короткой длине связи Mo–N и углу Mo–N–C(R), который составляет около 180°.Контрпримеры:
- транс -WO 2 (Me 2 PCH 2 CH 2 PMe 2 ) 2 (18 е − )
- Cp*ReO 3 (18 е − )
В этих случаях связи M=O представляют собой «чистые» двойные связи (т.е. без отдачи неподеленных пар кислорода металлу), что отражается в относительно длинных расстояниях связи.
π-донорные лиганды
[ редактировать ]Лиганды, в которых координирующие атомы, несущие несвязывающие неподеленные пары, часто стабилизируют ненасыщенные комплексы. Амиды и алкоксиды металлов часто нарушают правило 18e.
Комбинации эффектов
[ редактировать ]Вышеуказанные факторы иногда могут сочетаться. Примеры включают в себя
- Cp*VOCl 2 (14 е − )
- TiCl 4 (8 е − )
Большее количество электронов
[ редактировать ]Некоторые комплексы имеют более 18 электронов. Примеры:
- Кобальтоцен (19 е − )
- Никелоцен (20 е − )
- Ион гексааквамеди(II) [Cu(H 2 O) 6 ] 2+ (21 и − )
- ТМ (КО) 8 − ( ТМ = Sc, Y) (20 е − )
Часто случаи, когда в комплексах имеется более 18 валентных электронов, объясняют электростатическими силами — металл притягивает к себе лиганды, пытаясь уравновесить свой положительный заряд, и количество электронов, которые у него в итоге останутся, не имеет значения. В случае металлоценов хелатная природа циклопентадиенильного лиганда стабилизирует его связь с металлом. Несколько удовлетворительными являются два следующих наблюдения: кобальтоцен является сильным донором электронов, легко образуя 18-электронный катион кобальтоцения; а никельоцен имеет тенденцию реагировать с субстратами с образованием 18-электронных комплексов, например CpNiCl(PR 3 ) и свободного CpH.
В случае никельоцена дополнительные два электрона находятся на орбиталях, которые имеют слабую разрыхляющую связь металл-углерод; поэтому он часто участвует в реакциях, в которых связи M–C разрываются и число электронов металла изменяется до 18. [9]
20-электронные системы TM(CO) 8 − (TM = Sc, Y) имеют кубическую ( O h ) геометрию равновесия и синглетную ( 1 1g ) основное электронное состояние. Имеется одна занятая валентная МО с симметрией 2u , которая образована только лигандными орбиталями без вклада АО металлов. Но аддукты TM(CO) 8 − (TM=Sc, Y) удовлетворяют правилу 18 электронов, если рассматривать только те валентные электроны, которые занимают связующие орбитали металл-лиганд. [10]
См. также
[ редактировать ]- Подсчет электронов - формализм, используемый для классификации соединений.
- Теория поля лигандов - Теория молекулярных орбиталей в применении к комплексам переходных металлов
- d количество электронов - описание электронной конфигурации.
- Правило Толмена - Правило, описывающее химические реакции.
Ссылки
[ редактировать ]- ^ Jump up to: а б Ленгмюр, И. (1921). «Типы валентности» . Наука . 54 (1386): 59–67. Бибкод : 1921Sci....54...59L . дои : 10.1126/science.54.1386.59 . ПМИД 17843674 .
- ^ Дженсен, Уильям Б. (2005). «Происхождение правила 18 электронов». Журнал химического образования . 82 (1): 28. Бибкод : 2005JChEd..82...28J . дои : 10.1021/ed082p28 .
- ^ Фрекинг, Гернот; Шайк, Сасон, ред. (май 2014 г.). «Глава 7: Химическая связь в соединениях переходных металлов». Химическая связь: химическая связь в периодической таблице . Вайли-ВЧ. ISBN 978-3-527-33315-8 .
- ^ Лэндис, ЧР; Вайнхольд, Ф. (2007). «Валентные и экстравалентные орбитали в основной группе и связи переходных металлов» . Журнал вычислительной химии . 28 (1): 198–203. дои : 10.1002/jcc.20492 . ПМИД 17063478 .
- ^ Фрекинг, Гернот; Фрелих, Николаус (2000). «Природа связи в соединениях переходных металлов». Химические обзоры . 100 (2): 717–774. дои : 10.1021/cr980401l . ПМИД 11749249 .
- ^ Чжао, Лили; Хольцманн, Николь; Швердтфегер, Питер; Френкинг, Гернот (2019). «Химическая связь и модели связи соединений основной группы». Химические обзоры . 119 (14): 8781–8845. doi : 10.1021/acs.chemrev.8b00722 . ПМИД 31251603 . S2CID 195761899 .
- ^ Бэйс, Крейг; Холл, Майкл (1999). «Прогнозирование геометрии простых полигидридных комплексов переходных металлов с помощью анализа симметрии». Журнал Американского химического общества . 121 (6): 1348–1358. дои : 10.1021/ja981965+ .
- ^ Кинг, РБ (2000). «Структура и связь в гомолептических анионах гидридов переходных металлов». Обзоры координационной химии . 200–202: 813–829. дои : 10.1016/S0010-8545(00)00263-0 .
- ^ Джиролами, Грегори; Раухфус, Томас; Анжеличи, Роберт (1999). «Эксперимент 20». Синтез и техника в неорганической химии . Саусалито, Калифорния: Университетские научные книги. ISBN 978-0-935702-48-4 .
- ^ Джин, Джиай; Ян, Тао; Синь, Кэ; Ван, Гуаньцзюнь; Цзинь, Сяоян; Чжоу, Минфэй; Френкинг, Гернот (25 апреля 2018 г.). «Октакарбонильные анионные комплексы переходных металлов третьей группы [TM (CO) 8] - (TM = Sc, Y, La) и правило 18 электронов». Angewandte Chemie, международное издание . 57 (21): 6236–6241. дои : 10.1002/anie.201802590 . ISSN 1433-7851 . ПМИД 29578636 .
Дальнейшее чтение
[ редактировать ]- Толман, Калифорния (1972). «Правило 16 и 18 электронов в металлоорганической химии и гомогенном катализе». хим. Соц. Ред. 1 (3): 337. doi : 10.1039/CS9720100337 .