Кристалл


Кристалл молекулы или кристаллическое твердое вещество — это твердый материал, составляющие которого (такие как атомы , . или ионы ) расположены в высокоупорядоченной микроскопической структуре, образуя кристаллическую решетку , простирающуюся во всех направлениях [1] [2] Кроме того, макроскопические монокристаллы обычно можно идентифицировать по их геометрической форме , состоящей из плоских граней с определенной характерной ориентацией. Научное исследование кристаллов и их образования известно как кристаллография . Процесс образования кристаллов по механизмам роста кристаллов называется кристаллизацией или затвердеванием .
Слово «хрусталь» происходит от древнегреческого слова κρύσταλλος ( krustallos ), означающего одновременно « лед » и « горный хрусталь ». [3] от κρύος ( круос ), «ледяной холод, мороз». [4] [5]
Примеры крупных кристаллов включают снежинки , бриллианты и поваренную соль . Большинство неорганических твердых тел представляют собой не кристаллы, а поликристаллы , то есть множество микроскопических кристаллов, сросшихся в одно твердое вещество. Поликристаллы включают большинство металлов , горных пород, керамики и льда . Третья категория твердых тел — аморфные твердые тела , атомы которых вообще не имеют периодической структуры. Примеры аморфных твердых веществ включают стекло , воск и многие пластмассы .
Несмотря на название, свинцовый хрусталь, хрустальное стекло и сопутствующие изделия не являются кристаллами, а являются разновидностью стекла, то есть аморфными твердыми веществами.
Кристаллы, или кристаллические твердые вещества, часто используются в псевдонаучных практиках, таких как кристаллотерапия , и, наряду с драгоценными камнями , иногда связаны с работой заклинаний в викканских верованиях и связанных с ними религиозных движениях. [6] [7] [8]
Кристаллическая структура (микроскопическая)
Научное определение «кристалла» основано на микроскопическом расположении атомов внутри него, называемом кристаллической структурой . Кристалл – это твердое тело, атомы которого образуют периодическое расположение. ( Квазикристаллы являются исключением, см. ниже ).
Не все твердые тела являются кристаллами. Например, когда жидкая вода начинает замерзать, фазовый переход начинается с маленьких кристаллов льда, которые растут, пока не сливаются, образуя поликристаллическую структуру. В последней глыбе льда каждый из маленьких кристаллов (называемых « кристаллитами » или «зернами») представляет собой настоящий кристалл с периодическим расположением атомов, но весь поликристалл не имеет периодического расположения атомов, поскольку периодическая структура разрывается по границам зерен . Большинство макроскопических неорганических твердых тел являются поликристаллическими, включая почти все металлы , керамику , лед , камни и т. д. Твердые тела, которые не являются ни кристаллическими, ни поликристаллическими, например стекло , называются аморфными твердыми телами , также называемыми стекловидными , стеклообразными или некристаллическими. Они не имеют периодического порядка, даже микроскопически. Существуют явные различия между кристаллическими и аморфными твердыми телами: в первую очередь, процесс формирования стекла не высвобождает скрытую теплоту плавления , а образование кристалла.
Кристаллическая структура (расположение атомов в кристалле) характеризуется своей элементарной ячейкой — небольшим воображаемым ящиком, содержащим один или несколько атомов в определенном пространственном расположении. Элементарные ячейки складываются в трехмерном пространстве, образуя кристалл.
Симметрия кристалла ограничена требованием, чтобы элементарные ячейки укладывались идеально, без зазоров. Существует 219 возможных кристаллических симметрий (обычно упоминается 230, но при этом киральные эквиваленты рассматриваются как отдельные объекты), называемые кристаллографическими пространственными группами . [9] Они сгруппированы в 7 кристаллических систем , таких как кубическая кристаллическая система (где кристаллы могут образовывать кубы или прямоугольные коробки, например, галит, показанный справа) или гексагональная кристаллическая система (где кристаллы могут образовывать шестиугольники, например, обычный водяной лед ).
Кристаллические грани, формы и кристаллографические формы

Кристаллы обычно распознаются макроскопически по их форме, состоящей из плоских граней с острыми углами. Эти характеристики формы не являются необходимыми для кристалла — кристалл с научной точки зрения определяется его микроскопическим расположением атомов, а не его макроскопической формой — но характерная макроскопическая форма часто присутствует и ее легко увидеть.
Идиоморфные кристаллы — это кристаллы, которые имеют четкие, хорошо сформированные плоские грани. Кангедральные кристаллы этого не делают, обычно потому, что кристалл представляет собой одно зерно поликристаллического твердого тела.
Плоские грани (также называемые гранями ) идиоморфного кристалла ориентированы определенным образом относительно основного расположения атомов кристалла : они представляют собой плоскости с относительно низким индексом Миллера . [10] Это происходит потому, что некоторые ориентации поверхности более стабильны, чем другие (более низкая поверхностная энергия ). По мере роста кристалла новые атомы легко прикрепляются к более шероховатым и менее стабильным частям поверхности, но с меньшей легкостью — к плоским и стабильным поверхностям. Поэтому плоские поверхности имеют тенденцию становиться больше и более гладкими, пока вся поверхность кристалла не будет состоять из этих плоских поверхностей. (См. схему справа.)
Один из старейших методов в науке кристаллографии состоит в измерении трехмерной ориентации граней кристалла и использовании ее для вывода о лежащей в ее основе симметрии кристалла .
кристалла Кристаллографические формы — это набор возможных граней кристалла, связанных одной из симметрий кристалла. Например, кристаллы галенита часто принимают форму кубов, причем шесть граней куба принадлежат кристаллографической форме, отображающей одну из симметрий изометрической кристаллической системы . Галенит также иногда кристаллизуется в виде октаэдров, причем восемь граней октаэдра принадлежат другой кристаллографической форме, отражающей иную симметрию изометрической системы. Кристаллографическая форма описывается помещением индексов Миллера одной из ее граней в скобки. Например, октаэдрическая форма записывается как {111}, а остальные грани формы подразумеваются симметрией кристалла.
Формы могут быть закрытыми, то есть форма может полностью закрывать объем пространства, или открытыми, то есть не могут. Кубическая и октаэдрическая формы являются примерами закрытых форм. Все формы изометрической системы закрыты, а все формы моноклинной и триклинной кристаллических систем открыты. Все грани кристалла могут принадлежать одной и той же закрытой форме или представлять собой комбинацию нескольких открытых или закрытых форм. [11]
– Привычка кристалла это его видимая внешняя форма. Это определяется кристаллической структурой (которая ограничивает возможные ориентации граней), специфической кристаллохимией и связями (которые могут отдавать предпочтение одним типам граней над другими), а также условиями, при которых образовался кристалл.
Встречаемость в природе


Скалы
По объёму и весу самые большие концентрации кристаллов на Земле находятся в её твёрдой основе . Кристаллы, встречающиеся в горных породах, обычно имеют размер от долей миллиметра до нескольких сантиметров в поперечнике, хотя иногда встречаются и исключительно крупные кристаллы. По состоянию на 1999 год [update]Самый большой известный в мире природный кристалл — это кристалл берилла из Малакиалины, Мадагаскар , длиной 18 м (59 футов), диаметром 3,5 м (11 футов) и весом 380 000 кг (840 000 фунтов). [12]
Некоторые кристаллы образовались в результате магматических и метаморфических процессов, в результате чего образовались большие массы кристаллических пород . Подавляющее большинство магматических пород образуется из расплавленной магмы, и степень кристаллизации зависит прежде всего от условий, при которых они затвердевали. Такие породы, как гранит , которые охлаждались очень медленно и под большим давлением, полностью кристаллизовались; но многие виды лавы излились на поверхность и очень быстро остыли, и в этой последней группе небольшое количество аморфного или стекловидного обычно встречается вещества. Другие кристаллические породы, метаморфические породы, такие как мрамор , слюдяные сланцы и кварциты , перекристаллизовываются. Это означает, что сначала они представляли собой обломочные породы, такие как известняк , сланец и песчаник , и никогда не находились ни в расплавленном состоянии, ни полностью в растворе, но условия высокой температуры и давления метаморфизма действовали на них, стирая их первоначальные структуры и вызывая рекристаллизацию в твердое состояние. [13]
Другие горные кристаллы образовались из осадков жидкостей, обычно воды, с образованием друз или кварцевых жил. Эвапориты, такие как галит , гипс и некоторые известняки, отлагались из водных растворов, главным образом вследствие испарения в засушливом климате.
Лед
на водной основе Лед в виде снега , морского льда и ледников — распространенные кристаллические/поликристаллические структуры на Земле и других планетах. [14] Отдельная снежинка — это один кристалл или совокупность кристаллов. [15] а кубик льда — это поликристалл . [16] Кристаллы льда могут образовываться в результате охлаждения жидкой воды ниже точки замерзания, например, кубики льда или замерзшее озеро. Иней , снежинки или мелкие кристаллики льда, взвешенные в воздухе ( ледяной туман ) чаще вырастают из пересыщенного газообразного раствора водяного пара и воздуха, когда температура воздуха падает ниже точки росы , не переходя в жидкое состояние. Еще одно необычное свойство воды заключается в том, что при кристаллизации она расширяется, а не сжимается. [17]
Органические кристаллы
Многие живые организмы способны производить кристаллы, выращенные из водного раствора , например кальцит и арагонит в случае большинства моллюсков или гидроксилапатит в случае костей и зубов у позвоночных .
Полиморфизм и аллотропия
Одна и та же группа атомов часто может затвердевать разными способами. Полиморфизм – это способность твердого тела существовать более чем в одной кристаллической форме. Например, водяной лед обычно имеет шестиугольную форму Ice I h , но может также существовать в виде кубического льда I c , ромбоэдрического льда II и многих других форм. Различные полиморфы обычно называют разными фазами .
Кроме того, те же атомы могут образовывать некристаллические фазы . Например, вода также может образовывать аморфный лед , а SiO 2 может образовывать как плавленый кварц (аморфное стекло), так и кварц (кристалл). Аналогично, если вещество может образовывать кристаллы, оно также может образовывать поликристаллы.
Для чистых химических элементов полиморфизм известен как аллотропия . Например, алмаз и графит представляют собой две кристаллические формы углерода , а аморфный углерод — некристаллическую форму. Полиморфы, несмотря на наличие одинаковых атомов, могут иметь совершенно разные свойства. Например, алмаз — самое твердое из известных веществ, а графит настолько мягок, что его используют в качестве смазки. Шоколад может образовывать шесть различных типов кристаллов, но только один имеет подходящую твердость и температуру плавления для шоколадных батончиков и кондитерских изделий. Полиморфизм стали отвечает за ее способность подвергаться термической обработке , что придает ей широкий спектр свойств.
Полиаморфизм — аналогичное явление, когда одни и те же атомы могут существовать более чем в одной аморфной твердой форме.
Кристаллизация

Кристаллизация — это процесс образования кристаллической структуры из жидкости или материалов, растворенных в жидкости. (Реже кристаллы могут осаждаться непосредственно из газа; см.: Эпитаксия и мороз .)
Кристаллизация — сложная и тщательно изученная область, поскольку в зависимости от условий одна жидкость может затвердевать во многих различных возможных формах. Он может образовывать монокристалл , возможно, с различными возможными фазами , стехиометрией , примесями, дефектами и привычками . Или он может образовывать поликристалл с различными возможностями размера, расположения, ориентации и фазы зерен. Окончательная форма твердого тела определяется условиями, при которых жидкость затвердевает, такими как химический состав жидкости, давление окружающей среды , температура и скорость, с которой изменяются все эти параметры.
Конкретные промышленные методы производства крупных монокристаллов (так называемых булей ) включают процесс Чохральского и метод Бриджмена . В зависимости от физических свойств вещества могут использоваться и другие менее экзотические методы кристаллизации, включая гидротермальный синтез , сублимацию или просто кристаллизацию на основе растворителя .
Большие монокристаллы могут быть созданы в результате геологических процессов. Например, кристаллы селенита размером более 10 м обнаружены в Пещере кристаллов в Наике, Мексика. [18] Подробнее о геологическом кристаллообразовании см. выше .
Кристаллы также могут образовываться в результате биологических процессов, см. выше . И наоборот, у некоторых организмов есть специальные методы предотвращения кристаллизации, например белки-антифризы .
Дефекты, примеси и двойникование
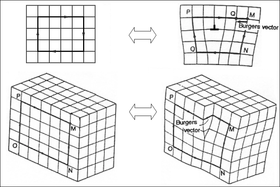
кристалле В идеальном каждый атом имеет идеальный, точно повторяющийся узор. [19] Однако на самом деле большинство кристаллических материалов имеют различные кристаллографические дефекты — места, где рисунок кристалла прерывается. Типы и структуры этих дефектов могут оказывать глубокое влияние на свойства материалов.
Несколько примеров кристаллографических дефектов включают вакансионные дефекты (пустое пространство, куда должен поместиться атом), межузельные дефекты (лишний атом, втиснутый туда, где он не помещается) и дислокации (см. рисунок справа). Дислокации особенно важны в материаловедении , поскольку они помогают определять механическую прочность материалов .
Другой распространенный тип кристаллографического дефекта — это примесь , означающая, что в кристалле присутствует «неправильный» тип атома. Например, идеальный кристалл алмаза будет содержать только атомы углерода несколько атомов бора , но настоящий кристалл, возможно, может содержать также . Эти примеси бора меняют цвет бриллианта на слегка синий. Аналогично, единственная разница между рубином и сапфиром — это тип примесей, присутствующих в кристалле корунда .

В полупроводниках особый тип примеси, называемый легирующей примесью , радикально меняет электрические свойства кристалла. Полупроводниковые устройства , такие как транзисторы , стали возможными во многом благодаря помещению различных полупроводниковых примесей в разные места и по определенным схемам.
Двойникование — это явление, находящееся где-то между кристаллографическим дефектом и границей зерна . Как и граница зерна, граница двойника имеет разную ориентацию кристаллов с двух сторон. Но в отличие от границы зерна, ориентации не случайны, а связаны определенным зеркальным образом.
Мозаичность – это распространение ориентаций кристаллических плоскостей. Мозаичный кристалл состоит из более мелких кристаллических единиц, несколько смещенных друг относительно друга.
Химические связи
В общем, твердые тела могут удерживаться вместе различными типами химических связей , такими как металлические связи , ионные связи , ковалентные связи , связи Ван-дер-Ваальса и другие. Ни один из них не обязательно является кристаллическим или некристаллическим. Однако существуют некоторые общие тенденции:
Металлы быстро кристаллизуются и почти всегда являются поликристаллическими, хотя есть исключения, такие как аморфные металлы и монокристаллические металлы. Последние выращиваются синтетически, например, турбины истребителей обычно изготавливаются путем сначала выращивания монокристалла титанового сплава, что увеличивает его прочность и температуру плавления по сравнению с поликристаллическим титаном. Небольшой кусок металла может естественным образом сформироваться в монокристалл, например теллурическое железо 2-го типа , но более крупные куски обычно не образуются, если только не происходит чрезвычайно медленное охлаждение. Например, железные метеориты часто состоят из монокристаллов или множества крупных кристаллов, размер которых может достигать нескольких метров из-за очень медленного охлаждения в космическом вакууме. Медленное охлаждение может привести к осаждению отдельной фазы внутри кристаллической решетки, которая образуется под определенными углами, определяемыми решеткой, так называемыми узорами Видманштетта . [20]
Ионные соединения обычно образуются, когда металл реагирует с неметаллом, например натрием с хлором. Они часто образуют вещества, называемые солями, такие как хлорид натрия (поваренная соль) или нитрат калия ( селитра ), с кристаллами, которые часто являются хрупкими и относительно легко расщепляются. Ионные материалы обычно являются кристаллическими или поликристаллическими. На практике крупные кристаллы соли могут быть созданы путем затвердевания расплавленной жидкости или кристаллизации из раствора. Некоторые ионные соединения могут быть очень твердыми, например, оксиды алюминия, содержащиеся во многих драгоценных камнях, таких как рубин и синтетический сапфир .
Твердые тела с ковалентной связью (иногда называемые твердыми телами с ковалентной сетью ) обычно образуются из одного или нескольких неметаллов, таких как углерод или кремний и кислород, и часто бывают очень твердыми, жесткими и хрупкими. Они также очень распространены, яркими примерами являются алмаз и кварц соответственно. [21]
Слабые силы Ван-дер-Ваальса также помогают удерживать вместе определенные кристаллы, такие как кристаллические молекулярные твердые тела , а также межслоевые связи в графите . Такие вещества, как жиры , липиды и воск, образуют молекулярные связи, поскольку большие молекулы не упаковываются так плотно, как атомные связи. Это приводит к тому, что кристаллы становятся намного мягче и их легче разрывать или ломать. Типичные примеры включают шоколад, свечи или вирусы. Водяной лед и сухой лед являются примерами других материалов с молекулярными связями. [22] Полимерные материалы обычно образуют кристаллические области, но длина молекул обычно препятствует полной кристаллизации, а иногда полимеры полностью аморфны.
Квазикристаллы

Квазикристалл . состоит из массивов атомов, которые упорядочены, но не строго периодически Они имеют много общих свойств с обычными кристаллами, например, отображение дискретного рисунка при дифракции рентгеновских лучей и способность образовывать формы с гладкими плоскими гранями.
Квазикристаллы наиболее известны своей способностью проявлять пятикратную симметрию, что невозможно для обычного периодического кристалла (см. кристаллографическую ограничительную теорему ).
Международный союз кристаллографии дал новое определение термину «кристалл», включив в него как обычные периодические кристаллы, так и квазикристаллы («любое твердое тело, имеющее по существу дискретную дифракционную диаграмму»). [23] ).
Квазикристаллы, впервые обнаруженные в 1982 году, на практике встречаются довольно редко. Известно, что только около 100 твердых тел образуют квазикристаллы по сравнению с примерно 400 000 периодическими кристаллами, известными в 2004 году. [24] 2011 года Нобелевская премия по химии была присуждена Дэну Шехтману за открытие квазикристаллов. [25]
Особые свойства из-за анизотропии
Кристаллы могут обладать определенными особыми электрическими, оптическими и механическими свойствами, которых стекло и поликристаллы обычно не имеют . Эти свойства связаны с анизотропией кристалла, т. е. с отсутствием вращательной симметрии в расположении его атомов. Одним из таких свойств является пьезоэлектрический эффект , при котором напряжение на кристалле может сжимать или растягивать его. Другой вариант — двойное лучепреломление , при котором при взгляде через кристалл появляется двойное изображение. Более того, различные свойства кристалла, включая электропроводность , электрическую проницаемость и модуль Юнга , могут быть разными в разных направлениях в кристалле. Например, кристаллы графита состоят из стопки листов, и хотя каждый отдельный лист механически очень прочен, листы довольно слабо связаны друг с другом. Поэтому механическая прочность материала весьма различна в зависимости от направления напряжения.
Не все кристаллы обладают всеми этими свойствами. И наоборот, эти свойства не являются исключительными только для кристаллов. Они могут появиться в стеклах или поликристаллах , которые стали анизотропными в результате обработки или напряжения — например, двойного лучепреломления, вызванного напряжением .
Кристаллография
Кристаллография — это наука об измерении кристаллической структуры (другими словами, расположения атомов) кристалла. Одним из широко используемых методов кристаллографии является дифракция рентгеновских лучей . Большое количество известных кристаллических структур хранится в кристаллографических базах данных .
Галерея изображений
- инсулина Кристаллы , выращенные на околоземной орбите . Низкая гравитация позволяет выращивать кристаллы с минимальными дефектами.
- Иней : разновидность кристаллов льда (снимок сделан с расстояния около 5 см).
- Галлий — металл, который легко образует крупные кристаллы.
- Кристалл апатита расположен спереди и в центре на вишнево-красных ромбах родохроита, фиолетовых кубиках флюорита, кварце и напылении медно-желтых кубиков пирита.
- Образец, состоящий из кристалла халькопирита, покрытого борнитом, заключенного в слой прозрачных кристаллов кварца и блестящих кристаллов пирита. Кристалл, покрытый борнитом, имеет диаметр до 1,5 см.
- Игольчатые кристаллы миллерита , частично заключенные в кристаллы кальцита и окисленные на поверхности до заратита ; из девонской формации Милуоки в Висконсине
- Кристаллизованный сахар. Кристаллы справа были выращены из кубика сахара, а слева — из одного затравочного кристалла, взятого справа. Красный краситель добавлялся в раствор при выращивании более крупного кристалла, но, поскольку он был нерастворим в твердом сахаре, все его следы, кроме небольших, выпадали в осадок по мере роста.
См. также
Ссылки
- ^ Стивен Лоуэр. «Онлайн-учебник Chem1 — Состояния вещества» . Проверено 19 сентября 2016 г.
- ^ Эшкрофт и Мермин (1976). Физика твердого тела .
- ^ κρύσταλλος , Генри Джордж Лидделл , Роберт Скотт , Греко-английский лексикон , в цифровой библиотеке Персея
- ^ κρύος , Генри Джордж Лидделл, Роберт Скотт, Греко-английский лексикон , в цифровой библиотеке Персея
- ^ «кристалл» . Словарь американского наследия английского языка . Проверено 17 июня 2023 г.
- ^ Регал, Брайан. (2009). Лженаука: критическая энциклопедия . Гринвуд. п. 51. ISBN 978-0-313-35507-3
- ^ Патти Вигингтон (31 августа 2016 г.). «Использование кристаллов и драгоценных камней в магии» . О сайте.com . Архивировано из оригинала 15 ноября 2016 года . Проверено 14 ноября 2016 г.
- ^ «Магия кристаллов и драгоценных камней» . ВедьмыЛор . 14 декабря 2011 года . Проверено 14 ноября 2016 г.
- ^ Велберри, Т.Р., изд. (2021), Международные таблицы по кристаллографии , том. А, Честер, Англия: Международный союз кристаллографии, номер номера : 10.1107/97809553602060000001 , ISBN. 978-1-119-95235-0 , S2CID 146060934
- ^ Наука о поверхности оксидов металлов , Виктор Э. Хенрих, П.А. Кокс, стр. 28, ссылка на книги Google
- ^ Синканкас, Джон (1964). Минералогия для любителей . Принстон, Нью-Джерси: Ван Ностранд. стр. 134–138. ISBN 0442276249 .
- ^ Г. Кресси и И.Ф. Мерсер, (1999) Кристаллы , Лондон, Музей естественной истории, стр. 58
- ^ Одно или несколько предыдущих предложений включают текст из публикации, которая сейчас находится в свободном доступе : Флетт, Джон Смит (1911). « Петрология ». В Чисхолме, Хью (ред.). Британская энциклопедия . Том. 21 (11-е изд.). Издательство Кембриджского университета.
- ^ Ёсинори Фурукава, «Лед»; Матти Леппяранта, «Морской лед»; Д.П. Добхал, «Ледник»; и другие статьи в изданиях Виджая П. Сингха, Пратапа Сингха и Умеша К. Хариташьи, ред., «Энциклопедия снега, льда и ледников» (Дордрехт, Небраска: Springer Science & Business Media, 2011). ISBN 904812641X , 9789048126415
- ^ Либбрехт, Кеннет; Винг, Рэйчел (01 сентября 2015 г.). Снежинка: Холодное искусство зимы . Вояджер Пресс. ISBN 9781627887335 .
- ^ Йорт-Хансен, Э. (19 октября 2017 г.). Snow Engineering 2000: Последние достижения и разработки . Рутледж. ISBN 9781351416238 .
- ^ Нуклеация воды: от фундаментальной науки к атмосфере и дополнительным применениям , Ари Лааксонен, Юсси Малила - Elsevier, 2022, стр. 239--240
- ^ Ши, Нил (ноябрь 2008 г.). «Пещера хрустальных гигантов» . Журнал «Нэшнл Географик» . Архивировано из оригинала 19 декабря 2017 года.
- ^ Великобритания), Совет научных исследований (Великолепный (1972). Отчет Совета . Канцелярия Ее Величества.
- ↑ Энциклопедия Солнечной системы Тилмана Спона, Дорис Брейер, Торренса В. Джонсона — Elsevier, 2014, стр. 632
- ^ Государственный университет Анджело: формулы и номенклатура ионных и ковалентных соединений
- ^ Наука для реставраторов, Том 3: Клеи и покрытия, Комиссия музеев и галерей - Комиссия музеев и галерей, 2005 г., стр. 57
- ^ Международный союз кристаллографии (1992). «Отчет исполкома за 1991 год» . Акта Кристаллогр. А. 48 (6): 922–946. дои : 10.1107/S0108767392008328 . ПМК 1826680 .
- ^ Штойрер В. (2004). «Двадцать лет исследования структуры квазикристаллов. Часть I. Пятиугольные, восьмиугольные, декагональные и додекагональные квазикристаллы» . З. Кристаллогр . 219 (7–2004): 391–446. Бибкод : 2004ЗК....219..391С . дои : 10.1524/zkri.219.7.391.35643 .
- ^ «Нобелевская премия по химии 2011» . Нобелевская премия.org . Проверено 29 декабря 2011 г.
Дальнейшее чтение
- Ховард, Дж. Майкл; Дарси Ховард (иллюстратор) (1998). «Введение в кристаллографию и минерально-кристаллические системы» . Рок-магазин Боба. Архивировано из оригинала 26 августа 2006 г. Проверено 20 апреля 2008 г.
- Крассманн, Томас (2005–2008). «Проект гигантского кристалла» . Крассманн. Архивировано из оригинала 26 апреля 2008 г. Проверено 20 апреля 2008 г.
- «Обучающие брошюры» . Комиссия по кристаллографическому обучению. 2007. Архивировано из оригинала 17 апреля 2008 г. Проверено 20 апреля 2008 г.
- «Структуры кристаллической решетки: индекс по пространственной группе» . 2004 . Проверено 3 декабря 2016 г.
- «Кристаллография» . Испанский национальный исследовательский совет , кафедра кристаллографии. 2010 . Проверено 8 января 2010 г.










