Индуцированные плюрипотентные стволовые клетки
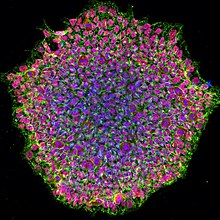
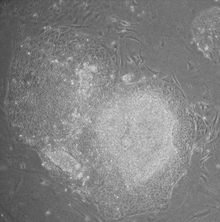
Индуцированные плюрипотентные стволовые клетки (также известные как iPS- клетки или iPSC ) представляют собой тип плюрипотентных стволовых клеток , которые могут быть получены непосредственно из соматической клетки . Технология iPSC была впервые использована Шинья Яманака и Казутоши Такахаши в Киото , Япония , которые вместе показали в 2006 году, что введение четырех специфических генов (названных Myc , Oct3/4 , Sox2 и Klf4 ), известных под общим названием факторы Яманака, кодирующих факторы транскрипции , могут превращать соматические клетки в плюрипотентные стволовые клетки. [1] Шинья Яманака был удостоен Нобелевской премии 2012 года вместе с сэром Джоном Гердоном «за открытие того, что зрелые клетки можно перепрограммировать, чтобы они стали плюрипотентными». [2]
Плюрипотентные стволовые клетки открывают перспективы в области регенеративной медицины . [3] Поскольку они могут размножаться бесконечно, а также давать начало любому другому типу клеток в организме (например, нейронам, клеткам сердца, поджелудочной железы и печени), они представляют собой единый источник клеток, которые можно использовать для замены тех, которые были потеряны в результате повреждения. или болезнь.
Наиболее известным типом плюрипотентных стволовых клеток являются эмбриональные стволовые клетки . Однако, поскольку создание эмбриональных стволовых клеток предполагает разрушение (или, по крайней мере, манипуляцию) [4] эмбрионов на предимплантационной стадии, было много споров вокруг их использования . Подходящие для пациента линии эмбриональных стволовых клеток теперь можно получить с помощью переноса ядер соматических клеток (SCNT). [ нужна ссылка ]
Поскольку ИПСК могут быть получены непосредственно из тканей взрослого человека, они не только обходят необходимость в эмбрионах, но и могут быть созданы индивидуально для каждого пациента, а это означает, что у каждого человека может быть своя собственная линия плюрипотентных стволовых клеток. Эти неограниченные запасы аутологичных клеток можно использовать для создания трансплантатов без риска иммунного отторжения. Хотя технология ИПСК еще не достигла той стадии, когда терапевтические трансплантаты считаются безопасными, ИПСК с готовностью используются в попытках персонализировать поиск лекарств и понять индивидуальную основу заболевания. [5]
Яманака назвал iPSC строчной буквой «i» из-за популярности iPod и других продуктов. [6] [7] [8] [9] [10] [ сомнительно – обсудить ]
На своем Нобелевском семинаре Яманака сослался на более раннюю плодотворную работу Гарольда Вайнтрауба о роли белка 1, определяющего миобласты (MyoD) в перепрограммировании судьбы клеток в мышечную линию, как на важную предпосылку открытия ИПСК. [11]
Производство
[ редактировать ]
ИПСК обычно получают путем введения продуктов определенных наборов генов, связанных с плюрипотентностью, или «факторов перепрограммирования», в данный тип клеток. Исходным набором факторов репрограммирования (также называемых факторами Яманаки) являются факторы транскрипции Oct4 (Pou5f1), Sox2 , Klf4 и cMyc . Хотя эта комбинация наиболее традиционна для получения ИПСК, каждый из факторов может быть функционально заменен родственными факторами транскрипции, микроРНК , небольшими молекулами или даже несвязанными генами, такими как спецификаторы линии. [12] Также ясно, что промитотические факторы, такие как C-MYC/L-MYC, или репрессия контрольных точек клеточного цикла, такие как p53, являются проводниками для создания совместимого клеточного состояния для перепрограммирования iPSC. [13]
Получение ИПСК обычно представляет собой медленный и неэффективный процесс, занимающий одну-две недели для клеток мыши и три-четыре недели для клеток человека, с эффективностью около 0,01–0,1%. Однако были достигнуты значительные успехи в повышении эффективности и времени, необходимого для получения ИПСК. При введении факторов репрограммирования клетки начинают образовывать колонии, напоминающие плюрипотентные стволовые клетки, которые можно выделить на основе их морфологии, условий, определяющих их рост, или посредством экспрессии поверхностных маркеров или репортерных генов .
Первое поколение (мышь)
[ редактировать ]Индуцированные плюрипотентные стволовые клетки были впервые созданы Синья Яманака и Кадзутоши Такахаши в Киотском университете , Япония, в 2006 году. [1] Они предположили, что гены, важные для функционирования эмбриональных стволовых клеток (ЭСК), могут индуцировать эмбриональное состояние взрослых клеток. Они выбрали двадцать четыре гена, ранее идентифицированные как важные в ЭСК, и использовали ретровирусы для доставки этих генов в фибробласты мыши . Фибробласты были сконструированы таким образом, чтобы любые клетки, реактивирующие ESC-специфичный ген Fbx15 , можно было выделить с помощью селекции антибиотиков.
После доставки всех двадцати четырех факторов возникли ESC-подобные колонии, которые реактивировали репортер Fbx15 и могли размножаться бесконечно. Чтобы идентифицировать гены, необходимые для перепрограммирования, исследователи удаляли по одному фактору из двадцати четырех. С помощью этого процесса они идентифицировали четыре фактора: Oct4, Sox2, cMyc и Klf4, каждый из которых был необходим и вместе достаточен для создания ESC-подобных колоний, отбираемых для реактивации Fbx15.
Второе поколение (мышь)
[ редактировать ]В июне 2007 года три отдельные исследовательские группы, в том числе группа Яманаки, сотрудничество Гарварда / Калифорнийского университета в Лос-Анджелесе и группа из Массачусетского технологического института , опубликовали исследования, которые существенно улучшили подход к перепрограммированию, что привело к появлению ИПСК, неотличимых от ЭСК. . В отличие от ИПСК первого поколения, эти ИПСК второго поколения дали жизнеспособных химерных мышей и внесли вклад в зародышевую линию мышей, тем самым достигнув «золотого стандарта» для плюрипотентных стволовых клеток.
Эти ИПСК второго поколения были получены из фибробластов мыши путем ретровирусной экспрессии тех же четырех факторов транскрипции (Oct4, Sox2, cMyc, Klf4). Однако вместо того, чтобы использовать Fbx15 для отбора плюрипотентных клеток, исследователи использовали Nanog , ген, который функционально важен в ЭСК. Используя эту другую стратегию, исследователи создали ИПСК, функционально идентичные ЭСК. [14] [15] [16] [17]
Индуцированные человеком плюрипотентные стволовые клетки
[ редактировать ]Генерация из фибробластов человека
[ редактировать ]О перепрограммировании клеток человека в ИПСК сообщили в ноябре 2007 года две независимые исследовательские группы: Шинья Яманака из Киотского университета, Япония, который впервые применил оригинальный метод ИПСК, и Джеймс Томсон из Университета Висконсин-Мэдисон , который первым получил эмбриональный ствол человека. клетки. Используя тот же принцип, который использовался при перепрограммировании мышей, группа Яманаки успешно трансформировала человеческие фибробласты в ИПСК с теми же четырьмя ключевыми генами: Oct4, Sox2, Klf4 и cMyc, используя ретровирусную систему. [18] в то время как Томсон и его коллеги использовали другой набор факторов: Oct4, Sox2, Nanog и Lin28, используя лентивирусную систему. [19]
Генерация из дополнительных типов клеток
[ редактировать ]Получение фибробластов для производства ИПСК включает биопсию кожи, и наблюдается стремление определить типы клеток, которые более доступны. [20] [21] В 2008 году ИПСК были получены из кератиноцитов человека, которые можно было получить из одного выдергивания волос. [22] [23] В 2010 году ИПСК были получены из клеток периферической крови. [24] [25] а в 2012 году ИПСК были получены из почечных эпителиальных клеток в моче. [26]
Другие соображения в отношении исходного типа клеток включают мутационную нагрузку (например, клетки кожи могут содержать больше мутаций из-за воздействия ультрафиолета), [20] [21] время, необходимое для увеличения популяции стартовых клеток, [20] и способность дифференцироваться в определенный тип клеток. [27]
Гены, используемые для производства ИПСК
[ редактировать ][ нужна ссылка ]
Генерация индуцированных плюрипотентных клеток решающим образом зависит от транскрипционных факторов, используемых для индукции.
Oct-3/4 и некоторые продукты семейства генов Sox (Sox1, Sox2, Sox3 и Sox15) были идентифицированы как важные регуляторы транскрипции, участвующие в процессе индукции, отсутствие которых делает индукцию невозможной. дополнительные гены, в том числе некоторые члены семейства Klf (Klf1, Klf2, Klf4 и Klf5), семейства Myc (c-myc, L-myc и N-myc), Nanog и LIN28 Однако были идентифицированы . увеличить эффективность индукции.
- Oct-3/4 (Pou5f1) Oct-3/4 относится к семейству транскрипционных факторов октамера («Oct») и играет решающую роль в поддержании плюрипотентности. Отсутствие 3/4 октября в 3/4 октября + клеток, таких как бластомеры и эмбриональные стволовые клетки, приводит к спонтанной дифференцировке трофобласта , и присутствие Oct-3/4, таким образом, приводит к плюрипотентности и потенциалу дифференцировки эмбриональных стволовых клеток. Различные другие гены семейства Oct, включая близких родственников Oct-3/4, Oct1 и Oct6 , не способны вызвать индукцию, что демонстрирует исключительность Oct-3/4 для процесса индукции. Шёлер показал, что сверхэкспрессия Oct4 во время репрограммирования вызывает эпигенетические изменения, ухудшающие качество ИПСК. По сравнению с OSKM (Oct4, Sox2, Klf4 и c-Myc) новое перепрограммирование SKM (Sox2, Klf4 и c-Myc) генерирует ИПСК с потенциалом развития, эквивалентным эмбриональным стволовым клеткам, что определяется их способностью генерировать мышей, состоящих только из ИПСК, через тетраплоид. комплементация эмбриона . [28] [29] ИПСК с более высоким потенциалом развития также могут быть получены путем усиления димеризации между Oct4 и Sox2 с использованием химерного фактора Sox. [30]
- Семейство Sox : Семейство транскрипционных факторов Sox связано с поддержанием плюрипотентности, аналогичной Oct-3/4, хотя оно связано с мультипотентными и унипотентными стволовыми клетками в отличие от Oct-3/4, который экспрессируется исключительно в плюрипотентных стволовых клетках. Хотя Sox2 был исходным геном, использованным для индукции Yamanaka et al., Jaenisch et al. и Thomson et al., было обнаружено, что другие транскрипционные факторы семейства Sox также работают в процессе индукции. Sox1 дает ИПСК с такой же эффективностью, как Sox2, а гены Sox3 , Sox15 и Sox18 также генерируют ИПСК, хотя и с пониженной эффективностью. Величко и др. разработали химерный фактор суперрепрограммирования Sox2-17 или «супер-Sox», который усиливал или позволял генерировать ИПСК мыши, человека, яванского макака, свиньи и крупного рогатого скота. [30]
- Семейство Klf : Klf4 семейства транскрипционных факторов Klf первоначально был идентифицирован Yamanaka et al. и подтверждено Jaenish et al. В качестве фактора образования мышиных iPS-клеток было продемонстрировано Yamanaka et al. как фактор генерации iPS-клеток человека. Однако Томсон и др. сообщили, что Klf4 не нужен для генерации iPS-клеток человека и фактически не способен генерировать iPS-клетки человека. Было обнаружено, что Klf2 и Klf4 являются факторами, способными генерировать iPS-клетки, а родственные гены Klf1 и Klf5 тоже делают это, хотя и с пониженной эффективностью.
- Семейство Myc : Семейство транскрипционных факторов Myc представляет собой протоонкогены, участвующие в развитии рака. Яманака и др. и Джениш и др. продемонстрировали, что c-myc является фактором, участвующим в образовании iPS-клеток мыши, а Yamanaka et al. продемонстрировали, что это фактор, участвующий в образовании iPS-клеток человека. Однако Томсон и др., Яманака и др. Использование семейства генов «myc» для индукции iPS-клеток вызывает беспокойство по поводу возможности использования iPS-клеток в качестве клинической терапии, поскольку у 25% мышей, которым трансплантировали iPS-клетки, индуцированные c-myc, развились летальные тератомы . N-myc и L-myc индуцируют вместо c-myc с одинаковой эффективностью. Было обнаружено, что
- Nanog : В эмбриональных стволовых клетках Nanog, наряду с Oct-3/4 и Sox2, необходим для обеспечения плюрипотентности. Поэтому было удивительно, когда Yamanaka et al. сообщили, что Nanog не требуется для индукции, хотя Thomson et al. сообщил, что можно создавать iPS-клетки с использованием Nanog в качестве одного из факторов.
- LIN28 : LIN28 представляет собой белок, связывающий мРНК. [31] экспрессируется в эмбриональных стволовых клетках и клетках эмбриональной карциномы, связанных с дифференцировкой и пролиферацией. Томсон и др. продемонстрировали, что LIN28 является фактором генерации ИПСК в сочетании с OCT4, SOX2 и NANOG. [19]
- Glis1 : Glis1 представляет собой транскрипционный фактор, который можно использовать с Oct-3/4, Sox2 и Klf4 для индукции плюрипотентности. Он дает многочисленные преимущества при использовании вместо C-myc. [32]
Проблемы перепрограммирования клеток в плюрипотентность
[ редактировать ]Хотя методы, впервые предложенные Яманакой и другими, продемонстрировали, что взрослые клетки можно перепрограммировать в iPS-клетки, с этой технологией все еще существуют проблемы:
- Низкая эффективность: в целом конверсия в iPS-ячейки была невероятно низкой. Например, скорость, с которой соматические клетки перепрограммировались в iPS-клетки в оригинальном исследовании Яманаки на мышах, составляла 0,01–0,1%. [1] Низкий уровень эффективности может отражать необходимость точного времени, баланса и абсолютных уровней экспрессии перепрограммирующих генов. Это также может указывать на необходимость редких генетических или эпигенетических изменений в исходной популяции соматических клеток или в продленной культуре. Однако недавно был найден путь эффективного перепрограммирования, который требует подавления нуклеосом комплекса ремоделирования и деацетилирования ( NuRD ). Сверхэкспрессия Mbd3, субъединицы NuRD, ингибирует индукцию ИПСК. С другой стороны, истощение Mbd3 повышает эффективность перепрограммирования. [33] это приводит к детерминированному и синхронизированному перепрограммированию iPS-клеток (эффективность около 100% в течение семи дней для клеток мыши и человека). [34]
- Геномная вставка: геномная интеграция факторов транскрипции ограничивает полезность подхода с использованием факторов транскрипции из-за риска внедрения мутаций в геном клетки-мишени. [35] Распространенной стратегией предотвращения геномной вставки было использование другого вектора для ввода. Плазмиды , аденовирусы и транспозонные векторы были исследованы, но они часто имеют компромисс с более низкой пропускной способностью. [36] [37] [38]
- Туморогенность: в зависимости от используемых методов перепрограммирование взрослых клеток для получения ИПСК может представлять значительные риски, которые могут ограничить их использование у людей. Например, если вирусы используются для геномного изменения клеток, потенциально может быть запущена экспрессия онкогенов (генов, вызывающих рак). В феврале 2008 года ученые объявили об открытии метода, позволяющего удалять онкогены после индукции плюрипотентности, тем самым увеличивая потенциальное использование iPS-клеток при заболеваниях человека. [39] В другом исследовании Яманака сообщил, что можно создавать ИПСК без онкогена c-Myc. Процесс занял больше времени и был не таким эффективным, но у полученных химер не развился рак. [40] Инактивация или удаление опухолевого супрессора р53, который является ключевым регулятором рака, значительно повышает эффективность перепрограммирования. [41] Таким образом, по-видимому, существует компромисс между эффективностью перепрограммирования и образованием опухолей.
- Неполное перепрограммирование: перепрограммирование также сталкивается с проблемой полноты. Это особенно сложно, потому что полногеномный эпигенетический код должен быть переформатирован в код целевого типа клеток, чтобы полностью перепрограммировать клетку. Однако три отдельные группы смогли найти iPS-клетки, полученные из эмбриональных фибробластов мыши (MEF), которые можно было инъецировать в тетраплоидные бластоцисты , что привело к рождению живых мышей, полностью полученных из iPS-клеток, что положило конец дебатам об эквивалентности эмбриональных стволовых клеток. клетки (ЭСК) и иПС с точки зрения плюрипотентности. [42]
В таблице справа суммированы ключевые стратегии и методы, использованные для разработки iPS-клеток в первые пять лет после прорыва Яманаки и др. в 2006 году. Строки одинакового цвета представляют собой исследования, в которых использовались схожие стратегии перепрограммирования.

Альтернативные подходы
[ редактировать ]Имитация факторов транскрипции с помощью химических веществ
[ редактировать ]Одной из основных стратегий избежать проблем (1) и (2) было использование небольших молекул , которые могут имитировать эффекты факторов транскрипции. Эти соединения могут компенсировать фактор перепрограммирования, который не эффективно воздействует на геном или не может перепрограммировать по другой причине; таким образом они повышают эффективность перепрограммирования. Они также избегают проблемы геномной интеграции, которая в некоторых случаях способствует опухолевому генезу. Ключевые исследования с использованием такой стратегии были проведены в 2008 году. Melton et al. изучали эффекты ингибитора гистондеацетилазы (HDAC) вальпроевой кислоты. Они обнаружили, что это увеличило эффективность перепрограммирования в 100 раз (по сравнению с традиционным методом транскрипционных факторов Яманаки). [43] Исследователи предположили, что это соединение имитирует передачу сигналов, которая обычно вызывается фактором транскрипции c-Myc. Подобный тип механизма компенсации был предложен для имитации эффектов Sox2 . В 2008 году Дин и др. использовали ингибирование гистонметилтрансферазы (HMT) с помощью BIX-01294 в сочетании с активацией кальциевых каналов в плазматической мембране с целью повышения эффективности перепрограммирования. [44] Дэн и др. Пекинского университета сообщили в июле 2013 года, что индуцированные плюрипотентные стволовые клетки могут быть созданы без какой-либо генетической модификации. Они использовали коктейль из семи низкомолекулярных соединений, включая DZNep, чтобы индуцировать соматические клетки мыши в стволовые клетки, которые они назвали клетками CiPS, с эффективностью – 0,2% – сравнимой с эффективностью использования стандартных методов производства ИПСК. Клетки CiPS были введены в развивающиеся эмбрионы мышей, и было обнаружено, что они вносят вклад во все основные типы клеток, что доказывает их плюрипотентность. [45] [46]
Дин и др . продемонстрировали альтернативу перепрограммированию факторов транскрипции за счет использования химических веществ, подобных лекарствам. Изучая процесс мезенхимально-эпителиального перехода (MET), при котором фибробласты переходят в состояние, подобное стволовым клеткам, группа Дина определила два химических вещества – ингибитор ALK5 SB431412 и ингибитор MEK (митоген-активируемой протеинкиназы) PD0325901 – которые, как было обнаружено, увеличивают эффективность классического генетического метода в 100 раз. Добавление третьего соединения, которое, как известно, участвует в пути выживания клеток, тиазовивин еще больше увеличивает эффективность в 200 раз. Использование комбинации этих трех соединений также снизило процесс перепрограммирования фибробластов человека с четырех до двух недель. [47] [48]
В апреле 2009 года было продемонстрировано, что создание iPS-клеток возможно без какого-либо генетического изменения взрослой клетки: повторная обработка клеток определенными белками, направляемыми в клетки через полиаргининовые якоря, была достаточна для индукции плюрипотентности. [49] Для этих ИПСК используется аббревиатура пиПСК (белко-индуцированные плюрипотентные стволовые клетки).
Альтернативные векторы
[ редактировать ]Другая ключевая стратегия, позволяющая избежать таких проблем, как онкогенез и низкая производительность, заключалась в использовании альтернативных форм векторов: аденовирусов , плазмид и голой ДНК или белковых соединений.
В 2008 году Хохдлингер и др. использовали аденовирус для транспортировки необходимых четырех факторов транскрипции в ДНК клеток кожи и печени мышей, в результате чего были получены клетки, идентичные ЭСК. Аденовирус уникален среди других векторов, таких как вирусы и ретровирусы, поскольку он не включает ни один из своих собственных генов в целевой хозяин и позволяет избежать возможности инсерционного мутагенеза. [44] В 2009 году Фрид и др. продемонстрировали успешное перепрограммирование фибробластов человека в iPS-клетки. [50] Еще одним преимуществом использования аденовирусов является то, что им необходимо присутствовать лишь в течение короткого периода времени, чтобы произошло эффективное перепрограммирование.
Также в 2008 г. Яманака и др. обнаружили, что они могут передавать четыре необходимых гена с помощью плазмиды. [36] Группа Яманаки успешно перепрограммировала мышиные клетки путем трансфекции двумя плазмидными конструкциями, несущими факторы перепрограммирования; первая плазмида экспрессировала c-Myc, а вторая экспрессировала три других фактора ( Oct4 , Klf4 и Sox2 ). Хотя плазмидные методы позволяют избежать вирусов, для перепрограммирования им по-прежнему требуются гены, способствующие развитию рака. Другая основная проблема этих методов заключается в том, что они, как правило, гораздо менее эффективны по сравнению с ретровирусными методами. Более того, было показано, что трансфицированные плазмиды интегрируются в геном хозяина и, следовательно, по-прежнему представляют риск инсерционного мутагенеза. Поскольку неретровирусные подходы продемонстрировали такой низкий уровень эффективности, исследователи попытались эффективно спасти эту технику с помощью так называемой транспозонной системы PiggyBac . Несколько исследований показали, что эта система может эффективно доставлять ключевые факторы перепрограммирования, не оставляя мутаций в геноме клетки-хозяина. Транспозонная система PiggyBac предполагает повторное удаление экзогенных генов, что устраняет проблему инсерционного мутагенеза. [ нужна ссылка ]
Запускаемое стимулом приобретение плюрипотентной клетки
[ редактировать ]В январе 2014 года были опубликованы две статьи, в которых утверждалось, что определенный тип плюрипотентных стволовых клеток может быть создан путем подвергания клеток определенным видам стресса (бактериальный токсин, низкий уровень pH 5,7 или физическое сжатие); Полученные клетки были названы клетками STAP для приобретения плюрипотентности, запускаемого стимулом . [51]
В свете трудностей, с которыми столкнулись другие лаборатории при воспроизведении результатов удивительного исследования, в марте 2014 года один из соавторов призвал отозвать статьи. [52] 4 июня 2014 года ведущий автор Обоката согласился отозвать обе статьи. [53] после того, как было установлено, что она совершила «неправомерное проведение исследований», как было установлено в расследовании RIKEN 1 апреля 2014 года. [54]
Молекулы РНК
[ редактировать ]МикроРНК представляют собой короткие молекулы РНК, которые связываются с комплементарными последовательностями информационной РНК и блокируют экспрессию гена. Измерение изменений экспрессии микроРНК в iPS-клетках можно использовать для прогнозирования их дифференцировочного потенциала. [55] Добавление микроРНК также можно использовать для повышения потенциала iPS. Было предложено несколько механизмов. [55] Молекулы микроРНК, специфичные для ES-клеток (такие как миР-291, миР-294 и миР-295), повышают эффективность индуцированной плюрипотентности, действуя ниже c-Myc. [56] МикроРНК также могут блокировать экспрессию репрессоров четырех факторов транскрипции Яманаки, и могут существовать дополнительные механизмы, индуцирующие перепрограммирование даже в отсутствие добавленных экзогенных факторов транскрипции. [55]
Личность
[ редактировать ]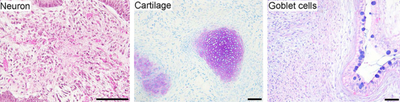
Индуцированные плюрипотентные стволовые клетки сходны с природными плюрипотентными стволовыми клетками, такими как эмбриональные стволовые клетки, во многих аспектах, таких как экспрессия определенных генов и белков стволовых клеток, характер метилирования хроматина , время удвоения, эмбриоидных тел образование , образование тератом , жизнеспособные химеры. образование, активность и дифференцируемость, но полная степень их связи с природными плюрипотентными стволовыми клетками все еще оценивается. [1]
экспрессия генов и общегеномные H3K4me3 и H3K27me3 чрезвычайно схожи между ES и iPS-клетками. Было обнаружено, что [57] [ нужна ссылка ] Полученные ИПСК были удивительно похожи на естественно выделенные плюрипотентные стволовые клетки (такие как эмбриональные стволовые клетки мыши и человека, мЭСК и чЭСК соответственно) в следующих отношениях, что подтверждало идентичность, аутентичность и плюрипотентность ИПСК по отношению к естественно выделенным плюрипотентным стволовым клеткам. :
- Клеточные биологические свойства
- Морфология: ИПСК морфологически сходны с ЭСК. Каждая клетка имела округлую форму, крупное ядрышко и скудную цитоплазму . Колонии ИПСК также были аналогичны колониям ЭСК. ИПСК человека образовывали плоские, плотно упакованные колонии с острыми краями, подобные чЭСК, а ИПСК мыши образовывали колонии, подобные мЭСК, менее плоские и более агрегированные, чем у чЭСК.
- Свойства роста: время удвоения и митотическая активность являются краеугольными камнями ЭСК, поскольку стволовые клетки должны самообновляться как часть их определения. ИПСК были митотически активны, активно самообновлялись, пролиферировали и делились со скоростью, равной ЭСК.
- Маркеры стволовых клеток: ИПСК экспрессируют антигенные маркеры клеточной поверхности, экспрессируемые на ЭСК. ИПСК человека экспрессируют маркеры, специфичные для чЭСК, включая SSEA-3, SSEA-4, TRA-1-60, TRA-1-81, TRA-2-49/6E и Nanog. Мышиные ИПСК экспрессируют SSEA-1, но не SSEA-3 и SSEA-4, как и мЭСК.
- Гены стволовых клеток: ИПСК экспрессируют гены, экспрессируемые в недифференцированных ЭСК, включая Oct-3/4, Sox2, Nanog, GDF3, REX1, FGF4, ESG1, DPPA2, DPPA4 и hTERT.
- Теломеразная активность: Теломеразы необходимы для поддержания деления клеток, не ограниченного пределом Хейфлика, составляющим ~ 50 клеточных делений. ЭСК экспрессируют высокую теломеразную активность, поддерживающую самообновление и пролиферацию, а ИПСК человека также демонстрируют высокую теломеразную активность и экспрессируют hTERT ( обратную транскриптазу теломеразы человека ), необходимый компонент белкового комплекса теломеразы.
- Плюрипотентность: ИПСК были способны дифференцироваться аналогично ЭСК в полностью дифференцированные ткани.
- Нейронная дифференцировка: ИПСК дифференцировались в нейроны , экспрессирующие βIII-тубулин, тирозингидроксилазу, AADC, DAT, ChAT, LMX1B и MAP2. Присутствие катехоламин -ассоциированных ферментов может указывать на то, что иПСК, как и чЭСК, могут дифференцироваться в дофаминергические нейроны. Гены, связанные со стволовыми клетками, были подавлены после дифференцировки.
- Сердечная дифференцировка: ИПСК были дифференцированы в кардиомиоциты , которые спонтанно начали сокращаться. Кардиомиоциты экспрессируют TnTc, MEF2C, MYL2A, MYHCβ и NKX2.5. Гены, связанные со стволовыми клетками, были подавлены после дифференцировки.
- Формирование тератомы: иПСК, введенные мышам с иммунодефицитом спонтанно образовывали тератомы , через девять недель . Тератомы представляют собой опухоли нескольких линий, содержащие ткань, полученную из трех зародышевых листков: энтодермы , мезодермы и эктодермы ; это отличается от других опухолей, которые обычно состоят только из одного типа клеток. Формирование тератомы является знаковым тестом на плюрипотентность.
- Эмбриоидное тело: ЭСК в культуре спонтанно образуют шарообразные эмбрионоподобные структуры, называемые « эмбриоидными телами », которые состоят из ядра из митотически активных и дифференцирующихся ЭСК и периферии из полностью дифференцированных клеток всех трех зародышевых листков. ИПСК также образуют эмбриоидные тельца и имеют периферические дифференцированные клетки.
- Химерные мыши: чЭСК естественным образом находятся во внутренней клеточной массе ( эмбриобласте ) бластоцисты и в эмбриобласте дифференцируются в эмбрион, тогда как оболочка бластоцисты ( трофобласт ) дифференцируется во внеэмбриональные ткани. Полый трофобласт не способен образовывать живой эмбрион, и поэтому эмбриональным стволовым клеткам внутри эмбриобласта необходимо дифференцироваться и сформировать эмбрион. ИПСК вводили микропипеткой в трофобласт, а бластоцисты переносили самкам-реципиентам. Были созданы химерные живые мышиные детеныши: мыши с производными ИПСК, включенными по всему телу с 10–90% химеризмом.
- Тетраплоидная комплементация : iPS-клетки из фибробластов эмбриона мыши, введенные в тетраплоидные бластоцисты (которые сами по себе могут образовывать только внеэмбриональные ткани), могут образовывать целых, нехимерных, фертильных мышей, хотя и с низкой вероятностью успеха. [42] [58] [59] Эффективность производства всех PSC мышей может быть повышена за счет кратковременного воздействия на линию плюрипотентных стволовых клеток эписомальной плазмиды, кодирующей сконструированные Sox2 и Klf4 (коктейль SK). [30]
- Эпигенетическое перепрограммирование
- Деметилирование промотора: Метилирование — это перенос метильной группы на основание ДНК, обычно перенос метильной группы на молекулу цитозина в сайте CpG (смежная последовательность цитозина/гуанина). Широко распространенное метилирование гена препятствует экспрессии , предотвращая активность экспрессирующих белков или привлекая ферменты, которые мешают экспрессии. Таким образом, метилирование гена эффективно подавляет его, предотвращая транскрипцию. Промоторы генов, связанных с плюрипотентностью, включая Oct-3/4, Rex1 и Nanog, были деметилированы в ИПСК, что продемонстрировало их промоторную активность, а также активное продвижение и экспрессию генов, связанных с плюрипотентностью, в ИПСК.
- Глобальное метилирование ДНК: iPS-клетки человека очень похожи на ES-клетки по своей структуре, в которой цитозины метилируются , больше , чем на клетки любого другого типа. Однако порядка тысячи сайтов демонстрируют различия в нескольких линиях клеток iPS. Половина из них напоминает линию соматических клеток, из которой произошли iPS-клетки, остальные специфичны для iPSC. десятки областей размером в мегабазы , где iPS-клетки не перепрограммированы в состояние ES-клеток. Также были обнаружены [60]
- Деметилирование гистонов. Гистоны представляют собой компактирующие белки, которые структурно локализованы в последовательностях ДНК и могут влиять на их активность посредством различных модификаций, связанных с хроматином. Гистоны H3, связанные с Oct-3/4, Sox2 и Nanog, были деметилированы, что указывает на экспрессию Oct-3/4, Sox2 и Nanog.
Безопасность
[ редактировать ]- Основной проблемой потенциального клинического применения ИПСК является их склонность к образованию опухолей. [61] Во многом так же, как и ЭСК, иПСК легко образуют тератому при инъекции мышам с иммунодефицитом. FDA считает образование тератомы основным препятствием для регенеративной медицины на основе стволовых клеток.
- Более недавнее исследование восстановления двигательных функций после травм спинного мозга на мышах показало, что после того, как индуцированные человеком плюрипотентные стволовые клетки были трансплантированы мышам, клетки дифференцировались в три нейронные линии спинного мозга. Клетки стимулировали рост поврежденного спинного мозга, поддерживали миелинизацию и образовывали синапсы. Такие положительные результаты наблюдались на протяжении более 112 дней после травмы спинного мозга без образования опухоли. [62] Тем не менее, последующее исследование, проведенное той же группой, показало, что отдельные клоны индуцированных человеком плюрипотентных стволовых клеток в конечном итоге образуют опухоли. [63]
- Поскольку в настоящее время ИПСК могут быть получены с высокой эффективностью только с использованием модификаций, обычно прогнозируется, что они менее безопасны и более канцерогенны, чем чЭСК. Все гены, которые, как было показано, способствуют образованию ИПСК, также так или иначе связаны с раком. Некоторые из генов являются известными онкогенами, включая членов семейства Myc. Хотя исключение Myc по-прежнему позволяет формировать ИПСК, эффективность снижается до 100 раз.
- Был продемонстрирован негенетический метод получения ИПСК с использованием рекомбинантных белков, однако его эффективность оказалась весьма низкой. [49] Однако усовершенствования этой методологии, дающие более высокую эффективность, могут привести к производству более безопасных ИПСК. Другие подходы, такие как использование аденовирусов или плазмид, обычно считаются более безопасными, чем ретровирусные методы.
- Важным направлением будущих исследований в области ИПСК является непосредственное тестирование онкогенности ИПСК с использованием методов, имитирующих подходы, которые будут использоваться в терапии регенеративной медицины. Такие исследования имеют решающее значение, поскольку ИПСК не только образуют тератому, но и мыши, полученные из ИПСК, имеют высокий уровень смертности от злокачественного рака. [64] В 2010 году в журнале Stem Cells была опубликована статья, в которой указывается, что iPS-клетки гораздо более туморогенны, чем ESC, что подтверждает мнение о том, что безопасность iPS-клеток вызывает серьезную озабоченность. [65]
- Обеспокоенность по поводу иммуногенности IPS-клеток возникла в 2011 году, когда Zhou et al. провели исследование, включающее анализ образования тератом, и продемонстрировали, что клетки IPS вызывают достаточно сильный иммунный ответ, чтобы вызвать отторжение клеток. Однако когда аналогичная процедура была проведена на генетически эквивалентных ES-клетках, Zhou et al. обнаружили тератомы , что указывало на то, что клетки переносятся иммунной системой. [66] В 2013 году Араки и др. попытались воспроизвести вывод, полученный Zhou et al. используя другую процедуру. Они взяли клетки химеры, выращенной из клонов IPSC и эмбриона мыши, затем эту ткань трансплантировали сингенным мышам. Они провели аналогичное исследование с использованием ES клеток вместо клона IPSC и сравнили результаты. Результаты показывают, что не было значительной разницы в иммуногенном ответе, продуцируемом IPS-клетками и ES-клетками. Более того, Араки и др. сообщили о незначительном иммуногенном ответе или его отсутствии для обеих клеточных линий. [67] Таким образом, Араки и др. не смог прийти к такому же выводу, как Чжоу и др.
Медицинские исследования
[ редактировать ]Задача производства iPS-клеток продолжает оставаться сложной из-за шести проблем, упомянутых выше. Ключевым компромиссом, который необходимо преодолеть, является компромисс между эффективностью и геномной интеграцией. Большинство методов, не основанных на интеграции трансгенов, неэффективны, тогда как те, которые полагаются на интеграцию трансгенов, сталкиваются с проблемами неполного перепрограммирования и опухолевого генеза, хотя было предпринято огромное количество попыток и методов. Другой большой набор стратегий — провести протеомную характеристику iPS-клеток. [59] Дальнейшие исследования и новые стратегии должны найти оптимальные решения пяти основных проблем. Один из подходов может попытаться объединить положительные свойства этих стратегий в чрезвычайно эффективную технику перепрограммирования клеток в iPS-клетки.
Другой подход — использование iPS-клеток, полученных от пациентов, для определения терапевтических препаратов, способных спасти фенотип. Например, линии iPS-клеток, полученные от пациентов, страдающих синдромом эктодермальной дисплазии (EEC), у которых мутирован ген p63 , демонстрируют аномальную детерминацию эпителия, которую можно частично восстановить с помощью небольшого соединения. [68]
Моделирование заболеваний и разработка лекарств
[ редактировать ]Привлекательной особенностью iPS-клеток человека является возможность получать их от взрослых пациентов для изучения клеточной основы заболеваний человека. Поскольку iPS-клетки являются самообновляющимися и плюрипотентными, они представляют собой теоретически неограниченный источник клеток, полученных от пациента, которые можно превратить в клетки любого типа в организме. Это особенно важно, поскольку многие другие типы клеток человека, полученные от пациентов, имеют тенденцию переставать расти после нескольких пассажей в лабораторной культуре. iPS-клетки были созданы для лечения широкого спектра генетических заболеваний человека, включая распространенные заболевания, такие как синдром Дауна и поликистоз почек. [69] [70] [71] Во многих случаях iPS-клетки, полученные от пациента, обнаруживают клеточные дефекты, не наблюдаемые в iPS-клетках здоровых людей, что дает представление о патофизиологии заболевания. [72] [73] Международный совместный проект StemBANCC был создан в 2012 году для создания коллекции линий iPS-клеток для скрининга лекарств на различные заболевания. Проект , управляемый Оксфордским университетом , объединил средства и ресурсы 10 фармацевтических компаний и 23 университетов. Цель состоит в том, чтобы создать библиотеку из 1500 линий iPS-клеток, которые будут использоваться в ранних испытаниях лекарств, создавая среду, моделирующую заболевание человека. [74] Кроме того, сочетание технологии hiPSC и низкомолекулярных или генетически закодированных индикаторов напряжения и кальция обеспечило крупномасштабную и высокопроизводительную платформу для скрининга безопасности сердечно-сосудистых препаратов. [75] [76] [77] [78] [79]
Синтез органов
[ редактировать ]об доказательстве концепции использования индуцированных плюрипотентных стволовых клеток (ИПСК) для создания человеческого органа для трансплантации Исследователи из Японии сообщили зачатки» человека . « Печеночные (ИПСК-LB) выращивали из смеси трех различных типов стволовых клеток: гепатоцитов (для функции печени), полученных из ИПСК; эндотелиальные стволовые клетки (для формирования слизистой оболочки кровеносных сосудов ) из пуповинной крови ; и мезенхимальные стволовые клетки (для формирования соединительной ткани ). Этот новый подход позволяет различным типам клеток самоорганизовываться в сложный орган, имитируя процесс развития плода . После выращивания in vitro в течение нескольких дней зачатки печени были трансплантированы мышам, где «печень» быстро соединилась с кровеносными сосудами хозяина и продолжила расти. Самое главное, он выполнял регулярные функции печени, включая метаболизм лекарств и выработку специфичных для печени белков. Дальнейшие исследования позволят отслеживать продолжительность жизни пересаженного органа в организме хозяина (способность интегрироваться или избегать отторжения ) и трансформируется ли он в опухоль . [80] [81]
Регенерация органов
[ редактировать ]переключаемых факторов Яманаки, В 2021 году на мышах был продемонстрирован подход, основанный на перепрограммировании для регенерации поврежденного сердца без образования опухоли, который оказался успешным, если вмешательство проводилось непосредственно до или после сердечного приступа. [82]
Восстановление тканей
[ редактировать ]Эмбриональные клетки пуповинной крови индуцировали в плюрипотентные стволовые клетки с использованием плазмидной ДНК. Используя эндотелиальные/перицитарные маркеры клеточной поверхности CD31 и CD146 , исследователи идентифицировали «сосудистых предшественников», высококачественные мультипотентные сосудистые стволовые клетки. После того, как iPS-клетки были инъецированы непосредственно в стекловидное тело поврежденной сетчатки мышей, стволовые клетки приживлялись в сетчатке, росли и восстанавливали сосуды . [83] [84]
, полученные из ИПСК, Показано, что меченые НСК инъецированные лабораторным животным с поражениями головного мозга, мигрируют к очагам поражения и наблюдается некоторое улучшение двигательных функций. [85]
Кардиомиоциты
[ редактировать ], полученные из ИПСК Бьющиеся клетки сердечной мышцы, кардиомиоциты , могут производиться массово с использованием химически определенных протоколов дифференцировки. [86] [87] Эти протоколы обычно модулируют те же сигнальные пути развития, которые необходимы для развития сердца . [88] Эти iPSC-кардиомиоциты могут повторять генетические аритмии и реакцию на сердечные лекарства, поскольку они имеют тот же генетический фон, что и пациент, от которого они были получены. [89] [90] [91] [92]
В июне 2014 года Takara Bio получила передачу технологий от iHeart Japan, венчурной компании Научно-исследовательского института iPS-клеток Киотского университета, чтобы сделать возможным исключительное использование технологий и патентов, которые индуцируют дифференцировку iPS-клеток в кардиомиоциты в Азии. Компания объявила об идее продажи кардиомиоцитов фармацевтическим компаниям и университетам для помощи в разработке новых лекарств от болезней сердца. [93]
9 марта 2018 года Специальный комитет регенеративной медицины Университета Осаки официально одобрил первый в мире план клинических исследований по трансплантации «листа миокарда», изготовленного из iPS-клеток, в сердце пациентов с тяжелой сердечной недостаточностью. Университет Осаки объявил, что в тот же день подал заявку в Министерство здравоохранения, труда и социального обеспечения.
16 мая 2018 года план клинических исследований был одобрен экспертной группой Министерства здравоохранения, труда и социального обеспечения с условием. [94] [95]
В октябре 2019 года группа из Университета Окаямы разработала модель ишемической болезни сердца с использованием кардиомиоцитов, дифференцированных из iPS-клеток. [96]
Красные кровяные тельца
[ редактировать ]Хотя в пинте донорской крови содержится около двух триллионов эритроцитов, а во всем мире собрано более 107 миллионов доноров крови, по-прежнему существует острая потребность в крови для переливания. В 2014 году типа O эритроциты были синтезированы в Шотландской национальной службе переливания крови с помощью iPSC. Клетки были вынуждены стать мезодермой , затем клетками крови , а затем эритроцитами. Последним шагом было заставить их выбросить свои ядра и правильно созреть. Тип О можно переливать всем пациентам. Ожидается, что клинические испытания на людях начнутся не раньше 2016 года. [97]
Клиническое исследование
[ редактировать ]Первое клиническое исследование на людях с использованием аутологичных ИПСК было одобрено Министерством здравоохранения Японии и должно было быть проведено в 2014 году в Центре биологии развития Рикен в Кобе . Однако испытание было приостановлено после того, как в ноябре 2015 года вступили в силу новые законы Японии о регенеративной медицине. [98] В частности, существующий набор руководящих принципов был усилен, чтобы иметь силу закона (ранее это были просто рекомендации). [99] ИПСК, полученные из клеток кожи шести пациентов с влажной возрастной макулярной дегенерацией, были перепрограммированы для дифференцировки в пигментного эпителия сетчатки клетки (RPE). Клеточный лист будет трансплантирован в пораженную сетчатку , где будет иссечена дегенерировавшая ткань РПЭ. Мониторинг безопасности и восстановления зрения должен был длиться от одного до трех лет. [100] [101]
В марте 2017 года команда под руководством Масайо Такахаши завершила первую успешную трансплантацию клеток сетчатки, полученных из iPS, от донора в глаз человека с прогрессирующей дегенерацией желтого пятна. [102] Однако сообщалось, что сейчас у них возникли осложнения. [103] Преимущества использования аутологичных ИПСК заключаются в том, что теоретически отсутствует риск отторжения и устраняется необходимость использования эмбриональных стволовых клеток. Однако эти ИПСК были получены от другого человека. [101]
Новые клинические исследования с использованием ИПСК сейчас продолжаются не только в Японии, но также в США и Европе. [104] Исследование, проведенное в 2021 году в реестре исследований Clinicaltrials.gov, выявило 129 списков исследований, в которых упоминались ИПСК, но большинство из них были неинтервенционными. [105]
Стратегия получения универсальных ИПСК
[ редактировать ]технологии регенеративной медицины на основе ИПСК доступными большему количеству пациентов, необходимо создать универсальные ИПСК, которые можно будет трансплантировать независимо от гаплотипов HLA Чтобы сделать . Текущая стратегия создания универсальных ИПСК преследует две основные цели: устранить экспрессию HLA и предотвратить атаку NK-клеток за счет делеции HLA. удаление генов B2M и CIITA с использованием системы CRISPR/Cas9 Сообщалось, что подавляет экспрессию HLA класса I и класса II соответственно. Чтобы избежать атак NK-клеток. трансдукция лигандов, ингибирующих NK-клетки, таких как HLA-E и CD47 . использовалась [106] HLA-C оставлен без изменений, поскольку 12 общих аллелей HLA-C достаточно, чтобы охватить 95% населения земного шара. [106]
Антивозрастные свойства
[ редактировать ]Мультипотентные мезенхимальные стволовые клетки, когда они приобретают плюрипотентность, открывают большие перспективы для замедления или обращения вспять фенотипов старения. Такие антивозрастные свойства были продемонстрированы в ранних клинических исследованиях в 2017 году. [107] В 2020 году исследователи Стэнфордского университета после изучения пожилых мышей пришли к выводу, что старые человеческие клетки, подвергшиеся воздействию факторов Яманаки, могут омолажиться и стать почти неотличимыми от своих более молодых собратьев. [108]
См. также
[ редактировать ]- Индуцированные стволовые клетки
- Лечение стволовыми клетками
- Запускаемое стимулом приобретение плюрипотентных клеток , ныне дискредитированное утверждение о генерации плюрипотентных стволовых клеток путем погружения клеток в кислоту.
- Индуцированные плюрипотентные стволовые клетки в сравнении с линиями эмбриональных стволовых клеток, полученными методом SCNT (обсуждение)
- Дедифференцировка
- Направленная дифференциация
- Плюрипотентность
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Такахаши К., Яманака С. (август 2006 г.). «Индукция плюрипотентных стволовых клеток из культур эмбриональных и взрослых фибробластов мышей с помощью определенных факторов» . Клетка . 126 (4): 663–76. дои : 10.1016/j.cell.2006.07.024 . hdl : 2433/159777 . ПМИД 16904174 .

- ^ «Нобелевская премия по физиологии и медицине – пресс-релиз 2012 г.» . Нобель Медиа АБ. 8 октября 2012 г.
- ^ Махла РС (2016). «Применение стволовых клеток в регенеративной медицине и терапии заболеваний» . Международный журнал клеточной биологии . 2016 : 6940283. doi : 10.1155/2016/6940283 . ПМЦ 4969512 . ПМИД 27516776 .
- ^ Климанская И., Чунг Ю., Беккер С., Лу С.Дж., Ланза Р. (ноябрь 2006 г.). «Линии эмбриональных стволовых клеток человека, полученные из одиночных бластомеров». Природа . 444 (7118): 481–5. Бибкод : 2006Natur.444..481K . дои : 10.1038/nature05142 . ПМИД 16929302 . S2CID 84792371 .
- ^ Хоккемейер Д., Йениш Р. (май 2016 г.). «Индуцированные плюрипотентные стволовые клетки и редактирование генома» . Клеточная стволовая клетка . 18 (5): 573–86. дои : 10.1016/j.stem.2016.04.013 . ПМЦ 4871596 . ПМИД 27152442 .
- ^ Яманака 2010 , с. 120.
- ^ "'i' PS Почему строчными буквами? Что за человек г-н Яманака? " .Asahi Shimbun . 8 октября 2012. Архивировано из оригинала 21 ноября 2012 года . Проверено 27 апреля 2013 года .
- ^ «Я хочу, чтобы универсальные ячейки iPS стали такими же популярными, как iPod » . Sports Nippon , 9 октября 2012 г. Проверено 14 октября 2012 г.
- ^ ячейки профессора Яманаки — это копия iPod!? Он хочет сделать их популярными». Проверено « iPS- апреля 28 2013 г. .
- ^ Эгуисабаль С, Аран Б, Чува де Соуза Лопес С.М., Гинс М., Хейндрикс Б., Панула С., Попович М., Вассена Р., Вейга А. (2019). «Два десятилетия эмбриональных стволовых клеток: исторический обзор» . Репродукция человека Открыть . 2019 (1): сегодня024. дои : 10.1093/hropen/hoy024 . ПМК 6396646 . ПМИД 30895264 .
- ^ Яманака С. (декабрь 2013 г.). «Извилистая дорога к плюрипотентности (Нобелевская лекция)». Ангеванде Хеми . 52 (52): 13900–9. дои : 10.1002/anie.201306721 . ПМИД 24255017 .
- ^ Го XL, Чен Дж.С. (2015). «Исследование индуцированных плюрипотентных стволовых клеток и их применение в тканях глаза» . Международный журнал офтальмологии . 8 (4): 818–25. дои : 10.3980/j.issn.2222-3959.2015.04.31 . ПМЦ 4539634 . ПМИД 26309885 .
- ^ Торнтон, Кристофер Д.; Филдинг, Стюарт; Карбовничек, Кинга; Ройг-Мерино, Алисия; Берроуз, Алиша Э.; ФитцПатрик, Лорна М.; Шарайре, Асиль; Тите, Джон П.; Моул, Сара Э.; Харботтл, Ричард П.; Капрони, Лиза Дж.; Маккей, Тристан Р. (10 декабря 2021 г.). «Безопасное и стабильное создание индуцированных плюрипотентных стволовых клеток с использованием векторов ДНК собачьей кости» . Молекулярная терапия – методы и клинические разработки . 23 : 348–358. дои : 10.1016/j.omtm.2021.09.018 . ISSN 2329-0501 . ПМЦ 8546411 . ПМИД 34729381 .
- ^ Окита К., Ичисака Т., Яманака С. (июль 2007 г.). «Получение компетентных к зародышевой линии индуцированных плюрипотентных стволовых клеток». Природа . 448 (7151): 313–7. Бибкод : 2007Natur.448..313O . дои : 10.1038/nature05934 . ПМИД 17554338 . S2CID 459050 .
- ^ Верниг М, Мейснер А, Форман Р, Брамбринк Т, Ку М, Хохдлингер К и др. (июль 2007 г.). «Перепрограммирование фибробластов in vitro в плюрипотентное состояние, подобное ES-клеткам». Природа . 448 (7151): 318–24. Бибкод : 2007Natur.448..318W . дои : 10.1038/nature05944 . ПМИД 17554336 . S2CID 4377572 .
- ^ Махерали Н., Шридхаран Р., Се В., Утикал Дж., Эминли С., Арнольд К. и др. (июнь 2007 г.). «Непосредственно перепрограммированные фибробласты демонстрируют глобальное эпигенетическое ремоделирование и широко распространенный вклад в ткани» . Клеточная стволовая клетка . 1 (1): 55–70. дои : 10.1016/j.stem.2007.05.014 . ПМИД 18371336 .
- ^ «Поколения ИПСК и соответствующие ссылки» . Архивировано из оригинала 30 июня 2018 года . Проверено 5 ноября 2007 г.
- ^ Такахаши К., Танабэ К., Онуки М., Нарита М., Ичисака Т., Томода К., Яманака С. (ноябрь 2007 г.). «Индукция плюрипотентных стволовых клеток из фибробластов взрослого человека определенными факторами» . Клетка . 131 (5): 861–72. дои : 10.1016/j.cell.2007.11.019 . hdl : 2433/49782 . ПМИД 18035408 .
- ^ Перейти обратно: а б Ю Дж., Водяник М.А., Смуга-Отто К., Антосевич-Бурже Дж., Фране Дж.Л., Тиан С. и др. (декабрь 2007 г.). «Индуцированные плюрипотентные линии стволовых клеток, полученные из соматических клеток человека». Наука . 318 (5858): 1917–20. Бибкод : 2007Sci...318.1917Y . дои : 10.1126/science.1151526 . ПМИД 18029452 . S2CID 86129154 .
- ^ Перейти обратно: а б с Яманака С. (июль 2010 г.). «Плюрипотентные стволовые клетки, специфичные для пациента, становятся еще более доступными» . Клеточная стволовая клетка . 7 (1): 1–2. дои : 10.1016/j.stem.2010.06.009 . ПМИД 20621038 .
- ^ Перейти обратно: а б Махерали Н., Хохдлингер К. (декабрь 2008 г.). «Руководство и методы получения индуцированных плюрипотентных стволовых клеток» . Клеточная стволовая клетка . 3 (6): 595–605. дои : 10.1016/j.stem.2008.11.008 . ПМИД 19041776 .
- ^ Махерали Н., Ахфельдт Т., Ригамонти А., Утикал Дж., Коуэн С., Хочедлингер К. (сентябрь 2008 г.). «Высокоэффективная система для получения и изучения индуцированных человеком плюрипотентных стволовых клеток» . Клеточная стволовая клетка . 3 (3): 340–5. дои : 10.1016/j.stem.2008.08.003 . ПМЦ 3987901 . ПМИД 18786420 .
- ^ Аасен Т., Рая А., Барреро М.Дж., Гаррета Е., Консильо А., Гонсалес Ф. и др. (ноябрь 2008 г.). «Эффективное и быстрое получение индуцированных плюрипотентных стволовых клеток из кератиноцитов человека». Природная биотехнология . 26 (11): 1276–84. дои : 10.1038/nbt.1503 . ПМИД 18931654 . S2CID 205274019 .
- ^ Стаерк Дж., Даулати М.М., Гао К., Мэцель Д., Ханна Дж., Соммер К.А. и др. (июль 2010 г.). «Перепрограммирование клеток периферической крови человека в индуцированные плюрипотентные стволовые клетки» . Клеточная стволовая клетка . 7 (1): 20–4. дои : 10.1016/j.stem.2010.06.002 . ПМЦ 2917234 . ПМИД 20621045 .
- ^ Ло Й.Х., Хартунг О., Ли Х., Го С., Сахали Дж.М., Манос П.Д. и др. (июль 2010 г.). «Репрограммирование Т-клеток периферической крови человека» . Клеточная стволовая клетка . 7 (1): 15–9. дои : 10.1016/j.stem.2010.06.004 . ПМЦ 2913590 . ПМИД 20621044 .
- ^ Чжоу Т., Бенда С., Дунцигер С., Хуан Ю., Хо Дж.К., Ян Дж. и др. (декабрь 2012 г.). «Получение индуцированных человеком плюрипотентных стволовых клеток из образцов мочи». Протоколы природы . 7 (12): 2080–9. дои : 10.1038/nprot.2012.115 . ПМИД 23138349 . S2CID 205465442 .
- ^ Поло Дж.М., Лю С., Фигероа М.Е., Кулалерт В., Эминли С., Тан К.Ю. и др. (август 2010 г.). «Тип происхождения клеток влияет на молекулярные и функциональные свойства плюрипотентных стволовых клеток, индуцированных мышью» . Природная биотехнология . 28 (8): 848–55. дои : 10.1038/nbt.1667 . ПМК 3148605 . ПМИД 20644536 .
- ^ Величко С., Адачи К., Ким КП, Хоу Ю, Маккарти СМ, Ву Г, Шолер HR (декабрь 2019 г.). «Исключение Oct4 из коктейля Яманака раскрывает потенциал развития ИПСК» . Клеточная стволовая клетка . 25 (6): 737–753.е4. дои : 10.1016/j.stem.2019.10.002 . ПМК 6900749 . ПМИД 31708402 .
- ^ Качество индуцированных плюрипотентных стволовых клеток значительно повышается за счет исключения того, что считалось наиболее важным фактором перепрограммирования. Oct4 не только не нужен, но и вреден при создании индуцированных мышами плюрипотентных стволовых клеток (ИПСК)
- ^ Перейти обратно: а б с Маккарти, Кейтлин М.; Ву, Гуанмин; Малик, Викас; Менухин-Ласовский, Йотам; Величко, Тарас; Кешет, Гал; Фан, Руи; Беджов, Иван; Черч, Джордж М.; Яух, Ральф; Кожокару, Влад; Шёлер, Ганс Р.; Величко, Сергей (декабрь 2023 г.). «Химерный супер-SOX с высокой степенью взаимодействия вызывает наивную плюрипотентность у разных видов» . Клеточная стволовая клетка . 31 (1): 127–147.е9. дои : 10.1016/j.stem.2023.11.010 . ПМИД 38141611 .
- ^ Али П.С., Гошдастидер У., Хоффманн Дж., Брутши Б., Филипек С. (ноябрь 2012 г.). «Распознавание предшественника микроРНК let-7g человеческим Lin28B» . Письма ФЭБС . 586 (22): 3986–90. Бибкод : 2012FEBSL.586.3986S . дои : 10.1016/j.febslet.2012.09.034 . ПМИД 23063642 . S2CID 28899778 .
- ^ Маэкава М., Ямагути К., Накамура Т., Сибукава Р., Коданака И., Ичисака Т. и др. (июнь 2011 г.). «Прямому перепрограммированию соматических клеток способствует материнский фактор транскрипции Glis1». Природа . 474 (7350): 225–9. дои : 10.1038/nature10106 . hdl : 2433/141930 . ПМИД 21654807 . S2CID 4428172 .
- ^ Луо М, Лин Т, Се В, Сунь Х, Чжоу Ю, Чжу Ц и др. (июль 2013 г.). «NuRD блокирует перепрограммирование соматических клеток мыши в плюрипотентные стволовые клетки». Стволовые клетки . 31 (7): 1278–86. дои : 10.1002/stem.1374 . hdl : 10397/18487 . ПМИД 23533168 . S2CID 206512562 .
- ^ Раис Ю., Звиран А., Геула С., Гафни О., Хомский Е., Вьюков С. и др. (октябрь 2013 г.). «Детерминированное прямое перепрограммирование соматических клеток в плюрипотентность». Природа . 502 (7469): 65–70. Бибкод : 2013Natur.502...65R . дои : 10.1038/nature12587 . ПМИД 24048479 . S2CID 4386833 .
- ^ Сельварадж В., Плейн Дж. М., Уильямс А. Дж., Дэн В. (апрель 2010 г.). «Переключение судьбы клеток: значительный рост количества индуцированных плюрипотентных стволовых клеток и технологий перепрограммирования клонов» . Тенденции в биотехнологии . 28 (4): 214–23. дои : 10.1016/j.tibtech.2010.01.002 . ПМЦ 2843790 . ПМИД 20149468 .
- ^ Перейти обратно: а б Окита К., Накагава М., Хенджонг Х., Ичисака Т., Яманака С. (ноябрь 2008 г.). «Получение индуцированных мышью плюрипотентных стволовых клеток без вирусных векторов» . Наука . 322 (5903): 949–53. Бибкод : 2008Sci...322..949O . дои : 10.1126/science.1164270 . ПМИД 18845712 . S2CID 23735743 .
- ^ Штадтфельд М., Нагая М., Утикал Дж., Вейр Г., Хохдлингер К. (ноябрь 2008 г.). «Индуцированные плюрипотентные стволовые клетки, полученные без вирусной интеграции» . Наука . 322 (5903): 945–9. Бибкод : 2008Sci...322..945S . дои : 10.1126/science.1162494 . ПМЦ 3987909 . ПМИД 18818365 .
- ^ Волтьен К., Майкл И.П., Мохсени П., Десаи Р., Милейковски М., Хямяляйнен Р. и др. (апрель 2009 г.). «Транспозиция piggyBac перепрограммирует фибробласты в индуцированные плюрипотентные стволовые клетки» . Природа . 458 (7239): 766–70. Бибкод : 2009Natur.458..766W . дои : 10.1038/nature07863 . ПМЦ 3758996 . ПМИД 19252478 .
- ^ Каплан К. (6 марта 2009 г.). «Угроза рака устранена из стволовых клеток, говорят ученые» . Лос-Анджелес Таймс .
- ^ Сваминатан Н. (30 ноября 2007 г.). «Стволовые клетки – на этот раз без рака» . Научные американские новости . Проверено 11 декабря 2007 г.
- ^ Марион Р.М., Страти К., Ли Х., Мурга М., Бланко Р., Ортега С. и др. (август 2009 г.). «Реакция на повреждение ДНК, опосредованная р53, ограничивает перепрограммирование для обеспечения геномной целостности iPS-клеток» . Природа . 460 (7259): 1149–53. Бибкод : 2009Natur.460.1149M . дои : 10.1038/nature08287 . ПМК 3624089 . ПМИД 19668189 .
- ^ Перейти обратно: а б Чжао XY, Ли W, Lv Z, Лю Л, Тонг М, Хай Т и др. (сентябрь 2009 г.). «iPS-клетки производят жизнеспособных мышей посредством тетраплоидной комплементации». Природа . 461 (7260): 86–90. Бибкод : 2009Natur.461...86Z . дои : 10.1038/nature08267 . ПМИД 19672241 . S2CID 205217762 .
- ^ Хуанфу Д., Мэр Р., Го В., Эйкеленбум А., Снитоу М., Чен А.Е., Мелтон Д.А. (июль 2008 г.). «Индукция плюрипотентных стволовых клеток определенными факторами значительно улучшается с помощью низкомолекулярных соединений» . Природная биотехнология . 26 (7): 795–7. дои : 10.1038/nbt1418 . ПМК 6334647 . ПМИД 18568017 .
- ^ Перейти обратно: а б Ши Ю, Деспонтс К., До Дж.Т., Хам Х.С., Шелер Х.Р., Дин С. (ноябрь 2008 г.). «Индукция плюрипотентных стволовых клеток из эмбриональных фибробластов мыши с помощью Oct4 и Klf4 низкомолекулярными соединениями» . Клеточная стволовая клетка . 3 (5): 568–74. дои : 10.1016/j.stem.2008.10.004 . ПМИД 18983970 .
- ^ Сираноски Д. (18 июля 2013 г.). «Стволовые клетки перепрограммируются с помощью одних только химических веществ» . Новости природы . дои : 10.1038/nature.2013.13416 . S2CID 88247014 . Проверено 22 июля 2013 г.
- ^ Хоу П., Ли Ю, Чжан Х, Лю С, Гуань Дж, Ли Х и др. (август 2013 г.). «Плюрипотентные стволовые клетки, индуцированные из соматических клеток мыши низкомолекулярными соединениями». Наука . 341 (6146): 651–4. Бибкод : 2013Sci...341..651H . дои : 10.1126/science.1239278 . ПМИД 23868920 . S2CID 45685692 .
- ^ «Важный шаг в создании лучших стволовых клеток из тканей взрослого человека» . Наука Дейли . 19 октября 2009 года . Проверено 30 сентября 2013 г.
- ^ Лин Т., Амбасудхан Р., Юань Х., Ли В., Хилков С., Абуджарур Р. и др. (ноябрь 2009 г.). «Химическая платформа для улучшения индукции ИПСК человека» . Природные методы . 6 (11): 805–8. дои : 10.1038/nmeth.1393 . ПМЦ 3724527 . ПМИД 19838168 .
- ^ Перейти обратно: а б Чжоу Х., Ву С., Джу Цзюй, Чжу С., Хань Д.В., Лин Т. и др. (май 2009 г.). «Генерация индуцированных плюрипотентных стволовых клеток с использованием рекомбинантных белков» . Клеточная стволовая клетка . 4 (5): 381–4. дои : 10.1016/j.stem.2009.04.005 . ПМЦ 10182564 . ПМИД 19398399 .
- ^ Чжоу В., Фрид Ч.Р. (ноябрь 2009 г.). «Доставка аденовирусного гена может перепрограммировать фибробласты человека в индуцированные плюрипотентные стволовые клетки» . Стволовые клетки . 27 (11): 2667–74. дои : 10.1002/stem.201 . ПМИД 19697349 . S2CID 41418742 .
- ^ Дэвид Сираноски для Nature News. 29 января 2014 г. Кислотная ванна открывает легкий путь к стволовым клеткам
- ^ Трейси Венс для учёного. 11 марта 2014 г. Призыв к отзыву STAP
- ^ Ложь E (4 июня 2014 г.). «Японский исследователь согласен отозвать спорную статью о стволовых клетках» . Рейтер . Проверено 4 июня 2014 г.
- ^ Пресс-релиз (1 апреля 2014 г.). «Отчет о расследовании исследовательского документа STAP Cell» . РИКЕН . Проверено 2 июня 2014 г.
- ^ Перейти обратно: а б с Бао X, Чжу X, Ляо Б, Бенда С, Чжуан Ц, Пей Д и др. (апрель 2013 г.). «МикроРНК в перепрограммировании соматических клеток». Современное мнение в области клеточной биологии . 25 (2): 208–14. дои : 10.1016/j.ceb.2012.12.004 . ПМИД 23332905 .
- ^ Джадсон Р.Л., Бабьярц Дж.Э., Венере М., Блеллох Р. (май 2009 г.). «Специфические для эмбриональных стволовых клеток микроРНК способствуют индуцированной плюрипотентности» . Природная биотехнология . 27 (5): 459–61. дои : 10.1038/nbt.1535 . ПМЦ 2743930 . ПМИД 19363475 .
- ^ Гюнтер М.Г., Фрэмптон Г.М., Солднер Ф., Хоккемейер Д., Миталипова М., Йениш Р., Янг Р.А. (август 2010 г.). «Структура хроматина и программы экспрессии генов эмбриональных и индуцированных плюрипотентных стволовых клеток человека» . Клеточная стволовая клетка . 7 (2): 249–57. дои : 10.1016/j.stem.2010.06.015 . ПМК 3010384 . ПМИД 20682450 .
- ^ Кан Л., Ван Дж., Чжан Ю., Коу З., Гао С. (август 2009 г.). «iPS-клетки могут поддерживать полноценное развитие тетраплоидных эмбрионов, дополненных бластоцистами» . Клеточная стволовая клетка . 5 (2): 135–8. дои : 10.1016/j.stem.2009.07.001 . ПМИД 19631602 .
- ^ Перейти обратно: а б Боланд М.Дж., Хазен Дж.Л., Назор К.Л., Родригес А.Р., Гиффорд В., Мартин Г. и др. (сентябрь 2009 г.). «Взрослые мыши, полученные из индуцированных плюрипотентных стволовых клеток». Природа . 461 (7260): 91–4. Бибкод : 2009Natur.461...91B . дои : 10.1038/nature08310 . ПМИД 19672243 . S2CID 4423755 .
- ^ Листер Р., Пелиццола М., Кида Ю.С., Хокинс Р.Д., Нери Дж.Р., Хон Дж. и др. (март 2011 г.). «Горячие точки аберрантного эпигеномного перепрограммирования в индуцированных человеком плюрипотентных стволовых клетках» . Природа . 471 (7336): 68–73. Бибкод : 2011Natur.471...68L . дои : 10.1038/nature09798 . ПМК 3100360 . ПМИД 21289626 .
- ^ Кнопфлер PS (май 2009 г.). «Деконструкция туморогенности стволовых клеток: путь к безопасной регенеративной медицине» . Стволовые клетки . 27 (5): 1050–6. дои : 10.1002/stem.37 . ПМЦ 2733374 . ПМИД 19415771 .
- ^ Нори С., Окада Ю., Ясуда А., Цудзи О., Такахаши Ю., Кобаяши Ю. и др. (октябрь 2011 г.). «Привитые человеком плюрипотентные нейросферы, полученные из стволовых клеток, способствуют восстановлению двигательных функций после травмы спинного мозга у мышей» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (40): 16825–30. Бибкод : 2011PNAS..10816825N . дои : 10.1073/pnas.1108077108 . ПМК 3189018 . ПМИД 21949375 .
- ^ Нори С., Окада Ю., Нишимура С., Сасаки Т., Итакура Г., Кобаяши Ю. и др. (март 2015 г.). «Проблемы долгосрочной безопасности клеточной терапии на основе ИПСК в модели травмы спинного мозга: онкогенная трансформация с эпителиально-мезенхимальным переходом» . Отчеты о стволовых клетках . 4 (3): 360–73. дои : 10.1016/j.stemcr.2015.01.006 . ПМЦ 4375796 . ПМИД 25684226 .
- ^ Аой Т., Яе К., Накагава М., Ичисака Т., Окита К., Такахаши К. и др. (август 2008 г.). «Получение плюрипотентных стволовых клеток из клеток печени и желудка взрослой мыши». Наука . 321 (5889): 699–702. Бибкод : 2008Sci...321..699A . дои : 10.1126/science.1154884 . hdl : 2433/124215 . ПМИД 18276851 . S2CID 52869734 .
- ^ Гутьеррес-Аранда И., Рамос-Мехиа В., Буэно С., Муньос-Лопес М., Реал П.Дж., Масия А. и др. (сентябрь 2010 г.). «Индуцированные человеком плюрипотентные стволовые клетки развивают тератому более эффективно и быстрее, чем эмбриональные стволовые клетки человека, независимо от места инъекции» . Стволовые клетки . 28 (9): 1568–70. дои : 10.1002/stem.471 . ПМК 2996086 . ПМИД 20641038 .
- ^ Чжао Т., Чжан З.Н., Жун З., Сюй Ю (май 2011 г.). «Иммуногенность индуцированных плюрипотентных стволовых клеток». Природа . 474 (7350): 212–5. CiteSeerX 10.1.1.864.8029 . дои : 10.1038/nature10135 . ПМИД 21572395 . S2CID 4416964 .
- ^ Араки Р., Уда М., Хоки Ю., Сунаяма М., Накамура М., Андо С. и др. (февраль 2013 г.). «Незначительная иммуногенность окончательно дифференцированных клеток, полученных из индуцированных плюрипотентных или эмбриональных стволовых клеток». Природа . 494 (7435): 100–4. Бибкод : 2013Natur.494..100A . дои : 10.1038/nature11807 . ПМИД 23302801 . S2CID 205232231 .
- ^ Шалом-Фойерштейн Р., Серрор Л., Абердам Э., Мюллер Ф.Дж., ван Боховен Х., Виман К.Г. и др. (февраль 2013 г.). «Нарушение эпителиальной дифференцировки индуцированных плюрипотентных стволовых клеток у пациентов, связанных с эктодермальной дисплазией, восстанавливается с помощью небольшого соединения APR-246/PRIMA-1MET» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (6): 2152–6. Бибкод : 2013PNAS..110.2152S . дои : 10.1073/pnas.1201753109 . ПМЦ 3568301 . ПМИД 23355677 .
- ^ Парк И.Х., Арора Н., Хо Х., Махерали Н., Ахфельдт Т., Шимамура А. и др. (сентябрь 2008 г.). «Плюрипотентные стволовые клетки, индуцированные специфическим заболеванием» . Клетка . 134 (5): 877–86. дои : 10.1016/j.cell.2008.07.041 . ПМЦ 2633781 . ПМИД 18691744 .
- ^ Фридман Б.С., Лам А.К., Сундсбак Дж.Л., Ятрино Р., Су Х, Кун С.Дж. и др. (октябрь 2013 г.). «Понижение цилиарного полицистина-2 в индуцированных плюрипотентных стволовых клетках пациентов с поликистозом почек с мутациями PKD1» . Журнал Американского общества нефрологов . 24 (10): 1571–86. дои : 10.1681/ASN.2012111089 . ПМЦ 3785271 . ПМИД 24009235 .
- ^ Долметч Р., Гешвинд Д. (июнь 2011 г.). «Человеческий мозг в блюде: перспективы нейронов, полученных из ИПСК» . Клетка . 145 (6): 831–4. дои : 10.1016/j.cell.2011.05.034 . ПМК 3691069 . ПМИД 21663789 .
- ^ Грскович М., Джавахериан А., Струловичи Б., Дейли GQ (ноябрь 2011 г.). «Индуцированные плюрипотентные стволовые клетки - возможности для моделирования заболеваний и открытия лекарств». Обзоры природы. Открытие наркотиков . 10 (12): 915–29. дои : 10.1038/nrd3577 . ПМИД 22076509 . S2CID 7945956 .
- ^ Ши Ю, Иноуэ Х, Ву Дж. К., Яманака С. (февраль 2017 г.). «Технология индуцированных плюрипотентных стволовых клеток: десятилетие прогресса» . Nat Rev Drug Discov . 16 (2): 115–30. дои : 10.1038/nrd.2016.245 . ПМК 6416143 . ПМИД 27980341 .
- ^ Герлин А (5 декабря 2012 г.). «Roche, Pfizer и Sanofi планируют создать банк стволовых клеток на сумму 72,7 миллиона долларов» . Bloomberg.com . Проверено 23 декабря 2012 .
- ^ Шиннави Р., Хубер И., Майзелс Л., Шахин Н., Гепштейн А., Арбель Г. и др. (октябрь 2015 г.). «Мониторинг индуцированных человеком плюрипотентных кардиомиоцитов, полученных из стволовых клеток, с помощью генетически закодированных кальциевых и флуоресцентных репортеров напряжения» . Отчеты о стволовых клетках . 5 (4): 582–96. дои : 10.1016/j.stemcr.2015.08.009 . ПМЦ 4624957 . ПМИД 26372632 .
- ^ Шахин Н., Шити А., Хубер И., Шиннави Р., Арбель Г., Гепштейн А. и др. (июнь 2018 г.). «Индуцированные человеком плюрипотентные стволовые клетки сердечных клеток, экспрессирующие генетически закодированный индикатор напряжения для фармакологических исследований и исследований аритмии» . Отчеты о стволовых клетках . 10 (6): 1879–1894. дои : 10.1016/j.stemcr.2018.04.006 . ПМЦ 5989818 . ПМИД 29754959 .
- ^ Шарма, Арун; Берридж, Пол В.; Маккейтан, Уэсли Л.; Серрано, Рикардо; Шукла, Правин; Саид, Назиш; Чурко, Джаред М.; Китани, Томоя; Ву, Хаоди; Хольмстрём, Александра; Маца, Елена (15 февраля 2017 г.). «Высокопроизводительный скрининг кардиотоксичности ингибитора тирозинкиназы с использованием индуцированных человеком плюрипотентных стволовых клеток» . Наука трансляционной медицины . 9 (377): eaaf2584. doi : 10.1126/scitranslmed.aaf2584 . ISSN 1946-6242 . ПМК 5409837 . ПМИД 28202772 .
- ^ Маккейтан, Уэсли Л.; Савченко, Алексей; Ю, Майкл С.; Чериньоли, Фабио; Брюнель, Арне А.Н.; Прайс, Джеффри Х.; Колас, Александр Р.; Миллер, Эван В.; Кэшман, Джон Р.; Меркола, Марк (2017). «Автоматизированная платформа для оценки врожденной и лекарственной аритмии с использованием кардиомиоцитов, полученных из hiPSC» . Границы в физиологии . 8 : 766. дои : 10.3389/fphys.2017.00766 . ISSN 1664-042X . ПМК 5641590 . ПМИД 29075196 .
- ^ Серрано, Рикардо; Фейен, Дрис AM; Брюнель, Арне А.Н.; Гнатюк Анна П.; Ву, Мишель М.; Аматья, Прашила Л.; Переа-Гил, Исаак; Прадо, Марисела; Сигер, Тимон; Ву, Джозеф К.; Каракикс, Иоаннис; Меркола, Марк (январь 2023 г.). «Платформа глубокого обучения для оценки риска лекарственной проаритмии» . Клеточная стволовая клетка . 30 (1): 86–95.e4. дои : 10.1016/j.stem.2022.12.002 . ПМЦ 9924077 . ПМИД 36563695 .
- ^ Бейкер М. (3 июля 2013 г.). «Миниатюрная человеческая печень, выращенная на мышах» . Природа . дои : 10.1038/nature.2013.13324 . S2CID 87064973 . Проверено 19 июля 2013 г.
- ^ Такебе Т., Секине К., Эномура М., Койке Х., Кимура М., Огаэри Т. и др. (июль 2013 г.). «Васкуляризованная и функциональная печень человека из трансплантата органа, полученного из ИПСК». Природа . 499 (7459): 481–4. Бибкод : 2013Natur.499..481T . дои : 10.1038/nature12271 . ПМИД 23823721 . S2CID 4423004 .
- ^ Чен Ю, Люттманн Ф.Ф., Шогер Э., Шёлер Х.Р., Зеларайян Л.С., Ким К.П. и др. (сентябрь 2021 г.). «Обратимое перепрограммирование кардиомиоцитов в состояние плода способствует регенерации сердца у мышей». Наука . 373 (6562): 1537–1540. Бибкод : 2021Sci...373.1537C . дои : 10.1126/science.abg5159 . ПМИД 34554778 . S2CID 237617229 .
- ^ Маллин Э. (28 января 2014 г.). «Исследователи восстанавливают сетчатку у мышей с помощью безвирусных стволовых клеток» . www.fightbiotech.com . Проверено 17 февраля 2014 г.
- ^ Парк Т.С., Бхутто И., Циммерлин Л., Хо Дж.С., Нагария П., Миллер Д. и др. (январь 2014 г.). «Сосудистые предшественники из индуцированных плюрипотентных стволовых клеток, полученных из пуповинной крови, обладают повышенной способностью к регенерации ишемизированной сосудистой сети сетчатки» . Тираж . 129 (3): 359–72. doi : 10.1161/CIRCULATIONAHA.113.003000 . ПМК 4090244 . ПМИД 24163065 .
- ^ Тан Х, Ша Х, Сунь Х, Ву Х, Се Л, Ван П и др. (октябрь 2013 г.). «Отслеживание индуцированных нервных стволовых клеток, полученных из плюрипотентных стволовых клеток, в центральной нервной системе крыс и обезьян» . Клеточное перепрограммирование . 15 (5): 435–42. дои : 10.1089/cell.2012.0081 . ПМЦ 3787483 . ПМИД 24020696 .
- ^ Берридж П.В., Матса Э., Шукла П., Лин З.К., Чурко Дж.М., Эберт А.Д. и др. (август 2014 г.). «Химически определяемая генерация кардиомиоцитов человека» . Природные методы . 11 (8): 855–60. дои : 10.1038/nmeth.2999 . ПМК 4169698 . ПМИД 24930130 .
- ^ Фейен, Дрис AM; Маккейтан, Уэсли Л.; Брюнель, Арне А.Н.; Спиринг, Шон; Хёрманн, Лариса; Ульмер, Бербель; Чжан, Хуэй; Бриганти, Франческа; Швейцер, Микаэла; Хедьи, Бенце; Ляо, Чжанди (21 июля 2020 г.). «Среды метаболического созревания улучшают физиологическую функцию кардиомиоцитов человека, полученных из ИПСК» . Отчеты по ячейкам . 32 (3): 107925. doi : 10.1016/j.celrep.2020.107925 . ISSN 2211-1247 . ПМЦ 7437654 . ПМИД 32697997 .
- ^ Виллемс Э., Спиринг С., Давидович Х., Ланье М., Ся З., Доусон М. и др. (август 2011 г.). «Низкомолекулярные ингибиторы пути Wnt мощно стимулируют кардиомиоциты из мезодермы, полученной из эмбриональных стволовых клеток человека» . Исследование кровообращения . 109 (4): 360–4. дои : 10.1161/CIRCRESAHA.111.249540 . ПМЦ 3327303 . ПМИД 21737789 .
- ^ Ядзава М., Сюэ Б., Цзя Х, Паска А.М., Бернштейн Дж.А., Холлмайер Дж., Долметч Р.Э. (март 2011 г.). «Использование индуцированных плюрипотентных стволовых клеток для исследования сердечных фенотипов при синдроме Тимоти» . Природа . 471 (7337): 230–4. Бибкод : 2011Natur.471..230Y . дои : 10.1038/nature09855 . ПМК 3077925 . ПМИД 21307850 .
- ^ Ицхаки И., Майзельс Л., Хубер И., Цви-Дантсис Л., Каспи О., Винтерштерн А. и др. (март 2011 г.). «Моделирование синдрома удлиненного интервала QT с помощью индуцированных плюрипотентных стволовых клеток». Природа . 471 (7337): 225–9. Бибкод : 2011Natur.471..225I . дои : 10.1038/nature09747 . ПМИД 21240260 . S2CID 4384573 .
- ^ Шарма А., Берридж П.В., Маккейтан В.Л., Серрано Р., Шукла П., Сайед Н. и др. (февраль 2017 г.). «Высокопроизводительный скрининг кардиотоксичности ингибитора тирозинкиназы с использованием индуцированных человеком плюрипотентных стволовых клеток» . Наука трансляционной медицины . 9 (377): eaaf2584. doi : 10.1126/scitranslmed.aaf2584 . ПМК 5409837 . ПМИД 28202772 .
- ^ Маккейтан, Уэсли Л.; Фейен, Дрис AM; Брюнель, Арне А.Н.; Околотович, Карл Дж.; Райан, Дэниел А.; Сэмпсон, Кевин Дж.; Поте, Франк; Савченко, Алексей; Гомес-Галено, Хорхе; Ву, Мишель; Серрано, Рикардо (5 ноября 2020 г.). «Реинжиниринг антиаритмического препарата с использованием кардиомиоцитов пациента hiPSC для улучшения терапевтического потенциала и снижения токсичности» . Клеточная стволовая клетка . 27 (5): 813–821.e6. дои : 10.1016/j.stem.2020.08.003 . ISSN 1875-9777 . ПМЦ 7655512 . ПМИД 32931730 .
- ^ «Производство клеток сердечной мышцы из iPS: Takara Bio and Venture» Электронная версия Nihon Keizai Shimbun (на японском языке) 24 июня 2014 г. Проверено 8 ноября 2019 г.
- ^ «iPS одобрен для лечения сердца, шаг к очень сложной регенеративной медицине» Электронная версия Nihon Keizai Shimbun (на японском языке), дата обращения 8 ноября 2019 г.
- ^ «Правительство в целом одобряет клинические исследования по трансплантации iPS-клеток миокарда: Asahi Shimbun Digital» ( на г.) . , 16 мая 2018 японском языке
- ^ Вэй Х., Ван С., Го Р., Такахаши К., Нарусэ К. (декабрь 2019 г.). «Разработка модели ишемической болезни сердца с использованием кардиомиоцитов, дифференцированных из индуцированных человеком плюрипотентных стволовых клеток» . Связь с биохимическими и биофизическими исследованиями . 520 (3): 600–605. дои : 10.1016/j.bbrc.2019.09.119 . ПМИД 31623826 .
- ^ «Первые переливания «фабрикованной» крови запланированы на 2016 год» . Gizmag.com. 23 апреля 2014 года . Проверено 23 апреля 2014 г.
- ^ Гарбер К. (сентябрь 2015 г.). «RIKEN приостанавливает первое клиническое исследование с использованием индуцированных плюрипотентных стволовых клеток». Природная биотехнология . 33 (9): 890–1. дои : 10.1038/nbt0915-890 . ПМИД 26348942 . S2CID 205271169 .
- ^ Тобита М., Кономи К., Торашима Ю., Кимура К., Таока М., Каминота М. (июнь 2016 г.). «Проблемы Японии в области трансляционной регенеративной медицины: Закон о безопасности регенеративной медицины» . Регенеративная терапия . 4 : 78–81. дои : 10.1016/j.reth.2016.04.001 . ПМК 6581824 . ПМИД 31245489 .
- ^ Рикен Центр биологии развития. «Информация о предложенном пилотном исследовании безопасности и возможности трансплантации аутологичных листов пигментного эпителия сетчатки (RPE), полученных из hiPSC, у пациентов с неоваскулярной возрастной макулярной дегенерацией» . Исследовать . Архивировано из оригинала 26 июня 2013 года . Проверено 23 июля 2013 г.
- ^ Перейти обратно: а б Галлахер Дж. (19 июля 2013 г.). «Новаторское исследование стволовых клеток взрослых, одобренное Японией» . Новости Би-би-си . Проверено 23 июля 2013 г.
- ^ «Первая донорская трансплантация клеток РПЭ, полученных из ИПСК, пациенту с ВМД» . RIKEN Центр биологии развития. 4 апреля 2017 года . Проверено 6 сентября 2017 г.
- ^ «Сообщено о первой серьезной побочной реакции на трансплантацию клеток сетчатки, полученных из iPS» . «Джапан таймс онлайн» . 17 января 2018 г.
- ^ Дайнсбергер Дж., Райзингер Д., Вебер Б. (11 сентября 2020 г.). «Глобальные тенденции в клинических исследованиях с использованием плюрипотентных стволовых клеток: систематический анализ нескольких баз данных» . npj Регенеративная медицина . 5 (1): 15. дои : 10.1038/s41536-020-00100-4 . ПМЦ 7486930 . ПМИД 32983575 .
- ^ Нопфлер П. (25 января 2021 г.). «Что такое индуцированные плюрипотентные стволовые клетки или IPS-клетки и их клинические перспективы?» . Ниша . Проверено 7 февраля 2021 г.
- ^ Перейти обратно: а б Кога К., Ван Б., Канеко С. (2020). «Текущий статус и будущие перспективы HLA-индуцированных плюрипотентных стволовых клеток» . Воспаление и регенерация . 40:23 . дои : 10.1186/s41232-020-00132-9 . ПМЦ 7528263 . ПМИД 33014207 .
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 . - ^ Хариди Р. (23 октября 2017 г.). «Лечение старения стволовыми клетками оказалось успешным в ранних испытаниях на людях» . Новый Атлас .
- ^ Саркар Т.Дж., Кварта М., Мукерджи С., Колвилл А., Пейн П., Доан Л. и др. (март 2020 г.). «Транзиторная неинтегративная экспрессия факторов ядерного репрограммирования способствует многогранному замедлению старения в клетках человека» . Природные коммуникации . 11 (1): 1545. Бибкод : 2020NatCo..11.1545S . дои : 10.1038/s41467-020-15174-3 . ПМК 7093390 . ПМИД 32210226 .
Внешние ссылки
[ редактировать ]- Центр исследований и применения iPS-клеток, Киотский университет
- Под воздействием небольшого количества факторов взрослые клетки приобретают характер эмбриональных стволовых клеток.
- Создание iPS-клеток из MEFS посредством принудительной экспрессии Sox-2, Oct-4, c-Myc и Klf4
- Двухминутное видео от BSCRF об индуцированных плюрипотентных стволовых клетках. Архивировано 18 апреля 2011 г. на Wayback Machine.
- 20-минутное видео / Открытие и будущее индуцированных плюрипотентных стволовых (iPS) клеток, автор Яманака , 8 января 2008 г.
- Информационный бюллетень о перепрограммировании
- Практический семинар Оксфордского университета по технологии плюрипотентных стволовых клеток. Архивировано 8 апреля 2016 г. в Wayback Machine.
- Allen Cell Explorer – реалистичная трехмерная визуализация живого hiPSC на основе данных в его плюрипотентном состоянии.
- Курс CamBioScience iPSC. Архивировано 23 апреля 2019 г. на Wayback Machine.