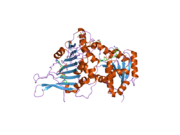Глюкозо-6-фосфатдегидрогеназа
| Глюкозо-6-фосфатдегидрогеназа, домен связывания NAD | |||
|---|---|---|---|
 глюкоза 6-фосфатдегидрогеназа из Leuconostoc mesenteroides | |||
| Идентификаторы | |||
| Символ | G6pd_n | ||
| Pfam | PF00479 | ||
| PFAM клан | CL0063 | ||
| InterPro | IPR022674 | ||
| PROSITE | PDOC00067 | ||
| Краткое содержание | 1dpg / scope / supfam | ||
| |||
| Глюкозо-6-фосфатдегидрогеназа | |||
|---|---|---|---|
| Идентификаторы | |||
| ЕС №. | 1.1.1.49 | ||
| CAS №. | 9001-40-5 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
Глюкозо-6-фосфатдегидрогеназа ( G6PD или G6PDH ) ( EC 1.1.1.49 ) представляет собой цитозольный фермент , который катализирует химическую реакцию
- D -Glucose 6 -фосфат + NADP + + H 2 o ⇌ 6-phospho -d -glucono-1,5-лактон + nadph + h +
Этот фермент участвует в пентозофосфатном пути (см. Изображение), метаболический путь , который обеспечивает снижение энергии к клеткам (таким как эритроциты ), поддержав уровень сниженного формы никотинамида -динуклеотид фосфата (NADPH). NADPH, в свою очередь, поддерживает уровень глутатиона в этих клетках, который помогает защитить эритроциты от окислительного повреждения от таких соединений, как перекись водорода . [ 1 ] Более высокое количественное значение имеет продукцию NADPH для тканей, участвующих в биосинтезе жирных кислот или изопреноидов , таких как печень, молочные железы , жировые ткани и надпочечники . G6PD уменьшает NADP + для NADPH при окислении глюкозы-6-фосфата . [ 2 ] Глюкозо-6-фосфатдегидрогеназа также является ферментом в пути Entner-Doudoroff , типа гликолиза.
Клинически, X-связанный генетический дефицит G6PD делает человеческий склонность к неиммунной гемолитической анемии . [ 3 ]
Виды распределение
[ редактировать ]G6PD широко распространен во многих видах от бактерий до людей . Выравнивание множественных последовательностей более 100 известных G6PD из разных организмов выявляет идентичность последовательности от 30% до 94%. [ 4 ] Человеческий G6PD имеет более 30% идентичности в аминокислотной последовательности до последовательностей G6PD от других видов. [ 5 ] У людей также есть две изоформы одного гена, кодирующего G6PD. [ 6 ] Более того, было обнаружено, по крайней мере, 168 мутаций, вызывающих заболевание в этом гене. [ 7 ] Эти мутации являются в основном миссенс -мутациями, которые приводят к аминокислотным заменам, [ 8 ] И хотя некоторые из них приводят к дефициту G6PD, другие, похоже, не приводят к каким -либо заметным функциональным различиям. [ 8 ] Некоторые ученые предположили, что некоторые генетические вариации в G6PD человека были вызваны поколениями адаптации к малярийной инфекции. [ 9 ]
Другие виды также испытывают различия в G6PD. о более высоких растениях несколько изоформ Сообщалось G6PDH, которые локализованы в цитозоле , пластидной строме и пероксисомах . [ 10 ] Модифицированный F 420 -зависимый (в отличие от NADP + -Зазующее) G6PD обнаруживается в туберкулезе Mycobacterium и представляет интерес для лечения туберкулеза . [ 11 ] Было показано, что бактериальный G6PD, обнаруженный в Leuconostoc Mesenteroides, реагирует в направлении 4-гидроксиноненала , в дополнение к G6P. [ 12 ]
Структура фермента
[ редактировать ]
G6PD обычно встречается как димер из двух идентичных мономеров (см. Главную миниатюру). [ 8 ] В зависимости от условий, таких как pH , эти димеры могут сами димеризировать образу тетрамеров . [ 5 ] Каждый мономер в комплексе имеет сайт связывания субстрата , который связывается с G6P, и сайт связывания каталитического кофермента, который связывается с NADP + /Nadph с использованием сгиба Rossman . [ 4 ] Для некоторых более высоких организмов, таких как люди, G6PD содержит дополнительный NADP + сайт связывания, называемый NADP + Структурное место, которое, по -видимому, не участвует непосредственно в реакции, катализируемой G6PD. Эволюционная цель NADP + Структурный сайт неизвестен. [ 4 ] Что касается размера, каждый мономер составляет около 500 аминокислот длиной (514 аминокислот для людей [ 5 ] ).
Функциональное и структурное сохранение между G6PD человека и Leuconostoc Mesenteroides G6PD указывает на 3 широко консервативных областях на ферменте: пептид 9 остатков в субстратном сайте связывания, Ridhylgke (остатки 198-206 на G6PD человека), нуклеотидный отпечаток, GXXGDLA (g6pd-нуклеотид, GXXGD Остатки 38-44 на G6PD человека) и частично консервативная последовательность EKPXG вблизи сайта связывания субстрата (остатки 170-174 на G6PD человека), где мы имеем «X» для обозначения переменной аминокислоты. [ 4 ] Кристаллическая структура G6PD выявляет обширную сеть электростатических взаимодействий и водородных связей, включающих G6P, 3 молекулы воды, 3 лизина , 1 аргинин , 2 гистидина , 2 глутаминовые кислоты и другие полярные аминокислоты.
в Считается, что пролин позиции 172 играет решающую роль в правильном расположении Lys171 по отношению к субстрату, G6P. В двух кристаллических структурах нормального G6P человека Pro172 наблюдается исключительно в конформации CIS , в то время как в кристаллической структуре одного заболевания, вызывающего мутант (вариант кантона R459L), Pro172 наблюдается почти исключительно в транс -конформации. [ 4 ]
С доступом к кристаллическим структурам некоторые ученые пытались смоделировать структуры других мутантов. Например, в немецком происхождении, где фермапатия из -за дефицита G6PD редка, было показано, что сайты мутаций на G6PD лежат рядом с NADP + сайт связывания, сайт связывания G6P и рядом с границей между двумя мономерами. Таким образом, мутации в этих критических областях возможны без полного нарушения функции G6PD. [ 8 ] Фактически, было показано, что большинство заболеваний, вызывающих мутации G6PD, встречаются вблизи NADP + Структурный сайт. [ 13 ]
NADP + Структурный сайт
[ редактировать ]NADP + Структурное место расположено более чем на 20вку от сайта связывания субстрата и каталитического коэнзимента NADP + связующий сайт. Его цель в ферменте катализируемой реакцией была неясной в течение многих лет. Некоторое время считалось, что NADP + Связывание с структурным сайтом было необходимо для димеризации ферментных мономеров. Однако это было показано, что это неверно. [ 13 ] С другой стороны, было показано, что присутствие NADP + На структурном участке способствует димеризация димеров с образованием ферментных тетрамеров. [ 13 ] Также считалось, что состояние тетрамера необходимо для каталитической активности; Однако это также было показано, что это ложное. [ 13 ] NADP + Структурный сайт сильно отличается от NADP + Каталитический сайт связывания коэнзимов и содержит нуклеотидсвязывающий отпечаток пальца.
Структурный участок, связанный с NADP + обладает благоприятными взаимодействиями, которые держат его крепко. В частности, существует сильная сеть водородных связей с электростатическими зарядами, диффундируемыми по нескольким атомам посредством водородной связи с 4 молекулами воды (см. Рисунок). Кроме того, существует чрезвычайно сильный набор гидрофобных стековых взаимодействий, которые приводят к перекрывающимся π -системам.
Было показано, что структурный участок важен для поддержания долгосрочной стабильности фермента. [ 13 ] Более 40 тяжелых мутаций класса I включают мутации вблизи структурного сайта, что влияет на долгосрочную стабильность этих ферментов в организме, что в конечном итоге приводит к дефициту G6PD. [ 13 ] Например, две тяжелые мутации класса I, G488S и G488V, резко увеличивают постоянную диссоциацию между NADP + и структурное место в течение 7-13. С близостью остатка 488 к ARG487 считается, что мутация в положении 488 может повлиять на позиционирование ARG487 относительно NADP + , [ 13 ] и, таким образом, нарушать связывание.
Регулирование
[ редактировать ]G6PD преобразует G6P в 6-фосфоглюконо-Δ-лактон и является ограничивающим скоростью фермента пентозофосфатного пути . Таким образом, регуляция G6PD имеет последующие последствия для активности остальной части пентозофосфатного пути .
Глюкозо-6-фосфатдегидрогеназа стимулируется подложкой G6P. Обычное соотношение NADPH/NADP + В цитозоле тканей, участвующих в биосинтезах, составляет около 100/1. Повышенное использование NADPH для биосинтеза жирных кислот значительно увеличит уровень NADP + , таким образом, стимулирование G6PD для получения большего количества NADPH. Дрожжи G6PD ингибируются длинными цепными жирными кислотами в соответствии с двумя более старыми публикациями [ 14 ] [ 15 ] и может быть ингибирование продукта при синтезе жирных кислот, которое требует NADPH.
G6PD отрицательно регулируется ацетилированием на лизине 403 (Lys403), эволюционно консервативном остатках. Acetylated G6PD K403 неспособен формировать активные димеры и отображать полную потерю активности. Механистически, ацетилизирующий Lys403 стерильно препятствует NADP + от входа в NADP + Структурный сайт, который снижает стабильность фермента. Клетки ощущают внеклеточные окислительные стимулы, чтобы уменьшить ацетилирование G6PD в SIRT2 зависимости от . Опосредованное SIRT2 деацетилирование и активация G6PD стимулирует пентозофосфатный путь для снабжения цитозольной NADPH для противодействия окислительному повреждению и защите мышиных эритроцитов . [ 16 ]
Регуляция также может происходить через генетические пути. Изоформа G6PDH регулируется факторами транскрипции и посттранскрипции. [ 17 ] Кроме того, G6PD является одним из ряда гликолитических ферментов, активируемых фактором транскрипции, индуцируемого гипоксией фактором 1 (HIF1). [ 18 ]
Клиническое значение
[ редактировать ]G6PD примечателен своим генетическим разнообразием. Многие варианты G6PD, в основном продуцируемые из миссенс-мутаций , были описаны с широкими уровнями активности ферментов и связанными с клиническими симптомами . два варианта транскрипта, кодирующие разные изоформы . Для этого гена были обнаружены [ 19 ]
Дефицит глюкозо-6-фосфатдегидрогеназы очень распространен во всем мире и вызывает острую гемолитическую анемию в присутствии простой инфекции, проглатывания бобов фар или реакции с определенными лекарствами, антибиотиками, антифарими и антималарийными. [ 3 ]
На рост и пролиферацию клеток влияют G6PD. [ 20 ] Было показано, что фармакологически Ablating G6PD преодолевает перекрестную толерантность клеток рака молочной железы в антрациклины. [ 21 ] Ингибиторы G6PD рассматриваются для лечения рака и других условий. [ 18 ] Анализ пролиферации клеток in vitro показывает, что ингибиторы G6PD, DHEA (дегидроэпиандростерон) и ANAD (6-аминоникотинамид), эффективно снижают рост клеточных линий AML. [ 20 ] [ 22 ] G6PD гипометилизируется при K403 при острой миелоидной лейкозе , SIRT2 активирует G6PD для усиления выработки NADPH и способствует пролиферации клеток лейкоза. [ 22 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Томас Д., Шерест Х, Сурдин-Кержан Ю (март 1991 г.). «Идентификация структурного гена для глюкозо-6-фосфатдегидрогеназы у дрожжей. Инактивация приводит к потребности в питании для органической серы» . Embo Journal . 10 (3): 547–53. doi : 10.1002/j.1460-2075.1991.tb07981.x . PMC 452682 . PMID 2001672 .
- ^ Aster J, Kumar V, Robbins SL, Abbas AK, Fausto N, Cotran RS (2010). Роббинс и патологическая основа болезни . Saunders/Elsevier. Стр. Расположение Kindle 33340–33341. ISBN 978-1-4160-3121-5 .
- ^ Jump up to: а беременный Cappellini MD, Fiorelli G (январь 2008 г.). «Дефицит глюкозы-6-фосфатдегидрогеназы». Лансет . 371 (9606): 64–74. doi : 10.1016/s0140-6736 (08) 60073-2 . PMID 18177777 . S2CID 29165746 .
- ^ Jump up to: а беременный в дюймовый и Kotaka M, Guber S, Vandeputte-Rutten L, AU SW, LAM VM, Adams MJ (май 2005 г.). «Структурные исследования глюкозо-6-фосфата и связывания NADP+ с глюкозо-6-фосфатом человека» (PDF) . Acta Crystallographica d . 61 (Pt 5): 495–504. doi : 10.1107/s0907444905002350 . PMID 15858258 .
- ^ Jump up to: а беременный в AU SW, Гомин С., Лам В.М., Адамс М.Дж. (март 2000 г.). «Человеческая глюкоза-6-фосфатдегидрогеназа: кристаллическая структура выявляет структурную молекулу NADP (+) и дает представление о дефиците фермента» . Структура 8 (3): 293–303. doi : 10.1016/s0969-2126 (00) 00104-0 . PMID 10745013 .
- ^ «G6PD глюкозо-6-фосфатдегидрогеназа [Homo sapiens (человек)]» . NCBI . Получено 13 декабря 2015 года .
- ^ Шимчикова Д, Хенеберг П (декабрь 2019 г.). «Уточнение прогнозов эволюционной медицины, основанных на клинических данных о проявлениях заболеваний менделей» . Научные отчеты . 9 (1): 18577. Bibcode : 2019natsr ... 918577S . doi : 10.1038/s41598-019-54976-4 . PMC 6901466 . PMID 31819097 .
- ^ Jump up to: а беременный в дюймовый Kiani F, Schwarzl S, Fischer S, Efferth T (июль 2007 г.). «Трехмерное моделирование глюкозо-6-фосфатдегидрогеназы, дефицитных вариантов от немецкого происхождения» . Plos один . 2 (7): E625. Bibcode : 2007ploso ... 2..625K . doi : 10.1371/journal.pone.0000625 . PMC 1913203 . PMID 17637841 .
- ^ Luzzatto L, Bienzle U (июнь 1979 г.). «Гипотеза малярии/G.-6-PD». Лансет . 1 (8127): 1183–4. doi : 10.1016/s0140-6736 (79) 91857-9 . PMID 86896 . S2CID 31214682 .
- ^ Corpas FJ, Barroso JB, Sandalio LM, Distefano S, Palma JM, Lupiáñez JA, Del Río La (март 1998 г.). «Опосредованная дегидрогеназой система переработки NADPH в пероксисомах растений» . Биохимический журнал . 330 (Pt 2): 777–84. doi : 10.1042/bj3300777 . PMC 1219205 . PMID 9480890 .
- ^ Башири Г., Сквайр К.Дж., Морленд Н.Дж., Бейкер Эн (июнь 2008 г.). «Кристаллические структуры F420-зависимой глюкозо-6-фосфатдегидрогеназы FGD1, участвующих в активации кандидата препарата против туберкулеза PA-824, выявляют основу коэнзимента и субстрата» . Журнал биологической химии . 283 (25): 17531–41. doi : 10.1074/jbc.m801854200 . PMID 18434308 .
- ^ Зведа Ли, Учида К., Цай Л., Стадтман Е.Р. (февраль 1993 г.). «Инактивация глюкозо-6-фосфатдегидрогеназы с помощью 4-гидрокси-2-ноненал. Селективная модификация лизина активного сайта» . Журнал биологической химии . 268 (5): 3342–7. doi : 10.1016/s0021-9258 (18) 53699-1 . PMID 8429010 .
- ^ Jump up to: а беременный в дюймовый и фон глин Wang XT, Chan TF, LAM VM, Engel PC (август 2008 г.). «Какова роль второго« структурного »сайта NADP+-связан в 6-фосфат-дегидрогеназе человека?» Полем Белковая наука . 17 (8): 1403–11. doi : 10.1110/ps.035352.108 . PMC 2492815 . PMID 18493020 .
- ^ Eger-neufeldt I, Teinzer A, Weiss L, Wieland O (март 1965 г.). «Ингибирование глюкозо-6-фосфатдегидрогеназы с помощью длинного цепного ацил-кофермента А». Биохимическая и биофизическая исследовательская коммуникация . 19 (1): 43–48. doi : 10.1016/0006-291x (65) 90116-6 .
- ^ Kawaguchi A, Bloch K (сентябрь 1974 г.). «Ингибирование глюкозы 6-фосфатдегидрогеназы пальмитоил коэнзим А» . Журнал биологической химии . 249 (18): 5793–800. doi : 10.1016/s0021-9258 (20) 79887-x . PMID 4153382 .
- ^ Wang YP, Zhou LS, Zhao YZ, Wang SW, Chen LL, Liu LX, Ling ZQ, Hu FJ, Sun YP, Zhang JY, Yang C, Yang Y, Xiong Y, Guan KL, Ye D (июнь 2014 г.). «Регуляция ацетилирования G6PD с помощью SIRT2 и KAT9 модулирует гомеостаз NADPH и выживаемость клеток во время окислительного стресса» . Embo Journal . 33 (12): 1304–20. doi : 10.1002/embj.201387224 . PMC 4194121 . PMID 24769394 .
- ^ Kletzien RF, Harris PK, Foellmi LA (февраль 1994 г.). «Глюкозо-6-фосфатдегидрогеназа:« домашнее хозяйство », подверженное тканевой регуляции гормонами, питательными веществами и окислительным стрессом» . FASEB Journal . 8 (2): 174–81. doi : 10.1096/fasebj.8.2.8119488 . PMID 8119488 . S2CID 38768580 .
- ^ Jump up to: а беременный De Lartigue J (2012-06-12). «Исследование рака выходит за рамки первоначальных отличительных черт рака» . Onclive. Архивировано с оригинала 2018-01-02 . Получено 2012-06-26 .
- ^ «Ген Entrez: G6PD глюкозо-6-фосфатдегидрогеназа» .
- ^ Jump up to: а беременный Tian WN, Braunstein LD, Pang J, Stuhlmeier KM, XI QC, Tian X, Stanton RC (апрель 1998 г.). «Важность активности глюкозо-6-фосфатдегидрогеназы для роста клеток» . Журнал биологической химии . 273 (17): 10609–17. doi : 10.1074/jbc.273.17.10609 . PMID 9553122 .
- ^ Goldman A, Khiste S, Freinkman E, Dhawan A, Majumder B, Mondal J, et al. (Август 2019). «Нацеливание фенотипической пластичности опухоли и метаболического ремоделирования при адаптивной толерантности к поперечным лекарствам» . Наука сигнализация . 12 (595). doi : 10.1126/scisignal.aas8779 . PMC 7261372 . PMID 31431543 .
- ^ Jump up to: а беременный Xu SN, Wang TS, Li X, Wang YP (сентябрь 2016 г.). «SIRT2 активирует G6PD для усиления производства NADPH и способствует пролиферации клеток лейкемии» . Научные отчеты . 6 : 32734. Bibcode : 2016natsr ... 632734x . doi : 10.1038/srep32734 . PMC 5009355 . PMID 27586085 .
Дальнейшее чтение
[ редактировать ]- Vulliamy T, Beutler E, Luzzatto L (1993). «Варианты глюкозо-6-фосфатдегидрогеназы обусловлены миссенс-мутациями, распространяющимися по всей области кодирующей области гена» . Человеческая мутация . 2 (3): 159–67. doi : 10.1002/Humu.1380020302 . PMID 8364584 . S2CID 46431236 .
- Мейсон PJ (сентябрь 1996 г.). «Новое понимание дефицита G6PD». Британский журнал гематологии . 94 (4): 585–91. doi : 10.1111/j.1365-2141.1996.tb00001.x . PMID 8826878 . S2CID 221484452 .
- Wajcman H, Galactéros F (август 2004 г.). «[Дефицит 6-фосфатдегидрогеназы глюкозы: защита от малярии и риск гемолитических несчастных случаев]». Comptes Rendus Biologies (по -французски). 327 (8): 711–20. doi : 10.1016/j.crvi.2004.07.010 . PMID 15506519 .