Ацетилирование белка
Ацетилирование белков (и деацетилирование) — это ацетилирования реакции , которые происходят в живых клетках в ходе метаболизма лекарств под действием ферментов печени и других органов (например, мозга). Фармацевтические препараты часто используют ацетилирование, чтобы такие сложные эфиры могли проникнуть через гематоэнцефалический барьер (и плаценту ), где они деацетилируются ферментами ( карбоксилэстеразами ) аналогично ацетилхолину . Примерами ацетилированных фармацевтических препаратов являются диацетилморфин (героин), ацетилсалициловая кислота (аспирин), ТГК-О-ацетат и диацереин . И наоборот, такие лекарства, как изониазид, ацетилируются в печени во время метаболизма лекарств. Лекарство, действие которого зависит от таких метаболических преобразований, называется пролекарством .
Ацетилирование является важной модификацией белков в клеточной биологии ; и протеомные исследования выявили тысячи ацетилированных белков млекопитающих. [ 1 ] [ 2 ] [ 3 ] Ацетилирование происходит как котрансляционная и модификация белков посттрансляционная , например, гистонов , р53 и тубулинов . Среди этих белков хроматина широко представлены белки и метаболические ферменты, что указывает на то, что ацетилирование оказывает значительное влияние на экспрессию генов и метаболизм . У бактерий 90% белков, участвующих в центральном метаболизме Salmonella enterica, ацетилированы. [ 4 ] [ 5 ]
N-концевое ацетилирование
[ редактировать ]
N-концевое ацетилирование является одной из наиболее распространенных котрансляционных ковалентных модификаций белков у эукариот и имеет решающее значение для регуляции и функционирования различных белков. N-концевое ацетилирование играет важную роль в синтезе, стабильности и локализации белков. Около 85% всех белков человека и 68% белков дрожжей ацетилированы на Nα-конце. [ 6 ] Некоторые белки прокариот и архей также модифицируются путем N-концевого ацетилирования.
N-концевое ацетилирование катализируется набором ферментных комплексов, N-концевых ацетилтрансфераз (NAT). NAT переносят ацетильную группу от ацетил-кофермента А (Ac-CoA) к α-аминогруппе первого аминокислотного остатка белка. Различные NAT ответственны за ацетилирование N-концевого белка, и до сих пор было обнаружено, что ацетилирование является необратимым. [ 7 ]
N-концевые ацетилтрансферазы
[ редактировать ]На сегодняшний день у человека обнаружено семь различных NAT — NatA, NatB, NatC, NatD, NatE, NatF и NatH. Каждый из этих различных ферментных комплексов специфичен для разных аминокислот или аминокислотных последовательностей, что показано в следующей таблице.
Таблица 1. Состав и субстратная специфичность НАТ.
| НАТ | Субъединицы (каталитические субъединицы выделены жирным шрифтом ). | Субстраты |
|---|---|---|
| Рожденный | Наа10 (Ард1) Наа15 (Нат1) | Ser- , Ala- , Gly- , Thr-, Val- , Cys- N -конец |
| НацБ | Naa20 (Nat3) Naa25 (Mdm20) | Met - Glu- , Met - Asp- , Met - Asn- , Met - Gln - N-конец |
| НацК | Наа30 (Мак3) Наа35 (Мак10) Наа38 (Мак31) | Met - Leu -, Met -Ile-, Met -Trp-, Met - Phe - N-конец |
| НАТД | Наа40 (Нат4) | Ser - Gly - Gly -, Ser - Gly - Arg - N-конец |
| НатЭ | Naa50 (Nat5) Naa10 (Ard1) Naa15 (Nat1) | Мет -Leu-, Мет - Ала -, Мет - Лис -, Мет - Мет - N-конец |
| НатФ | Наа60 | Met - Lys -, Met - Leu -, Met -Ile-, Met -Trp-, Met - Phe - N-конец |
| НатХ | Наа80 | Актин - N-конец |
Рожденный
[ редактировать ]
NatA состоит из двух субъединиц: каталитической субъединицы Naa10 и вспомогательной субъединицы Naa15. более сложны, Субъединицы NatA у высших эукариот чем у низших эукариот. В дополнение к генам NAA10 и NAA15 , специфичные для млекопитающих гены NAA11 и NAA16 образуют функциональные генные продукты, которые образуют различные активные комплексы NatA. Этими четырьмя белками образуются четыре возможных каталитически-вспомогательных димера hNatA. Однако Naa10/Naa15 является наиболее распространенным NatA. [ 9 ]
NatA ацетилирует Ser , Ala- , Gly- , Thr-, Val- и Cys N-концы после удаления инициатора метионина метионинаминопептидазами. Эти аминокислоты чаще экспрессируются на N-конце белков эукариот, поэтому NatA является основным NAT, соответствующим целому числу его потенциальных субстратов. [ 10 ]
В N-концевом ацетилировании NatA участвуют несколько различных партнеров по взаимодействию. Белок K, взаимодействующий с хантингтином (HYPK), взаимодействует с hNatA на рибосоме , влияя на N-концевое ацетилирование подмножества субстратов NatA. Субъединицы hNaa10 и hNaa15 увеличивают склонность к агрегации Хантингтина, если HYPK истощается. индуцируемый гипоксией фактор (HIF)-1α взаимодействует с hNaa10, ингибируя hNaa10-опосредованную активацию транскрипционной активности β-катенина. Также было обнаружено, что [ 11 ]
НацБ
[ редактировать ]Комплексы NatB состоят из каталитической субъединицы Naa20p и вспомогательной субъединицы Naa25p, которые обнаружены как у дрожжей, так и у человека. У дрожжей все субъединицы NatB связаны с рибосомами; но у людей обнаружено, что субъединицы NatB представляют собой как ассоциированную с рибосомами, так и нерибосомальную форму. NatB ацетилирует N-концевой метионин субстратов, начиная с Met - Glu- , Met - Asp- , Met - Asn- или Met - Gln -N-концев.
НацК
[ редактировать ]Комплекс NatC состоит из одной каталитической субъединицы Naa30p и двух вспомогательных субъединиц Naa35p и Naa38p. Все три субъединицы обнаружены на рибосоме дрожжей, но они также обнаружены в нерибосомальных формах NAT, таких как Nat2. Комплекс NatC ацетилирует N-концевой метионин субстратов Met - Leu- , Met -Ile-, Met -Trp- или Met - Phe N-концев.
НАТД
[ редактировать ]NatD состоит только из каталитических единиц Naa40p и Naa40p и концептуально отличается от других NAT. Сначала у дрожжей и человека были идентифицированы только два субстрата: H2A и H4. Во-вторых, субстратная специфичность Naa40p лежит в пределах первых 30-50 остатков, что значительно превышает субстратную специфичность других NAT. Ацетилирование гистонов NatD частично связано с рибосомами, а субстратами аминокислот являются те самые N-концевые остатки, что отличает его от лизин-N-ацетилтрансфераз (КАТ). [ 12 ]
НатЭ
[ редактировать ]Комплекс NatE состоит из субъединицы Naa50p и двух субъединиц NatA, Naa10p и Naa15p. N-конец субстратов Naa50p отличается от тех, которые ацетилируются NatA-активностью Naa10p. [ 13 ] NAA50 в растениях необходим для контроля роста, развития и реакции на стресс, а функция NAA50 высоко консервативна между людьми и растениями. [ 14 ] [ 15 ] [ 16 ] [ 17 ]
НатФ
[ редактировать ]
NatF — это NAT, состоящий из фермента Naa60. Первоначально считалось, что NatF обнаружен только у высших эукариот, поскольку он отсутствует в дрожжах. [ 18 ] Однако позже было обнаружено, что Naa60 встречается во всем эукариотическом домене, но был вторично потерян в линии грибов. [ 19 ] По сравнению с дрожжами NatF способствует более высокому распространению N-концевого ацетилирования у людей. Комплекс NatF ацетилирует N-концевой метионин субстратов Met - Lys- , Met - Leu- , Met -Ile-, Met -Trp- и Met - Phe N-концы, которые частично перекрываются с NatC и NatE. [ 6 ] Было показано, что NatF имеет органеллярную локализацию и ацетилирует цитозольные N-концы трансмембранных белков. [ 20 ] Органеллярная локализация Naa60 опосредована его уникальным С-концом, который состоит из двух альфа-спиралей, которые периферически связываются с мембраной и опосредуют взаимодействия с PI(4)P . [ 21 ]
НАА80/НатХ
[ редактировать ]NAA80/NatH представляет собой N-концевую ацетилтрансферазу, которая специфически ацетилирует N-конец актина . [ 22 ]
N-концевая функция ацетилирования
[ редактировать ]Стабильность белка
[ редактировать ]N-концевое ацетилирование белков может влиять на стабильность белков, но результаты и механизм до сих пор не были очень ясны. [ 23 ] Считалось, что N-концевое ацетилирование защищает белки от деградации, поскольку Nα-ацетилирование предполагало, что N-концы блокируют N-концевое убиквитинирование и последующую деградацию белка . [ 24 ] Однако несколько исследований показали, что N-концевой ацетилированный белок имеет такую же скорость деградации, что и белки с неблокированным N-концом. [ 25 ]
Локализация белка
[ редактировать ]Было показано, что N-концевое ацетилирование может управлять локализацией белков. Arl3p — одна из Arf-подобных (Arl) GTPases , которая имеет решающее значение для организации мембранного трафика. [ 26 ] Ему необходима Nα-ацетильная группа для нацеливания на мембрану Гольджи путем взаимодействия с белком Sys1p, находящимся в мембране Гольджи. Если Phe или Tyr заменены на Ala на N-конце Arl3p, он больше не может локализоваться на мембране Гольджи, что указывает на то, что Arl3p нуждается в своих естественных N-концевых остатках, которые могут быть ацетилированы для правильной локализации. [ 27 ]
Метаболизм и апоптоз
[ редактировать ]Также было доказано, что N-концевое ацетилирование белка связано с регуляцией клеточного цикла и апоптозом в экспериментах по нокдауну белка. Нокдаун комплекса NatA или NatC приводит к индукции p53 -зависимого апоптоза , что может указывать на то, что антиапоптотические белки были менее функциональны или больше не функционировали из-за снижения ацетилирования N-конца белка. [ 28 ] Но, напротив, каспаза-2 , которая ацетилируется NatA, может взаимодействовать с адаптерным белком RIP, связанным с гомологичным белком Ich-1/Ced-3 с доменом смерти (RAIDD). Это может активировать каспазу-2 и вызвать апоптоз клеток . [ 29 ]
Синтез белка
[ редактировать ]Белки рибосом играют важную роль в синтезе белков, которые также могут быть ацетилированы по N-концу. N-концевое ацетилирование белков рибосом может влиять на синтез белка. Снижение скорости синтеза белка на 27 и 23% наблюдалось у штаммов с делециями NatA и NatB. Снижение точности трансляции наблюдалось у штамма с делецией NatA, а дефект рибосомы был отмечен у штамма с делецией NatB. [ 30 ]
Рак
[ редактировать ]Было высказано предположение, что NAT действуют как онкобелки и супрессоры опухолей при раке человека, а экспрессия NAT может увеличиваться или уменьшаться в раковых клетках. Эктопическая экспрессия hNaa10p увеличивает пролиферацию клеток и усиливает регуляцию гена, участвующего в пролиферации и метаболизме клеток . Сверхэкспрессия hNaa10p наблюдалась при раке мочевого пузыря , раке молочной железы и карциноме шейки матки . [ 31 ] Но высокий уровень экспрессии hNaa10p может также подавлять рост опухоли, а пониженный уровень экспрессии hNaa10p связан с плохим прогнозом, большими опухолями и большим количеством метастазов в лимфатических узлах.
Таблица 2. Обзор экспрессии субъединиц NatA в различных раковых тканях [ 32 ]
| Nat-субъединицы | Раковая ткань | Шаблон выражения |
|---|---|---|
| хНаа10 | рак легких , рак молочной железы , колоректальный рак , гепатоцеллюлярная карцинома | с высоким содержанием опухолей |
| хНаа10 | рак легких , рак молочной железы , рак поджелудочной железы , рак яичников | потеря гетерозиготности в опухолях |
| хНаа10 | рак молочной железы , рак желудка , рак легких | высокий при первичных опухолях, но низкий при метастазах в лимфатические узлы |
| хНаа10 | Немелкоклеточный рак легкого | низкий уровень опухолей |
| хНаа15 | папиллярный рак щитовидной железы , рак желудка | с высоким содержанием опухолей |
| хНаа15 | нейробластома | высокий при опухолях поздней стадии |
| хНаа11 | гепатоцеллюлярная карцинома | потеря гетерозиготности в опухолях |
Ацетилирование и деацетилирование лизина
[ редактировать ]
Белки обычно ацетилируются по остаткам лизина , и эта реакция основана на использовании ацетил-кофермента А в качестве донора ацетильной группы. При ацетилировании и деацетилировании гистонов белки гистонов ацетилируются и деацетилируются по остаткам лизина в N-концевом хвосте как часть регуляции гена . Обычно эти реакции катализируются ферментами с активностью гистон-ацетилтрансферазы (HAT) или гистон-деацетилазы (HDAC), хотя HAT и HDAC также могут изменять статус ацетилирования негистоновых белков. [ 33 ]
Регуляция факторов транскрипции, эффекторных белков, молекулярных шаперонов и белков цитоскелета путем ацетилирования и деацетилирования является важным механизмом посттрансляционной регуляции. [ 34 ] Эти регуляторные механизмы аналогичны фосфорилированию и дефосфорилированию под действием киназ и фосфатаз . Мало того, что состояние ацетилирования белка может изменить его активность, но недавно было высказано предположение, что эта посттрансляционная модификация может также пересекаться с фосфорилированием , метилированием , убиквитинированием , сумойлированием и другими для динамического контроля клеточной передачи сигналов. [ 35 ] Регуляция белка тубулина является примером этого в нейронах мыши и астроглии. [ 36 ] [ 37 ] Тубулинацетилтрансфераза . расположена в аксонеме и ацетилирует субъединицу α-тубулина в собранной микротрубочке После разборки это ацетилирование удаляется другой специфической деацетилазой в цитозоле клетки. Таким образом, аксонемные микротрубочки, имеющие длительный период полураспада, несут «характерное ацетилирование», которое отсутствует в цитозольных микротрубочках с более коротким периодом полураспада.
В области эпигенетики было показано , ) гистонов что ацетилирование (и деацетилирование является важным механизмом регуляции транскрипции генов. Гистоны, однако, не единственные белки, регулируемые посттрансляционным ацетилированием. Ниже приведены примеры различных других белков, участвующих в регуляции передачи сигнала, на активность которых также влияет ацетилирование и деацетилирование.
стр.53
[ редактировать ]Белок p53 является супрессором опухолей , который играет важную роль в передаче сигналов в клетках, особенно в поддержании стабильности генома путем предотвращения мутаций. Поэтому он также известен как «хранитель генома». Он также регулирует клеточный цикл и останавливает рост клеток, активируя регулятор клеточного цикла p21 . При серьезном повреждении ДНК он также инициирует запрограммированную гибель клеток . Функция p53 . отрицательно регулируется онкопротеином Mdm2 . Исследования показали, что Mdm2 образует комплекс с p53 и предотвращает его связывание со специфическими генами, чувствительными к p53 [ 38 ] [ 39 ]
Ацетилирование p53
[ редактировать ]
Ацетилирование р53 необходимо для его активации. Сообщалось, что уровень ацетилирования р53 значительно возрастает, когда клетка подвергается стрессу. Сайты ацетилирования наблюдались на ДНК-связывающем домене (K164 и K120) и на С-конце. [ 40 ] Сайты ацетилирования демонстрируют значительную избыточность: если только один сайт ацетилирования инактивируется мутацией на аргинин, экспрессия p21 все еще наблюдается. Однако если блокируются несколько сайтов ацетилирования, экспрессия р21 и подавление роста клеток, вызванное р53, полностью теряются. Кроме того, ацетилирование р53 предотвращает его связывание с репрессором Mdm2 на ДНК. [ 41 ] Кроме того, предполагается, что ацетилирование р53 имеет решающее значение для его независимых от транскрипции проапоптотических функций. [ 42 ] Сайт ацетилирования С-конца был исследован с помощью молекулярно-динамического моделирования и спектроскопии кругового дихроизма , и было высказано предположение, что ацетилирование изменяет структурный ансамбль С-конца. [ 43 ]
Последствия для терапии рака
[ редактировать ]Поскольку основной функцией р53 является подавление опухолей , идея о том, что активация р53 является привлекательной стратегией лечения рака. Нутлин-3 [ 44 ] представляет собой небольшую молекулу, предназначенную для воздействия на p53 и Mdm2 взаимодействие p53 . , которое предотвращает дезактивацию [ 45 ] Отчеты также показали, что в раковых клетках, подвергшихся лечению Нутилином-3а, ацетилирование lys 382 наблюдалось на c-конце p53. [ 46 ] [ 47 ]
Микротрубочка
[ редактировать ]
Структура микротрубочек представляет собой длинный полый цилиндр, динамически собранный из димеров α/β- тубулина . Они играют существенную роль в поддержании структуры клетки, а также клеточных процессов, например, движения органелл . [ 48 ] Кроме того, микротрубочки ответственны за формирование митотического веретена в эукариотических клетках для транспортировки хромосом при делении клеток . [ 49 ] [ 50 ]
Ацетилирование тубулина
[ редактировать ]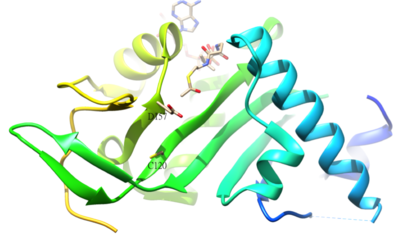
Ацетилированный остаток α- тубулина представляет собой K40, который у человека катализируется ацетилтрансферазой α-тубулина (α-ТАТ). Ацетилирование K40 на α-тубулине является признаком стабильных микротрубочек . Остатки активного центра D157 и C120 α-TAT1 ответственны за катализ из-за формы, комплементарной α-тубулину. Кроме того, некоторые уникальные структурные особенности, такие как шпилька β4-β5 , C-концевая петля и области петли α1-α2, важны для специфического молекулярного распознавания α-тубулина . [ 51 ] Обратная реакция ацетилирования катализируется деацетилазой гистонов 6. [ 52 ]
Последствия для терапии рака
[ редактировать ]Поскольку микротрубочки играют важную роль в делении клеток , особенно в фазе G2/M клеточного цикла , были предприняты попытки препятствовать функции микротрубочек с помощью низкомолекулярных ингибиторов, которые успешно используются в клиниках в качестве лечения рака. [ 53 ] Например, барвинка алкалоиды и таксаны избирательно связывают и ингибируют микротрубочки , что приводит к остановке клеточного цикла. [ 54 ] Идентификация кристаллической структуры ацетилирования α-тубулинацетилтрансферазы (α-ТАТ) также проливает свет на открытие небольшой молекулы, которая может модулировать стабильность или деполимеризацию тубулина . Другими словами, нацеливаясь на α-ТАТ, можно предотвратить ацетилирование тубулина и привести к дестабилизации тубулина, что является аналогичным механизмом для агентов, дестабилизирующих тубулин. [ 51 ]
СТАТ3
[ редактировать ]Преобразователь сигнала и активатор транскрипции 3 ( STAT3 ) представляет собой фактор транскрипции, который фосфорилируется рецептор-ассоциированными киназами , например, тирозинкиназами семейства Janus , и перемещается в ядро . STAT3 регулирует несколько генов в ответ на факторы роста и цитокины и играет важную роль в росте клеток. Таким образом, STAT3 способствует онкогенезу в различных путях, связанных с ростом клеток. С другой стороны, он также играет роль супрессора опухолей . [ 55 ]
Ацетилирование STAT3
[ редактировать ]
Ацетилирование Lys685 STAT3 важно для STAT3 гомодимеризации , которая необходима для связывания ДНК и активации транскрипции онкогенов . Ацетилирование STAT3 катализируется гистон-ацетилтрансферазой p300 и обращается вспять гистон-деацетилазой 1 типа . Ацетилирование лизина STAT3 также повышено в раковых клетках. [ 56 ]
Терапевтическое значение терапии рака
[ редактировать ]Поскольку ацетилирование STAT3 важно из-за его онкогенной активности, а также того факта, что уровень ацетилированного STAT3 высок в раковых клетках, предполагается, что нацеливание на ацетилированный STAT3 для химиопрофилактики и химиотерапии является многообещающей стратегией. Эта стратегия подтверждается лечением ресвератрола , ингибитора ацетилирования STAT3, в линии раковых клеток, обращающего вспять аберрантное метилирование CpG-островков. [ 57 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Чоудхари С., Кумар С., Гнад Ф., Нильсен М.Л., Рехман М., Вальтер Т.К., Олсен Дж.В., Манн М. (2009). «Ацетилирование лизина нацелено на белковые комплексы и совместно регулирует основные клеточные функции» . Наука . 325 (5942): 834–840. Бибкод : 2009Sci...325..834C . дои : 10.1126/science.1175371 . ПМИД 19608861 . S2CID 206520776 .
- ^ Фриц К.С., Галлиган Дж.Дж., Хирши М.Д., Вердин Э., Петерсен Д.Р. (2012). «Анализ митохондриального ацетилома на мышиной модели вызванного алкоголем повреждения печени с использованием мышей, нокаутных по SIRT3» . J. Протеом Рез . 11 (3): 1633–1643. дои : 10.1021/pr2008384 . ПМЦ 3324946 . ПМИД 22309199 .
- ^ Брук Т. «Ацетилирование белка: гораздо больше, чем ацетилирование гистонов» . Кайман Кемикал. Архивировано из оригинала 28 февраля 2014 г.
- ^ Чжао С, Сюй В, Цзян В, Юй В, Линь Ю, Чжан Т, Яо Дж, Чжоу Л, Цзэн Ю, Ли Х, Ли Ю, Ши Дж, Ан В, Хэнкок С.М., Хэ Ф, Цинь Л, Чин Дж , Ян П., Чен X, Лэй Ц, Сюн Ю, Гуань К.Л. (2010). «Регуляция клеточного метаболизма путем ацетилирования белка лизина» . Наука . 327 (5968): 1000–1004. Бибкод : 2010Sci...327.1000Z . дои : 10.1126/science.1179689 . ПМЦ 3232675 . ПМИД 20167786 .
- ^ Ван Ц, Чжан Ю, Ян С, Сюн Х, Линь Ю, Яо Дж и др. (февраль 2010 г.). «Ацетилирование метаболических ферментов координирует использование источника углерода и метаболический поток» . Наука . 327 (5968): 1004–7. Бибкод : 2010Sci...327.1004W . дои : 10.1126/science.1179687 . ПМК 4183141 . ПМИД 20167787 .
- ^ Перейти обратно: а б Ван Дамм П., Хоул К., Пимента-Маркес А., Хелсенс К., Вандекеркхове Дж., Мартиньо Р.Г., Геверт К., Арнесен Т. (2011). «NatF способствует эволюционному сдвигу в N-концевом ацетилировании белка и важен для нормальной сегрегации хромосом» . ПЛОС Генет . 7 (7): e1002169. дои : 10.1371/journal.pgen.1002169 . ПМК 3131286 . ПМИД 21750686 .
- ^ Стархейм К.К., Геверт К., Арнесен Т. (2012). «Белковые N-концевые ацетилтрансферазы: когда начало имеет значение». Тенденции биохимии. Наука . 37 (4): 152–161. дои : 10.1016/j.tibs.2012.02.003 . ПМИД 22405572 .
- ^ Лищак Г., Гольдберг Дж.М., Фойн Х., Петерссон Э.Дж., Арнесен Т., Марморштейн Р. (2013). «Молекулярные основы N-концевого ацетилирования гетеродимерным комплексом NatA» . Нат. Структура. Мол. Биол . 20 (9): 1098–105. дои : 10.1038/nsmb.2636 . ПМЦ 3766382 . ПМИД 23912279 .
- ^ Стархейм К.К., Громыко Д., Вельде Р., Вархауг Дж.Э., Арнесен Т. (2009). «Состав и биологическое значение нальфа-концевых ацетилтрансфераз человека» . Дело БМК . 3 (Дополнение 6): S3. дои : 10.1186/1753-6561-3-s6-s3 . ПМК 2722096 . ПМИД 19660096 .
- ^ Арнесен Т., Ван Дамм П., Полевода Б., Хелсенс К., Эвьент Р., Колерт Н., Вархауг Дж. Э., Вандекеркхове Дж., Лиллехауг Дж. Р., Шерман Ф., Геварт К. (2009). «Протеомный анализ показывает эволюционную консервативность и расхождение N-концевых ацетилтрансфераз дрожжей и человека» . Учеб. Натл. акад. наук. США . 106 (20): 8157–8162. Бибкод : 2009PNAS..106.8157A . дои : 10.1073/pnas.0901931106 . ПМЦ 2688859 . ПМИД 19420222 .
- ^ Арнесен Т., Стархейм К.К., Ван Дамм П., Эвьент Р., Динь Х., Беттс М.Дж., Райнинген А., Вандекеркхове Дж., Геварт К., Андерсон Д. (2010). «Шапероноподобный белок HYPK действует вместе с NatA в котрансляционном N-концевом ацетилировании и предотвращении агрегации хантингтина» . Мол. Клетка. Биол . 30 (8): 1898–1909. дои : 10.1128/mcb.01199-09 . ПМЦ 2849469 . ПМИД 20154145 .
- ^ Хоул К., Ван Дамм П., Далва М., Акснес Х., Гломнес Н., Вархауг Дж.Э., Лиллехауг Дж.Р., Геварт К., Арнесен Т. (2011). «Человеческая N-альфа-ацетилтрансфераза 40 (hNaa40p/hNatD) консервативна из дрожжей и ацетилирует по N-концу гистоны H2A и H4» . ПЛОС ОДИН . 6 (9): e24713. Бибкод : 2011PLoSO...624713H . дои : 10.1371/journal.pone.0024713 . ПМК 3174195 . ПМИД 21935442 .
- ^ Гаучи М., Джаст С., Мун А., Росс С., Рюкнагель П., Дубаки И. и др. (октябрь 2003 г.). «Дрожжевая N(альфа)-ацетилтрансфераза NatA количественно закрепляется на рибосоме и взаимодействует с возникающими полипептидами» . Молекулярная и клеточная биология . 23 (20): 7403–14. дои : 10.1128/mcb.23.20.7403-7414.2003 . ПМК 230319 . ПМИД 14517307 .
- ^ Хартман С. (август 2020 г.). «Значение цели: N-концевая ацетилтрансфераза NAA50 контролирует рост растений и реакцию на стресс» . Физиология растений . 183 (4): 1410–1411. дои : 10.1104/стр.20.00794 . ПМК 7401126 . ПМИД 32747486 .
- ^ Армбрустер Л., Линстер Э., Бойер Дж.Б., Брюнье А., Эйрих Дж., Стефан I и др. (август 2020 г.). «NAA50 представляет собой ферментативно активный N а -Ацетилтрансфераза, имеющая решающее значение для развития и регуляции стрессовых реакций» . Физиология растений . 183 (4): 1502–1516. : 10.1104 /pp.20.00222 . PMC 7401105. . PMID 32461302 doi
- ^ Нойбауэр М., Иннес Р.В. (август 2020 г.). «Потеря ацетилтрансферазы NAA50 вызывает стресс эндоплазматической сети и иммунные реакции и подавляет рост» . Физиология растений . 183 (4): 1838–1854. дои : 10.1104/стр.20.00225 . ПМК 7401112 . ПМИД 32457093 .
- ^ Фэн Дж, Ху Дж, Ли Ю, Ли Р, Ю Х, Ма Л (сентябрь 2020 г.). «N-концевая ацетилтрансфераза Naa50 регулирует рост арабидопсиса и реакцию на осмотический стресс». Физиология растений и клеток . 61 (9): 1565–1575. дои : 10.1093/pcp/pcaa081 . ПМИД 32544241 .
- ^ Ван Дамм П., Хоул К., Пимента-Маркес А., Хелсенс К., Вандекеркхове Дж., Мартиньо Р.Г. и др. (июль 2011 г.). «NatF способствует эволюционному сдвигу в N-концевом ацетилировании белка и важен для нормальной сегрегации хромосом» . ПЛОС Генетика . 7 (7): e1002169. дои : 10.1371/journal.pgen.1002169 . ПМК 3131286 . ПМИД 21750686 .
- ^ Ратор О.С., Фаустино А., Пруденсио П., Ван Дамм П., Кокс С.Дж., Мартиньо Р.Г. (февраль 2016 г.). «Отсутствие диверсификации N-концевой ацетилтрансферазы в ходе эволюции эукариотических организмов» . Научные отчеты . 6 : 21304. Бибкод : 2016NatSR...621304R . дои : 10.1038/srep21304 . ПМЦ 4748286 . ПМИД 26861501 .
- ^ Акснес Х., Ван Дамм П., Горис М., Стархейм К.К., Мари М., Стёве С.И. и др. (март 2015 г.). «Органелларная nα-ацетилтрансфераза, naa60, ацетилирует цитозольные N-концы трансмембранных белков и поддерживает целостность аппарата Гольджи» . Отчеты по ячейкам . 10 (8): 1362–74. дои : 10.1016/j.celrep.2015.01.053 . HDL : 1956/10959 . ПМИД 25732826 .
- ^ Акснес Х., Горис М., Стрёмланд О., Дразич А., Вахид К., Рейтер Н., Арнесен Т. (апрель 2017 г.). «Молекулярные детерминанты N-концевой ацетилтрансферазы Naa60, закрепляющейся на мембране Гольджи» . Журнал биологической химии . 292 (16): 6821–6837. дои : 10.1074/jbc.M116.770362 . ПМК 5399128 . ПМИД 28196861 .
- ^ Дражич А., Акснес Х., Мари М., Бочковска М., Варланд С., Тиммерман Е., Фойн Х., Гломнес Н., Ребовски Г., Импенс Ф., Геварт К., Домингес Р. и Арнесен Т. (2018). «NAA80 представляет собой N-концевую ацетилтрансферазу актина и регулирует сборку цитоскелета и подвижность клеток» . Proc Natl Acad Sci США . 115 (17): 4399–4404. дои : 10.1073/pnas.1718336115 . ПМЦ 5924898 . ПМИД 29581253 .
- ^ Холлебек Дж., Ван Дамм П., Геварт К. (2012). «N-концевое ацетилирование и другие функции Nα-ацетилтрансфераз». Биол. Хим . 393 (4): 291–8. дои : 10.1515/hsz-2011-0228 . ПМИД 22718636 . S2CID 40566358 .
- ^ Гершко А, Хеллер Х, Эйтан Э, Каклий Г, Роуз ИА (1984). «Роль альфа-аминогруппы белка в убиквитин-опосредованном распаде белка» . Учеб. Натл. акад. наук. США . 81 (22): 7021–5. Бибкод : 1984PNAS...81.7021H . дои : 10.1073/pnas.81.22.7021 . ПМК 392068 . ПМИД 6095265 .
- ^ Хван К.С., Шеморри А., Варшавский А. (2010). «N-концевое ацетилирование клеточных белков создает специфические сигналы деградации» . Наука . 327 (5968): 973–977. Бибкод : 2010Sci...327..973H . дои : 10.1126/science.1183147 . ПМЦ 4259118 . ПМИД 20110468 .
- ^ Бениа Р., Паник Б., Уайт-младший, Манро С. (2004). «Нацеливание Arf-подобной ГТФазы Arl3p на аппарат Гольджи требует N-концевого ацетилирования и мембранного белка Sys1p». Нат. Клеточная Биол . 6 (5): 405–413. дои : 10.1038/ncb1120 . ПМИД 15077113 . S2CID 22954283 .
- ^ Стархейм К.К., Громыко Д., Эвьент Р., Рюнинген А., Вархауг Дж.Э., Лиллехауг Дж.Р., Арнесен Т. (2009). «Нокдаун комплекса C человеческой N-альфа-концевой ацетилтрансферазы приводит к p53-зависимому апоптозу и аберрантной локализации человеческого Arl8b» . Мол. Клетка. Биол . 29 (13): 3569–3581. дои : 10.1128/mcb.01909-08 . ПМЦ 2698767 . ПМИД 19398576 .
- ^ Громыко Д., Арнесен Т., Рюнинген А., Вархауг Дж.Э., Лиллехауг Дж.Р. (2010). «Истощение Nα-концевой ацетилтрансферазы А человека вызывает p53-зависимый апоптоз и p53-независимое ингибирование роста» . Межд. Дж. Рак . 127 (12): 2777–2789. дои : 10.1002/ijc.25275 . ПМИД 21351257 .
- ^ Йи CH, Пан Х., Сибахер Дж., Джанг И.Х., Хайбертс С.Г., Хеффрон Г.Дж., Вандер Хайден М.Г., Ян Р., Ли Ф., Локасейл Дж.В., Шарфи Х., Чжай Б., Родригес-Миас Р., Луитхардт Х., Кэнтли Л.С., Дейли Г.К. , Асара Дж.М., Гиги С.П., Вагнер Г., Лю К.Ф., Юань Дж. (2011). «Метаболическая регуляция N-альфа-ацетилирования белка с помощью Bcl-xL способствует выживанию клеток» . Клетка . 146 (4): 607–620. дои : 10.1016/j.cell.2011.06.050 . ПМК 3182480 . ПМИД 21854985 .
- ^ Камита М., Кимура Ю., Ино Ю., Камп Р.М., Полевода Б., Шерман Ф., Хирано Х. (2011). «N (α)-ацетилирование рибосомальных белков дрожжей и его влияние на синтез белка». J Протеомика . 74 (4): 431–441. дои : 10.1016/j.jprot.2010.12.007 . ПМИД 21184851 .
- ^ Ю М, Гонг Дж, Ма М, Ян Х, Лай Дж, Ву Х, Ли Л, Ли Л, Тан Д (2009). «Иммуногистохимический анализ человеческого ареста-дефекта-1, выраженного при раке in vivo» . Онкол. Представитель . 21 (4): 909–15. дои : 10.3892/or_00000303 . ПМИД 19287988 .
- ^ Калвик ТВ, Арнесен Т (2013). «Белковые N-концевые ацетилтрансферазы при раке» . Онкоген . 32 (3): 269–276. дои : 10.1038/onc.2012.82 . ПМИД 22391571 .
- ^ Садул К., Бойо С., Пабион М., Хохбин С. (2008). «Регуляция белкового обмена ацетилтрансферазами и деацетилазами». Биохимия . 90 (2): 306–12. дои : 10.1016/j.biochi.2007.06.009 . ПМИД 17681659 .
- ^ Глозак М.А., Сенгупта Н., Чжан Х, Сето Э (2005). «Ацетилирование и деацетилирование негистоновых белков». Джин . 363 : 15–23. дои : 10.1016/j.gene.2005.09.010 . ПМИД 16289629 .
- ^ Ян XJ, Сето Э (2008). «Ацетилирование лизина: кодифицированные перекрестные помехи с другими посттрансляционными модификациями» . Мол. Клетка . 31 (4): 449–61. doi : 10.1016/j.molcel.2008.07.002 . ПМЦ 2551738 . ПМИД 18722172 .
- ^ Эдде Б., Денуле П., де Нешо Б., Кулаков А., Бервальд-Неттер Ю., Грос Ф. (1989). «Посттрансляционные модификации тубулина в культивируемых нейронах головного мозга и астроглии мышей». Биол. Клетка . 65 (2): 109–117. дои : 10.1016/0248-4900(89)90018-x . ПМИД 2736326 .
- ^ Марута Х., Грир К., Розенбаум Дж.Л. (1986). «Ацетилирование альфа-тубулина и его связь со сборкой и разборкой микротрубочек» . Дж. Клеточная Биол . 103 (2): 571–579. дои : 10.1083/jcb.103.2.571 . ПМК 2113826 . ПМИД 3733880 .
- ^ Альбертс Б. (март 2002 г.). Молекулярная биология клетки . Гирляндная наука. ISBN 0815332181 .
- ^ Вайнберг Р.А. (2013). Биология рака (2-е изд.). [Sl]: Наука о гирляндах. ISBN 978-0815342205 .
- ^ Брукс CL, Гу В (2011). «Влияние ацетилирования и деацетилирования на путь р53» . Белковая клетка . 2 (6): 456–462. дои : 10.1007/s13238-011-1063-9 . ПМК 3690542 . ПМИД 21748595 .
- ^ Тан Ю, Чжао В, Чэнь Ю, Чжао Ю, Гу В (2008). «Ацетилирование необходимо для активации р53» . Клетка . 133 (4): 612–626. дои : 10.1016/j.cell.2008.03.025 . ПМЦ 2914560 . ПМИД 18485870 .
- ^ Ямагути Х., Вудс Н.Т., Пилузо Л.Г., Ли Х.Х., Чен Дж., Бхалла К.Н., Монтейро А., Лю Икс, Хунг М.К., Ван Х.Г. (2009). «Ацетилирование p53 имеет решающее значение для его независимых от транскрипции проапоптотических функций» . Ж. Биол. Хим . 284 (17): 11171–11183. дои : 10.1074/jbc.M809268200 . ПМК 2670122 . ПМИД 19265193 .
- ^ Иида С., Машимо Т., Куросава Т., Ходзё Х., Мута Х., Гото Ю. и др. (декабрь 2016 г.). «Изменение ландшафта свободной энергии С-концевого домена p53, индуцированное ацетилированием: расширенная конформационная выборка» . Журнал вычислительной химии . 37 (31): 2687–2700. дои : 10.1002/jcc.24494 . ПМЦ 5242334 . ПМИД 27735058 .
- ^ Василев Л.Т., Ву Б.Т., Грейвс Б., Карвахал Д., Подласки Ф., Филипович З., Конг Н., Каммлотт У., Лукач С., Кляйн С., Фотоухи Н., Лю Э.А. (2004). «In vivo активация пути p53 низкомолекулярными антагонистами MDM2». Наука . 303 (5659): 844–848. Бибкод : 2004Sci...303..844V . дои : 10.1126/science.1092472 . ПМИД 14704432 . S2CID 16132757 .
- ^ Шангари С., Ван С. (2009). «Низкомолекулярные ингибиторы белок-белкового взаимодействия MDM2-p53 для реактивации функции p53: новый подход к терапии рака» . Анну. Преподобный Фармакол. Токсикол . 49 (1): 223–241. doi : 10.1146/annurev.pharmtox.48.113006.094723 . ПМЦ 2676449 . ПМИД 18834305 .
- ^ Зайкович А, Кшесняк М, Матушчик И, Гловала-Косиньска М, Буткевич Д, Русин М (2013). «Нутлин-3а, антагонист MDM2 и активатор р53, помогает сохранить репликативный потенциал раковых клеток, обработанных генотоксичной дозой ресвератрола» . Мол. Биол. Представитель . 40 (8): 5013–5026. дои : 10.1007/s11033-013-2602-7 . ПМЦ 3723979 . ПМИД 23666059 .
- ^ Кумамото К., Спилларе Э.А., Фудзита К., Хорикава И., Ямасита Т., Аппелла Е., Нагасима М., Такэношита С., Ёкота Дж., Харрис CC (2008). «Нутлин-3а активирует р53, подавляя экспрессию ингибитора роста 2 и повышая экспрессию mir-34a, mir-34b и mir-34c, а также вызывая старение» . Рак Рез . 68 (9): 3193–3203. дои : 10.1158/0008-5472.CAN-07-2780 . ПМК 2440635 . ПМИД 18451145 .
- ^ Крейс Т., Вейл Р., ред. (1999). Путеводитель по цитоскелетным и моторным белкам (2-е изд.). Оксфорд [ua]: Oxford Univ. Нажимать. ISBN 0198599560 .
- ^ Лодиш Х (2013). Молекулярно-клеточная биология (7-е изд.). WH Freeman and Co. Нью-Йорк: ISBN 978-1429234139 .
- ^ Фойо Т., изд. (2008). Роль микротрубочек в клеточной биологии, нейробиологии и онкологии (под ред. [Online-Ausg.]). Тотова, Нью-Джерси: Humana Press. ISBN 978-1588292940 .
- ^ Перейти обратно: а б Фридманн Д.Р., Агилар А., Фан Дж., Начури М.В., Марморштейн Р. (2012). «Структура α-тубулинацетилтрансферазы, αTAT1, и значение тубулин-специфического ацетилирования» . Учеб. Натл. акад. наук. США . 109 (48): 19655–19660. Бибкод : 2012PNAS..10919655F . дои : 10.1073/pnas.1209357109 . ПМЦ 3511727 . ПМИД 23071314 .
- ^ Хабберт С, Гвардиола А, Шао Р, Кавагути Ю, Ито А, Никсон А, Ёсида М, Ван XF, Яо ТП (2002). «HDAC6 представляет собой деацетилазу, связанную с микротрубочками». Природа . 417 (6887): 455–458. Бибкод : 2002Natur.417..455H . дои : 10.1038/417455a . ПМИД 12024216 . S2CID 4373254 .
- ^ Тереза Карломаньо, изд. (2009). Агенты, связывающие тубулин: синтетические, структурные и механистические идеи . вклад К.-Х. Альтманн. Берлин: Шпрингер. ISBN 978-3540690368 .
- ^ Зито Т.Л., Лемке Т.Л., Уильямс Д.А., Рош В.Г., Уильям С., ред. (2013). Принципы медицинской химии Фоя (7-е изд.). Филадельфия: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 978-1609133450 .
- ^ Мюллер-Декер FM, Клингмюллер Великобритания (2009). Обработка клеточных сигналов: введение в молекулярные механизмы передачи сигналов . Нью-Йорк: Garland Science. ISBN 978-0815342151 .
- ^ Юань З.Л., Гуань Ю.Дж., Чаттерджи Д., Чин Й.Е. (2005). «Димеризация Stat3, регулируемая обратимым ацетилированием одного остатка лизина». Наука . 307 (5707): 269–273. Бибкод : 2005Sci...307..269Y . дои : 10.1126/science.1105166 . ПМИД 15653507 . S2CID 25269192 .
- ^ Ли Х, Чжан П., Херрманн А., Ян С., Синь Х., Ван З., Хун Д.С., Форман С.Дж., Джов Р., Риггс А.Д., Ю Х (2012). «Ацетилированный STAT3 имеет решающее значение для метилирования промоторов генов-супрессоров опухолей, а ингибирование ресвератролом приводит к деметилированию» . Учеб. Натл. акад. наук. США . 109 (20): 7765–7769. Бибкод : 2012PNAS..109.7765L . дои : 10.1073/pnas.1205132109 . ПМК 3356652 . ПМИД 22547799 .