Глюкозо-6-фосфатдегидрогеназа
| Глюкозо-6-фосфатдегидрогеназа, НАД-связывающий домен | |||
|---|---|---|---|
 глюкозо-6-фосфатдегидрогеназа Leuconostoc mesenteroides | |||
| Идентификаторы | |||
| Символ | G6PD_N | ||
| Пфам | PF00479 | ||
| Пфам Клан | CL0063 | ||
| ИнтерПро | ИПР022674 | ||
| PROSITE | PDOC00067 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1дпг / СКОПе / СУПФАМ | ||
| |||
| Глюкозо-6-фосфатдегидрогеназа | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 1.1.1.49 | ||
| Номер CAS. | 9001-40-5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Глюкозо-6-фосфатдегидрогеназа ( G6PD или G6PDH ) ( EC 1.1.1.49 ) представляет собой цитозольный фермент химическую , катализирующий реакцию .
- D -глюкозо-6-фосфат + НАДФ + + H 2 O ⇌ 6-фосфо- D -глюконо-1,5-лактон + НАДФН + Н +
Этот фермент участвует в пентозофосфатном пути (см. изображение), метаболическом пути , который поставляет восстанавливающую энергию клеткам (таким как эритроциты ) путем поддержания уровня восстановленной формы кофермента никотинамидадениндинуклеотидфосфата ( НАДФН). НАДФН, в свою очередь, поддерживает уровень глутатиона в этих клетках, что помогает защитить эритроциты от окислительного повреждения такими соединениями, как перекись водорода . [ 1 ] Большую количественную значимость имеет продукция НАДФН для тканей, участвующих в биосинтезе жирных кислот или изопреноидов , таких как печень, молочные железы , жировая ткань , надпочечники . G6PD снижает НАДФ + до НАДФН при окислении глюкозо-6-фосфата . [ 2 ] Глюкозо-6-фосфатдегидрогеназа также является ферментом пути Энтнера-Дудорова , типа гликолиза.
Клинически Х-сцепленный генетический дефицит G6PD делает человека склонным к неиммунной гемолитической анемии . [ 3 ]
Распространение видов
[ редактировать ]G6PD широко распространен у многих видов, от бактерий до человека . Множественное выравнивание последовательностей более 100 известных G6PD из разных организмов обнаруживает идентичность последовательностей в диапазоне от 30% до 94%. [ 4 ] Человеческий G6PD имеет более чем 30% идентичности аминокислотной последовательности с последовательностями G6PD других видов. [ 5 ] У людей также есть две изоформы одного гена, кодирующего G6PD. [ 6 ] Более того, обнаружено как минимум 168 болезнетворных мутаций в этом гене. [ 7 ] Эти мутации в основном представляют собой миссенс-мутации, которые приводят к заменам аминокислот. [ 8 ] и хотя некоторые из них приводят к дефициту G6PD, другие, похоже, не приводят к каким-либо заметным функциональным различиям. [ 8 ] Некоторые ученые предположили, что некоторые генетические вариации человеческого G6PD являются результатом адаптации поколений к малярийной инфекции. [ 9 ]
У других видов также наблюдаются вариации G6PD. У высших растений о нескольких изоформах сообщалось G6PDH, которые локализуются в цитозоле , пластидной строме и пероксисомах . [ 10 ] Модифицированный F 420 -зависимый (в отличие от НАДФ + -зависимый) G6PD обнаружен в микобактериях туберкулеза и представляет интерес для лечения туберкулеза . [ 11 ] Было показано, что бактериальный G6PD, обнаруженный у Leuconostoc mesenteroides , в дополнение к G6P реагирует с 4-гидроксиноненалем . [ 12 ]
Структура фермента
[ редактировать ]
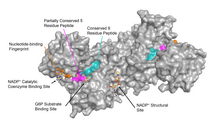
G6PD обычно встречается в виде димера двух идентичных мономеров (см. главное изображение). [ 8 ] В зависимости от условий, таких как pH , эти димеры сами могут димеризоваться с образованием тетрамеров . [ 5 ] Каждый мономер в комплексе имеет сайт связывания субстрата , который связывается с G6P, и сайт связывания каталитического кофермента, который связывается с НАДФ. + /НАДФН с использованием складки Россмана . [ 4 ] У некоторых высших организмов, например человека, G6PD содержит дополнительный НАДФ. + сайт связывания, называемый НАДФ + структурный участок, который, по-видимому, не участвует непосредственно в реакции, катализируемой G6PD. Эволюционная цель НАДП + Структурный сайт неизвестен. [ 4 ] Что касается размера, то длина каждого мономера составляет примерно 500 аминокислот (для человека 514 аминокислот). [ 5 ] ).
Функциональная и структурная консервативность между G6PD человека и G6PD Leuconostoc mesenteroides указывает на 3 широко консервативных участка фермента: пептид из 9 остатков в сайте связывания субстрата, RIDHYLGKE (остатки 198-206 на G6PD человека), нуклеотидсвязывающий отпечаток пальца, GxxGDLA ( остатки 38–44 на G6PD человека) и частично консервативную последовательность EKPxG рядом с сайтом связывания субстрата (остатки 170–174 на G6PD человека), где мы использовали «x» для обозначения вариабельной аминокислоты. [ 4 ] Кристаллическая структура G6PD обнаруживает обширную сеть электростатических взаимодействий и водородных связей, включающую G6P, 3 молекулы воды, 3 лизина , 1 аргинин , 2 гистидина , 2 глутаминовые кислоты и другие полярные аминокислоты.
в Считается, что пролин положении 172 играет решающую роль в правильном позиционировании Lys171 относительно субстрата G6P. В двух кристаллических структурах нормального человеческого G6P Pro172 наблюдается исключительно в цис-конформации , тогда как в кристаллической структуре одного мутанта, вызывающего заболевание (вариант Canton R459L), Pro172 наблюдается почти исключительно в транс-конформации. [ 4 ]
Имея доступ к кристаллическим структурам, некоторые учёные попытались смоделировать структуры других мутантов. Например, у представителей немецкого происхождения, где энзимопатия из-за дефицита G6PD встречается редко, было показано, что сайты мутаций G6PD лежат рядом с НАДФ. + сайт связывания, сайт связывания G6P и вблизи границы раздела между двумя мономерами. Таким образом, мутации в этих критических областях возможны без полного нарушения функции G6PD. [ 8 ] Фактически было показано, что большинство мутаций G6PD, вызывающих заболевания, происходят вблизи НАДФ. + Структурный сайт. [ 13 ]
НАДП + структурный участок
[ редактировать ]НАДП + структурный сайт расположен на расстоянии более 20 Å от сайта связывания субстрата и каталитического кофермента НАДФ. + сайт связывания. Его назначение в реакциях, катализируемых ферментами, в течение многих лет было неясно. Некоторое время считалось, что НАДФ + связывание со структурным участком было необходимо для димеризации мономеров фермента. Однако было показано, что это неверно. [ 13 ] С другой стороны, было показано, что наличие НАДФ + в структурном участке способствует димеризации димеров с образованием тетрамеров фермента. [ 13 ] Также считалось, что состояние тетрамера необходимо для каталитической активности; однако и это оказалось ложью. [ 13 ] НАДП + Структурный участок сильно отличается от НАДП. + сайт связывания каталитического кофермента и содержит нуклеотидсвязывающий отпечаток пальца.
Структурный сайт, связанный с НАДФ. + обладает благоприятными взаимодействиями, которые удерживают его прочно связанным. В частности, существует прочная сеть водородных связей, в которой электростатические заряды распространяются по множеству атомов посредством водородных связей с 4 молекулами воды (см. рисунок). Более того, существует чрезвычайно сильный набор гидрофобных стэкинг -взаимодействий, которые приводят к перекрытию π-систем.
Было показано, что структурный сайт важен для поддержания долгосрочной стабильности фермента. [ 13 ] Более 40 тяжелых мутаций класса I связаны с мутациями вблизи структурного участка, что влияет на долгосрочную стабильность этих ферментов в организме, что в конечном итоге приводит к дефициту G6PD. [ 13 ] Например, две тяжелые мутации класса I, G488S и G488V, резко увеличивают константу диссоциации НАДФ. + и структурный сайт - в 7-13 раз. Учитывая близость остатка 488 к Arg487, считается, что мутация в положении 488 может повлиять на положение Arg487 относительно НАДФ. + , [ 13 ] и тем самым нарушить связывание.
Регулирование
[ редактировать ]G6PD превращает G6P в 6-фосфоглюконо-δ-лактон и является лимитирующим скорость ферментом, пентозофосфатного пути . Таким образом, регуляция G6PD имеет последующие последствия для активности остальной части пентозофосфатного пути .
Глюкозо-6-фосфатдегидрогеназа стимулируется ее субстратом G6P. Обычное соотношение НАДФН/НАДФ + в цитозоле тканей, участвующих в биосинтезе, составляет около 100/1. Повышенное использование НАДФН для биосинтеза жирных кислот резко повысит уровень НАДФ. + , тем самым стимулируя G6PD производить больше НАДФН. Согласно двум старым публикациям, дрожжевой G6PD ингибируется длинноцепочечными жирными кислотами. [ 14 ] [ 15 ] и это может быть ингибирование продуктов синтеза жирных кислот, для которого требуется НАДФН.
G6PD отрицательно регулируется путем ацетилирования лизина 403 (Lys403), эволюционно консервативного остатка. Ацетилированный K403 G6PD не способен образовывать активные димеры и полностью утрачивает активность. Механистически ацетилирование Lys403 стерически препятствует НАДФ. + от вступления в НАДП + структурный участок, что снижает стабильность фермента. Клетки воспринимают внеклеточные окислительные стимулы для снижения ацетилирования G6PD SIRT2 -зависимым образом. SIRT2-опосредованное деацетилирование и активация G6PD стимулирует пентозофосфатный путь для снабжения цитозольного НАДФН для противодействия окислительному повреждению и защиты эритроцитов мыши . [ 16 ]
Регулирование также может происходить посредством генетических путей. Изоформа G6PDH регулируется факторами транскрипции и посттранскрипции. [ 17 ] Более того, G6PD является одним из ряда гликолитических ферментов, активируемых транскрипционным фактором 1, индуцируемым гипоксией (HIF1). [ 18 ]
Клиническое значение
[ редактировать ]G6PD отличается своим генетическим разнообразием. Многие варианты G6PD, в основном образующиеся в результате миссенс-мутаций , были описаны с широким диапазоном уровней активности фермента и связанных с ними клинических симптомов . два варианта транскрипта, кодирующие разные изоформы . Для этого гена обнаружено [ 19 ]
Дефицит глюкозо-6-фосфатдегидрогеназы очень распространен во всем мире и вызывает острую гемолитическую анемию при простой инфекции, употреблении в пищу бобов или реакции на некоторые лекарства, антибиотики, жаропонижающие и противомалярийные средства. [ 3 ]
G6PD влияет на рост и пролиферацию клеток. [ 20 ] Было показано, что фармакологическое удаление G6PD преодолевает перекрестную толерантность клеток рака молочной железы к антрациклинам. [ 21 ] Ингибиторы G6PD исследуются для лечения рака и других заболеваний. [ 18 ] Анализ пролиферации клеток in vitro показывает, что ингибиторы G6PD, DHEA (дегидроэпиандростерон) и ANAD (6-аминоникотинамид), эффективно снижают рост клеточных линий ОМЛ. [ 20 ] [ 22 ] G6PD гипометилирован по K403 при остром миелолейкозе , SIRT2 активирует G6PD, увеличивая выработку НАДФН и способствуя пролиферации клеток лейкемии. [ 22 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Томас Д., Черест Х., Сурдин-Керджан Ю. (март 1991 г.). «Идентификация структурного гена глюкозо-6-фосфатдегидрогеназы у дрожжей. Инактивация приводит к потребности в органической сере» . Журнал ЭМБО . 10 (3): 547–53. дои : 10.1002/j.1460-2075.1991.tb07981.x . ПМК 452682 . ПМИД 2001672 .
- ^ Астер Дж., Кумар В., Роббинс С.Л., Аббас А.К., Фаусто Н., Котран Р.С. (2010). Роббинс и Котран Патологическая основа болезней . Сондерс/Эльзевир. стр. Адреса Kindle: 33340–33341. ISBN 978-1-4160-3121-5 .
- ^ Перейти обратно: а б Каппеллини, доктор медицинских наук, Фиорелли Дж. (январь 2008 г.). «Дефицит глюкозо-6-фосфатдегидрогеназы». Ланцет . 371 (9606): 64–74. дои : 10.1016/S0140-6736(08)60073-2 . ПМИД 18177777 . S2CID 29165746 .
- ^ Перейти обратно: а б с д и Котака М., Говер С., Вандепутте-Руттен Л., Ау С.В., Лам В.М., Адамс М.Дж. (май 2005 г.). «Структурные исследования связывания глюкозо-6-фосфата и НАДФ + с глюкозо-6-фосфатдегидрогеназой человека» (PDF) . Акта Кристаллографика Д. 61 (Часть 5): 495–504. дои : 10.1107/S0907444905002350 . ПМИД 15858258 .
- ^ Перейти обратно: а б с Ау С.В., Говер С., Лам В.М., Адамс М.Дж. (март 2000 г.). «Человеческая глюкозо-6-фосфатдегидрогеназа: кристаллическая структура обнаруживает структурную молекулу НАДФ (+) и дает представление о дефиците фермента» . Структура . 8 (3): 293–303. дои : 10.1016/S0969-2126(00)00104-0 . ПМИД 10745013 .
- ^ «G6PD глюкозо-6-фосфатдегидрогеназа [Homo sapiens (человек)]» . НКБИ . Проверено 13 декабря 2015 г.
- ^ Шимчикова Д., Хенеберг П. (декабрь 2019 г.). «Уточнение прогнозов эволюционной медицины на основе клинических данных о проявлениях менделевских болезней» . Научные отчеты . 9 (1): 18577. Бибкод : 2019NatSR...918577S . дои : 10.1038/s41598-019-54976-4 . ПМК 6901466 . ПМИД 31819097 .
- ^ Перейти обратно: а б с д Киани Ф, Шварцль С, Фишер С, Эфферт Т (июль 2007 г.). «Трехмерное моделирование вариантов с дефицитом глюкозо-6-фосфатдегидрогеназы немецкого происхождения» . ПЛОС ОДИН . 2 (7): е625. Бибкод : 2007PLoSO...2..625K . дои : 10.1371/journal.pone.0000625 . ПМЦ 1913203 . ПМИД 17637841 .
- ^ Луццато Л., Биенцле У (июнь 1979 г.). «Гипотеза малярии/Г.-6-ПД». Ланцет . 1 (8127): 1183–4. дои : 10.1016/S0140-6736(79)91857-9 . ПМИД 86896 . S2CID 31214682 .
- ^ Корпас Ф.Д., Баррозу Х.Б., Сандалио Л.М., Дистефано С., Пальма Х.М., Лупианьес Х.А., Дель Рио Л.А. (март 1998 г.). «Система рециркуляции НАДФН, опосредованная дегидрогеназой, в пероксисомах растений» . Биохимический журнал . 330 (Часть 2): 777–84. дои : 10.1042/bj3300777 . ПМК 1219205 . ПМИД 9480890 .
- ^ Башири Дж., Сквайр С.Дж., Морленд, Нью-Джерси, Бейкер Э.Н. (июнь 2008 г.). «Кристаллические структуры F420-зависимой глюкозо-6-фосфатдегидрогеназы FGD1, участвующей в активации кандидатного противотуберкулезного препарата PA-824, раскрывают основу связывания коферментов и субстратов» . Журнал биологической химии . 283 (25): 17531–41. дои : 10.1074/jbc.M801854200 . ПМИД 18434308 .
- ^ Шведа Л.И., Учида К., Цай Л., Штадтман Э.Р. (февраль 1993 г.). «Инактивация глюкозо-6-фосфатдегидрогеназы 4-гидрокси-2-ноненалем. Селективная модификация лизина активного центра» . Журнал биологической химии . 268 (5): 3342–7. дои : 10.1016/S0021-9258(18)53699-1 . ПМИД 8429010 .
- ^ Перейти обратно: а б с д и ж г Ван ХТ, Чан ТФ, Лам ВМ, Энгель ПК (август 2008 г.). «Какова роль второго «структурного» сайта связывания НАДФ+ в глюкозо-6-фосфатдегидрогеназе человека?» . Белковая наука . 17 (8): 1403–11. дои : 10.1110/ps.035352.108 . ПМК 2492815 . ПМИД 18493020 .
- ^ Эгер-Нойфельдт И., Тейнцер А., Вайс Л., Виланд О. (март 1965 г.). «Ингибирование глюкозо-6-фосфатдегидрогеназы длинноцепочечным ацил-коферментом А». Связь с биохимическими и биофизическими исследованиями . 19 (1): 43–48. дои : 10.1016/0006-291X(65)90116-6 .
- ^ Кавагути А., Блох К. (сентябрь 1974 г.). «Ингибирование глюкозо-6-фосфатдегидрогеназы пальмитоил-коэнзимом А» . Журнал биологической химии . 249 (18): 5793–800. дои : 10.1016/S0021-9258(20)79887-X . ПМИД 4153382 .
- ^ Ван Ю.П., Чжоу Л.С., Чжао Ю.З., Ван С.В., Чен Л.Л., Лю LX, Лин ZQ, Ху Ф.Дж., Сунь Ю.П., Чжан Ю., Ян С., Ян Ю., Сюн Ю., Гуань К.Л., Е Д. (июнь 2014 г.). «Регуляция ацетилирования G6PD с помощью SIRT2 и KAT9 модулирует гомеостаз НАДФН и выживаемость клеток во время окислительного стресса» . Журнал ЭМБО . 33 (12): 1304–20. дои : 10.1002/embj.201387224 . ПМЦ 4194121 . ПМИД 24769394 .
- ^ Клетциен Р.Ф., Харрис П.К., Фоэллми Л.А. (февраль 1994 г.). «Глюкозо-6-фосфатдегидрогеназа: фермент «домашнего хозяйства», подверженный тканеспецифической регуляции гормонами, питательными веществами и окислительным стрессом» . Журнал ФАСЭБ . 8 (2): 174–81. дои : 10.1096/fasebj.8.2.8119488 . ПМИД 8119488 . S2CID 38768580 .
- ^ Перейти обратно: а б де Лартиг Ж (12 июня 2012 г.). «Исследования рака выходят за рамки первоначальных признаков рака» . ОнкЛайв. Архивировано из оригинала 2 января 2018 г. Проверено 26 июня 2012 г.
- ^ «Ген Энтрез: глюкозо-6-фосфатдегидрогеназа G6PD» .
- ^ Перейти обратно: а б Тиан В.Н., Браунштейн Л.Д., Панг Дж., Штулмайер К.М., Си QC, Тиан X, Стэнтон RC (апрель 1998 г.). «Важность активности глюкозо-6-фосфатдегидрогеназы для роста клеток» . Журнал биологической химии . 273 (17): 10609–17. дои : 10.1074/jbc.273.17.10609 . ПМИД 9553122 .
- ^ Голдман А., Хисте С., Фрейнкман Е., Дхаван А., Маджумдер Б., Мондал Дж. и др. (август 2019 г.). «Нацеливание на фенотипическую пластичность опухолей и метаболическое ремоделирование при адаптивной толерантности к перекрестным лекарствам» . Научная сигнализация . 12 (595). doi : 10.1126/scisignal.aas8779 . ПМЦ 7261372 . ПМИД 31431543 .
- ^ Перейти обратно: а б Сюй С.Н., Ван Т.С., Ли Х, Ван Ю.П. (сентябрь 2016 г.). «SIRT2 активирует G6PD, увеличивая выработку НАДФН и способствуя пролиферации клеток лейкемии» . Научные отчеты . 6 : 32734. Бибкод : 2016NatSR...632734X . дои : 10.1038/srep32734 . ПМК 5009355 . ПМИД 27586085 .
Дальнейшее чтение
[ редактировать ]- Вуллиами Т., Бойтлер Э., Луццато Л. (1993). «Варианты глюкозо-6-фосфатдегидрогеназы возникают вследствие миссенс-мутаций, распространяющихся по всей кодирующей области гена» . Человеческая мутация . 2 (3): 159–67. дои : 10.1002/humu.1380020302 . ПМИД 8364584 . S2CID 46431236 .
- Мейсон П.Дж. (сентябрь 1996 г.). «Новый взгляд на дефицит G6PD». Британский журнал гематологии . 94 (4): 585–91. дои : 10.1111/j.1365-2141.1996.tb00001.x . PMID 8826878 . S2CID 221484452 .
- Вайцман Х., Галактерос Ф (август 2004 г.). «[Дефицит глюкозо-6-фосфатдегидрогеназы: защита от малярии и риск гемолитических катастроф]». Comptes Rendus Biologies (на французском языке). 327 (8): 711–20. дои : 10.1016/j.crvi.2004.07.010 . ПМИД 15506519 .





