Лактаза
| Лактаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 3.2.1.108 | ||
| Номер CAS. | 9031-11-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Лактаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ЛКТ | ||
| Альт. символы | ЛАК; ЛПХ; ЛПХ1 | ||
| ген NCBI | 3938 | ||
| HGNC | 6530 | ||
| МОЙ БОГ | 603202 | ||
| RefSeq | НМ_002299 | ||
| ЮниПрот | P09848 | ||
| Другие данные | |||
| Номер ЕС | 3.2.1.108 | ||
| Локус | Хр. 2 q21 | ||
| |||
Лактаза ( EC 3.2.1.108 ) представляет собой фермент, вырабатываемый многими организмами, и он необходим для полного переваривания цельного молока . Он расщепляет сахарную лактозу на составные части: галактозу и глюкозу . Лактаза содержится в щеточной кайме тонкого кишечника человека и других млекопитающих. Люди с дефицитом лактазы или отсутствием функциональной лактазы могут испытывать симптомы непереносимости лактозы после употребления молочных продуктов . [ 1 ] Микробную β-галактозидазу (часто условно называемую лактазой) можно приобрести в качестве пищевой добавки , и ее добавляют в молоко для производства «безлактозных» молочных продуктов.
Использование
[ редактировать ]Использование продуктов питания
[ редактировать ]Лактаза — это фермент, который у некоторых людей не вырабатывается в тонком кишечнике. [ 2 ] Технология производства безлактозного молока, мороженого и йогурта была разработана Службой сельскохозяйственных исследований Министерства сельского хозяйства США в 1985 году. [ 3 ] Эта технология используется для добавления лактазы в молоко, тем самым гидролизуя лактозу, естественным образом содержащуюся в молоке, делая его слегка сладким, но легкоусвояемым. [ 4 ] Без лактазы люди с непереносимостью лактозы переносят лактозу в толстую кишку непереваренной. [ 5 ] где бактерии расщепляют его, образуя углекислый газ, который приводит к вздутию живота и метеоризму.
Медицинское использование
[ редактировать ]Добавки лактазы можно использовать для лечения непереносимости лактозы . [ 6 ]
Промышленное использование
[ редактировать ]Лактазу, выпускаемую в промышленных масштабах, можно экстрагировать как из дрожжей , таких как Kluyveromyces fragilis и Kluyveromyces Lactis, так и из плесени, такой как Aspergillus niger и Aspergillus oryzae . [ 7 ] Его основное коммерческое использование в добавках заключается в расщеплении лактозы в молоке, чтобы сделать его пригодным для людей с непереносимостью лактозы. [ 8 ] [ 9 ] Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США не проводило независимую оценку этих продуктов. [ 10 ]
Лактаза (или подобная форма β-галактозидазы ) также используется для скрининга сине-белых колоний в множественных сайтах клонирования различных плазмидных векторов в Escherichia coli или других бактериях. [ 11 ] [ 12 ]
Механизм
[ редактировать ]Оптимальная температура для лактазы человека составляет около 37°С. [ 13 ] Оптимум pH равен 6 . [ 14 ]
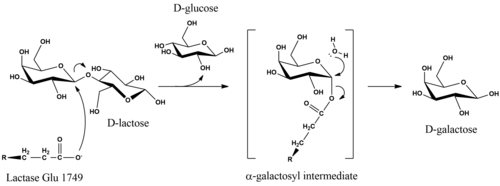
В процессе метаболизма β-гликозидная связь в D- лактозе гидролизуется с образованием D -галактозы и D -глюкозы, которые могут всасываться через стенки кишечника и попадать в кровоток. Общая реакция, которую катализирует лактаза, выглядит следующим образом:
- C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6 + тепло.
- лактоза + H 2 O → β- D -галактоза + D -глюкоза
Каталитический механизм гидролиза D -лактозы сохраняет в продуктах аномерную конфигурацию субстрата. [ 15 ] Хотя детали механизма неясны, стереохимическое удержание достигается за счет реакции двойного замещения. Исследования лактазы E. coli показали, что гидролиз инициируется, когда глутаматный нуклеофил атакует фермент с аксиальной стороны галактозильного углерода в β-гликозидной связи. [ 16 ] Удаление уходящей группы D -глюкозы может быть облегчено Mg-зависимым кислотным катализом. [ 16 ] Фермент высвобождается из α-галактозильного фрагмента при экваториальной нуклеофильной атаке воды, в результате чего образуется D -галактоза. [ 15 ]
Исследования модификации субстрата показали, что фрагменты 3'-OH и 2'-OH на галактопиранозном кольце необходимы для ферментативного распознавания и гидролиза. [ 17 ] 3'-гидроксигруппа участвует в первоначальном связывании с субстратом, тогда как 2'-группа не необходима для узнавания, но необходима на последующих этапах. Об этом свидетельствует тот факт, что 2-дезоксианалог является эффективным конкурентным ингибитором (K i = 10 мМ). [ 17 ] Удаление специфических гидроксильных групп глюкопиранозного фрагмента не устраняет катализ. [ 17 ]
Лактаза также катализирует превращение флоризина во флоретин и глюкозу.
Лактаза ( коммерческий Lactaid ) используется в качестве лекарства от непереносимости лактозы. Поскольку это фермент, его функция может подавляться кислотностью желудка. Однако он упакован в кислотоустойчивую таблетку, позволяющую ферменту пройти через желудок в целости и сохранности и остаться в тонком кишечнике. В тонком кишечнике он может действовать на проглоченные молекулы лактозы, позволяя организму усваивать переваренный сахар, который в противном случае вызвал бы спазмы и диарею. Поскольку фермент не всасывается, он выводится при следующем испражнении. [ нужна ссылка ]
Структура и биосинтез
[ редактировать ]Препролактаза, первичный продукт трансляции, имеет единую полипептидную первичную структуру, состоящую из 1927 аминокислот. [ 18 ] , состоящую из 19 аминокислот Его можно разделить на пять доменов: (i) сигнальную последовательность ; (ii) большой домен пропоследовательности, которого нет в зрелой лактазе; (iii) сегмент зрелой лактазы; (iv) трансмембранный гидрофобный якорь; и (v) короткий гидрофильный карбоксильный конец. [ 18 ] Сигнальная последовательность расщепляется в эндоплазматическом ретикулуме , и полученный про-ЛПГ массой 215 кДа отправляется в аппарат Гольджи , где он сильно гликозилируется и протеолитически процессируется до зрелой формы. [ 19 ] Было показано, что продомен действует как внутримолекулярный шаперон в ЭР, предотвращая расщепление трипсином и позволяя ЛПГ принять необходимую трехмерную структуру для транспортировки в аппарат Гольджи. [ 20 ]
Зрелая лактаза человека состоит из одной полипептидной цепи массой 160 кДа, которая локализуется на мембране щеточной каймы эпителиальных клеток кишечника. Он ориентирован N-концом вне клетки и С-концом в цитозоле. [ 18 ] ЛПХ содержит два каталитических центра глутаминовой кислоты. В человеческом ферменте активность лактазы связана с Glu-1749, а Glu-1273 является местом функции флоризингидролазы. [ 21 ]
Генетическая экспрессия и регуляция
[ редактировать ]У человека лактаза кодируется одним генетическим локусом на второй хромосоме. [ 22 ] Он экспрессируется исключительно энтероцитами тонкого кишечника млекопитающих и в очень низких уровнях в толстой кишке во время развития плода. [ 22 ] Люди рождаются с высоким уровнем экспрессии лактазы. У большей части населения мира транскрипция лактазы снижается после отлучения от груди, что приводит к снижению экспрессии лактазы в тонком кишечнике. [ 22 ] который вызывает общие симптомы гиполактазии взрослого типа или непереносимости лактозы. [ 23 ] Ген LCT обеспечивает инструкции по выработке лактазы. Непереносимость лактозы у младенцев (врожденная лактазная недостаточность) вызвана мутациями в гене LCT . Считается, что мутации нарушают функцию лактазы, в результате чего у пораженных младенцев наблюдается серьезное нарушение способности переваривать лактозу в грудном молоке или молочной смеси. [ 24 ]
В некоторых сегментах населения наблюдается персистенция лактазы в результате мутации, которая, как предполагается, произошла 5 000–10 000 лет назад, что совпало с ростом одомашнивания крупного рогатого скота. [ 25 ] Эта мутация позволила почти половине населения мира усваивать лактозу без каких-либо симптомов. Исследования связали возникновение персистенции лактазы с двумя различными однонуклеотидными полиморфизмами, расположенными примерно в 14 и 22 тысячах оснований выше 5'-конца гена LPH. [ 26 ] Обе мутации, C→T в положении -13910 и G→A в положении -22018, независимо связаны с персистенцией лактазы. [ 27 ]
Промотор лактазы имеет длину 150 пар оснований и расположен выше места инициации транскрипции. [ 27 ] Эта последовательность высоко консервативна у млекопитающих, что позволяет предположить, что критические регуляторы цис-транскрипции расположены поблизости. [ 27 ] Cdx-2 , HNF-1α и GATA были идентифицированы как факторы транскрипции. [ 27 ] Исследования возникновения гиполактазии показали, что, несмотря на полиморфизмы, существуют небольшие различия в экспрессии лактазы у младенцев, показывая, что мутации становятся все более актуальными в процессе развития. [ 28 ] ДНК-связывающие белки, регулируемые развитием, могут подавлять транскрипцию или дестабилизировать транскрипты мРНК, вызывая снижение экспрессии ЛПГ после отлучения от груди. [ 28 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Ярвеля И, Торниайнен С, Колхо К.Л. (2009). «Молекулярная генетика лактазной недостаточности человека» . Анналы медицины . 41 (8): 568–75. дои : 10.1080/07853890903121033 . ПМИД 19639477 . S2CID 205586720 .
- ^ «Непереносимость лактозы» . Клиника Мэйо . Проверено 13 марта 2018 г.
- ^ Крыльцо К (12 апреля 2018 г.). «Безлактозное молоко, нежирный сыр и другие открытия в области молочных продуктов» . www.federallabs.org . Проверено 26 октября 2018 г.
- ^ «Вопрос: Как молочные заводы производят безлактозное молоко?» . США сегодня . 3 сентября 2014 года . Проверено 13 марта 2018 г.
- ^ «Непереносимость лактозы – Симптомы и причины» . Клиника Мэйо . Проверено 8 ноября 2020 г.
- ^ «Непереносимость лактозы» . НИДДК . Июнь 2014 года . Проверено 25 октября 2016 г.
- ^ Сейис И, Аксоз Н (2004). «Производство лактазы Trichoderma sp» . Пищевые технологии и биотехнологии . 42 (2): 121–124.
- ^ DSM Food Specialities (3 апреля 2014 г.). «Уведомление GRAS о кислой лактазе Aspergillus oryzae, экспрессируемой в Aspergillus niger » (PDF) . п. 1. Архивировано из оригинала 31 октября 2017 года – через Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
- ^ Холсингер В.Х. (1992). «Инновационные продукты для пищевой промышленности: история Lactaid» . Новые культуры, новое использование, новые рынки: Ежегодник сельского хозяйства 1992 года . Министерство сельского хозяйства США. стр. 256–258. Архивировано из оригинала 17 июля 2022 г. Проверено 11 января 2022 г.
- ^ Тарантино, LM (12 декабря 2003 г.). «Письмо-ответ агентства GRAS № GRN 000132» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 26 марта 2011 года.
- ^ Лау Х.М., Ли Л.С., Со У.К., вторник, юго-запад (март 2013 г.). "Введение" . Лактаза . Технологический университет Малайзии . Проверено 16 ноября 2018 г. .
- ^ «pBluescript II KS(+/−), pBluescript II SK(+/−): описание и карта ограничений» . Ферментас. Архивировано из оригинала 19 октября 2008 года.
- ^ Эрмида С., Корралес Дж., Каньяда Ф.Дж., Арагон Дж.Дж., Фернандес-Майоралас А. (июль 2007 г.). «Оптимизация ферментативного синтеза β-D-галактопиранозил-D-ксилоз для их использования в оценке активности лактазы in vivo ». Биоорганическая и медицинская химия . 15 (14): 4836–40. дои : 10.1016/j.bmc.2007.04.067 . hdl : 10261/81580 . ПМИД 17512743 .
- ^ Сковбьерг Х., Сьёстрем Х., Норен О. (март 1981 г.). «Очистка и характеристика амфифильной лактазы/флоризингидролазы из тонкого кишечника человека». Европейский журнал биохимии . 114 (3): 653–61. дои : 10.1111/j.1432-1033.1981.tb05193.x . ПМИД 6786877 .
- ^ Jump up to: а б Синнотт М. (ноябрь 1990 г.). «Каталитические механизмы ферментативного переноса гликозила». хим. Преподобный . 90 (7): 1171–1202. дои : 10.1021/cr00105a006 .
- ^ Jump up to: а б Джуерс Д.Х., Хайтман Т.Д., Васелла А., Маккартер Дж.Д., Маккензи Л., Уизерс С.Г., Мэтьюз Б.В. (декабрь 2001 г.). «Структурный взгляд на действие β-галактозидазы Escherichia coli (lacZ)». Биохимия . 40 (49): 14781–94. дои : 10.1021/bi011727i . ПМИД 11732897 .
- ^ Jump up to: а б с Фернандес П., Каньяда Ф.Дж., Хименес-Барберо Х., Мартин-Ломас М. (июль 1995 г.). «Субстратная специфичность тонкокишечной лактазы: изучение стерических эффектов и водородных связей, участвующих во взаимодействии фермент-субстрат». Исследование углеводов . 271 (1): 31–42. дои : 10.1016/0008-6215(95)00034-Q . ПМИД 7648581 .
- ^ Jump up to: а б с Мантей Н., Вилла М., Энцлер Т., Вакер Х., Болл В., Джеймс П., Хунцикер В., Семенца Г. (сентябрь 1988 г.). «Полная первичная структура лактазно-флоризингидролазы человека и кролика: значение для биосинтеза, мембранного закрепления и эволюции фермента» . Журнал ЭМБО . 7 (9): 2705–13. дои : 10.1002/j.1460-2075.1988.tb03124.x . ПМК 457059 . ПМИД 2460343 .
- ^ Наим Х.Ю., Стерчи Э.Э., Ленце М.Дж. (январь 1987 г.). «Биосинтез и созревание лактазо-флоризингидролазы в эпителиальных клетках тонкой кишки человека» . Биохимический журнал . 241 (2): 427–34. дои : 10.1042/bj2410427 . ПМЦ 1147578 . ПМИД 3109375 .
- ^ Наим Х.И., Джейкоб Р., Наим Х., Сэмбрук Дж.Ф., Гетинг М.Дж. (октябрь 1994 г.). «Про-область кишечной лактазно-флоризингидролазы человека» . Журнал биологической химии . 269 (43): 26933–43. дои : 10.1016/S0021-9258(18)47109-8 . ПМИД 7523415 .
- ^ Зекка Л., Месонеро Дж.Э., Штутц А., Пуаре Х.К., Джудичелли Дж., Курсио Р., Глур С.М., Семенца Г. (сентябрь 1998 г.). «Кишечная лактаза-флоризингидролаза (ЛПГ): два каталитических центра; роль поджелудочной железы в созревании про-ЛПГ» . Письма ФЭБС . 435 (2–3): 225–8. дои : 10.1016/S0014-5793(98)01076-X . ПМИД 9762914 . S2CID 33421778 .
- ^ Jump up to: а б с Троелсен Дж.Т., Митчелмор С., Сподсберг Н., Йенсен А.М., Норен О., Шёстрём Х. (март 1997 г.). «Регуляция экспрессии гена лактазо-флоризингидролазы с помощью каудального гомеодоменного белка Cdx-2» . Биохимический журнал . 322 (Часть 3) (Часть 3): 833–8. дои : 10.1042/bj3220833 . ПМЦ 1218263 . ПМИД 9148757 .
- ^ Ссылка на ГХ. «Ген LCT» . Домашний справочник по генетике . Проверено 3 апреля 2018 г.
- ^ «Непереносимость лактозы: MedlinePlus Genetics» . medlineplus.gov . Проверено 22 марта 2022 г.
- ^ Берсальери Т., Сабети ПК, Паттерсон Н., Вандерплоег Т., Шаффнер С.Ф., Дрейк Дж.А., Роудс М., Райх Д.Э., Хиршхорн Дж.Н. (июнь 2004 г.). «Генетические признаки сильного недавнего положительного отбора гена лактазы» . Американский журнал генетики человека . 74 (6): 1111–20. дои : 10.1086/421051 . ПМК 1182075 . ПМИД 15114531 .
- ^ Куокканен М., Энаттах Н.С., Оксанен А., Савилахти Е., Орпана А., Ярвеля I (май 2003 г.). «Регуляция транскрипции гена лактазно-флоризингидролазы с помощью полиморфизмов, связанных с гиполактазией взрослого типа» . Гут . 52 (5): 647–52. дои : 10.1136/gut.52.5.647 . ПМЦ 1773659 . ПМИД 12692047 .
- ^ Jump up to: а б с д Троелсен Дж.Т. (май 2005 г.). «Гилактазия взрослого типа и регуляция экспрессии лактазы». Biochimica et Biophysical Acta (BBA) – Общие предметы . 1723 (1–3): 19–32. дои : 10.1016/j.bbagen.2005.02.003 . ПМИД 15777735 .
- ^ Jump up to: а б Ван Ю, Харви С.Б., Холлокс Э.Дж., Филлипс А.Д., Поултер М., Клэй П., Уокер-Смит Дж.А., Своллоу Д.М. (июнь 1998 г.). «Генетически запрограммированное снижение лактазы у детей» . Гастроэнтерология . 114 (6): 1230–6. дои : 10.1016/S0016-5085(98)70429-9 . ПМИД 9609760 .
Внешние ссылки
[ редактировать ]- Белок лактазы
- E. coli β-галактозидаза : PDB : 1JYY
- Генная онтология лактазы
- Создание сильнейших: есть лактаза? Коэволюция генов и культуры
- Сохранение лактазы указывает на связь с ожирением
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для бета-галактозидазы человека.
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для бета-галактозидазы Escherichia coli.
- ^ Биб Дж. А., Фрей П. А. (1 октября 1998 г.). «Галактозомутаротаза: очистка, характеристика и исследование двух важных остатков гистидина» . Биохимия . 37 (42): 14989–14997. дои : 10.1021/bi9816047 . ISSN 0006-2960 .