Субтилис
| Пептидаза S8, связанная с субтилизином | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | Peptidase_s8 | ||
| Pfam | PF00082 | ||
| InterPro | IPR015500 | ||
| PROSITE | PDOC00125 | ||
| Кат - | 1cse | ||
| Краткое содержание | 1cse / scope / supfam | ||
| CDD | CD07477 | ||
| |||
| Subtilisin bpn ' | |||
|---|---|---|---|
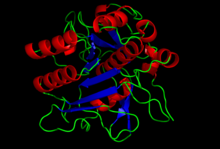 Кристаллическая структура домена субтилизина S8. [ 1 ] | |||
| Идентификаторы | |||
| Организм | |||
| Символ | апрель | ||
| Номер CAS | 9014-01-1 | ||
| Входить | 5712479 | ||
| PDB | 1st2 больше структур | ||
| Uniprot | P00782 | ||
| Другие данные | |||
| ЕС номер | 3.4.21.62 | ||
| |||
| GO: 0004252 | |||
Субтилизин является протеазой ( протеино-усваивающий фермент ), первоначально полученный из Bacillus subtilis . [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ]
Субтилизины относятся к субтилазам , группе сериновых протеаз , которые - как и все сериновые протеазы - инициируют нуклеофильную атаку на пептидную (амид) связь через сериновый остаток в активном сайте . Субтилизины обычно имеют молекулярные массы 27 кДа. Их можно получить из определенных типов почвенных бактерий , например, Bacillus amyliquefaciens, из которых они секретируются в больших количествах.
Номенклатура
[ редактировать ]«Субтилизин» относится не к одному белке, а ко всему кладу при субтилазах, содержащих классические субтилизины. Клада может быть дополнительно разделена на четыре группы: «истинные субтилизины» (содержащие классические элементы), «высококкулиновые субтилизины», «внутриклеточные субтилизины» и «филогенетически промежуточные субтилизины» (PIS). [ 9 ] [ 10 ] Примечательные субтилизины включают:
| Семья | Организм | Uniprot | Имена | Примечания |
|---|---|---|---|---|
| Истинный | B. licheniformis | P00780 | Subtilisin Carlsberg, Alcalase ( Novozymes ), Maxatase (?) "Subtilisin dy" (рентгеновский мутант) [ 11 ] |
Тип сериновой эндопептидазы семейства Merops S8. |
| ? | B. licheniformis | ? | Эндокут-02L (APS APS) | |
| ? | ? | ? | биопраза , биопраза Al | |
| ? | Ледербергия Лента | Подождите (новазимы) | Структура определена, но не найдена на PDB. [ 12 ] | |
| Высококвуалин | Ледербергия Лента | P29600 | Subtilisin Savinase, Savinase (Novozymes) | PDB : 1SVN [ 13 ] |
| Истинный | B. Amyloliquefaciens | P00782 | Subtilisin bpn ', alcalase (novozymes) | |
| ? | Geobacillus stearothermophilus | P29142 | Subtilisin J, Thermoase (Amano) | [ 14 ] |
Другие некоммерческие названия включают альк-энзимент , бациллопептидазу , щелочную протеиназу Bacillus Subtilis , колистиназу , гененазу I , протеазу XXVII , субтилопептидаза , казузаза , протеаза VIII , протеза A 3L , протеаза S.
Другие коммерческие названия с неопознанными молекулярными идентичностями включают SP 266 , Orientase 10b (HBI Enzymes), прогресс (Novozyme), Libanase (Novozyme).
Структура
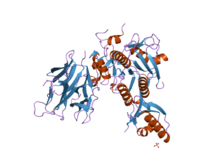
[ редактировать ]Структура субтилизина была определена с помощью рентгеновской кристаллографии . с 275 остановками Зрелая форма представляет собой глобулярный белок с несколькими альфа-спиралями и большим бета-листом . N-концевой содержит пропептидный домен I9 ( InterPro : IPR010259 ), который помогает складываться субтилизином. Протеолитическое удаление домена активирует фермент. Он структурно не связан с химотрипсином -кланом сериновых протеаз, но использует тот же тип каталитической триады в активном сайте . Это делает его классическим примером конвергентной эволюции .
Механизм катализа
[ редактировать ]Активный сайт оснащена сетью заряда, включающей ASP-32, HIS-64 и активный сайт Ser-221, расположенный в каталитической триаде . Сеть заряда функционирует следующим образом: карбоксилатная боковая цепь водородных связей ASP-32 к протону с азотом с имидазолом HIS-64 . Это возможно, потому что ASP негативно заряжен при физиологическом pH . Другой азот на водородных связях Hy-64 до протона OH Ser-221. Это последнее взаимодействие приводит к серии ОН, а атом кислорода является более нуклеофильным. Это позволяет атому кислорода Ser-221 атаковать входящие субстраты (то есть пептидные связи), которым помогает соседняя боковая цепь карбоксимида ASN-155.
Несмотря на то, что ASP-32, HIS-64 и SER-221 последовательно находятся далеко друг от друга, они сходится в трехмерной структуре , чтобы сформировать активное сайт.
Чтобы суммировать взаимодействия, описанные выше, SER-221 действует как нуклеофил и расщепляет пептидные связи с его частично отрицательным атомом кислорода. Это возможно из-за характера зарядового сайта субтилизина.
Приложения
[ редактировать ]Исследовательский инструмент
[ редактировать ]В молекулярной биологии с использованием B. subtilis в качестве модельного организма ген, кодирующий субтилизин ( APRE ), часто является вторым геном, выбранным после AMYE для интеграции репортерных конструкций в его доходы.
Коммерческий
[ редактировать ]Протеино-инженерные субтилизины широко используются в коммерческих продуктах (нативный фермент легко инактивируется детергентами и высокими температурами) и также называется пятном, например, в прачечной [ 15 ] и моющие средства для мытья посуды , косметика , пищевая переработка , [ 16 ] Продукты по уходу за кожей, очистки контактных линз и исследования в области синтетической органической химии .
Профессиональная безопасность и здоровье
[ редактировать ]Люди могут подвергаться воздействию субтилизина на рабочем месте, вдыхая его, проглатывая его, контакт с кожей и зрительный контакт. Национальный институт безопасности и гигиены труда (NIOSH) установил рекомендуемый лимит воздействия (REL) 60 нг/м 3 за 60-минутный период. [ 17 ]
Субтилизин может вызвать «ферментативную моющую среду астму». Люди, которые чувствительны к субтилизину (альфалазе), обычно также аллергия на бактерий Bacillus subtilis . [ 18 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ PDB : 1st2 ; Ботт Р., Ультш М., Коссиакофф А., Грейкар Т., Кац Б., Пауэр С (июнь 1988 г.). «Трехмерная структура субтилизина Bacillus amyloliquefaciens в 1,8 А и анализ структурных последствий инактивации пероксида» . Журнал биологической химии . 263 (16): 7895–906. doi : 10.1016/s0021-9258 (18) 68582-5 . PMID 3286644 .
- ^ Ottesen M, Svendsen в (1970). Субтилизины . Методы фермент. Vol. doi : 10.1016/0076-6879 (70) 19014-8 . ISBN 978-0-12-181881-4 .
- ^ Markland FS, Smith EL (1971). «Субтилизины: первичная структура, химические и физические свойства». В Boyer Pd (ред.). Ферменты . Тол. 3 (3 -е изд.). Нью -Йорк: Академическая пресса. С. 561–608.
- ^ Филипп М., Бендер М.Л. (1983). «Кинетика субтилизина и тиолсилизина». Молекулярная и клеточная биохимия . 51 (1): 5–32. doi : 10.1007/bf00215583 . PMID 6343835 . S2CID 24136200 .
- ^ Недков П., Обертюр В., Браунитцер Г (апрель 1985 г.). «Определение полной аминокислотной последовательности субтилизина DY и его сравнение с первичными структурами субтилизинов BPN ', Карлсберга и амилосахахарита». Биологическая химия Hoppe-Seyler . 366 (4): 421–30. doi : 10.1515/bchm3.1985.366.1.421 . PMID 3927935 .
- ^ Ikemura H, Takagi H, Inouye M (июнь 1987 г.). «Требование о последовательности для производства активного субтилизина Е в Escherichia coli» . Журнал биологической химии . 262 (16): 7859–64. doi : 10.1016/s0021-9258 (18) 47646-6 . PMID 3108260 .
- ^ Polgár L (1987). «Структура и функция сериновых протеаз». В Броклехерсте К, Нойбергер А (ред.). Гидролитические ферменты . Амстердам: Elsevier. ISBN 0-444-80886-8 .
- ^ Васантха Н., Томпсон Л.Д., Родс С., Баннер С., Нагле Дж., Филпула Д (сентябрь 1984 г.). «Гены для щелочной протеазы и нейтральной протеазы из Bacillus amyloliquefaciens содержат большую открытую рамку считывания между областями, кодирующими сигнальную последовательность и зрелый белок» . Журнал бактериологии . 159 (3): 811–9. doi : 10.1128/jb.159.3.811-819.1984 . PMC 215730 . PMID 6090391 .
- ^ Фалькенберг, Фабиан; Рахба, Джейд; Фишер, Дэвид; Бот, Майкл; Bongaerts, Johannes; Зигерт, Петра (октябрь 2022 г.). «Биохимическая характеристика нового окислительно устойчивого, галолерантного и высококалькалинового субтилизина из Alkalihalobacillus okhensis KH10-101 T» . Febs Open Bio . 12 (10): 1729–1746. doi : 10.1002/2211-5463.13457 . PMC 9527586 . PMID 35727859 .
- ^ Falkenberg, F; Бот, м; Bongaerts, J; Siegert, P (2022). «Филогенетическое обследование семейства субтилазы и поиск данных на основе данных для новых субтилизинов от Bacillaceae» . Границы в микробиологии . 13 : 1017978. DOI : 10.3389/fmicb.2022.1017978 . PMC 9549277 . PMID 36225363 .
- ^ Eschenburg, S; Genov, N; Петерс, К; Fittkau, S; Stoeva, S; Уилсон, KS; Бетцель, C (15 октября 1998 г.). «Кристаллическая структура субтилизина DY, случайный мутант субтилизина Карлсберга». Европейский журнал биохимии . 257 (2): 309–18. doi : 10.1046/j.1432-1327.1998.2570309.x . PMID 9826175 .
- ^ Бетцель, C; Klupsch, S; Branner, S; Уилсон, KS (1996). Кристаллические структуры щелочной протеазвиназы и эсперазы из Bacillus Lentus . Достижения в области экспериментальной медицины и биологии. Тол. 379. С. 49–61. doi : 10.1007/978-1-4613-0319-0_7 . ISBN 978-0-306-45108-9 Полем PMID 8796310 .
- ^ Бетцель, C; Klupsch, S; Papendorf, g; Hastrup, S; Branner, S; Уилсон, KS (20 января 1992 г.). «Кристаллическая структура щелочной протеиназы савиназы из Bacillus Lentus при 1,4 -a разрешении». Журнал молекулярной биологии . 223 (2): 427–45. doi : 10.1016/0022-2836 (92) 90662-4 . PMID 1738156 .
- ^ «Thermoase PC10F от Amano Enzyme USA Co., Ltd. - еда, напитки и питание» . www.ulprospector.com .
- ^ «Содержание моющих средств для мытья лонга» .
- ^ Чаплин М (20 декабря 2004 г.). «Применение протеаз в пищевой промышленности» . Лондонский университет Южного берега . Архивировано из оригинала 2010-03-14 . Получено 3 марта 2015 года .
- ^ «CDC - Pocket Guide niosh к химическим опасностям - субтилизины» . www.cdc.gov . Получено 2015-11-21 .
- ^ Медицинский, сестринский и союзный союзный словарь, 14 -е издание, стр. 557