Нековалентное взаимодействие
В химии нековалентное взаимодействие отличается от ковалентной связи тем, что оно не включает в себя совместное использование электронов , [ 1 ] но скорее включает в себя более дисперсные вариации электромагнитных взаимодействий между молекулами или внутри молекулы. Химическая энергия , выделяемая при образовании нековалентных взаимодействий, обычно находится на порядок 1–5 ккал/ моль (1000–5000 калорий на 6,02 × 10 23 молекулы). [ 2 ] Нековалентные взаимодействия могут быть классифицированы на различные категории, такие как электростатические , π-эффекты , силы ван-дер-ваальса и гидрофобные эффекты . [ 3 ] [ 2 ]
Нековалентные взаимодействия [ 4 ] являются критическими при поддержании трехмерной структуры крупных молекул, таких как белки и нуклеиновые кислоты . Они также участвуют во многих биологических процессах, в которых крупные молекулы специально, но временно связываются друг с другом (см. Раздел свойств страницы ДНК ). Эти взаимодействия также сильно влияют на дизайн лекарств , кристалличность и дизайн материалов, особенно для самосборки , и, в целом, синтез многих органических молекул . [ 3 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ]
Нековалентные взаимодействия могут происходить между различными частями одной и той же молекулы (например, во время складывания белка ) или между различными молекулами и, следовательно, обсуждаются также как межмолекулярные силы .
Электростатические взаимодействия
[ редактировать ]Ионный
[ редактировать ]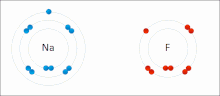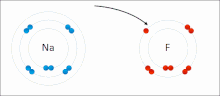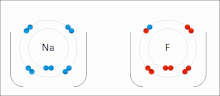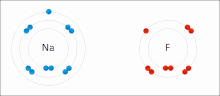
Ионные взаимодействия включают в себя привлечение ионов или молекул с полными постоянными зарядами противоположных знаков. Например, фторид натрия включает в себя притяжение положительного заряда на натрия (NA + ) с отрицательным зарядом на фторид (F − ). [ 9 ] Однако это конкретное взаимодействие легко нарушается при дополнении к воде или другим высокополярным растворителям . В воде ионно сочетание в основном энтропия; Один соляный мост обычно составляет значение примерно ΔG = 5 кДж/моль при промежуточной прочности ионов I, примерно в рамках нуля значение увеличивается примерно до 8 кДж/моль. Значения ΔG обычно являются аддитивными и в значительной степени не зависят от природы участвующих ионов, за исключением переходных металлов и т. Д. ионов [ 10 ]
Эти взаимодействия также можно увидеть в молекулах с локализованным зарядом по конкретному атому . Например, полный отрицательный заряд, связанный с , чаще всего сопровождается умоксидом, конъюгат -основанием этанола положительным зарядом соли щелочных металлов, такой как катион натрия (NA + ).
Водородная связь
[ редактировать ]
Водородная связь (H-связующая) представляет собой специфический тип взаимодействия, который включает в себя притяжение диполь-диполя между частично положительным атомом водорода и высокоэлектронегативным, частично отрицательным кислородом, азотом, серной или атомом фтора (не ковалентно связан атом). Это не ковалентная связь, а вместо этого классифицируется как сильное нековалентное взаимодействие. Это отвечает за то, почему вода является жидкостью при комнатной температуре, а не газом (дается низкая молекулярная масса воды ). Чаще всего прочность водородных связей лежит между 0–4 ккал/моль, но иногда может быть столь же сильной, как 40 ккал/моль [ 3 ] В растворителях, таких как хлороформ или тетрахлорид углерода, один наблюдает, например, для взаимодействия между амидами аддитивных значений около 5 кДж/моль. Согласно Линусу Полингу, сила водородной связи по существу определяется электростатическими зарядами. Измерения тысяч комплексов в хлороформе или тетрахлориде углерода привели к добавкам свободной энергии для всех видов комбинаций донор-акцептора. [ 11 ] [ 12 ]
Галогенная связь
[ редактировать ]
Галогенные связи -это тип нековалентного взаимодействия, который не включает в себя образование и разрыв фактических связей, а скорее аналогична взаимодействию диполь-диполя, известного как водородные связи . В галогенической связи атом галогена действует как электрофил или виды, ищущий электронов, и образует слабое электростатическое взаимодействие с нуклеофилом или богатым электроном. Нуклеофильный агент в этих взаимодействиях имеет тенденцию быть высокоэлектромигативным ( например, кислород , азот или сера ) или может быть анионным , неся отрицательный формальный заряд . По сравнению с водородными связями, атом галогена занимает место частично заряженного водорода в качестве электрофила. [ Цитация необходима ]
Галогенные связи не следует путать с галогено -ароматическими взаимодействиями, поскольку оба связаны, но различаются по определению. Галоген-ароматические взаимодействия включают богатый электроном ароматический π-облак в качестве нуклеофила; Галогенскую связь ограничена монатомическими нуклеофилами. [ 5 ]
Ван дер Ваальс силы
[ редактировать ]Силы Ван -дер -Ваальса представляют собой подмножество электростатических взаимодействий, включающих постоянные или индуцированные диполи (или мультиоли). К ним относятся следующее:
- Постоянные диполь -дипольные взаимодействия , альтернативно называемые силой Кисома
- дипольные дипольные взаимодействия или сила Дебая
- индуцированные дипольные дипольные взаимодействия, обычно называемые лондонскими дисперсионными силами
Водородная связь и галогенная связь, как правило, не классифицируются как силы Ван -дер -Ваальса.
Диполь -диполь
[ редактировать ]
Диполь-дипольные взаимодействия представляют собой электростатические взаимодействия между постоянными диполями в молекулах. Эти взаимодействия имеют тенденцию выравнивать молекулы для увеличения привлечения (снижение потенциальной энергии ). Обычно диполи связаны с электроотрицательными атомами, включая кислород , азот , серу и фтор .
Например, ацетон , активный ингредиент в некоторых удалениях лака для ногтей, имеет чистый диполь, связанный с карбонилом (см. Рисунок 2). Поскольку кислород является более электроотрицательным, чем углерод, который ковалентно связан с ним, электроны, связанные с этой связью, будут ближе к кислороду, чем у углерода, создавая частичный негативный заряд (Δ − ) на кислороде и частичный положительный заряд (Δ + ) на углероде. Они не являются полными зарядами, потому что электроны все еще разделяются через ковалентную связь между кислородом и углеродом. Если бы электроны больше не были распределены, то кислород-углеродная связь была бы электростатическим взаимодействием.
Часто молекулы содержат дипольные группы, но не имеют общего дипольного момента . Это происходит, если в молекуле существует симметрия, которая заставляет диполи отменять друг друга. Это происходит в молекулах, таких как тетрахлорметан . Обратите внимание, что взаимодействие диполь-диполя между двумя отдельными атомами обычно равно нулю, поскольку атомы редко несут постоянный диполь. Смотрите атомные диполи .
Диполь-индуцированный диполь
[ редактировать ]Дипольное индуцированное дипольное взаимодействие ( сила Дебая ) обусловлено подходом молекулы с постоянным диполем к другой неполярной молекуле без постоянного диполя. Этот подход приводит к тому, что электроны неполярной молекулы поляризуются в сторону или от диполя (или «индуцировать» диполь) приближающейся молекулы. [ 13 ] В частности, диполь может вызывать электростатическое притяжение или отталкивание электронов из неполярной молекулы, в зависимости от ориентации входящего диполя. [ 13 ] Атомы с более крупными атомными радиусами считаются более «поляризуемыми» и, следовательно, испытывают большие притяжения в результате силы Дебая. [ Цитация необходима ]
Лондонские дисперсионные силы
[ редактировать ]Лондонские дисперсионные силы [ 14 ] [ 15 ] [ 16 ] [ 17 ] являются самым слабым типом нековалентного взаимодействия. Однако в органических молекулах множество контактов может привести к большему вкладу, особенно в присутствии гетероатомов. Они также известны как «индуцированные дипольные дипольные взаимодействия» и присутствуют между всеми молекулами, даже те, которые по своей природе не имеют постоянных диполей. Дисперсивные взаимодействия увеличиваются с поляризуемостью взаимодействующих групп, но ослаблены растворителями повышенной поляризуемости. [ 18 ] Они вызваны временным отталкиванием электронов вдали от электронов соседней молекулы, что приводит к частично положительному диполю на одной молекуле и частично отрицательно отрицательно диполю на другой молекуле. [ 6 ] Гексан является хорошим примером молекулы без полярности или сильно электроотрицательных атомов, но является жидкостью при комнатной температуре, в основном из -за лондонских дисперсионных сил. В этом примере, когда одна молекула гексана приближается к другой, временный, слабый частично отрицательный диполь на входящем гексане может поляризовать электронное облако другого, вызывая частично положительный диполь на этой молекуле гексана. В отсутствие водоросли углеводородов, таких как гексан, образуют кристаллы из -за дисперсионных сил; Сублимационное тепло кристаллов является мерой дисперсионного взаимодействия. Хотя эти взаимодействия являются недолгими и очень слабыми, они могут нести ответственность за то, почему определенные неполярные молекулы являются жидкостями при комнатной температуре.
π-эффекты
[ редактировать ]π-эффекты могут быть разбиты на многочисленные категории, включая π-π-взаимодействия , катион-π и анион-π-взаимодействия и полярные взаимодействия. В целом, π-эффекты связаны с взаимодействиями молекул с π-системами конъюгированных молекул, таких как бензол . [ 3 ]
Если взаимодействие
[ редактировать ]
π-π-взаимодействия связаны с взаимодействием между π -орбиталями молекулярной системы. [ 3 ] Высокая поляризуемость ароматических колец приводит к дисперсионным взаимодействиям как основной вклад в так называемые эффекты укладки . Они играют важную роль для взаимодействия нуклеобаз, например в ДНК. [ 19 ] Для простого примера бензоловое кольцо с его полностью конъюгированным π -облаком будет взаимодействовать двумя основными способами (и одним незначительным способом) с соседним бензольным кольцом через π -π -взаимодействие (см. Рисунок 3). Два основных способа, которыми стеки бензола являются краями в лице, с энтальпией ~ 2 ккал/моль и смещенными (или сложенными), с энтальпией ~ 2,3 ккал/моль. [ 3 ] Конфигурация сэндвича не так устойчива в взаимодействии, как ранее два, упомянутые из -за высокого электростатического отталкивания электронов на π -орбиталях. [ 3 ]
Катион - π и анион -π -взаимодействие
[ редактировать ]
Катион-PI взаимодействия включают положительный заряд катиона, взаимодействующего с электронами в π-систему молекулы. [ 3 ] Это взаимодействие на удивление сильное (так же сильное или сильное, чем H-связывание в некоторых контекстах), [ 3 ] и имеет много потенциальных применений в химических датчиках. [ 20 ] Например, ион натрия может легко сидеть на вершине π -облака молекулы бензола с C 6 симметрией (см. Рисунок 4).
Анион -π -взаимодействия очень похожи на катион -π -взаимодействия, но обращаются. В этом случае анион находится на вершине π-системы, плотной с электроном, обычно устанавливаемым путем размещения заместителей электронов на конъюгированную молекулу [ 21 ]

Полярное
[ редактировать ]Полярные взаимодействия включают молекулы с постоянными диполями (такими как вода), взаимодействующие с квадрупольным моментом π-системы (например, в бензоле (см. Рисунок 5). Хотя это не так сильное, как катион-π-взаимодействие, эти взаимодействия могут быть довольно сильными (~ 1-2 ккал/моль), и обычно участвуют в складывании белка и кристалличности твердых веществ, содержащих как водородную связь, так и π-систем. [ 3 ] Фактически, любая молекула с донором водородных связей (водород, связанный с высокоэлектроотрицательным атом), будет иметь благоприятные электростатические взаимодействия с богатой электронами π-системой конъюгированной молекулы. [ Цитация необходима ]
Гидрофобный эффект
[ редактировать ]Гидрофобный эффект -это стремление к неполярным молекулам агрегировать в водных растворах, чтобы отделиться от воды. [ 22 ] Это явление приводит к минимальной открытой площади поверхности неполярных молекул к молекулам полярной воды (обычно сферических капель) и обычно используется в биохимии для изучения складывания белка и других различных биологических явлений. [ 22 ] Эффект также обычно наблюдается при смешивании различных масел (включая растительное масло) и воду. Со временем нефть, сидящее на вершине воды, начнет объединяться в большие сплюснутые сферы из более мелких капель, что в конечном итоге приводит к пленке всего масла, сидящего на луже воды. Однако гидрофобный эффект не считается нековалентным взаимодействием, поскольку оно является функцией энтропии, а не специфического взаимодействия между двумя молекулами, обычно характеризующимися энтропией. [ 23 ] [ 24 ] [ 25 ] По существу энтальпический гидрофобный эффект материализуется, если ограниченное количество молекул воды ограничено внутри полости; Смещение таких молекул воды лигандом освобождает молекулы воды, которые затем в объемной воде имеют максимум водородных связей около четырех. [ 26 ] [ 27 ]
Примеры
[ редактировать ]Дизайн наркотиков
[ редактировать ]Большинство фармацевтических препаратов представляют собой небольшие молекулы, которые вызывают физиологический ответ путем «связывания» с ферментами или рецепторами , вызывая увеличение или уменьшение способности фермента функционировать. Связывание небольшой молекулы с белком регулируется комбинацией стерических или пространственных соображений, в дополнение к различным нековалентным взаимодействиям, хотя некоторые препараты ковалентно модифицируют активное сайт (см. Необратимые ингибиторы ). Используя «модель блокировки и ключа», связывающего фермента, препарат (ключ) должен быть примерно из правильных размеров, чтобы соответствовать сайту связывания фермента (блокировка). [ 28 ] Используя молекулярное каркас соответствующего размера, препараты также должны взаимодействовать с ферментом нековалентно, чтобы максимизировать постоянную константу связывания связывания и уменьшить способность лекарственного средства отделяться от сайта связывания . Это достигается путем формирования различных нековалентных взаимодействий между малой молекулой и аминокислотами в сайте связывания, включая: водородную связь , электростатические взаимодействия , укладывание PI , взаимодействия ван дер-ваальса и диполь-дипольные взаимодействия .
Нековалентные лекарства металло были разработаны. Например, динуклеарные тройные соединения, в которых были приготовлены три нити лигандов, приводящих к примерно цилиндрическому тетрации. Эти соединения связываются с менее сообщаемыми структурами нуклеиновой кислоты, такими как дуплексная ДНК, Y-образная вилка и 4-направленные соединения. [ 29 ]
Складывание и структура белка
[ редактировать ]Складывание белков из первичной (линейной) последовательности аминокислот в трехмерную структуру направляется всеми типами нековалентных взаимодействий , включая гидрофобные силы и образование внутримолекулярных водородных связей . Трехмерные структуры белков , включая вторичные и третичные структуры , стабилизируются путем образования водородных связей. Благодаря серии небольших конформационных изменений, пространственная ориентация модифицируется так, чтобы достичь наиболее энергетически минимизированной ориентации, достижимой. Складывание белков часто облегчается ферментами, известными как молекулярные шапероны . [ 30 ] Стерика , штамм связи и угловой штамм также играют основные роли в складывании белка от его первичной последовательности до ее третичной структуры.
Односторонние структуры белка также могут собираться с образованием белковых комплексов, состоящих из множества независимо сложенных субъединиц. белка В целом это называется четвертичной структурой . Четвертичная структура генерируется образованием относительно сильных нековалентных взаимодействий, таких как водородные связи, между различными субъединицами для генерации функционального полимерного фермента. [ 31 ] Некоторые белки также используют нековалентные взаимодействия для связывания кофакторов в активном сайте во время катализа, однако кофактор также может быть ковалентно прикреплен к ферменту. Кофакторы могут быть либо органическими, либо неорганическими молекулами, которые помогают в каталитическом механизме активного фермента. Сила, с которой кофактор связан с ферментом, может сильно различаться; Нековалентно связанные кофакторы обычно закреплены водородными связями или электростатическими взаимодействиями .
Точки кипения
[ редактировать ]Нековалентные взаимодействия оказывают значительное влияние на точку кипения жидкости. Точка кипения определяется как температура, при которой давление пара жидкости равна давлению, окружающему жидкость. Проще говоря, это температура, при которой жидкость становится газом . Как и следовало ожидать, чем сильнее нековалентные взаимодействия, присутствующие для вещества, тем выше его температура кипения. Например, рассмотрим три соединения сходного химического состава: N-бутоксид натрия (C 4 H 9 ONA), диэтиловый эфир (C 4 H 10 O) и N-бутанол (C 4 H 9 OH).

Преобладающие нековалентные взаимодействия, связанные с каждым видом в растворе, перечислены на приведенной выше рисунке. Как обсуждалось ранее, ионные взаимодействия требуют значительно большей энергии для разрыва, чем водородные связи , которые, в свою очередь, требуют большей энергии, чем диполь -дипольные взаимодействия . Тенденции, наблюдаемые в их точках кипения (рис. 8), показывают точно ожидаемую корреляцию, где N-бутоксид натрия требует значительно большей тепловой энергии (более высокая температура), чем N-бутанол, который кипит при гораздо более высокой температуре, чем диэтиловый эфир. Тепловая энергия, необходимая для того, чтобы соединение переходило из жидкости на газ, связана с энергией, необходимой для разрушения межмолекулярных сил, каждая молекула испытывает в своем жидком состоянии.
Ссылки
[ редактировать ]- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Глоссарий" . Молекулярная клеточная биология (4 -е изд.). Нью -Йорк: WH Freeman. ISBN 978-0-7167-3136-8 .
- ^ Jump up to: а беременный Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). «Нековалентные связи» . Молекулярная клеточная биология (4 -е изд.). Нью -Йорк: WH Freeman. ISBN 978-0-7167-3136-8 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж Анслин Е. (2004). Современная физическая органическая химия . Sausalito, CA: Университетская наука. ISBN 978-1-891389-31-3 .
- ^ Schalley CA (март 2012 г.). «Введение» (PDF) . Аналитические методы в супрамолекулярной химии (2 -е изд.). Уайли. ISBN 978-3-527-32982-3 .
- ^ Jump up to: а беременный Cockroft SL, Hunter CA (февраль 2007 г.). «Химические двойные циклы: анализ нековалентных взаимодействий». Обзоры химического общества . 36 (2): 172–188. doi : 10.1039/b6038442p . PMID 17264921 .
- ^ Jump up to: а беременный Brown TL, Bursten BE, Eugene H, Lemay H (2009). Химия: центральная наука (11 -е изд.). Верхняя седл -река, Нью -Джерси: Пирсон Прентис Холл. ISBN 978-0-13-600617-6 .
- ^ Эйслер М. (2010). «Самосборка». Энциклопедия нанонауки и общества . Тысяча Оукс, Калифорния: Мудрец. doi : 10.4135/9781412972093.n412 . ISBN 978-1-4129-7209-3 .
- ^ Бидерманн Ф., Шнайдер Х.Дж. (май 2016 г.). «Экспериментальные энергии связывания в супрамолекулярных комплексах». Химические обзоры . 116 (9): 5216–5300. doi : 10.1021/acs.chemrev.5b00583 . PMID 27136957 .
- ^ Ciferri A, Perico A, Eds. (2012). Ионные взаимодействия в естественных и синтетических макромолекулах . Джон Уайли и сыновья. ISBN 978-0-470-52927-0 .
- ^ Schneider HJ (2009). «Механизмы связывания в супрамолекулярных комплексах». Angewandte Chemie . 48 (22): 3924–3977. doi : 10.1002/anie.200802947 . PMID 19415701 .
- ^ Авраам М.Х. (1993). «Шкалы растворенного водородного связывания: их конструкция и применение к физико-химическим и биохимическим процессам». Химический Соц Преподобный 22 (2): 73–83. doi : 10.1039/cs9932200073 .
- ^ Raevsky OA, Skvortsov vs (июнь 2005 г.). «Количественная оценка водородной связи в QSAR и молекулярном моделировании». SAR и QSAR в экологических исследованиях . 16 (3): 287–300. doi : 10.1080/10659360500036893 . PMID 15804815 . S2CID 34132761 .
- ^ Jump up to: а беременный «Индуцированные дипольные силы» . Получено 11 ноября 2013 года .
- ^ Кажется, ред. (2015). Нековалентные силы . Пружины. ISBN 978-3-319-14162-6 .
- ^ Otero de la Roza A, Dilabio GA, Eds. (2017). Нековалентные взаимодействия в квантовой химии и физике: теория и применение . Elsevier. ISBN 978-0-12-809835-6 .
- ^ Махаррамов А.М., Махмудов К.Т., Копилович М.Н., Помбейро А.Дж. (2016). Нековалентные взаимодействия в синтезе и дизайне новых соединений . Уайли. ISBN 978-1-119-10989-1 .
- ^ Hobza P, Müller-Dethlefs K (2009). Нековалентные взаимодействия: теория и эксперимент . Теоретическая и вычислительная химическая серия. Королевское общество химии. ISBN 978-1-84755-853-4 .
- ^ Schneider HJ (июль 2015 г.). «Дисперсивные взаимодействия в комплексах решений». Счета химических исследований . 48 (7): 1815–1822. doi : 10.1021/acs.accounts.5b00111 . PMID 26083908 .
- ^ Райли Ке, Хобза П (апрель 2013 г.). «О важности и происхождении ароматических взаимодействий в химии и биодисциплинах». Счета химических исследований . 46 (4): 927–936. doi : 10.1021/ar300083h . PMID 22872015 .
- ^ Махадеви А.С., Састр Г.Н. (март 2013 г.). «Катион-π-взаимодействие: его роль и актуальность в химии, биологии и материальной науке». Химические обзоры . 113 (3): 2100–2138. doi : 10.1021/cr3002222d . PMID 23145968 .
- ^ Quinon D, Garau C, Roger C, Border A, Corkbow P, Coast A, Deyà PM (сентябрь 2002 г.). "Анион-Pi взаимодействия: существует?" Angewandte Chemie 41 (18): 3389–3392. два 10.1002/1521-3773(20020916)41:18<3389::AID-ANIE3389>3.0.CO;2-S: 12298041PMID
- ^ Jump up to: а беременный IUPAC (2009). «Гидрофобное взаимодействие» . Сборник химической терминологии . doi : 10.1351/goldbook.h02907 . ISBN 978-0-9678550-9-7 Полем Получено 11 ноября 2013 года .
- ^ Кронберг Б. (2016). «Гидрофобный эффект». Карт Мнение Coll. Интерфейс Sci . 22 : 14–22. doi : 10.1016/j.cocis.2016.02.001 .
- ^ Hillyer MB, Gibb BC (май 2016 г.). «Молекулярная форма и гидрофобный эффект» . Ежегодный обзор физической химии . 67 : 307–329. BIBCODE : 2016ARPC ... 67..307H . doi : 10.1146/annurev-physchem-040215-112316 . PMC 5571648 . PMID 27215816 .
- ^ Бен-Амоц Д. (май 2016 г.). «Водопосредованные гидрофобные взаимодействия» . Ежегодный обзор физической химии . 67 : 617–638. BIBCODE : 2016ARPC ... 67..617B . doi : 10.1146/annurev-physchem-040215-112412 . PMID 27215821 .
- ^ Snyder PW, Lockett MR, Moustakas DT, Whitesides GM (2014). "Это форма полости или форма воды в полости?" Полем Европейский физический журнал Специальные темы . 223 (5): 853–891. BIBCODE : 2014EPJST.223..853S . doi : 10.1140/epjst/e2013-01818-y . S2CID 17572997 .
- ^ Бидерманн Ф., Нау В.М., Шнайдер Х.Дж. (октябрь 2014 г.). «Пересмотренный гидрофобный эффект-штурмы с супрамолекулярными комплексами подразумевают высокоэнергетическую воду в качестве нековалентной движущей силы». Angewandte Chemie . 53 (42): 11158–11171. doi : 10.1002/anie.201310958 . PMID 25070083 .
- ^ «Биомолекулы: ферменты» . Чемнориты . Университет Висконсина - Мэдисон . Получено 27 октября 2013 года .
- ^ Cardo L, Hannon MJ (февраль 2018 г.). Sigel A, Sigel H, Freisinger E, Sigel Rk (Eds.). «Нековалентные металлосы: использование формы для нацеливания на ДНК и РНК-соединения и другие структуры нуклеиновой кислоты». Металлические ионы в науках о жизни . 18 De Gruyter GmbH: 303–324. doi : 10.1515/9783110470734-017 . ISBN 978-3-11-047073-4 Полем PMID 29394030 .
- ^ Voet D, Voet JG (2010). Биохимия (4 -е изд.). Хобокен, Нью -Джерси: Джон Вили и сыновья. ISBN 978-0-470-57095-1 .
- ^ Silverman RB (2004). Органическая химия дизайна лекарств и действия лекарств (2. Изд.). Амстердам [UA]: Elsevier. ISBN 978-0-12-643732-4 .