Бромид золота(III)

| |

| |
| Имена | |
|---|---|
| Другие имена
Бромид золота
Бромид золота Бромид золота(III) Трибромид золота Гексабромид дизолота | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.582 |
| Номер ЕС |
|
| 164245 | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| AuBr 3 | |
| Молярная масса | 436.679 g·mol −1 |
| Появление | кристаллы от темно-красного до черного цвета |
| Температура плавления | 97,5 ° C (207,5 ° F; 370,6 К) |
| Слегка растворим [ 1 ] | |
| Опасности | |
| СГС Маркировка : [ 2 ] | |

| |
| Опасность | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P302+P361+P354 , P304+P340 , P305+P354+P338 , P316 , P321 , P363 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Бромид золота(III) представляет собой кристаллическое твердое вещество от темно-красного до черного цвета. [ 3 ] [ 4 ] [ 5 ] Имеет эмпирическую формулу AuBr 3 , но существует в виде димера с молекулярной формулой Au 2 Br 6 , в котором два атома золота соединены двумя атомами брома. [ 4 ] [ 5 ] [ 6 ] Его обычно называют бромидом золота (III), трибромидом золота и редко, но традиционно, бромидом золота, а иногда и гексабромидом дизолота. Аналогичные трибромиды меди или серебра не существуют. [ 7 ]
История
[ редактировать ]Первые упоминания о каких-либо исследованиях или изучении галогенидов золота относятся к началу-середине 19 века, и есть три основных исследователя, связанных с обширными исследованиями в этой конкретной области химии: Томсен, Шоттлендер и Крюсс. [ 8 ] [ 9 ] [ 10 ] [ 11 ]
Структура
[ редактировать ]Бромид золота (III) принимает структуры, наблюдаемые для других димерных соединений тригалогенида золота (III), таких как хлорид . Золотые центры демонстрируют плоскую квадратную координацию с валентными углами примерно 90 градусов. [ 5 ] [ 6 ]
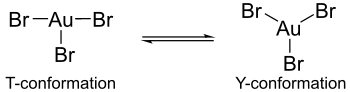
Расчеты показывают, что в гипотетических мономерных формах тригалогенидов золота эффект Яна-Теллера приводит к возникновению различий в строении галогенидных комплексов золота. Например, бромид золота(III) содержит одну длинную и две короткие связи золото-бром, тогда как хлорид золота(III) и фторид золота(III) состоят из двух длинных и одной короткой связи золото-галоген. [ 6 ] Более того, трибромид золота не обладает такой же координацией вокруг центрального атома золота, как трихлорид или трифторид золота. В последних комплексах координация имеет Т-конформацию, но в трибромиде золота координация существует как скорее динамический баланс между Y-конформацией и Т-конформацией. Эту координационную разницу можно объяснить эффектом Яна-Теллера, но в большей степени уменьшением π-обратной связи атомов золота с бромными лигандами по сравнению с π-обратной связью, обнаруженной с лигандами фтора и хлора. Именно это уменьшение π-обратной связи объясняет, почему трибромид золота менее стабилен, чем его трифторидные и трихлоридные аналоги. [ 6 ]
Подготовка
[ редактировать ]Наиболее распространенный метод синтеза бромида золота (III) - нагревание золота и избытка жидкого брома при 140 ° C: [ 3 ]
- 2 Au + 3 Br 2 → Au 2 Br 6
Альтернативно, реакция галоидного обмена хлорида золота (III) с бромистоводородной кислотой также оказалась успешной при синтезе бромида золота (III): [ 12 ]
- Au 2 Cl 6 + 6 HBr → 6 HCl + Au 2 Br 6
Химические свойства
[ редактировать ]Золото (III) демонстрирует квадратно-плоскую координационную геометрию. [ 5 ]
Тригалогениды золота (III) образуют множество четырехкоординированных аддуктов. [ 4 ] Одним из примеров является гидрат AuBr 3 ·H 2 O . Другим хорошо известным аддуктом является аддукт с тетрагидротиофеном . [ 13 ] Также известен тетрабромид:
- HBr + AuBr 3 → H + [Авр 4 ] −
Использование
[ редактировать ]Каталитическая химия
[ редактировать ]Бромид золота(III) катализирует множество реакций. В одном примере он катализирует реакцию Дильса-Альдера ениналя и карбонила . [ 14 ]
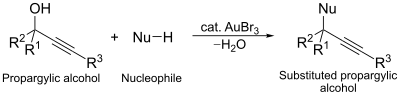
Другое каталитическое применение трибромида золота - реакция нуклеофильного замещения пропаргиловых спиртов. В этой реакции комплекс золота служит агентом, активирующим спирт, облегчающим замещение. [ 15 ]
Обнаружение кетамина
[ редактировать ]Бромид золота(III) можно использовать в качестве реагента для проверки присутствия кетамина . [ 16 ]
0.25% Приготовление AuBr 3 0,1 М NaOH дает коричнево-желтый раствор. Две капли этого раствора добавляются в пятно и небольшое количество кетамина. Смесь дает темно-фиолетовый цвет примерно за одну минуту, который примерно за две минуты превращается в темный черновато-фиолетовый цвет.
Ацетаминофен , аскорбиновая кислота , героин , лактоза , маннит , морфин и сахароза вызывают мгновенное изменение цвета на фиолетовый, как и другие соединения с фенольными и гидроксильными группами.
Ничто, обычно встречающееся в сочетании с кетамином, не вызывало такого же изменения цвета за одно и то же время.
«Первоначальный фиолетовый цвет может быть следствием образования комплекса между золотом и кетамином. Причина изменения цвета с фиолетового на тёмно-черно-фиолетовый неизвестна; однако это может быть следствием окислительно-восстановительной реакции, в результате которой образуется небольшое количество коллоидного золота ». [ 16 ]
Ссылки
[ редактировать ]- ^ «Бромид золота (III) 99,999% микроэлементов» . Сигма Олдрич . Проверено 27 мая 2021 г.
- ^ «Трибромид золота» . pubchem.ncbi.nlm.nih.gov .
- ^ Jump up to: а б Макинтайр, Дж. Э. (ред.) Словарь неорганических соединений ; Чепмен и Холл: Лондон, 1992; том. 1, стр. 121
- ^ Jump up to: а б с Гринвуд, штат Нью-Йорк; Эрншоу, А. Химия элементов ; Баттерворт-Хейнеман: Оксфорд, 1997; стр. 1183-1185
- ^ Jump up to: а б с д Коттон, ФА; Уилкинсон, Г.; Мурильо, Калифорния; Бохманн, М. Передовая неорганическая химия ; Джон Уайли и сыновья: Нью-Йорк, 1999; стр. 1101-1102
- ^ Jump up to: а б с д Шульц, А.; Харгиттай, М. Хим. Время. Дж. 2001 , вып. 7, с. 3657-3670
- ^ Швердтфегер, PJ Am. хим. 1989 , вып. 111, стр. 7261-7262.
- ^ Ленгефилд, FJ Am. хим. Соц. 1901 , вып. 26, с. 324
- ^ Thomsen, J. J. prakt. Chem. 1876 , vol. 13, pp. 337
- ^ Шоттлендер, Юстус Либигс Энн. хим. , вып. 217, стр. 312
- ^ Крусс, Г. Бер. Немецкий. хим. 1887 , т. 1, с. 20, стр. 2634
- ^ Делл'Амико, Д.Б.; Кальдераццо, Ф.; Морвилло, А.; Пелицци, Дж; Робино, PJ Chem. Soc., Далтон Транс. 1991, стр. 3009-3016
- ^ Ноттингем, Крис; Барбер, Верити; Lloyd-Jonesjournal = Органический синтез, Гай К. (2019). «Катализируемое золотом окислительное сочетание аренов и арилсиланов». Орг. Синтез . 96 : 150–178. дои : 10.15227/orgsyn.096.0150 .
- ^ Асао, Н.; Айкава, Х.; Ямамото, YJ Am. хим. Соц. 2004 , вып. 126, с. 7458-7459
- ^ Георгий, М.; Букар, В.; Кампания, JJ Am. Соц. 2005 , вып. 127, с. 14180-14181
- ^ Jump up to: а б Сарвар, Мохаммед. «Новый высокоспецифичный цветовой тест на кетамин» . Микрограмма . Управление по борьбе с наркотиками. Архивировано из оригинала 17 октября 2010 г. Проверено 26 января 2012 г.