Атрофия мышц
| Атрофия мышц | |
|---|---|
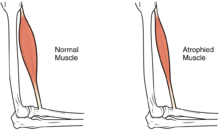 | |
| Размер мышцы уменьшается, как следствие происходит потеря силы и подвижности. | |
| Специальность | Физическая медицина и реабилитация |
Мышечная атрофия – это потеря массы скелетных мышц . Это может быть вызвано обездвиженностью , старением, недоеданием , приемом лекарств или широким спектром травм или заболеваний, которые влияют на скелетно-мышечную или нервную систему . Атрофия мышц приводит к мышечной слабости и инвалидности.
Неиспользование вызывает быструю мышечную атрофию и часто возникает во время травм или заболеваний, требующих иммобилизации конечности или постельного режима. В зависимости от продолжительности неиспользования и состояния здоровья человека, это может быть полностью обращено вспять с помощью активности. Недоедание сначала приводит к потере жира, но при длительном голодании может привести к атрофии мышц и может быть обращено вспять с помощью диетотерапии. Напротив, кахексия — это синдром истощения, вызванный основным заболеванием, например раком, который вызывает резкую мышечную атрофию и не может быть полностью устранен с помощью диетотерапии. Саркопения — это возрастная мышечная атрофия, которую можно замедлить с помощью физических упражнений. Наконец, заболевания мышц, такие как мышечная дистрофия или миопатии, могут вызвать атрофию, а также повреждение нервной системы, например, при травме спинного мозга или инсульте . Таким образом, мышечная атрофия обычно является проявлением ( признаком или симптомом ) заболевания, а не заболеванием сама по себе. Однако некоторые синдромы мышечной атрофии классифицируются как спектры заболеваний или болезненные формы, а не просто как клинические синдромы, например различные синдромы. спинальная мышечная атрофия .
Мышечная атрофия возникает в результате дисбаланса между синтезом белка и его деградацией, хотя механизмы до конца не изучены и варьируются в зависимости от причины. Потерю мышечной массы можно оценить количественно с помощью расширенных визуализирующих исследований, но это делается нечасто. Лечение зависит от основной причины, но часто включает физические упражнения и адекватное питание. Анаболические агенты могут иметь некоторую эффективность, но не часто используются из-за побочных эффектов. В настоящее время исследуются многочисленные методы лечения и добавки, но в настоящее время в клинической практике имеется ограниченное количество вариантов лечения. Учитывая последствия мышечной атрофии и ограниченные возможности лечения, минимизация неподвижности имеет решающее значение при травмах или заболеваниях.
Признаки и симптомы
[ редактировать ]Отличительным признаком мышечной атрофии является потеря мышечной массы. Это изменение может быть трудно обнаружить из-за ожирения, изменений жировой массы или отеков. Изменения веса, окружности конечностей или талии не являются надежными индикаторами изменений мышечной массы. [1]
Преобладающим симптомом является усиление слабости, что может привести к затруднениям или неспособности выполнять физические задачи в зависимости от того, какие мышцы поражены. Атрофия мышц корпуса или ног может вызывать трудности с вставанием из положения сидя, ходьбой или подъемом по лестнице, а также может привести к увеличению частоты падений. Атрофия мышц горла может вызвать затруднение глотания, а атрофия диафрагмы может вызвать затруднение дыхания. Атрофия мышц может протекать бессимптомно и оставаться незамеченной до тех пор, пока не будет потеряно значительное количество мышц. [2]
Причины
[ редактировать ]
Скелетные мышцы служат местом хранения аминокислот , креатина , миоглобина и аденозинтрифосфата , которые можно использовать для производства энергии, когда потребность в них высока, а запасы низкие. Если метаболические потребности превышают синтез белка, мышечная масса теряется. [3] Многие заболевания и состояния могут привести к такому дисбалансу либо из-за самой болезни, либо из-за связанных с ней изменений аппетита, таких как потеря вкуса из-за Covid-19 . Причины мышечной атрофии включают обездвиженность, старение, недоедание , некоторые системные заболевания ( рак , застойная сердечная недостаточность ; хроническая обструктивная болезнь легких ; СПИД , заболевания печени и т. д.), деиннервация, внутренние мышечные заболевания или прием лекарств (например, глюкокортикоидов ). [4]
Неподвижность
[ редактировать ]Неиспользование является распространенной причиной мышечной атрофии и может быть локальным (из-за травмы или гипсовой повязки) или общим (постельный режим). Скорость мышечной атрофии из-за неиспользования (10–42 дня) составляет примерно 0,5–0,6% от общей мышечной массы в день, хотя между людьми существуют значительные различия. [5] Пожилые люди наиболее уязвимы к резкой потере мышечной массы из-за обездвиженности. В большинстве авторитетных исследований изучалось длительное неиспользование (> 10 дней), при котором мышцы повреждаются в первую очередь из-за снижения скорости синтеза мышечного белка, а не из-за изменений в распаде мышечного белка. Имеются данные, позволяющие предположить, что во время кратковременной неподвижности (<10 дней) может происходить более активный распад белка. [5]
Кахексия
[ редактировать ]Некоторые заболевания могут вызвать сложный синдром атрофии мышц, известный как кахексия . Его часто наблюдают при раке, застойной сердечной недостаточности , хронической обструктивной болезни легких , хронической болезни почек и СПИДе, хотя он связан со многими болезненными процессами, обычно со значительным воспалительным компонентом. Кахексия вызывает постоянную потерю мышечной массы, которую не полностью устраняет диетотерапия. [6] Патофизиология до конца не изучена, но воспалительные цитокины считается, что играют центральную роль. В отличие от потери веса из-за недостаточного потребления калорий, кахексия вызывает преимущественно потерю мышечной массы, а не потери жира, и она не так хорошо реагирует на диетическое вмешательство. Кахексия может значительно ухудшить качество жизни и функциональный статус и связана с плохими исходами. [7] [8]
Саркопения
[ редактировать ]Саркопения – это дегенеративная потеря массы, качества и силы скелетных мышц, связанная со старением. Это включает мышечную атрофию, уменьшение количества мышечных волокон и сдвиг в сторону «медленно сокращающихся» волокон скелетных мышц I типа по сравнению с «быстро сокращающимися» волокнами II типа . [3] Скорость потери мышечной массы зависит от уровня физической нагрузки, сопутствующих заболеваний, питания и других факторов. Существует множество предполагаемых механизмов саркопении, таких как снижение способности к окислительному фосфорилированию, клеточное старение или изменение передачи сигналов путей, регулирующих синтез белка. [9] и считается результатом изменений в сигнальных путях мышечного синтеза и постепенного отказа сателлитных клеток , которые помогают регенерировать волокна скелетных мышц, особенно в «быстро сокращающихся» миофибрах. [10]
Саркопения может привести к снижению функционального статуса и вызвать значительную инвалидность, но является состоянием, отличным от кахексии, хотя они могут сосуществовать. [8] [11] В 2016 году был выпущен код МКБ саркопении, что способствовало ее признанию в качестве заболевания. [12]
Внутренние мышечные заболевания
[ редактировать ]

Мышечные заболевания, такие как мышечная дистрофия , боковой амиотрофический склероз (БАС) или миозит, такой как миозит с включенными тельцами, могут вызвать мышечную атрофию. [13]
Поражение центральной нервной системы
[ редактировать ]Повреждение нейронов головного или спинного мозга может вызвать выраженную мышечную атрофию. Это может быть локализованная мышечная атрофия и слабость или паралич, например, при инсульте или травме спинного мозга . [14] Более распространенные повреждения, такие как черепно-мозговая травма или церебральный паралич, могут вызвать генерализованную мышечную атрофию. [15]
Поражение периферической нервной системы
[ редактировать ]Травмы или заболевания периферических нервов, иннервирующих определенные мышцы, также могут вызвать мышечную атрофию. Это наблюдается при повреждении нерва в результате травмы или хирургического осложнения, ущемления нерва или наследственных заболеваний, таких как болезнь Шарко-Мари-Тута . [16]
Лекарства
[ редактировать ]Известно, что некоторые лекарства вызывают атрофию мышц, обычно из-за прямого воздействия на мышцы. Сюда входят глюкокортикоиды, вызывающие глюкокортикоидную миопатию. [4] или лекарства, токсичные для мышц, такие как доксорубицин . [17]
Эндокринопатии
[ редактировать ]заболевания эндокринной системы, такие как болезнь Кушинга или гипотиреоз, вызывают мышечную атрофию. Известно, что [18]
Патофизиология
[ редактировать ]Атрофия мышц возникает из-за дисбаланса между нормальным балансом между синтезом белка и его деградацией. Это включает в себя сложную клеточную передачу сигналов, которая до конца не изучена, а мышечная атрофия, вероятно, является результатом множества механизмов, способствующих этому. [19]
Митохондриальная функция имеет решающее значение для здоровья скелетных мышц, и вредные изменения на уровне митохондрий могут способствовать мышечной атрофии. [20] Снижение плотности и качества митохондрий постоянно наблюдается при мышечной атрофии из-за неиспользования. [20]
АТФ - зависимый путь убиквитин / протеасома является одним из механизмов разрушения белков в мышцах. Это включает в себя пометку конкретных белков для разрушения с помощью небольшого пептида, называемого убиквитином , который позволяет протеасоме распознавать деградацию белка. [21]
Диагностика
[ редактировать ]Скрининг мышечной атрофии ограничен отсутствием установленных диагностических критериев, хотя многие из них были предложены. диагностические критерии других состояний, таких как саркопения или кахексия . Могут использоваться [3] Эти синдромы также можно выявить с помощью скрининговых анкет. [ нужна ссылка ]
Мышечную массу и изменения можно оценить количественно с помощью визуализирующих исследований, таких как компьютерная томография или магнитно-резонансная томография (МРТ) . Биомаркеры, такие как мочевина в моче , можно использовать для приблизительной оценки потери мышечной массы в условиях быстрой потери мышечной массы. [22] Другие биомаркеры в настоящее время находятся на стадии изучения, но не используются в клинической практике. [3]
Уход
[ редактировать ]Атрофию мышц можно отсрочить, предотвратить, а иногда и обратить вспять с помощью лечения. Подходы к лечению включают воздействие на сигнальные пути, которые вызывают мышечную гипертрофию или замедление распада мышц, а также оптимизацию статуса питания. [ нужна ссылка ]
Физическая активность обеспечивает значительный анаболический стимул мышц и является важнейшим компонентом замедления или обращения вспять мышечной атрофии. [3] До сих пор неизвестно, какова идеальная «дозировка» упражнений. Было доказано, что упражнения с отягощениями полезны для уменьшения мышечной атрофии у пожилых людей. [23] [24] У пациентов, которые не могут заниматься спортом из-за физических ограничений, таких как параплегия, функциональную электростимуляцию . для внешней стимуляции мышц можно использовать [25]
Адекватное количество калорий и белка имеет решающее значение для предотвращения атрофии мышц. Потребности в белке могут существенно различаться в зависимости от метаболических факторов и состояния заболевания, поэтому добавки с высоким содержанием белка могут быть полезными. [3] Добавки белка или аминокислот с разветвленной цепью , особенно лейцина, могут стимулировать синтез мышц и ингибировать распад белка, а также изучались при мышечной атрофии при саркопении и кахексии. [3] [26] β-Гидрокси-β-метилбутират (HMB), метаболит лейцина , который продается в качестве пищевой добавки , продемонстрировал эффективность в предотвращении потери мышечной массы при некоторых состояниях атрофии мышц у людей, особенно при саркопении . [26] [27] [28] На основании метаанализа семи рандомизированных контролируемых исследований , опубликованного в 2015 году, прием добавок HMB эффективен в качестве лечения для сохранения мышечной массы у пожилых людей. [29] Необходимы дополнительные исследования, чтобы определить точное влияние HMB на мышечную силу и функцию в различных группах населения. [29]
В тяжелых случаях мышечной атрофии пациентам в качестве потенциального лечения можно назначать анаболические стероиды, такие как метандростенолон, хотя их использование ограничено побочными эффектами. Новый класс препаратов, называемый селективными модуляторами андрогенных рецепторов , исследуется с многообещающими результатами. Они будут иметь меньше побочных эффектов , но при этом будут способствовать росту и регенерации мышечной и костной ткани. Эти эффекты еще предстоит подтвердить в более крупных клинических исследованиях. [30]
Результаты
[ редактировать ]Исходы мышечной атрофии зависят от основной причины и состояния здоровья пациента. Неподвижность или постельный режим в группах населения, предрасположенных к мышечной атрофии, таких как пожилые люди или люди с болезненными состояниями, которые обычно вызывают кахексию , могут вызвать резкую мышечную атрофию и повлиять на функциональные результаты. У пожилых людей это часто приводит к снижению биологического резерва и повышенной уязвимости к стрессорам, известным как « синдром слабости ». [3] Потеря мышечной массы тела также связана с повышенным риском инфекций, снижением иммунитета и плохим заживлением ран. Слабость, которая сопровождает мышечную атрофию, приводит к более высокому риску падений, переломов, физической инвалидности, потребности в стационарном уходе, снижению качества жизни, увеличению смертности и увеличению затрат на здравоохранение. [3]
Другие животные
[ редактировать ]Бездействие и голодание у млекопитающих приводят к атрофии скелетных мышц, сопровождающейся меньшим количеством и размером мышечных клеток, а также меньшим содержанием белка. [31] Известно, что у людей длительные периоды иммобилизации, например, в случае постельного режима или полета космонавтов в космос, приводят к ослаблению и атрофии мышц. Подобные последствия наблюдаются и у мелких млекопитающих, впадающих в спячку, таких как золотопокрытые суслики и бурые летучие мыши. [32]
Медведи — исключение из этого правила; Виды семейства Ursidae известны своей способностью переживать неблагоприятные условия окружающей среды, низкие температуры и ограниченную доступность питания в зимний период посредством спячки . За это время медведи претерпевают ряд физиологических, морфологических и поведенческих изменений. [33] Их способность сохранять количество и размер скелетных мышц во время неиспользования имеет важное значение. [ нужна ссылка ]
Во время спячки медведи проводят 4–7 месяцев в бездействии и анорексии, не подвергаясь атрофии мышц и потере белка. [32] Несколько известных факторов способствуют поддержанию мышечной ткани. Летом медведи пользуются доступностью питания и накапливают мышечный белок. Белковый баланс во время покоя также поддерживается за счет более низкого уровня распада белка в зимний период. [32] Во время неподвижности атрофия мышц у медведей также подавляется протеолитическим ингибитором, который высвобождается в кровообращение. [31] Другим фактором, способствующим поддержанию мышечной силы у спящих медведей, является возникновение периодических произвольных сокращений и непроизвольных сокращений от дрожи во время оцепенения . [34] Три-четыре ежедневных эпизода мышечной активности отвечают за поддержание мышечной силы и реакции медведей во время спячки. [34]
Доклинические модели
[ редактировать ]Мышечную атрофию можно вызвать на доклинических моделях (например, на мышах) для изучения эффектов терапевтических вмешательств против мышечной атрофии. Ограничение диеты, то есть ограничение калорий, приводит к значительной потере мышечной массы в течение двух недель, а потерю мышечной массы можно компенсировать с помощью диетического вмешательства. [35] Иммобилизация одной из задних ног мышей также приводит к атрофии мышц и характеризуется потерей как мышечной массы, так и силы. Ограничение приема пищи и иммобилизация могут использоваться на моделях мышей, и было показано, что они частично совпадают с механизмами, связанными с саркопенией у людей. [36]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Дев Р. (январь 2019 г.). «Измерительные критерии диагностики кахексии» . Анналы паллиативной медицины . 8 (1): 24–32. дои : 10.21037/ап.2018.08.07 . ПМИД 30525765 .
- ^ Кретою С.М., Зуграву, Калифорния (2018). «Аспекты питания для предотвращения атрофии мышц». В Сяо Дж (ред.). Атрофия мышц . Достижения экспериментальной медицины и биологии. Том. 1088. Спрингер Сингапур. стр. 497–528. дои : 10.1007/978-981-13-1435-3_23 . ISBN 9789811314346 . ПМИД 30390267 .
- ^ Jump up to: а б с д и ж г час я Аргилес Х.М., Кампос Н., Лопес-Педроса Х.М., Руэда Р., Родригес-Маньяс Л. (сентябрь 2016 г.). «Скелетные мышцы регулируют обмен веществ посредством межорганных перекрестных помех: роль в здоровье и заболеваниях» . Журнал Американской ассоциации медицинских директоров . 17 (9): 789–96. дои : 10.1016/j.jamda.2016.04.019 . ПМИД 27324808 .
- ^ Jump up to: а б Сине Т. (июль 1994 г.). «Обмен сократительных белков скелетных мышц при глюкокортикоидной миопатии». Журнал биохимии стероидов и молекулярной биологии . 50 (1–2): 1–4. дои : 10.1016/0960-0760(94)90165-1 . ПМИД 8049126 . S2CID 27814895 .
- ^ Jump up to: а б Уолл Б.Т., Диркс М.Л., Ван Лун Л.Дж. (сентябрь 2013 г.). «Атрофия скелетных мышц при кратковременном бездействии: последствия возрастной саркопении». Обзоры исследований старения . 12 (4): 898–906. дои : 10.1016/J.arr.2013.07.003 . ПМИД 23948422 . S2CID 30149063 .
- ^ Эванс В.Дж., Морли Дж.Э., Аргилес Дж., Бэйлс С., Баракос В., Гаттридж Д. и др. (декабрь 2008 г.). «Кахексия: новое определение». Клиническое питание . 27 (6): 793–9. дои : 10.1016/j.clnu.2008.06.013 . ПМИД 18718696 . S2CID 206821612 .
- ^ Морли Дж. Э., Томас Д. Р., Уилсон М. М. (апрель 2006 г.). «Кахексия: патофизиология и клиническое значение» . Американский журнал клинического питания . 83 (4): 735–43. дои : 10.1093/ajcn/83.4.735 . ПМИД 16600922 .
- ^ Jump up to: а б Петерсон С.Дж., Мозер М. (февраль 2017 г.). «Дифференциация саркопении и кахексии у онкологических больных». Питание в клинической практике . 32 (1): 30–39. дои : 10.1177/0884533616680354 . ПМИД 28124947 . S2CID 206555460 .
- ^ де Йонг Дж. (февраль 2023 г.). «Половые различия в траектории старения скелетных мышц: те же процессы, но с другим рейтингом» . GeroScience (оригинальные исследования). 45 (4): 2367–2386. дои : 10.1007/s11357-023-00750-4 . ПМЦ 10651666 . ПМИД 36820956 .
- ^ Вердейк Л. (январь 2007 г.). «Содержание сателлитных клеток особенно снижается в волокнах скелетных мышц типа II у пожилых людей» . Американский журнал физиологии. Эндокринология и обмен веществ (оригинальные исследования). 292 (1): E151–E157. дои : 10.1152/ajpendo.00278.2006 . ПМИД 16926381 .
- ^ Марсель Т.Дж. (октябрь 2003 г.). «Саркопения: причины, последствия и профилактика» . Журналы геронтологии. Серия А, Биологические и медицинские науки . 58 (10): М911-6. дои : 10.1093/gerona/58.10.m911 . ПМИД 14570858 .
- ^ Анкер С.Д., Морли Дж.Э., фон Хэлинг С. (декабрь 2016 г.). «Добро пожаловать в код саркопении МКБ-10» . Журнал кахексии, саркопении и мышц . 7 (5): 512–514. дои : 10.1002/jcsm.12147 . ПМК 5114626 . ПМИД 27891296 .
- ^ Пауэрс С.К., Линч Г.С., Мерфи К.Т., Рид М.Б., Зейдевинд I (ноябрь 2016 г.). «Вызванная заболеванием атрофия скелетных мышц и усталость» . Медицина и наука в спорте и физических упражнениях . 48 (11): 2307–2319. дои : 10.1249/MSS.0000000000000975 . ПМК 5069191 . ПМИД 27128663 .
- ^ О'Брайен LC, Горги А.С. (октябрь 2016 г.). «Здоровье митохондрий скелетных мышц и повреждение спинного мозга» . Всемирный журнал ортопедии . 7 (10): 628–637. дои : 10.5312/wjo.v7.i10.628 . ПМК 5065669 . ПМИД 27795944 .
- ^ Вершурен О., Сморенбург А.Р., Луйкинг Ю., Белл К., Барбер Л., Петерсон, доктор медицинских наук (июнь 2018 г.). «Детерминанты сохранения мышц у людей с церебральным параличом на протяжении всей жизни: обзор литературы» . Журнал кахексии, саркопении и мышц . 9 (3): 453–464. дои : 10.1002/jcsm.12287 . ПМЦ 5989853 . ПМИД 29392922 .
- ^ Вонг А., Померанц Дж. Х. (март 2019 г.). «Роль мышечных стволовых клеток в регенерации и восстановлении после денервации: обзор». Пластическая и реконструктивная хирургия . 143 (3): 779–788. дои : 10.1097/PRS.0000000000005370 . ПМИД 30817650 . S2CID 73495244 .
- ^ Хиенш А.Е., Болам К.А., Миджвел С., Дженесон Дж.А., Хуитема А.Д., Краненбург О. и др. (октябрь 2019 г.). «Атрофия скелетных мышц, индуцированная доксорубицином: выяснение основных молекулярных путей» . Акта Физиологика . 229 (2): e13400. дои : 10.1111/apha.13400 . ПМЦ 7317437 . ПМИД 31600860 .
- ^ Мартин А.И., Приего Т., Лопес-Кальдерон А. (2018). «Гормоны и мышечная атрофия». В Сяо Дж (ред.). Атрофия мышц . Достижения экспериментальной медицины и биологии. Том. 1088. Спрингер Сингапур. стр. 207–233. дои : 10.1007/978-981-13-1435-3_9 . ISBN 9789811314346 . ПМИД 30390253 .
- ^ Эгерман М.А., Glass DJ (январь – февраль 2014 г.). «Сигнальные пути, контролирующие массу скелетных мышц» . Crit Rev Biochem Mol Biol . 49 (1): 59–68. дои : 10.3109/10409238.2013.857291 . ПМЦ 3913083 . ПМИД 24237131 .
- ^ Jump up to: а б Абриго Дж., Саймон Ф., Кабрера Д., Вилос К., Кабельо-Верруджио К. (20 мая 2019 г.). «Митохондриальная дисфункция при патологиях скелетных мышц». Современная наука о белках и пептидах . 20 (6): 536–546. дои : 10.2174/1389203720666190402100902 . ПМИД 30947668 . S2CID 96434115 .
- ^ Сандри М (июнь 2008 г.). «Сигнализация при мышечной атрофии и гипертрофии». Физиология . 23 (3). Бетесда, Мэриленд: 160–70. дои : 10.1152/физиол.00041.2007 . ПМИД 18556469 .
- ^ Бишоп Дж., Брайони Т. (2007). «Раздел 1.9.2». Руководство по диетической практике . Уайли-Блэквелл. п. 76. ИСБН 978-1-4051-3525-2 .
- ^ Сайер А.А. (ноябрь 2014 г.). «Саркопения – новый гериатрический гигант: время воплотить результаты исследований в клиническую практику» . Возраст и старение . 43 (6): 736–7. дои : 10.1093/старение/afu118 . ПМИД 25227204 .
- ^ Лю CJ, Latham NK (июль 2009 г.). «Прогрессивная силовая тренировка с отягощениями для улучшения физических функций у пожилых людей» . Кокрановская база данных систематических обзоров . 2009 (3): CD002759. дои : 10.1002/14651858.CD002759.pub2 . ПМЦ 4324332 . ПМИД 19588334 .
- ^ Чжан Д., Гуань Т.Х., Виджаджа Ф., Анг В.Т. (23 апреля 2007 г.). Функциональная электростимуляция в реабилитационной технике: обзор . Материалы 1-го международного конгресса по реабилитационной технике и ассистивным технологиям: совместно с 1-м совещанием по нейрореабилитации в больнице Тан Ток Сенг. Ассоциация вычислительной техники. стр. 221–226. дои : 10.1145/1328491.1328546 . ISBN 978-1-59593-852-7 .
- ^ Jump up to: а б Филлипс С.М. (июль 2015 г.). «Пищевые добавки в поддержку упражнений с отягощениями для борьбы с возрастной саркопенией» . Достижения в области питания . 6 (4): 452–60. дои : 10.3945/ан.115.008367 . ПМЦ 4496741 . ПМИД 26178029 .
- ^ Brioche T, Pagano AF, Py G, Chopard A (август 2016 г.). «Мышечное истощение и старение: экспериментальные модели, жировые инфильтраты и профилактика» (PDF) . Молекулярные аспекты медицины . 50 : 56–87. дои : 10.1016/j.mam.2016.04.006 . ПМИД 27106402 . S2CID 29717535 .
- ^ Голечек М. (август 2017 г.). «Добавка бета-гидрокси-бета-метилбутирата и скелетные мышцы в здоровых условиях и в условиях истощения мышц» . Журнал кахексии, саркопении и мышц . 8 (4): 529–541. дои : 10.1002/jcsm.12208 . ПМЦ 5566641 . ПМИД 28493406 .
- ^ Jump up to: а б У Х, Ся Ю, Цзян Дж, Ду Х, Го X, Лю X и др. (2015). «Влияние добавок бета-гидрокси-бета-метилбутирата на потерю мышечной массы у пожилых людей: систематический обзор и метаанализ». Архив геронтологии и гериатрии . 61 (2): 168–75. дои : 10.1016/j.archger.2015.06.020 . ПМИД 26169182 .
- ^ Шринатх Р., Добс А. (февраль 2014 г.). «Энобосарм (GTx-024, S-22): потенциальное лечение кахексии». Будущая онкология . 10 (2): 187–94. дои : 10.2217/фон.13.273 . ПМИД 24490605 .
- ^ Jump up to: а б Фустер Г., Бускетс С., Альмендро В., Лопес-Сориано Ф.Х., Аргилес Х.М. (октябрь 2007 г.). «Антипротеолитические эффекты плазмы спящих медведей: новый подход к терапии атрофии мышц?». Клиническое питание . 26 (5): 658–61. дои : 10.1016/j.clnu.2007.07.003 . ПМИД 17904252 .
- ^ Jump up to: а б с Лохейс Т.Д., Харлоу Х.Дж., Бек Т.Д. (май 2007 г.). «Впадающие в спячку черные медведи (Ursus americanus) испытывают баланс белков скелетных мышц во время зимней анорексии». Сравнительная биохимия и физиология. Часть B. Биохимия и молекулярная биология . 147 (1): 20–8. дои : 10.1016/j.cbpb.2006.12.020 . ПМИД 17307375 .
- ^ Кэри Х.В., Эндрюс М.Т., Мартин С.Л. (октябрь 2003 г.). «Спячка млекопитающих: клеточные и молекулярные реакции на подавленный обмен веществ и низкую температуру». Физиологические обзоры . 83 (4): 1153–81. doi : 10.1152/physrev.00008.2003 . ПМИД 14506303 .
- ^ Jump up to: а б Харлоу Х.Дж., Лохуис Т., Андерсон-Спречер Р.К., Бек Т.Д. (2004). «Температура поверхности тела спящих черных медведей может быть связана с периодической мышечной активностью». Журнал маммологии . 85 (3): 414–419. doi : 10.1644/1545-1542(2004)085<0414:BSTOHB>2.0.CO;2 . S2CID 86315375 .
- ^ ван ден Хук А (август 2019 г.). «Новая пищевая добавка предотвращает потерю мышечной массы и ускоряет восстановление мышечной массы у мышей с ограниченной калорийностью» . Метаболизм (оригинальные исследования). 97 : 57–67. дои : 10.1016/j.metabol.2019.05.012 . ПМИД 31153978 .
- ^ де Йонг Дж. (июнь 2023 г.). «Ограничение калорий в сочетании с иммобилизацией как трансляционная модель саркопении, выражающая ключевые пути патологии человека» . Старение и болезни (оригинальные исследования). 14 (3): 937–957. дои : 10.14336/AD.2022.1201 . ПМЦ 10187708 . ПМИД 37191430 .
Внешние ссылки
[ редактировать ] СМИ, связанные с мышечной атрофией , на Викискладе?
СМИ, связанные с мышечной атрофией , на Викискладе? - Мышечная атрофия Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)