хинон
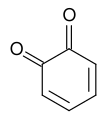
Хиноны представляют собой класс органических соединений , которые формально «получены из ароматических соединений [таких как бензол или нафталин ] путем превращения четного числа групп –CH= в группы –C(=O)– с любой необходимой перегруппировкой двойных связей. «, что приводит к «полностью сопряженной структуре циклического диона ». [ 1 ] [ 2 ] [ 3 ] Типичным представителем этого класса является 1,4-бензохинон или циклогексадиендион, часто называемый просто «хиноном» (отсюда и название класса). Другими важными примерами являются 1,2-бензохинон ( орто -хинон ), 1,4-нафтохинон и 9,10-антрахинон .
Название происходит от названия хинной кислоты (с суффиксом «-one», обозначающим кетон), поскольку это одно из соединений, получаемых при окислении хинной кислоты. [ 4 ] Хинную кислоту, как и хинин, получают из коры хинного дерева , называемой хинакиной на языках коренных перуанских племен .
Характеристики
[ редактировать ]Хиноны представляют собой окисленные производные ароматических соединений и часто легко получаются из реакционноспособных ароматических соединений с электронодонорными заместителями, такими как фенолы и катехолы , которые увеличивают нуклеофильность кольца и способствуют большому окислительно-восстановительному потенциалу , необходимому для разрушения ароматичности. (Хиноны являются конъюгированными, но не ароматическими). Хиноны представляют собой электрофильные акцепторы Михаэля , стабилизированные путем конъюгации. В зависимости от хинона и места восстановления восстановление может либо повторно ароматизировать соединение, либо разрушить конъюгацию. Присоединение конъюгата почти всегда нарушает конъюгацию.
Термин хинон также используется в более общем смысле для большого класса соединений, формально полученных из ароматических хинонов путем замены некоторых атомов водорода другими атомами или радикалами.
-
Хлоранил — реактив в органической химии.
-
Лоусон , краситель, содержащийся в листьях растения хны.
-
Ализарин — обычный красный краситель.
-
DDQ , реагент в органической химии.
-
Даунорубицин — противораковый препарат
Реакции
[ редактировать ]Хиноны образуют полимеры путем образования водородных связей с ρ-гидрохиноном. [ 5 ]
Снижение
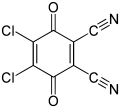
[ редактировать ]Хиноны являются окислителями , иногда обратимо. По сравнению с бензохиноном к более сильным окисляющим хинонам относятся хлоранил и 2,3-дихлор-5,6-дициано-1,4-бензохинон (также известный как DDQ). [ 6 ]
Окислительная сила хинонов усиливается в присутствии кислот. [ 7 ] В кислой среде хинон подвергается двухэлектронному и двухпротонному восстановлению до гидрохинона .

В щелочных условиях хиноны подвергаются обратимому одностадийному двухэлектронному восстановлению. В нейтральных условиях хиноны могут подвергаться однопротонному, двухэлектронному или двухэлектронному восстановлению. В апротонных средах хиноны восстанавливаются в два этапа без протонов. [ 8 ] короткоживущий полухинон На первом этапе образуется . На втором этапе семихинон восстанавливается до хинонового дианиона.
9,10-Антрахинон-2,7-дисульфоновая кислота (AQDS) — хинон, аналогичный тому, который в природе содержится в ревене, используется в качестве носителя заряда в безметалловых проточных батареях . [ 9 ]
Добавление
[ редактировать ]Хиноны вступают в реакцию присоединения с образованием продуктов 1,4-присоединения. [ 10 ] Примером реакции 1,4-присоединения является присоединение хлористого водорода с образованием хлоргидрохинона:

Хиноны могут вступать в реакции Дильса-Альдера . [ 10 ] Хинон действует как диенофил и реагирует с диеном по двойной связи углерод-углерод.
В реакциях Дильса-Альдера в качестве диенофилов используются хиноны. Исторически важные синтезы включают холестерин , кортизон , морфин и резерпин . [ 11 ]
Возникновение и использование
[ редактировать ]Производство перекиси водорода
[ редактировать ]Крупномасштабное промышленное применение хинонов связано с производством перекиси водорода . 2-Алкилантрахиноны гидрируются до соответствующих гидрохинонов (хинизаринов), которые затем переносят H
2 к кислороду:
- дигидроантрахинон + O
2 → антрахинон + H
22О
2
таким образом, несколько миллионов метрических тонн H
22О
2 производятся ежегодно. [ 12 ]
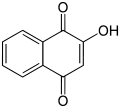
1,4- Нафтохинон , полученный окислением нафталина триоксидом хрома . [ 13 ] Это предшественник антрахинона.
Биохимия
[ редактировать ]Многочисленные хиноны играют важную роль в биологии. Витамин К, участвующий в свертывании крови, представляет собой хинон. Убихинон -10 представляет собой природный 1,4-бензохинон, участвующий в работе дыхательного аппарата. Пластохинон – это окислительно-восстановительный реле, участвующий в фотосинтезе. Пирролохинолинхинон является еще одним биологическим окислительно-восстановительным кофактором.

Предполагается, что хиноны встречаются во всех дышащих организмах. [ 14 ] Некоторые из них служат акцепторами электронов в цепях переноса электронов, например, при фотосинтезе ( пластохинон , филлохинон ) и аэробном дыхании ( убихинон ). Филлохинон также известен как витамин К 1 , поскольку он используется животными для карбоксилирования определенных белков, которые участвуют в свертывании крови , формировании костей и других процессах. И наоборот, токсичность парацетамола обусловлена его метаболизмом до хинонимина , который затем вступает в реакцию с белками печени, вызывая печеночную недостаточность.
Аутоокисление нейротрансмиттера дофамина и его предшественника L-допы приводит к образованию сравнительно стабильного дофаминхинона, который ингибирует функционирование транспортера дофамина (DAT) и фермента TH и приводит к снижению выработки митохондриального АТФ . [ 15 ]
Бензохинон блаттеллахинон половой феромон тараканов — . В брызгах жуков -бомбардиров гидрохинон реагирует с перекисью водорода, образуя огненный поток пара, который является сдерживающим фактором для животного мира.
Медицинский
[ редактировать ]Некоторые хиноны представляют фармакологический интерес. Они образуют основной класс противораковых цитотоксинов. Одним из примеров является даунорубицин , который обладает противолейкозным действием. [ 14 ] Некоторые из них проявляют противоопухолевую активность . Они воплощают некоторые утверждения в области фитотерапии . Эти применения включают слабительные ( сеннозиды ), противомикробные и противопаразитарные ( реин и сапрортохинон , атоваквон ), противоопухолевые ( эмодин и юглон ), ингибирование биосинтеза PGE2 ( арнебинон и арнебифуранон ) и противосердечные заболевания ( таншинон ). [ 16 ] Malbranchea cinnamomea — термофильный гриб, продуцирующий хинонный антибиотик.
Другим хинонсодержащим препаратом является мекарбинат ( димекарбин ), получаемый реакцией этил -N-метил-β-аминокротоната с пара-бензохиноном. Другие включают Амендол , Оксифемедол , Фемедол, все в FR5142 (M) — 05.06.1967. [ нужны разъяснения ] Примечание: все это индолы, полученные в результате синтеза индолов Неницеску . Противоопухолевый препарат Апазиквон .
Бензохиноновые соединения являются метаболитами парацетамола . [ 17 ]
Красители
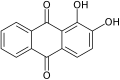
[ редактировать ]Многие натуральные и искусственные красящие вещества ( красители и пигменты ) являются производными хинона, например, лоусон – активное красящее соединение в хне . По значимости как красители они уступают только азокрасителям , с особым упором на синий цвет. Ализарин (1,2-дигидрокси-9,10-антрахинон), извлеченный из марены , был первым природным красителем, синтезированным из каменноугольной смолы.
Фотография
[ редактировать ]Коммерческое применение хинонов находится в черно-белой фотографии . Черно-белая пленка покрыта эмульсией, содержащей кристаллы бромида или йодида серебра, которые под действием света активируются. Гидрохинон используется для восстановления активированных ионов серебра до металлического серебра. В ходе этого процесса гидрохинон окисляется до хинона. Весь галогенид серебра, не активированный светом или восстановленный гидрохиноном, удаляется, оставляя негатив в виде осажденного серебра там, где пленка подверглась воздействию света. [ 18 ]
Номенклатура
[ редактировать ]Хиноны обычно называют с префиксом, указывающим исходный ароматический углеводород («бензо-» для бензола, «нафто-» для нафталина, «антра-» для антрацена и т. д.) и суффиксом «-хинон». Инфиксные множители «-ди-», «-три-», «-тетра-» (и т. д.) употребляются при наличии 4, 6, 8 (и т. д.) карбонилов. Положение карбонильных групп может указываться перед префиксом (например, «1,4,5,8-нафтодихинон») или после него («антра-1,4-хинон»).
Структурные аналоги хинонов
[ редактировать ]- Хинонметид - где один О заменен на С.
- Ксилол - где оба О заменены С.
- Хинонимин - где один О заменен на N, как показано NAPQI.
- Хинондиимин - где оба О заменены на N, что показано на примере антисептика амбазона.
- Азаксилилен - где оба O заменены одним N и одним C, что иллюстрируется различными фуксиновыми красителями, такими как парарозанилин.
Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Хиноны ». два : 10.1351/goldbook.Q05015
- ^ Патай, Саул; Раппопорт, Цви, ред. (1988). Хиноноидные соединения: Том. 1 (1988) . дои : 10.1002/9780470772119 . ISBN 9780470772119 .
- ^ Патай, Саул; Раппопорт, Цви, ред. (1988). Хиноноидные соединения: Том. 2 (1988) . дои : 10.1002/9780470772126 . ISBN 9780470772126 .
- ^ Химические новости и журнал физических наук . Гриффин, Бон и компания. 1773.
- ^ Сакурай, Т. (1968). «Об уточнении кристаллических структур фенохинона и моноклинного хингидрона». Acta Crystallographica Раздел B Структурная кристаллография и кристаллохимия . 24 (3): 403–412. Бибкод : 1968AcCrB..24..403S . дои : 10.1107/S0567740868002451 .
- ^ Марч, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура, 3-е издание , Нью-Йорк: Wiley, ISBN 9780471854722 , OCLC 642506595
- ^ Гуин, Партха Сарати; Дас, Саураб; Мандал, ПК (16 марта 2011 г.). «Электрохимическое восстановление хинонов в различных средах: обзор» . Международный журнал электрохимии . 2011 : e816202. дои : 10.4061/2011/816202 . ISSN 2090-3529 .
- ^ Рене, Алиса; Эванс, Деннис Х. (12 июля 2012 г.). «Электрохимическое восстановление некоторых о-хиноновых анионных радикалов: почему сила тока настолько мала?» . Журнал физической химии C. 116 (27): 14454–14460. дои : 10.1021/jp3038335 . ISSN 1932-7447 .
- ^ Хаскинсон, Брайан; Маршак, Михаил П.; Су, Чханвон; Э-э, Сулейман; Герхардт, Майкл Р.; Гэлвин, Купер Дж.; Чен, Сюдун; Аспуру-Гузик, Алан; Гордон, Рой Г.; Азиз, Майкл Дж. (9 января 2014 г.). «Безметалловый органически-неорганический проточный аккумулятор на водной основе» (PDF) . Природа 505 (7482): 195–198. Бибкод : 2014Nature.505..195H . дои : 10.1038/nature12909 . ПМИД 24402280 . S2CID 4459692 .
- ^ Перейти обратно: а б Смит, PWG; Тэтчелл, Арканзас (1 января 1969 г.), Смит, PWG; Тэтчелл, А.Р. (ред.), «Ароматические спирты и карбонильные соединения» , Ароматическая химия , Пергамон, стр. 144–175, doi : 10.1016/b978-0-08-012948-8.50010-3 , ISBN 978-0-08-012948-8 , получено 17 ноября 2022 г.
- ^ Наврат, Кристофер С.; Муди, Кристофер Дж. (17 февраля 2014 г.). «Хиноны как диенофилы в реакции Дильса-Альдера: история и применение в полном синтезе» . Angewandte Chemie, международное издание . 53 (8): 2056–2077. дои : 10.1002/anie.201305908 . ПМИД 24446164 . S2CID 1362687 .
- ^ Густав Гур, Юрген Гленнеберг, Сильвия Якоби «Перекись водорода» в Энциклопедии промышленной химии Ульмана, 2007, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a13_443.pub2 .
- ^ Брауде Э.А.; Фосетт, Дж. С. (1953). «1,4-Нафтохинон». Органические синтезы . 33 : 50. дои : 10.15227/orgsyn.033.0050 ; Сборник томов , т. 4, с. 698 .
- ^ Перейти обратно: а б О'Брайен, Пи Джей (1991). «Молекулярные механизмы хиноновой цитотоксичности». Химико-биологические взаимодействия . 80 (1): 1–41. дои : 10.1016/0009-2797(91)90029-7 . ПМИД 1913977 .
- ^ Доршевска, Иоланта; Прендецки, Михал; Козубски, Маргарет Лианери и Войцех (31 января 2014 г.). «Молекулярные эффекты терапии L-дофа при болезни Паркинсона» . Современная геномика . 15 (1): 11–17. дои : 10.2174/1389202914666131210213042 . ПМЦ 3958954 . ПМИД 24653659 .
- ^ Лю Х., «Экстракция и выделение соединений из лекарственных средств растительного происхождения» в книге «Методы исследования традиционной фитотерапии», под редакцией Уиллоу Дж. Х. Лю, 2011 г. John Wiley and Sons, Inc.
- ^ Далин, округ Колумбия; Мива, GT; Лу, АЙ; Нельсон, С.Д. (1984). «N-ацетил-п-бензохинон имин: опосредованный цитохромом P-450 продукт окисления ацетаминофена» . Труды Национальной академии наук Соединенных Штатов Америки . 81 (5): 1327–1331. Бибкод : 1984PNAS...81.1327D . дои : 10.1073/pnas.81.5.1327 . ПМЦ 344826 . ПМИД 6424115 .
- ^ Браун, Уильям Генри; Айверсон, Брент Л.; Анслин, Эрик В.; Фут, Кристофер С. (2018). Органическая химия (8-е изд.). Бостон, Массачусетс: Cengage Learning. ISBN 978-1-305-58035-0 . OCLC 974377227 .
Внешние ссылки
[ редактировать ]- Хиноны Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)