Сердечный потенциал действия

В отличие от потенциала действия в клетках скелетных мышц , сердечный потенциал действия не инициируется нервной деятельностью. Вместо этого он возникает из группы специализированных клеток, известных как клетки-водители ритма , которые обладают способностью автоматической генерации потенциала действия. В здоровом сердце эти клетки образуют кардиостимулятор и обнаруживаются в синоатриальном узле правого предсердия . Они производят примерно 60–100 потенциалов действия каждую минуту. Потенциал действия проходит вдоль клеточной мембраны, вызывая сокращение клетки, поэтому активность синоатриального узла приводит к частоте сердечных сокращений в состоянии покоя примерно 60–100 ударов в минуту. Все клетки сердечной мышцы электрически связаны друг с другом посредством вставочных дисков , которые позволяют потенциалу действия передаваться от одной клетки к другой. [1] [2] Это означает, что все клетки предсердий могут сокращаться вместе, а затем и все клетки желудочков.

Зависимость потенциала действия от скорости является фундаментальным свойством сердечных клеток, и изменения могут привести к тяжелым сердечным заболеваниям, включая сердечную аритмию , а иногда и внезапную смерть. [3] Активность потенциала действия в сердце можно зарегистрировать для получения электрокардиограммы (ЭКГ). Это серия восходящих и нисходящих импульсов (обозначенных P, Q, R, S и T), которые представляют собой деполяризацию (напряжение становится более положительным) и реполяризацию (напряжение становится более отрицательным) потенциала действия в предсердиях и желудочках . [4]
Обзор
[ редактировать ]| Элемент | Ион | внеклеточный | Внутриклеточный | Соотношение |
|---|---|---|---|---|
| Натрий | Уже + | 135 - 145 | 10 | 14:1 |
| Калий | К + | 3.5 - 5.0 | 155 | 1:30 |
| Хлористый | кл. − | 95 - 110 | 10 - 20 | 4:1 |
| Кальций | Что 2+ | 2 | 10 −4 | 2 х 10 4 :1 |
| Хотя внутриклеточный Са 2+ содержание составляет около 2 мМ, большая часть которого связана или секвестрируется во внутриклеточных органеллах (митохондриях и саркоплазматическом ретикулуме). [5] | ||||
Подобно скелетным мышцам, мембранный потенциал покоя (напряжение, когда клетка не электрически возбуждена) желудочковых клеток составляет около -90 милливольт (мВ; 1 мВ = 0,001 В), то есть внутренняя часть мембраны более отрицательна, чем внешняя. Основными ионами, находящимися вне клетки в состоянии покоя, являются натрий (Na + ) и хлорид (Cl − ), тогда как внутри клетки это преимущественно калий (K + ). [6]
Потенциал действия начинается с того, что напряжение становится более положительным; это известно как деполяризация и происходит главным образом из-за открытия натриевых каналов , которые позволяют Na + поступать в клетку. После задержки (известной как период абсолютной рефрактерности ) потенциал действия прекращается, когда открываются калиевые каналы, позволяя K + покинуть клетку и заставить мембранный потенциал вернуться к отрицательному, это известно как реполяризация . Другой важный ион — кальций (Ca 2+ ) , который можно найти внутри клетки в саркоплазматическом ретикулуме (SR), где хранится кальций, а также найти снаружи клетки. Выпуск Са 2+ из СР посредством процесса, называемого кальций-индуцированным высвобождением кальция , жизненно важно для фазы плато потенциала действия (см. фазу 2 ниже) и является фундаментальным этапом в соединении сердечного возбуждения и сокращения . [7]
Существуют важные физиологические различия между пейсмекерными клетками синоатриального узла , которые спонтанно генерируют сердечный потенциал действия, и теми не-кардиостимуляторными клетками, которые просто проводят его, например желудочковыми миоцитами . Конкретные различия в типах выраженных ионных каналов и механизмах их активации приводят к различиям в конфигурации формы волны потенциала действия, как показано на рисунке 2.
Сердечный автоматизм
[ редактировать ]Сердечный автоматизм, также известный как авторитмичность , представляет собой свойство специализированных проводящих мышечных клеток сердца генерировать спонтанные сердечные потенциалы действия. [8] [9] Автоматизм может быть нормальным или аномальным, вызванным временными изменениями характеристик ионных каналов , например, приемом определенных лекарств, или в случае аномального автоматизма изменениями в электротонической среде , вызванными, например, инфарктом миокарда . [10]
Фазы
[ редактировать ]
Стандартной моделью, используемой для понимания потенциала сердечного действия, является модель желудочковых миоцитов. Ниже описаны пять фаз потенциала действия желудочковых миоцитов, а также потенциал действия SAN.

Этап 4
[ редактировать ]В миоцитах желудочков фаза 4 наступает, когда клетка находится в состоянии покоя, в период, известный как диастола . В стандартной ячейке без кардиостимулятора напряжение во время этой фазы более или менее постоянное и составляет примерно -90 мВ. [11] Мембранный потенциал покоя возникает в результате потока ионов, поступивших в клетку (например, натрия и кальция), потока ионов, вышедших из клетки (например, калия, хлорида и бикарбоната), а также потока ионов, генерируемых Различные мембранные насосы идеально сбалансированы.
Деятельность этих насосов служит двум целям. Первый заключается в поддержании существования мембранного потенциала покоя путем противодействия деполяризации, вызванной утечкой ионов, не находящихся в электрохимическом равновесии (например, натрия и кальция). Нахождение этих ионов в равновесии является причиной существования электрического градиента, поскольку они представляют собой чистое смещение зарядов через мембрану, которые не могут немедленно вернуться в клетку для восстановления электрического равновесия. Следовательно, их медленное возвращение в клетку необходимо уравновешивать, иначе клетка будет медленно терять свой мембранный потенциал.
Вторая цель, неразрывно связанная с первой, состоит в том, чтобы поддерживать внутриклеточную концентрацию более или менее постоянной и в этом случае восстанавливать первоначальные химические градиенты, то есть вытеснять натрий и кальций, которые ранее поступали в клетку, из нее. он, и калий, который ранее перетек из клетки обратно в нее (хотя, поскольку калий в основном находится в электрохимическом равновесии, его химический градиент естественным образом восстанавливает равновесие в противоположность электрическому градиенту, без необходимости в активном механизме транспорта).
Например, натрий (Na + ) и калий (K + ) ионы поддерживаются натриево-калиевым насосом , который использует энергию (в виде аденозинтрифосфата (АТФ) ) для перемещения трех Na + из клетки и два К + в клетку. Другой пример - натрий-кальциевый обменник , удаляющий один Ca. 2+ из клетки за три Na + в клетку. [12]
На этом этапе мембрана наиболее проницаема для K. + , который может проникать в клетку или выходить из нее через каналы утечки, включая внутренний выпрямляющий калиевый канал. [13] Следовательно, мембранный потенциал покоя в большинстве случаев равен K + равновесный потенциал и может быть рассчитан с помощью уравнения напряжения Гольдмана-Ходжкина-Каца .
Однако клетки-водители ритма никогда не находятся в состоянии покоя. В этих клетках фаза 4 также известна как потенциал водителя ритма . Во время этой фазы мембранный потенциал медленно становится более положительным, пока не достигнет заданного значения (около -40 мВ; известного как пороговый потенциал) или пока он не будет деполяризован другим потенциалом действия, исходящим из соседней клетки.
Считается, что кардиостимуляторный потенциал обусловлен группой каналов, называемых каналами HCN (циклические нуклеотиды, активируемые гиперполяризацией) . Эти каналы открываются при очень отрицательном напряжении (т.е. сразу после фазы 3 предыдущего потенциала действия; см. ниже) и позволяют пройти как K + и На + в клетку. Из-за их необычного свойства активироваться очень отрицательными мембранными потенциалами, движение ионов через каналы HCN называется « веселым током» (см. ниже). [14]
Другая гипотеза относительно потенциала кардиостимулятора — это «кальциевые часы». Кальций высвобождается из саркоплазматического ретикулума внутри клетки. Этот кальций затем увеличивает активацию натрий-кальциевого обменника , что приводит к увеличению мембранного потенциала (поскольку в клетку вносится заряд +3 (за счет 3Na + ), но из клетки уходит только заряд +2 (за счет Ca 2+ ), следовательно, в ячейку поступает чистый заряд +1). Затем этот кальций перекачивается обратно в клетку и обратно в СР через кальциевые насосы (включая SERCA ). [15]
Фаза 0
[ редактировать ]Эта фаза состоит из быстрого положительного изменения напряжения на клеточной мембране ( деполяризации ), продолжающегося менее 2 мс в клетках желудочков и 10–20 мс в клетках SAN . [16] Это происходит из-за чистого потока положительного заряда в клетку.
В клетках, не являющихся кардиостимуляторами (т.е. клетках желудочков), это происходит преимущественно за счет активации Na. + каналы , что увеличивает мембранную проводимость (поток) Na + (г На ). Эти каналы активируются, когда потенциал действия поступает из соседней клетки через щелевые контакты . Когда это происходит, напряжение внутри ячейки немного увеличивается. Если это повышенное напряжение достигает порогового потенциала (приблизительно -70 мВ), это вызывает Na + каналы для открытия. Это приводит к увеличению притока натрия в клетку, быстро увеличивая напряжение примерно до +50 мВ. [6] то есть в сторону Na + равновесный потенциал. Однако если первоначальный стимул недостаточно силен и пороговый потенциал не достигнут, быстрые натриевые каналы не будут активированы и потенциал действия не будет произведен; это известно как закон «все или ничего» . [17] [18] Приток ионов кальция (Ca 2+ ) через кальциевые каналы L-типа также составляет незначительную часть эффекта деполяризации. [19] Наклон фазы 0 на форме волны потенциала действия (см. рисунок 2) представляет собой максимальную скорость изменения напряжения сердечного потенциала действия и известен как dV/dt max .
Однако в клетках-пейсмейкерах (например, клетках синоатриального узла ) увеличение мембранного напряжения происходит главным образом за счет активации кальциевых каналов L-типа. Эти каналы также активируются повышением напряжения, однако на этот раз это происходит либо за счет пейсмекерного потенциала (фаза 4), либо за счет встречного потенциала действия. Кальциевые каналы L-типа активируются медленнее, чем натриевые каналы, поэтому наклон деполяризации в форме волны потенциала действия пейсмейкера менее крутой, чем в форме волны потенциала действия без кардиостимулятора. [11] [20]
Этап 1
[ редактировать ]Эта фаза начинается с быстрой инактивации Na. + каналы внутренними воротами (воротами инактивации), уменьшая движение натрия в клетку. В то же время калиевые каналы (называемые I to1 ) быстро открываются и закрываются, обеспечивая кратковременный выход ионов калия из клетки, делая мембранный потенциал немного более отрицательным. Это называется «вырезом» на форме волны потенциала действия. [11]
В клетках кардиостимулятора явной фазы 1 нет.
Этап 2
[ редактировать ]Эта фаза также известна как фаза «плато», поскольку мембранный потенциал остается почти постоянным, поскольку мембрана медленно начинает реполяризоваться. Это происходит из-за почти равновесного заряда, движущегося в ячейку и из нее. Во время этой фазы калиевые каналы замедленного выпрямления (I ks ) позволяют калию покидать клетку, в то время как кальциевые каналы L-типа (активируемые притоком натрия во время фазы 0) позволяют движению ионов кальция в клетку. Эти ионы кальция связываются и открывают больше кальциевых каналов (так называемых рианодиновых рецепторов), расположенных на саркоплазматическом ретикулуме внутри клетки, обеспечивая выход кальция из СР. Эти ионы кальция ответственны за сокращение сердца.
Кальций также активирует хлоридные каналы, называемые Ito2 , которые позволяют Cl − чтобы войти в клетку. Повышенная концентрация кальция в клетке также увеличивает активность натрий-кальциевых обменников, тогда как повышенная концентрация натрия (в результате деполяризации фазы 0) увеличивает активность натриево-калиевых насосов. Движение всех этих ионов приводит к тому, что мембранный потенциал остается относительно постоянным, при этом K + отток, Cl − приток, а также Na + /К + насосы, способствующие реполяризации и Ca 2+ приток, а также Na + /Что 2+ обменники, способствующие деполяризации. [21] [11] Эта фаза отвечает за большую продолжительность потенциала действия и важна для предотвращения нерегулярного сердцебиения (сердечной аритмии).
Фаза плато в потенциалах действия пейсмекера отсутствует.
Этап 3
[ редактировать ]Во время фазы 3 (фаза «быстрой реполяризации») потенциала действия Са L-типа 2+ каналы закрываются, а медленный выпрямитель с задержкой (I Ks ) K + каналы остаются открытыми, поскольку открывается больше каналов утечки калия. Это обеспечивает чистый внешний положительный ток, соответствующий отрицательному изменению мембранного потенциала , что позволяет использовать больше типов K. + каналы для открытия. В первую очередь это быстродействующий выпрямитель с задержкой К. + каналы (I Кр ) и внутренне выпрямляющий К + ток, I K1 .Этот чистый направленный наружу положительный ток (равный потере положительного заряда клетки) вызывает реполяризацию клетки. Выпрямитель с задержкой К + каналы закрываются, когда мембранный потенциал восстанавливается примерно до уровня от -85 до -90 мВ, в то время как I K1 остается проводящим на протяжении всей фазы 4, что помогает установить мембранный потенциал покоя. [22]
Ионные насосы, как обсуждалось выше, такие как натриево-кальциевый обменник и натриево-калиевый насос, восстанавливают концентрацию ионов до сбалансированного состояния, соответствующего потенциалу предварительного действия. Это означает, что выкачивается внутриклеточный кальций, ответственный за сокращение кардиомиоцитов. Как только он теряется, сокращение прекращается и сердечные мышцы расслабляются.
В синоатриальном узле эта фаза также обусловлена закрытием кальциевых каналов L-типа, предотвращающим приток кальция внутрь. 2+ и открытие калиевых каналов быстрого замедленного выпрямления (I Кр ). [23]
Рефрактерный период
[ редактировать ]Сердечные клетки имеют два рефрактерных периода : первый — от начала фазы 0 до середины фазы 3; это известно как период абсолютной рефрактерности, в течение которого клетка не может вырабатывать другой потенциал действия. Сразу за этим, до конца фазы 3, следует относительный рефрактерный период, в течение которого требуется более сильный, чем обычно, стимул для создания нового потенциала действия. [24] [25]
Эти два рефрактерных периода обусловлены изменениями состояния натриевых и калиевых каналов . Быстрая деполяризация клетки во время фазы 0 приводит к тому, что мембранный потенциал приближается к равновесному потенциалу натрия (т.е. мембранному потенциалу, при котором натрий больше не втягивается в клетку или из нее). Когда мембранный потенциал становится более положительным, натриевые каналы закрываются и блокируются, это известно как «инактивированное» состояние. В этом состоянии каналы не могут открыться независимо от силы возбуждающего раздражителя — возникает период абсолютной рефрактерности. Относительный рефрактерный период обусловлен утечкой ионов калия, что делает мембранный потенциал более отрицательным (т.е. он гиперполяризуется), это перезагружает натриевые каналы; открывая ворота инактивации, но оставляя канал закрытым. Поскольку некоторые из потенциал-управляемых ионных каналов натрия восстановились, а потенциал-управляемые ионные каналы калия остаются открытыми, можно инициировать другой потенциал действия, если стимул сильнее, чем стимул, который может вызвать потенциал действия, когда мембрана находится в отдых. [26]
Щелевые соединения
[ редактировать ]Щелевые контакты позволяют потенциалу действия передаваться от одной клетки к другой (говорят, что они электрически соединяют соседние сердечные клетки ). Они состоят из белков семейства коннексинов , образующих поры, через которые ионы (в том числе Na + , Как 2+ и К + ) может пройти. Поскольку калия в клетке больше всего, через него проходит в основном калий. Повышенное содержание калия в соседней клетке вызывает незначительное увеличение мембранного потенциала, активируя натриевые каналы и инициируя потенциал действия в этой клетке. (Краткий отток Na+, вызванный химическим градиентом, через коннексон на пике деполяризации вызывает проводимость деполяризации от клетки к клетке, а не калий.) [27] Эти соединения обеспечивают быстрое проведение потенциала действия по всему сердцу и отвечают за совместное сокращение всех клеток предсердий, а также всех клеток желудочков. [28] Несогласованное сокращение сердечной мышцы является основой аритмии и сердечной недостаточности. [29]
Каналы
[ редактировать ]| Текущий ( я ) | белок α-субъединицы | ген α-субъединицы | Фаза/роль | |
|---|---|---|---|---|
| Уже + | В На | На версии 1.5 | SCN5A [31] | 0 |
| Что 2+ | В Ca(L) | Са В 1,2 | CACNA1C [32] | 0-2 |
| К + | я хочу1 | К В 4,2/4,3 | КСНД2 / КСНД3 | 1, выемка |
| К + | я кс | КВ 7.1 | KCNQ1 | 2,3 |
| К + | В Кр | К В 11,1 ( ГЭРГ ) | КЦНХ2 | 3 |
| К + | я К1 | К ир 2,1/2,2/2,3 | KCNJ2 / KCNJ12 / KCNJ4 | 3,4 |
| Уже + , Как 2+ | Я НаКа | 3На + -1Ca 2+ -обменник | NCX1 ( SLC8A1 ) | ионный гомеостаз |
| Уже + , К + | И НаК | 3На + -2К + -АТФаза | АТФ1А | ионный гомеостаз |
| Что 2+ | я ПКА | Что 2+ -транспортирующая АТФаза | АТФ1Б | ионный гомеостаз |
Ионные каналы — это белки, которые меняют форму в ответ на различные стимулы, чтобы либо разрешить, либо предотвратить движение определенных ионов через мембрану. Говорят, что они обладают избирательной проницаемостью. Стимулы, которые могут исходить либо снаружи клетки, либо изнутри клетки, могут включать связывание конкретной молекулы с рецептором на канале (также известном как лиганд-управляемые ионные каналы ) или изменение мембранного потенциала вокруг канала. обнаруживается датчиком (также известным как потенциалзависимые ионные каналы ) и может открывать или закрывать канал. Пора, образованная ионным каналом, является водной (заполненной водой) и позволяет ионам быстро перемещаться через мембрану. [33] Ионные каналы могут быть селективными для определенных ионов, поэтому существуют Na + , К + , Как 2+ и Cl − конкретные каналы. Они также могут быть специфичными для определенного заряда ионов (т.е. положительного или отрицательного). [34]
Каждый канал кодируется набором инструкций ДНК, которые сообщают клетке, как его создать. Эти инструкции известны как ген . На рисунке 3 показаны важные ионные каналы, участвующие в сердечном потенциале действия, ток (ионы), протекающий через каналы, их основные белковые субъединицы (строительные блоки канала), некоторые из их контролирующих генов, которые кодируют их структуру, и фазы, которые активны во время сердечного потенциала действия. Некоторые из наиболее важных ионных каналов, участвующих в сердечном потенциале действия, кратко описаны ниже.
каналы HCN
[ редактировать ]Активируемые гиперполяризацией циклические нуклеотид-зависимые каналы (HCN-каналы) расположены в основном в пейсмекерных клетках, эти каналы становятся активными при очень отрицательных мембранных потенциалах и обеспечивают прохождение как Na + и К + в клетку (это движение известно как смешной ток, I f ). Эти плохо селективные катионные (положительно заряженные ионы) каналы проводят больший ток, поскольку мембранный потенциал становится более отрицательным (гиперполяризованным). Активность этих каналов в клетках SAN вызывает медленную деполяризацию мембранного потенциала, поэтому считается, что они ответственны за потенциал водителя ритма. Симпатические нервы напрямую влияют на эти каналы, что приводит к увеличению частоты сердечных сокращений (см. ниже). [35] [14]
Быстрый натриевый канал
[ редактировать ]Эти натриевые каналы зависят от напряжения и быстро открываются из-за деполяризации мембраны, которая обычно происходит из соседних клеток через щелевые контакты. Они обеспечивают быстрый приток натрия в клетку, полностью деполяризуя мембрану и инициируя потенциал действия. По мере увеличения мембранного потенциала эти каналы закрываются и блокируются (становятся неактивными). Из-за быстрого притока ионов натрия (крутая фаза 0 в форме волны потенциала действия) активация и инактивация этих каналов происходит почти в одно и то же время. В состоянии инактивации Na + не может пройти (абсолютный рефрактерный период). Однако они начинают восстанавливаться после инактивации, поскольку мембранный потенциал становится более отрицательным (относительный рефрактерный период).
Калийные каналы
[ редактировать ]Двумя основными типами калиевых каналов в сердечных клетках являются внутренние выпрямители и потенциалзависимые калиевые каналы. [ нужна ссылка ]
Исправляющиеся внутрь калиевые каналы (K ir) способствуют потоку K. + в клетку. Однако этот приток калия увеличивается, когда мембранный потенциал более отрицателен, чем равновесный потенциал для K. + (~-90 мВ). Когда мембранный потенциал становится более положительным (т.е. во время стимуляции клетки со стороны соседней клетки), поток калия в клетку через K ir уменьшается. Следовательно, K ir отвечает за поддержание мембранного потенциала покоя и инициацию фазы деполяризации. Однако по мере того, как мембранный потенциал продолжает становиться более положительным, канал начинает пропускать K. + из клетки. Этот направленный наружу поток ионов калия при более положительных мембранных потенциалах означает, что K ir также может способствовать заключительным стадиям реполяризации. [36] [37]
Потенциал -управляемые калиевые каналы (Kv ) активируются деполяризацией. Токи, создаваемые этими каналами, включают переходный выходной калиевый Ito1 ток . Этот ток имеет две составляющие. Оба компонента активируются быстро, но « быстро» инактивируется быстрее, чем « медленно» . Эти токи способствуют ранней фазе реполяризации (фаза 1) потенциала действия. [ нужна ссылка ]
Другой формой потенциалзависимых калиевых каналов являются калиевые каналы замедленного выпрямления. Эти каналы несут калиевые токи, которые отвечают за фазу плато потенциала действия, и названы в зависимости от скорости их активации: медленно активирующий I Ks , быстро активирующий I Kr и сверхбыстро активирующий I Kur . [38]
Кальциевые каналы
[ редактировать ]есть два потенциалзависимых кальциевых канала В сердечной мышце : кальциевые каналы L-типа («L» означает «длительный») и кальциевые каналы Т-типа («T» означает «временный», то есть короткий). Каналы L-типа более распространены и наиболее густо заселены внутри мембраны Т-канальцев желудочковых клеток, тогда как каналы Т-типа обнаруживаются главным образом в клетках предсердий и пейсмекерных клетках , но все же в меньшей степени, чем каналы L-типа. [ нужна ссылка ]
Эти каналы по-разному реагируют на изменения напряжения на мембране: каналы L-типа активируются более положительными мембранными потенциалами, открываются дольше и остаются открытыми дольше, чем каналы Т-типа. Это означает, что каналы Т-типа вносят больший вклад в деполяризацию (фаза 0), тогда как каналы L-типа способствуют плато (фаза 2). [39]
Система проводимости
[ редактировать ]
В проводящей системе сердца электрическая активность, исходящая из синоатриального узла (САН), распространяется через сеть Гиса - Пуркинье , самый быстрый путь проводимости в сердце. Электрический сигнал проходит от синоатриального узла, который стимулирует предсердий сокращение , к атриовентрикулярному узлу (АВН) , который замедляет проведение потенциала действия от предсердий к желудочкам . Эта задержка позволяет желудочкам полностью наполниться кровью перед сокращением. Затем сигнал проходит вниз через пучок волокон, называемый пучком Гиса , расположенный между желудочками, а затем к волокнам Пуркинье в нижней части (верхушке) сердца, вызывая сокращение желудочков. [ нужна ссылка ]
Помимо SAN, волокна AVN и Пуркинье также обладают пейсмекерной активностью и, следовательно, могут спонтанно генерировать потенциал действия. Однако эти клетки обычно не деполяризуются спонтанно просто потому, что выработка потенциала действия в SAN происходит быстрее. Это означает, что прежде чем волокна АВН или Пуркинье достигнут порогового потенциала потенциала действия, они деполяризуются встречным импульсом из САС. [40] Это называется «подавлением перегрузки». [41] Кардиостимуляторная активность этих клеток жизненно важна, поскольку это означает, что если САН выйдет из строя, то сердце сможет продолжать биться, хотя и с меньшей частотой (AVN= 40-60 ударов в минуту,Волокна Пуркинье = 20-40 ударов в минуту). Эти кардиостимуляторы сохранят жизнь пациента до прибытия бригады скорой помощи. [ нужна ссылка ]
Примером преждевременного сокращения желудочков является классический синдром спортивного сердца . Постоянные тренировки спортсменов вызывают адаптацию сердца, при которой частота САС в состоянии покоя снижается (иногда около 40 ударов в минуту). Это может привести к атриовентрикулярной блокаде , при которой сигнал от SAN нарушается на пути к желудочкам. Это приводит к нескоординированным сокращениям между предсердиями и желудочками без правильной задержки между ними и в тяжелых случаях может привести к внезапной смерти. [42]
Регуляция вегетативной нервной системой
[ редактировать ]Скорость выработки потенциала действия в пейсмекерных клетках зависит, но не контролируется вегетативной нервной системой .
Симпатическая нервная система (нервы, доминирующие во время реакции организма «бей или беги» ) увеличивает частоту сердечных сокращений (положительная хронотропия ), уменьшая время для создания потенциала действия в САН. Нервы спинного мозга выделяют молекулу норадреналина , которая связывается и активирует рецепторы на мембране пейсмекерных клеток, называемые β1-адренорецепторами . Это активирует белок, называемый G s -белком (s – стимулирующий). Активация этого G-белка приводит к повышению уровня цАМФ в клетке (по пути цАМФ ). цАМФ связывается с каналами HCN (см. выше), увеличивая ток смешения и, следовательно, увеличивая скорость деполяризации во время действия кардиостимулятора. Увеличение цАМФ также увеличивает время открытия кальциевых каналов L-типа, увеличивая содержание кальция. 2+ ток через канал, ускоряя фазу 0. [43]
Парасимпатическая нервная система ( нервы доминируют, когда организм отдыхает и переваривает пищу) снижает частоту сердечных сокращений (отрицательная хронотропия ), увеличивая время, необходимое для создания потенциала действия в САН. Нерв, называемый блуждающим нервом , который начинается в головном мозге и идет к синоатриальному узлу, высвобождает молекулу, называемую ацетилхолином (АХ), которая связывается с рецептором, расположенным снаружи пейсмекерной клетки, называемым мускариновым рецептором М2 . Это активирует G i -белок (I означает ингибирующий), который состоит из трех субъединиц (α, β и γ), которые при активации отделяются от рецептора. Субъединицы β и γ активируют специальный набор калиевых каналов, увеличивая отток калия из клетки и снижая мембранный потенциал, а это означает, что клеткам-пейсмейкерам требуется больше времени, чтобы достичь своего порогового значения. [44] G i -белок также ингибирует путь цАМФ, тем самым уменьшая симпатические эффекты, вызываемые спинномозговыми нервами. [45]
Клиническое значение
[ редактировать ]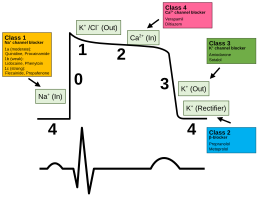
Антиаритмические препараты используются для регулирования сердечного ритма слишком быстрого . Другие препараты, используемые для влияния на сердечный потенциал действия, включают блокаторы натриевых каналов , бета-блокаторы , блокаторы калиевых каналов и блокаторы кальциевых каналов .
Ссылки
[ редактировать ]- ^ Чжао, Г; Цю, Ю; Чжан, HM; Ян, Д. (январь 2019 г.). «Вставочные диски: клеточная адгезия и передача сигналов при здоровье и заболеваниях сердца». Обзоры сердечной недостаточности . 24 (1): 115–132. дои : 10.1007/s10741-018-9743-7 . ПМИД 30288656 . S2CID 52919432 .
- ^ Куртенбах С., Куртенбах С., Зойдл Г. (2014). «Модуляция щелевого соединения и ее значение для функции сердца» . Границы в физиологии . 5 : 82. дои : 10.3389/fphys.2014.00082 . ПМЦ 3936571 . ПМИД 24578694 .
- ^ Солтысинская Э., Шпеершнейдер Т., Винтер С.В., Томсен М.Б. (август 2014 г.). «Дисфункция синоатриального узла вызывает сердечные аритмии у мышей с диабетом» . Сердечно-сосудистая диабетология . 13 : 122. дои : 10.1186/s12933-014-0122-y . ПМК 4149194 . ПМИД 25113792 .
- ^ Беккер Дэниел Э (2006). «Основы интерпретации электрокардиографии» . Прогресс анестезии . 53 (2): 53–64. doi : 10.2344/0003-3006(2006)53[53:foei]2.0.co;2 . ПМК 1614214 . ПМИД 16863387 .
- ^ Лоте, К. (2012). Принципы физиологии почек (5-е изд.). Спрингер. п. 150. ИСБН 9781461437840 .
- ^ Перейти обратно: а б Сантана, Луис Ф.; Ченг, Эдвард П.; Ледерер, В. Джонатан (1 декабря 2010 г.). «Как форма сердечного потенциала действия контролирует передачу сигналов кальция и сокращение сердца?» . Журнал молекулярной и клеточной кардиологии . 49 (6): 901–903. дои : 10.1016/j.yjmcc.2010.09.005 . ПМЦ 3623268 . ПМИД 20850450 .
- ^ Койвумяки, Юсси Т.; Корхонен, Топи; Тави, Паси (01 января 2011 г.). «Влияние высвобождения кальция саркоплазматическим ретикулумом на динамику кальция и морфологию потенциала действия в предсердных миоцитах человека: вычислительное исследование» . PLOS Вычислительная биология . 7 (1): e1001067. Бибкод : 2011PLSCB...7E1067K . дои : 10.1371/journal.pcbi.1001067 . ПМК 3029229 . ПМИД 21298076 .
- ^ Исса З.Ф., Миллер Дж.М., Зипес Д.П. (2019). «Электрофизиологические механизмы сердечных аритмий: аномальный автоматизм». В Исса З.Ф. (ред.). Клиническая аритмология и электрофизиология: спутник болезни сердца Браунвальда (Третье изд.). Филадельфия, Пенсильвания: Эльзевир. стр. 51–80. дои : 10.1016/B978-0-323-52356-1.00003-7 . ISBN 978-0-323-52356-1 .
- ^ Анцелевич С., Бурашников А. (март 2011 г.). «Обзор основных механизмов сердечной аритмии» . Клиника электрофизиологии сердца . 3 (1): 23–45. дои : 10.1016/j.ccep.2010.10.012 . ПМК 3164530 . ПМИД 21892379 .
- ^ Круль С. «Нарушения сердечного ритма – Учебник кардиологии» . www.textbookofcardiology.org . Проверено 17 мая 2022 г.
- ^ Перейти обратно: а б с д Сантана Л.Ф., Ченг Э.П. и Ледерер Дж.В. (2010a) «Как форма сердечного потенциала действия контролирует передачу сигналов кальция и сокращение в сердце?», 49(6).
- ^ Морад М., Тунг Л. (1982). «Ионные события, ответственные за сердечный отдых и потенциал действия». Американский журнал кардиологии . 49 (3): 584–594. дои : 10.1016/s0002-9149(82)80016-7 . ПМИД 6277179 .
- ^ Груннет М (2010). «Реполяризация сердечного потенциала действия. Является ли увеличение способности к реполяризации новым антиаритмическим принципом?» . Акта Физиологика . 198 : 1–48. дои : 10.1111/j.1748-1716.2009.02072.x . ПМИД 20132149 .
- ^ Перейти обратно: а б ДиФранческо, Дарио (19 февраля 2010 г.). «Роль смешного тока в деятельности кардиостимулятора» . Исследование кровообращения . 106 (3): 434–446. doi : 10.1161/CIRCRESAHA.109.208041 . ISSN 1524-4571 . ПМИД 20167941 .
- ^ Чжун Б., Чен П.С., Линь С.Ф. (март 2011 г.). «Роль кальция и часов напряжения в дисфункции синоатриального узла» . Медицинский журнал Йонсей . 52 (2): 211–9. дои : 10.3349/ymj.2011.52.2.211 . ПМК 3051220 . ПМИД 21319337 .
- ^ Ши, ХТ (1 января 1994 г.). «Анатомия потенциала действия в сердце» . Журнал Техасского института сердца . 21 (1): 30–41. ISSN 0730-2347 . ПМК 325129 . ПМИД 7514060 .
- ^ Первес и др. 2008 , стр. 26–28.
- ^ Роудс и Белл 2009 , с. 45.
- ^ Борон, Уолтер Ф.; Булпаеп, Эмиль Л. (2012). Медицинская физиология: клеточный и молекулярный подход . Борон, Уолтер Ф., Булпаеп, Эмиль Л. (Обновленная ред.). Филадельфия, Пенсильвания. п. 508. ИСБН 9781437717532 . OCLC 756281854 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Шервуд 2012 , с. 311.
- ^ Груннет М (2010б). «Реполяризация сердечного потенциала действия. Является ли увеличение способности к реполяризации новым антиаритмическим принципом?» . Акта Физиологика . 198 : 1–48. дои : 10.1111/j.1748-1716.2009.02072.x . ПМИД 20132149 .
- ^ Кубо, Ю; Адельман, JP; Клэпхэм, Делавэр; Ян, Л.Ю.; и др. (2005). «Международный союз фармакологии. LIV. Номенклатура и молекулярные взаимоотношения внутренне выпрямляющих калиевых каналов». Фармакол Рев . 57 (4): 509–26. дои : 10.1124/пр.57.4.11 . ПМИД 16382105 . S2CID 11588492 .
- ^ Кларк Р.Б., Мангони М.Э., Люгер А., Куэтт Б., Нарго Дж., Джайлз В.Р. (май 2004 г.). «Быстро активирующий ток K+ замедленного выпрямителя регулирует активность кардиостимулятора в клетках синоатриального узла взрослых мышей». Американский журнал физиологии. Физиология сердца и кровообращения . 286 (5): H1757–66. дои : 10.1152/ajpheart.00753.2003 . ПМИД 14693686 .
- ^ Первес и др. 2008 , с. 49.
- ^ Буллок, TH ; Орканд, Р; Гриннелл, А. (1977). Введение в нервную систему . Нью-Йорк: WH Freeman. п. 151 . ISBN 978-0716700302 .
- ^ Шервуд 2008 , с. 316.
- ^ Дубин (2003). Ионные приключения в Хартленде, том 1 . Издательство «Обложка». п. 145. ИСБН 978-0-912912-11-0 .
- ^ Гуденаф, Дэниел А.; Пол, Дэвид Л. (1 июля 2009 г.). «Щелевые соединения» . Перспективы Колд-Спринг-Харбор в биологии . 1 (1): а002576. doi : 10.1101/cshperspect.a002576 . ISSN 1943-0264 . ПМК 2742079 . ПМИД 20066080 .
- ^ Северс, Николас Дж. (1 декабря 2002 г.). «Ремоделирование щелевого соединения при сердечной недостаточности». Журнал сердечной недостаточности . 8 (6 Дополнение): S293–299. дои : 10.1054/jcaf.2002.129255 . ISSN 1071-9164 . ПМИД 12555135 .
- ^ Шервуд 2008 , стр. 248–50.
- ^ «Натриевый канал SCN5A, потенциалзависимый, тип V, альфа-субъединица [Homo sapiens (человек)]» . Национальный центр биотехнологической информации.
- ^ Ласерда, AE; Ким, HS; Рут, П; Перес-Рейес, Э; и др. (август 1991 г.). «Нормализация кинетики тока путем взаимодействия альфа-1 и бета-субъединиц дигидропиридин-чувствительного Ca2+-канала скелетных мышц». Природа . 352 (6335): 527–30. Бибкод : 1991Natur.352..527L . дои : 10.1038/352527a0 . ПМИД 1650913 . S2CID 4246540 .
- ^ Первс, Дейл; Августин, Джордж Дж.; Фитцпатрик, Дэвид; Кац, Лоуренс К.; ЛаМантия, Энтони-Самуэль; Макнамара, Джеймс О.; Уильямс, С. Марк (1 января 2001 г.). «Молекулярная структура ионных каналов». Нейронаука (2-е изд.).
- ^ Шэн, Морган. «Ионные каналы и рецепторы» (PDF) . Проверено 14 марта 2013 г.
- ^ Шервуд 2012 , стр. 310–1.
- ^ Хибино, Хироши; Инанобе, Ацуши; Фурутани, Казухару; Мураками, Шинго; Финдли, Ян; Курачи, Ёсихиса (01 января 2010 г.). «Внутреннее исправление калиевых каналов: их структура, функции и физиологическая роль». Физиологические обзоры . 90 (1): 291–366. doi : 10.1152/physrev.00021.2009 . ISSN 1522-1210 . ПМИД 20086079 . S2CID 472259 .
- ^ Дхамун, Амит С.; Джалифе, Хосе (01 марта 2005 г.). «Входящий выпрямительный ток (IK1) контролирует возбудимость сердца и участвует в аритмогенезе». Сердечный ритм . 2 (3): 316–324. дои : 10.1016/j.hrthm.2004.11.012 . ISSN 1547-5271 . ПМИД 15851327 .
- ^ Снайдерс, диджей (1 мая 1999 г.). «Строение и функция калиевых каналов сердца» . Сердечно-сосудистые исследования . 42 (2): 377–390. дои : 10.1016/s0008-6363(99)00071-1 . ISSN 0008-6363 . ПМИД 10533574 .
- ^ Наргеот, Дж. (31 марта 2000 г.). «Сказка о двух (кальциевых) каналах» . Исследование кровообращения . 86 (6): 613–615. дои : 10.1161/01.res.86.6.613 . ISSN 0009-7330 . ПМИД 10746994 .
- ^ Цянь, RW; Карпентер, DO (1 июня 1978 г.). «Ионные механизмы пейсмекерной активности в волокнах Пуркинье сердца». Труды Федерации . 37 (8): 2127–2131. ISSN 0014-9446 . ПМИД 350631 .
- ^ Вассаль, М. (1977). «Взаимосвязь между кардиостимуляторами: подавление перегрузки» . Исследование кровообращения . 41 (3): 269–77. дои : 10.1161/01.res.41.3.269 . ПМИД 330018 .
- ^ Фагард Р. (01 декабря 2003 г.). «Спортсменское сердце» . Сердце . 89 (12): 1455–61. дои : 10.1136/сердце.89.12.1455 . ПМЦ 1767992 . ПМИД 14617564 .
- ^ ДиФранческо, Д.; Тортора, П. (9 мая 1991 г.). «Прямая активация каналов кардиостимулятора внутриклеточным циклическим АМФ». Природа . 351 (6322): 145–147. Бибкод : 1991Natur.351..145D . дои : 10.1038/351145a0 . ISSN 0028-0836 . ПМИД 1709448 . S2CID 4326191 .
- ^ Остерридер, В.; Нома, А.; Траутвейн, В. (1 июля 1980 г.). «О кинетике калиевого канала, активированного ацетилхолином, в СА-узле сердца кролика». Архив Pflügers: Европейский журнал физиологии . 386 (2): 101–109. дои : 10.1007/bf00584196 . ISSN 0031-6768 . ПМИД 6253873 . S2CID 32845421 .
- ^ Демир, Семахат С.; Кларк, Джон В.; Джайлз, Уэйн Р. (1 июня 1999 г.). «Парасимпатическая модуляция пейсмекерной активности синоатриального узла в сердце кролика: объединяющая модель». Американский журнал физиологии. Физиология сердца и кровообращения . 276 (6): H2221–H2244. дои : 10.1152/ajpheart.1999.276.6.H2221 . ISSN 0363-6135 . ПМИД 10362707 .
Библиография
[ редактировать ]- Руди, Йорам (март 2008 г.). «Молекулярные основы реполяризации потенциала сердечного действия». Анналы Нью-Йоркской академии наук . 1123 (Контроль и регулирование явлений транспорта в сердечной системе): 113–8. Бибкод : 2008NYASA1123..113R . дои : 10.1196/анналы.1420.013 . ПМИД 18375583 . S2CID 13231624 .
- Шервуд, Л. (2008). Физиология человека, от клеток к системам (7-е изд.). Cengage Обучение . ISBN 9780495391845 .
- Шервуд, Л. (2012). Физиология человека, От клеток к системам (8-е [пересмотренное] изд.). Cengage Обучение . ISBN 9781111577438 .
- Пурвс, Д; Августин, Дж.Дж.; Фитцпатрик, Д; Холл, туалет; и др. (2008). Нейронаука (4-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 9780878936977 .
- Роудс, Р.; Белл, Д.Р., ред. (2009). Медицинская физиология: принципы клинической медицины . Липпинкотт Уильямс и Уилкинс . ISBN 9780781768528 .
Внешние ссылки
[ редактировать ]- Интерактивная анимация, иллюстрирующая генерацию потенциала сердечного действия.
- Интерактивные математические модели сердечного потенциала действия и других общих потенциалов действия