Хиральный вспомогательный
В стереохимии представляет хиральное вспомогательное вещество собой стереогенную группу или единицу, которая временно включается в органическое соединение для контроля стереохимического результата синтеза. [1] [2] Хиральность , присутствующая во вспомогательном веществе, может влиять на стереоселективность одной или нескольких последующих реакций. Затем вспомогательное вещество обычно может быть восстановлено для использования в будущем.

Большинство биологических молекул и фармацевтических мишеней существуют в виде одного из двух возможных энантиомеров ; следовательно, химический синтез натуральных продуктов и фармацевтических агентов часто направлен на получение мишени в энантиомерно чистой форме. [3] Хиральные вспомогательные вещества являются одной из многих стратегий, доступных химикам-синтетикам для селективного получения желаемого стереоизомера данного соединения. [4]
Хиральные вспомогательные вещества были представлены Элиасом Джеймсом Кори в 1975 году. [5] с хиральным 8-фенилментолом и Барри Тростом в 1980 году с хиральной миндальной кислотой. Соединение ментола сложно получить, и в качестве альтернативы Дж. К. Уайтселл в 1985 году предложил транс-2-фенил-1-циклогексанол.
Асимметричный синтез
[ редактировать ]Хиральные вспомогательные вещества включаются в синтетические пути для контроля абсолютной конфигурации стереогенных центров. Дэвида А. Эванса Синтез макролида цитоварицина , считающийся классическим, использует хиральные вспомогательные вещества оксазолидинона для одной реакции асимметричного алкилирования и четырех асимметричных альдольных реакций, устанавливая абсолютную стереохимию девяти стереоцентров. [6]

Типичная стереоселективная трансформация под контролем вспомогательного вещества включает три этапа: во-первых, вспомогательное вещество ковалентно связывается с субстратом; во-вторых, полученное соединение подвергается одному или нескольким диастереоселективным превращениям; и, наконец, вспомогательное вещество удаляют в условиях, не вызывающих рацемизации целевых продуктов. [4] Стоимость использования стехиометрического вспомогательного средства и необходимость проводить синтетические этапы добавления и удаления вспомогательного вещества делают этот подход неэффективным. Однако для многих трансформаций единственная доступная стереоселективная методология основана на использовании хиральных вспомогательных веществ. Кроме того, превращения с хиральными вспомогательными веществами, как правило, универсальны и очень хорошо изучены, что обеспечивает наиболее эффективный по времени доступ к энантиомерно чистым продуктам. [2]
Более того, [7] продукты реакций, направленных на вспомогательные вещества, представляют собой диастереомеры , что позволяет легко разделить их такими методами, как колоночная хроматография или кристаллизация.
8-фенилментол
[ редактировать ]В одном из первых примеров использования хирального вспомогательного вещества в асимметричном синтезе Э. Дж. Кори и его коллеги провели асимметричную реакцию Дильса-Альдера между (-)-8-фенилментола акриловым эфиром и 5-бензилоксиметилциклопентадиеном. [5] Продукт циклоприсоединения перешел к йодолактону, показанному ниже, промежуточному продукту в классическом синтезе простагландинов Кори . Предполагается, что задняя грань акрилата блокируется вспомогательным веществом, так что циклоприсоединение происходит на передней грани алкена.

-8-фенилментол может быть получен из любого энантиомера пулегона (- ) , [8] хотя ни один из маршрутов не является очень эффективным. Из-за широкого применения вспомогательного вещества 8-фенилментола более легко синтезируются альтернативные соединения, такие как транс -2-фенил-1-циклогексанол. [9] и транс -2-(1-фейл-1-метилэтил)циклогексанол [10] были исследованы.
1,1'-бинафтил-2,2'-диол (БИНОЛ)
[ редактировать ]1,1'-бинафтил-2,2'-диол , или БИНОЛ , используется в качестве хирального вспомогательного средства для асимметричного синтеза с 1983 года. [11] [12]

Хисаси Ямамото впервые использовал ( R )-БИНОЛ в качестве хирального вспомогательного средства в асимметричном синтезе лимонена , который является примером циклических монотерпенов . Мононериловый эфир ( R )-БИНОЛа получали моносилилированием и алкилированием ( R )-БИНОЛа в качестве хирального вспомогательного вещества. После восстановления алюмоорганическим реагентом лимонен был синтезирован с низкими выходами (выход 29%) и умеренными энантиомерными избытками до 64% ее. [12]

Получение множества энантиомерно чистых редких R -аминокислот может быть достигнуто путем алкилирования хиральных производных глицина, имеющих аксиально-хиральный БИНОЛ в качестве вспомогательного средства. Это было описано Fuji et al. В зависимости от различных электрофилов диастереомерный избыток варьировался от 69% до 86. [13]
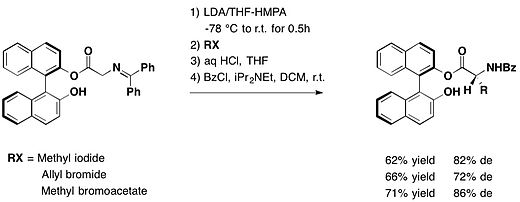
Защищенные по альдегидной функции с помощью (R)-БИНОЛа, арилглиоксали диастереоселективно реагировали с реагентами Гриньяра с образованием защищенного атролактальдегида с диастереомерным избытком от умеренного до превосходного и с высокими выходами. [14]
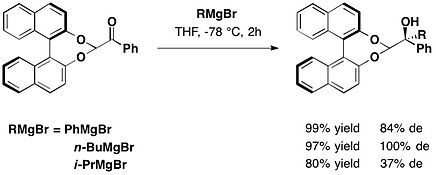
БИНОЛ также использовался в качестве хирального вспомогательного средства для контроля образования P-стереоцентра в процессе асимметричного катализируемого металлом CP-сочетания. Мондал и др. обнаружили, что катализируемая Pd реакция CP-кросс-сочетания между аксиально-хиральными фосфорамидитами на основе BINOL и арилгалогенидами или трифлатами протекает с превосходной стереоселективностью благодаря присутствию BINOL вблизи реагирующего P-центра. [15]
транс -2-фенилциклогексанол
[ редактировать ]
Один тип хирального вспомогательного средства основан на транс -2-фенилциклогексанольном мотиве, представленном Джеймсом К. Уайтселлом и его коллегами в 1985 году. Этот хиральный вспомогательный элемент использовался в еновых реакциях производного сложного эфира кислоты глиоксиловой . [16]
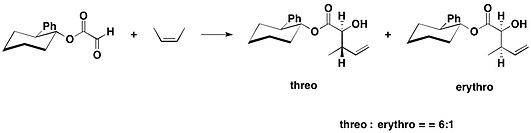
При суммарном синтезе (-)-гептемерона Б и (-)-гуанакастепена Е, присоединенных транс-2-фенилциклогексанолом, глиоксилат взаимодействовал с 2,4-диметилпент-2-еном в присутствии олова(IV). ) хлорид , дающий желаемый антиаддукт в качестве основного продукта вместе с небольшим количеством его син-изомера с диастереомерным соотношением 10:1 . [17]
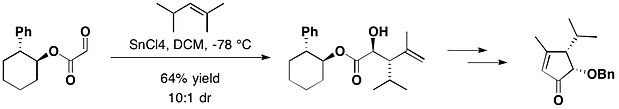
Для еще большего конформационного контроля переключение с фенильной группы на тритильную дает транс -2-тритилциклогексанол (ТТС). В 2015 году группа Брауна опубликовала эффективную окислительную циклизацию, опосредованную хиральным перманганатом, с ТТС. [18]

Оксазолидиноны
[ редактировать ]Вспомогательные вещества оксазолидинона , популяризированные Дэвидом А. Эвансом , применялись для многих стереоселективных преобразований, включая альдольные реакции , [19] алкилирования , реакции [20] и реакции Дильса-Альдера . [21] [22] Оксазолидиноны замещены в положениях 4 и 5. Благодаря стерическим затруднениям заместители направляют направление замещения различных групп. Вспомогательное вещество впоследствии удаляют, например, посредством гидролиза.
Подготовка
[ редактировать ]Оксазолидиноны можно получить из аминокислот или легкодоступных аминоспиртов . Большое количество оксазолидинонов коммерчески доступно, включая четыре, представленные ниже.

Ацилирование оксазолидинона достигается депротонированием н-бутиллитием и гашением ацилхлоридом .

Реакции алкилирования
[ редактировать ]Депротонирование по α-углероду оксазолидинонимида диизопропиламид сильным основанием, таким как лития, дает ( Z ) -енолят избирательно , который может подвергаться стереоселективному алкилированию .

Активированные электрофилы, такие как аллильные или бензилгалогениды . , являются очень хорошими субстратами
Альдольные реакции
[ редактировать ]Хиральные оксазолидиноны наиболее широко используются в стереоселективных альдольных реакциях.
Мягкая енолизация трифлатом дибутилбора кислоты Льюиса и основанием диизопропилэтиламином дает ( Z )-енолят, который подвергается диастереоселективной альдольной реакции с альдегидным субстратом. Трансформация особенно эффективна, поскольку одновременно создает два смежных стереоцентра.

Модель наблюдаемой стереоселективности можно найти ниже. Син - Циммермана-Тракслера шестичленного кольца стереоотношение между метильной группой и новым вторичным спиртом возникает в результате переходного состояния , в котором енолятный кислород и альдегидный кислород координируют бор. Альдегид ориентирован так, что водород располагается в псевдоаксиальной ориентации, чтобы минимизировать 1,3-диаксиальные взаимодействия . Абсолютная стереохимия двух стереоцентров контролируется хиральностью вспомогательного центра. В переходной структуре вспомогательный карбонил ориентирован в сторону от енолятного кислорода, чтобы минимизировать чистый диполь молекулы; одна грань енолята заблокирована заместителем на хиральном вспомогательном устройстве.

Удаление
[ редактировать ]Были разработаны различные трансформации для облегчения удаления вспомогательного оксазолидинона с образованием различных синтетически полезных функциональных групп .

Камфорсултам
[ редактировать ]Камфорсултам , или сультам Оппольцера, является классическим хиральным вспомогательным средством.
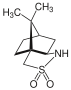
При полном синтезе манзацидина B группа Офьюна использовала камфорсултам для асимметричного построения основного оксазолинового кольца. По сравнению с оксазолидиноном в качестве хирального вспомогательного средства камфорсултам обладал значительной (2S , 3R ) -селективностью. [23]

Камфорсултам также действует как хиральное вспомогательное средство при добавлении Михаэля . Литиевое основание способствует стереоселективному присоединению тиолов по Михаэлю к N-мктакрилоилкамфорсултаму, что приводит к получению соответствующих продуктов присоединения с высокой диастереоселективностью. [24]
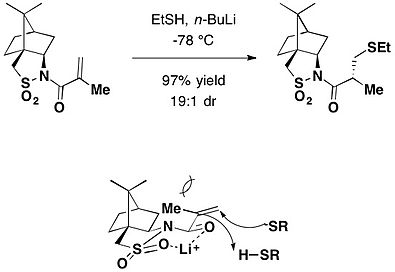
Камфорсултам использовался в качестве хирального вспомогательного средства для асимметричной перегруппировки Клайзена . В присутствии бутилированного гидрокситолуола (ВНТ), используемого в качестве поглотителя радикалов , толуольный раствор аддукта между гераниолом и камфорсултамом нагревали в запечатанной трубке при 140 °C, чтобы получить главным образом (2R , 3S ) -изомер в виде основной продукт перегруппировки с выходом 72%, обеспечивающий два смежных стереоцентра, включая четвертый углерод. [25]
Псевдоэфедрин и псевдоэфенамин
[ редактировать ]Как (R,R)-, так и (S,S) -псевдоэфедрин можно использовать в качестве хиральных вспомогательных веществ. [26] Псевдоэфедрин реагирует с карбоновой кислотой , ангидридом кислоты или ацилхлоридом с образованием соответствующего амида .
α-Протон карбонильного соединения легко депротонируется ненуклеофильным основанием с образованием енолята, который может в дальнейшем реагировать. Конфигурация присоединения, например, с алкилгалогенидом , определяется метильной группой. Таким образом, любой продукт присоединения будет син-с метильной группой и анти-с гидроксильной группой . Хиральный вспомогательный псевдоэфедрин впоследствии удаляется путем расщепления амидной связи подходящим нуклеофилом .
Подготовка
[ редактировать ]Оба энантиомера псевдоэфедрина коммерчески доступны. Рацемический псевдоэфедрин имеет множество медицинских применений. Поскольку псевдоэфедрин может использоваться для незаконного производства метамфетамина , покупка псевдоэфедрина для использования в академических или промышленных исследованиях довольно регламентирована. В качестве альтернативы Myers et al. сообщили о полезности хиральных вспомогательных веществ псевдоэфенамина в реакциях алкилирования. [27] Хотя псевдоэфенамин труднодоступен из коммерческих источников, его можно относительно легко синтезировать из бензила , и его нельзя использовать для производства амфетаминов . [28]

Амиды псевдоэфедрина обычно получают ацилированием ацилхлоридом или ангидридом . [29]

Алкилирование
[ редактировать ]Амиды псевдоэфедрина подвергаются депротонированию сильным основанием, таким как диизопропиламид лития (LDA), с образованием соответствующих ( Z ) -енолятов . Алкилирование этих енолятов лития протекает с высокой фациальной селективностью.

Считается, что диастереоселективность обусловлена конфигурацией, в которой одна грань енолята лития блокируется вторичным алкоксидом лития и молекулами растворителя, связанными с этим катионом лития. В соответствии с этим предложением было обнаружено, что диастереоселективность стадии алкилирования сильно зависит от количества присутствующего хлорида лития и растворителя, тетрагидрофурана (ТГФ). Обычно от 4 до 6 эквивалентов хлорида лития достаточно для насыщения раствора енолята в ТГФ при молярности реакции.

Одним из основных преимуществ асимметричного алкилирования амидами псевдоэфедрина является то, что еноляты амидов обычно достаточно нуклеофильны, чтобы реагировать с первичными и даже вторичными галогенидами при температурах в диапазоне от –78 ° C до 0 ° C. добавление ДМПУ . Также возможно создание четвертичных углеродных центров путем алкилирования енолятов α-разветвленных амидов, хотя для менее реакционноспособных электрофилов необходимо [30]
Удаление
[ редактировать ]Разработаны условия превращения амидов псевдоэфедрина в энантиомерно обогащенные карбоновые кислоты , спирты , альдегиды и кетоны — после расщепления вспомогательное вещество может быть восстановлено и использовано повторно.

трет -бутансульфинамид
[ редактировать ]Этот специфический хиральный сульфинамидный вспомогательный препарат был первоначально разработан Джонатаном А. Эллманом, и его группа широко исследовала его использование. [31] [32] Таким образом, его часто называют вспомогательным веществом Эллмана или сульфинамидом Эллмана.

Подготовка
[ редактировать ]Любой энантиомер трет -бутансульфинамида можно получить из трет -бутилдисульфида в две стадии: каталитическая реакция асимметричного окисления дает продукт окисления дисульфида (тиосульфинат) с высоким выходом и энантиомерным избытком. Обработка этого соединения амидом лития в аммиаке дает оптически чистый инвертированный продукт.

Конденсация трет -бутансульфинамида с альдегидом или кетоном протекает с высоким выходом и дает только ( E )-изомер соответствующих N -сульфинилиминов .

Синтез хиральных аминов
[ редактировать ]Добавление реактива Гриньяра к трет -бутансульфинилальдимину или кетимину приводит к асимметричному присоединению с образованием разветвленного сульфинамида. Наблюдаемую стереоселективность можно объяснить шестичленной кольцевой переходной структурой, в которой как кислород, так и азот сульфинилимина координируют магний.

Удаление
[ редактировать ]Вспомогательное вещество можно удалить из желаемого амина обработкой соляной кислотой в протонных растворителях .

САМП/РАМП
[ редактировать ]Реакции алкилирования хиральных ( S )-1-амино-2-метоксиметилпирролидина ( SAMP ) и ( R )-1-амино-2-метоксиметилпирролидина ( RAMP ) гидразонов были разработаны Дитером Эндерсом и Э. Дж. Кори. [33] [34]
Подготовка
[ редактировать ]SAMP можно получить в шесть стадий из ( S )-пролина, а RAMP можно получить в шесть стадий из ( R )-глутаминовой кислоты.

Реакции алкилирования
[ редактировать ]Конденсация SAMP или RAMP с альдегидом или кетоном дает ( E )-гидразин. Депротонирование диизопропиламидом лития и добавление алкилгалогенида дает алкилированный продукт. Вспомогательное вещество можно удалить озонолизом или гидролизом.

Хиральные вспомогательные вещества в промышленности
[ редактировать ]Хиральные вспомогательные вещества, как правило, надежны и универсальны, что позволяет эффективно синтезировать большое количество энантиомерно чистых соединений. Следовательно, хиральные вспомогательные вещества часто являются методом выбора на ранних стадиях разработки лекарств. [2]
Типранавир
[ редактировать ]Ингибитор протеазы ВИЧ Типранавир продается для лечения СПИДа. Первый путь энантиоселективной медицинской химии к Типранавиру включал конъюгированное добавление органокупратного реагента к хиральному акцептору Михаэля . [35] Хиральный оксазолидинон в акцепторе Михаэля контролировал стереохимию одного из двух стереоцентров молекулы. Последний коммерческий путь получения Типранавира не имеет хирального вспомогательного средства; вместо этого этот стереоцентр образуется в результате реакции асимметричного гидрирования . [36]

Аторвастатин
[ редактировать ]Кальциевая соль аторвастатина продается под торговым названием Липитор и предназначена для снижения уровня холестерина в крови. Первый энантиоселективный путь получения аторвастатина в медицинской химии основывался на диастереоселективной альдольной реакции с хиральным эфиром, устанавливающей один из двух спиртовых стереоцентров. [37] На коммерческом пути к аторвастатину этот стереоцентр происходит от легкодоступной пищевой добавки изоаскорбиновой кислоты . [38]

См. также
[ редактировать ]- Пример использования транс-2-фенил-1-циклогексанола в качестве хирального вспомогательного средства: лактам Охимы.
- Валин как хиральное вспомогательное средство в методе Шёллькопфа
Ссылки
[ редактировать ]- ^ Ключевые хиральные вспомогательные приложения (второе издание) (ред.: Роос, Г.), Academic Press, Бостон, 2014 г. ISBN 978-0-12-417034-6
- ^ Перейти обратно: а б с Глориус, Ф.; Гнас, Ю. (2006). «Хиральные вспомогательные вещества — принципы и недавние применения». Синтез . 2006 (12): 1899–1930. дои : 10.1055/s-2006-942399 .
- ^ Джамали, Фахреддин (1993). «Глава 14: Стереохимически чистые лекарства: обзор». В Вайнере, Ирвинг В. (ред.). Стереохимия лекарств: аналитические методы и фармакология . Марсель Деккер, Inc., стр. 375–382 . ISBN 978-0-8247-8819-3 .
- ^ Перейти обратно: а б Эванс, Д.А.; Хельмхен, Г.; Рюпинг, М. (2007). «Хиральные вспомогательные вещества в асимметричном синтезе». В Кристманне, М. (ред.). Асимметричный синтез — основы . Wiley-VCH Verlag GmbH & Co., стр. 3–9. ISBN 978-3-527-31399-0 .
- ^ Перейти обратно: а б Кори, Э.Дж.; Энсли, HE (1975). «Получение оптически активного промежуточного продукта простагландина посредством асимметричной индукции». Дж. Ам. хим. Соц. 97 (23): 6908–6909. дои : 10.1021/ja00856a074 . ПМИД 1184891 .
- ^ Николау, К.К. (2008). Классика в тотальном синтезе (5-е изд.). Нью-Йорк, Нью-Йорк: Wiley-VCH. стр. 485–508. ISBN 978-3-527-29231-8 .
- ^ Миллер, JP (2013). «ХимИнформ Реферат: Последние достижения в асимметричных реакциях Дильса-Альдера». ХимИнформ . 44 (48): нет. дои : 10.1002/chin.201348243 .
- ^ Кори, Э.Дж.; Энсли, HE; Парнелл, Калифорния (1978). «Удобный синтез высокоэффективного и перерабатываемого хирального директора для асимметричной индукции». Дж. Орг. хим. 43 (8): 1610–1611. дои : 10.1021/jo00402a037 .
- ^ Уайтселл, Дж. К.; Чен, Х.Х.; Лоуренс, РМ (1985). «Транс-2-фенилциклогексанол. Мощный и легкодоступный хиральный вспомогательный элемент». Дж. Орг. Хим . 50 (23): 4663–4664. дои : 10.1021/jo00223a055 .
- ^ Коминс, ДЛ; Сальвадор, доктор юридических наук (1993). «Эффективный синтез и разделение транс-2-(1-арил-1-метилэтил)циклогексанолов: практические альтернативы 8-P-фенилментолу». Дж. Орг. Хим . 58 (17): 4656–4661. дои : 10.1021/jo00069a031 .
- ^ Брюнель, Жан Мишель (2005). «БИНОЛ: универсальный хиральный реагент». Химические обзоры . 105 (3): 857–898. дои : 10.1021/cr040079g . ПМИД 15755079 .
- ^ Перейти обратно: а б Сакане, Соичи; Фудзивара, Джунья; Маруока, Кейджи; Ямамото, Хисаши (1983). «Хиральная уходящая группа. Асимметричный синтез лимонена и бисаболенов биогенетического типа». Журнал Американского химического общества . 105 (19): 6154–6155. дои : 10.1021/ja00357a033 .
- ^ Танака, Киёси; Ан, Миха; Ватанабэ, Юкари; Фудзи, Каору (1 июня 1996 г.). «Асимметричный синтез необычных α-аминокислот путем диастереоселективного алкилирования хирального эквивалента глицина». Тетраэдр: Асимметрия . 7 (6): 1771–1782. дои : 10.1016/0957-4166(96)00212-1 .
- ^ Мальоли, Паола; Де Лукки, Отторино; Делогу, Джованна; Валле, Джованни (1 января 1992 г.). «Высоко диастереоселективное восстановление и добавление нуклеофилов к арилглиоксалям, защищенным бинафтолом». Тетраэдр: Асимметрия . 3 (3): 365–366. дои : 10.1016/S0957-4166(00)80276-1 .
- ^ Мондал, Анирбан; Тиль, Никлас О.; Дорел, Рут; Феринга, Бен Л. (январь 2022 г.). «P-хирогенные соединения фосфора путем стереоселективного Pd-катализируемого арилирования фосфорамидитов» . Природный катализ . 5 (1): 10–19. дои : 10.1038/s41929-021-00697-9 . S2CID 245426891 .
- ^ Бучи, Джордж; Фогель, Деннис Э. (1985). «Новый метод получения γ,δ-ненасыщенных кетонов перегруппировкой Кляйзена». Журнал органической химии . 50 (23): 4664–4665. дои : 10.1021/jo00223a056 .
- ^ Миллер, Обри К.; Хьюз, Чемберс К.; Кеннеди-Смит, Джошуа Дж.; Градл, Стефан Н.; Дирк Траунер (2006). «Полный синтез (-)-гептемерона B и (-)-гуанакастепена E». Журнал Американского химического общества . 128 (51): 17057–17062. дои : 10.1021/ja0660507 . ПМИД 17177458 .
- ^ Аль Хазми, Али М.; Шейх Надим С.; Батай, Кэрол-младший; Аль-Хадеди, Аззам А.М.; Уоткин, Сэм В.; Люкер, Тим Дж.; Кэмп, Николас П.; Браун, Ричард CD (2014). « Транс -2-тритилциклогексанол как хиральное вспомогательное вещество в перманганат-опосредованной окислительной циклизации 2-метиленгепт-5-еноатов: применение для синтеза транс -(+)-линалоолоксида». Органические письма . 16 (19): 5104–5107. дои : 10.1021/ol502454r . ПМИД 25225741 .
- ^ Эванс, Д.А.; Бартроли, Дж.; Ши, ТЛ (1981). «Энантиоселективные альдольные конденсации. 2. Эритроселективные хиральные альдольные конденсации через еноляты бора». Дж. Ам. хим. Соц . 103 (8): 2127–2129. дои : 10.1021/ja00398a058 .
- ^ Эванс, Д.А.; Эннис, доктор медицины; Матре, диджей (1982). «Реакции асимметричного алкилирования хиральных имидных енолятов. Практический подход к энантиоселективному синтезу производных α-замещенных карбоновых кислот». Дж. Ам. хим. Соц . 104 (6): 1737–1739. дои : 10.1021/ja00370a050 .
- ^ Эванс, Д.А.; Чепмен, КТ; Бисаха, Дж. (1984). «Новые асимметричные реакции циклоприсоединения Дильса-Альдера. Хиральные α,β-ненасыщенные карбоксимиды как практические хиральные акрилатные и кротонатные диенофильные синтоны». Дж. Ам. хим. Соц . 106 (15): 4261–4263. дои : 10.1021/ja00327a031 .
- ^ Эванс, Д.А.; Чепмен, КТ; Хунг, DT; Кавагути, AT (1987). «П-сольватация переходного состояния ароматическими кольцами: электронный вклад в диастереоселективность реакции Дильса-Альдера». Энджью. хим. Межд. Эд. 26 (11): 1184–1186. дои : 10.1002/anie.198711841 .
- ^ Шинада, Тесро; Оэ, Кентаро; Офуне, Ясуфуми (27 июня 2012 г.). «Эффективный общий синтез манзацидина Б». тетраэдра Буквы 53 (26): 3250–3253. дои : 10.1016/joint.2012.04.042 .
- ^ Цай, Вэнь-Цзюань; Линь, И-Цонг; Уанг, Биинг-Цзюн (1 июля 1994 г.). «Асимметричное присоединение тиолов по Михаэлю к (1R,2R,4R)-(-)-2,10- N -еноилкамфорсултаму». Тетраэдр: Асимметрия . 5 (7): 1195–1198. дои : 10.1016/0957-4166(94)80155-X .
- ^ Такао, Кен-ичи; Сакамото, Шу; Туати, Марианна Лайт; Кусакава, Юсуке; Тадано, Кин-ичи (08 ноября 2012 г.). «Асимметричное построение полноуглеродных четвертичных стереоцентров посредством хирально-вспомогательно-опосредованной перегруппировки Клайзена и полного синтеза (+)-бакучиола» . Молекулы . 17 (11): 13330–13344. дои : 10.3390/molecules171113330 . ПМК 6268616 . ПМИД 23138536 .
- ^ Майерс, АГ; и др. (1997). «Псевдоэфедрин как практическое хиральное вспомогательное средство для синтеза высокоэнантиомерно обогащенных карбоновых кислот, спиртов, альдегидов и кетонов». Дж. Ам. хим. Соц . 119 (28): 6496–6511. дои : 10.1021/ja970402f .
- ^ Майерс, АГ; Моралес, MR; Меллем, КТ (2012). «Псевдофенамин: практическое хиральное вспомогательное средство для асимметричного синтеза» (PDF) . Энджью. Хим . 124 (19): 4646–4649. Бибкод : 2012АнгЧ.124.4646М . дои : 10.1002/ange.201200370 . ПМЦ 3854953 . ПМИД 22461381 .
- ^ Меллем, Кевин Т.; Майерс, Эндрю Г. (2013). «Простой масштабируемый синтетический путь к (+)- и (-)-псевдофенамину» . Органические письма . 15 (21): 5594–5597. дои : 10.1021/ol402815d . ISSN 1523-7060 . ПМЦ 3864801 . ПМИД 24138164 .
- ^ Майерс, АГ; Ян, Б.Х.; МакКинстри, Л.; Копецкий, диджей; Глисон, Дж. Л. (1997). «Псевдоэфедрин как практическое хиральное вспомогательное средство для синтеза высокоэнантиомерно обогащенных карбоновых кислот, спиртов, альдегидов и кетонов». Дж. Ам. хим. Соц . 119 (28): 6496–6511. дои : 10.1021/ja970402f .
- ^ Куммер, Д.А.; Цепочка, У.Дж.; Моралес, MR; Кирога, О.; Майерс, АГ (2008). «Стереоконтролируемое алкилативное построение четвертичных углеродных центров» . Дж. Ам. хим. Соц . 130 (40): 13231–13233. дои : 10.1021/ja806021y . ПМК 2666470 . ПМИД 18788739 .
- ^ Лю, Гуанчэн; Коган, Дерек А.; Эллман, Джонатан А. (октябрь 1997 г.). «Каталитический асимметричный синтез трет-бутансульфинамида. Применение к асимметричному синтезу аминов». Журнал Американского химического общества . 119 (41): 9913–9914. дои : 10.1021/ja972012z . ISSN 0002-7863 .
- ^ Эллман, Дж.А.; Оуэнс, Т.Д.; Тан, ТП (2002). «N-трет-бутансульфинилимины: универсальные промежуточные соединения для асимметричного синтеза аминов». Акк. хим. Рез. 35 (11): 984–995. дои : 10.1021/ar020066u . ПМИД 12437323 .
- ^ Кори, Э.Дж.; Эндерс, Д. (1976). «Применение N,N-диметилгидразонов в синтезе. Использование для эффективного, позиционно и стереохимически селективного образования связей CC; окислительный гидролиз до карбонильных соединений». Буквы тетраэдра . 17 (1): 3–6. дои : 10.1016/s0040-4039(00)71307-4 .
- ^ Курти, Л.; Чако, Б. (2005). Стратегическое применение названных реакций в органическом синтезе . Берлингтон, Массачусетс: Elsevier Academic Press. стр. 150–151. ISBN 978-0-12-369483-6 .
- ^ Тернер, ST; и др. (1998). «Типранавир (PNU-140690): мощный биодоступный пероральный непептидный ингибитор ВИЧ-протеазы класса 5,6-дигидро-4-гидрокси-2-пиронсульфонамидов». Дж. Мед. хим. 41 (18): 3467–3476. дои : 10.1021/jm9802158 . ПМИД 9719600 .
- ^ Карон, Стефан (2011). «Глава 15: Разработка синтетического пути избранных современных фармацевтических препаратов». В Кароне, Стефан (ред.). Практическая синтетическая органическая химия . John Wiley & Sons, Inc., стр. 666–670 . ISBN 978-0-470-03733-1 .
- ^ Рот, Б.Д.; и др. (1991). «Ингибиторы биосинтеза холестерина. 3. Тетрагидро-4-гидрокси-6-[2-(lH-пиррол-1-ил)этил]-2H-пиран-2-он Ингибиторы ГМГ-КоА-редуктазы. 2. Эффекты введения Заместители в третьем и четвертом положениях пиррольного ядра». Дж. Мед. Хим . 34 (1): 357–366. дои : 10.1021/jm00105a056 . ПМИД 1992137 .
- ^ Цзе Джек Ли; Дуглас С. Джонсон; Драго Р. Слискович; Брюс Д. Рот (2004). «Глава 9. Аторвастатин Кальций (Липитор)». Современный синтез лекарств . John Wiley & Sons, Inc., стр. 113–125. ISBN 978-0-471-21480-9 .