Муфта Соногашира
| Муфта Соногашира | |
|---|---|
| Назван в честь | Кенкичи Соногашира |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Соногашира-соединение |
| RSC Идентификатор онтологии | RXNO: 0000137 |
| Примеры и связанные реакции | |
| Подобные реакции | Муфта Соногашира, не содержащая меди |
Реакция Соногаширы — это реакция кросс-сочетания, используемая в органическом синтезе для образования связей углерод-углерод . В нем используется палладиевый катализатор , а также медный сокатализатор для образования углерод-углеродной связи между концевым алкином и арилом или винилгалогенидом . [ 1 ]
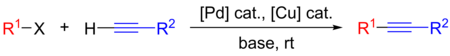 |
| Реакция Соногаширы |
|---|
- Р 1 : арил или винил
- Р 2 : произвольный
- X: I, Br, Cl или OTf
Реакция кросс-сочетания Соногаширы использовалась в самых разных областях благодаря ее полезности для образования связей углерод-углерод. Реакцию можно проводить в мягких условиях, например, при комнатной температуре, в водных средах и с мягким основанием, что позволило использовать реакцию кросс-сочетания Соногаширы в синтезе сложных молекул. Его области применения включают фармацевтику, натуральные продукты, органические материалы и наноматериалы . [ 1 ] Конкретные примеры включают его использование в синтезе тазаротена , [ 2 ] который используется для лечения псориаза и прыщей , а также в препарате SIB-1508Y, также известном как алтиниклин , [ 3 ] агонист рецепторов никотиновых .
История
[ редактировать ]О реакции алкинилирования арилгалогенидов с использованием ароматических ацетиленов сообщалось в 1975 году в трех независимых статьях Кассара: [ 4 ] Дик и Хек [ 5 ] а также Соногашира , Тохда и Хагихара. [ 6 ] Во всех реакциях используются палладиевые катализаторы, дающие одни и те же продукты реакции. Однако протоколы Кассара и Хека выполняются исключительно с использованием палладия и требуют жестких условий реакции (т.е. высоких температур реакции). Использование медного сокатализатора в дополнение к комплексам палладия в методике Соногаширы позволило проводить реакции в мягких условиях реакции с отличными выходами. Последовавшее за этим быстрое развитие систем Pd/Cu позволило реализовать множество синтетических применений, в то время как условия Кассара-Хека были оставлены, возможно несправедливо, почти забыты. [ 7 ] О замечательной полезности реакции может свидетельствовать объем исследований, которые все еще проводятся по пониманию и оптимизации ее синтетических возможностей, а также использованию процедур для получения различных соединений, имеющих синтетическое, медицинское или материальное/промышленное значение. [ 7 ] Среди реакций кросс-сочетания по количеству публикаций следует сразу за реакцией Сузуки и Хека. [ 8 ] а поиск по термину «Соногашира» в SciFinder дает более 1500 ссылок на журнальные публикации в период с 2007 по 2010 год. [ 7 ]
Реакция Соногаширы стала настолько хорошо известна, что часто все реакции, в которых используются современные металлоорганические катализаторы для соединения алкиновых мотивов, называются неким вариантом «реакции Соногаширы» , несмотря на то, что эти реакции не проводятся в истинных условиях реакции Соногаширы. [ 7 ]
Механизм
[ редактировать ]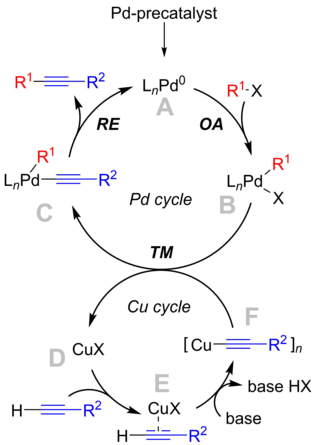
Механизм реакции не совсем понятен, но механизм учебника вращается вокруг палладиевого цикла, который соответствует «классическому» механизму перекрестного взаимодействия , и медного цикла, который менее известен. [ 9 ]
Палладиевый цикл
[ редактировать ]- Разновидности палладиевого прекатализатора активируются в условиях реакции с образованием реакционноспособного Pd. 0 соединение А. , Точная идентичность каталитических частиц сильно зависит от условий реакции. В случае простых фосфинов, таких как PPh 3 (n=2), и в случае объемистых фосфинов (т. е. P( o -Tol)
3 ) показано, что образуются монолигированные виды (n=1). [ 10 ] Более того, некоторые результаты указывают на образование анионных форм палладия [L 2 Pd 0 кл] − , которые могли бы быть настоящими катализаторами в присутствии анионов и галогенидов. [ 11 ] - Активный Pd 0 Катализатор участвует в стадии окислительного присоединения к арил- или винилгалогенидному субстрату с образованием Pd. II вид Б. Как и в приведенном выше обсуждении, его структура зависит от используемых лигандов. Считается, что эта стадия является лимитирующей стадией реакции.
- Комплекс B реагирует с ацетилидом меди, комплексом F , на стадии трансметаллирования , давая комплекс C и регенерируя медный катализатор.
- Строение комплекса С зависит от свойств лигандов. Для того чтобы произошло легкое восстановительное элиминирование , мотивы субстрата должны находиться в непосредственной близости, т.е. в цис-ориентации, чтобы могла происходить транс-цис-изомеризация . При восстановительном элиминировании продукт толан выводится из комплекса, а активные каталитические частицы Pd регенерируются.
Медный цикл
[ редактировать ]- Медный цикл не совсем хорошо описан. Предполагается, что наличие основания приводит к образованию π-алкинового E. комплекса Это увеличивает кислотность концевого протона и приводит к образованию ацетилида меди, комплекса F , при депротонировании.
- Затем ацетилид F участвует в реакции трансметаллирования с промежуточным соединением B. палладия
Механизм варианта Соногашира без меди
[ редактировать ]Хотя использование солей меди в «классической» реакции Соногаширы и выгодно для эффективности реакции, оно сопровождается рядом недостатков, таких как применение экологически вредных реагентов, образование нежелательных алкиновых гомосочетаний ( побочные продукты Глейзера ) и необходимость строгого исключения кислорода из реакционной смеси. Таким образом, с целью исключения меди из реакции были предприняты большие усилия по разработке безмедной реакции Соногаширы. Наряду с разработкой новых условий реакции многие экспериментальные и вычислительные исследования были сосредоточены на выяснении механизма реакции. [ 12 ] До недавнего времени точный механизм возникновения реакции без меди обсуждался, а важные механистические вопросы оставались без ответа. [ 7 ] Это было показано в 2018 году Кошмрлем и др. что реакция идет по двум связанным между собой Pd 0 /Пд II каталитические циклы. [ 13 ] [ 14 ]
![Механизм реакции Соногаширы без меди.[13][14]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Cu-free-mechanism.png/642px-Cu-free-mechanism.png) |
| Механизм реакции Соногаширы без меди. [ 13 ] [ 14 ] |
|---|
- Подобно оригинальному механизму, Pd 0 Цикл начинается с окислительного присоединения арилгалогенида или трифлата к Pd. 0 катализатор, образующий комплекс B и активирующий арилгалогенидный субстрат реакции.
- Ацетилен активируется во втором, Pd II опосредованный цикл. Было доказано, что фенилацетилен образует комплекс моноацетилида палладия D, а также комплекс бисацетилида палладия F в мягких условиях реакции.
- Оба активированных соединения, а именно комплексы и F , участвуют в стадии трансметаллирования , образуя комплекс C и регенерируя D. B
- Образующиеся продукты восстановительного элиминирования , дизамещенный алкиновый продукт, а также регенерированный Pd 0 каталитические виды, завершают Pd 0 каталитический цикл.
Показано, что амины конкурентоспособны по отношению к фосфинам, а также могут участвовать в качестве лигандов L в описанных реакциях. В зависимости от скорости конкуренции между амином и фосфинами ожидается динамичное и сложное взаимодействие при использовании разных координационных оснований. [ 15 ] [ 16 ] [ 13 ] [ 14 ]
Условия реакции
[ редактировать ]Реакция Соногаширы обычно протекает в мягких условиях. [ 17 ] Кросс-сочетание проводят при комнатной температуре с основанием, обычно амином, таким как диэтиламин . [ 6 ] он также действует как растворитель. Реакционная среда должна быть основной для нейтрализации галогеноводорода, образующегося как побочный продукт реакции сочетания, поэтому соединения алкиламинов, такие как триэтиламин и диэтиламин иногда используются в качестве растворителей , но в качестве растворителя можно использовать также ДМФ или простой эфир. Иногда используются другие основания, такие как карбонат калия или карбонат цезия. Кроме того, для реакций сочетания Соногаширы формально необходимы деаэрированные условия, поскольку комплексы палладия(0) неустойчивы на воздухе, а кислород способствует образованию гомосопряженных ацетиленов. Недавно разработка устойчивых на воздухе палладийорганических катализаторов позволила проводить эту реакцию в окружающей атмосфере. Кроме того, Р.М. Аль-Зуби и его коллеги успешно разработали метод с высокой региоселективностью для производных 1,2,3-тригалоарена с хорошими и высокими выходами в условиях окружающей среды. [ 18 ]
Катализаторы
[ редактировать ]Обычно для этой реакции необходимы два катализатора: нульвалентный комплекс палладия и галогенид меди(I). Общие примеры палладиевых катализаторов включают катализаторы, содержащие фосфиновые лиганды, такие как [Pd(PPh 3 ) 4 ] . Другим широко используемым источником палладия является [ Pd(PPh 3 ) 2 Cl 2 ] , но комплексы, содержащие бидентатные фосфиновые лиганды , такие как [Pd( dppe )Cl 2 ] , [Pd( dppp )Cl 2 ] и [Pd(dppf)Cl 2 ] также использовали. [ 9 ] Недостатком таких катализаторов является необходимость высоких загрузок палладия (до 5 мол%) и большего количества медного сокатализатора. [ 9 ] ПД II комплексы фактически являются предкатализаторами, поскольку их необходимо восстановить до Pd 0 прежде чем начнется катализ. ПД II комплексы обычно проявляют большую стабильность, чем Pd 0 комплексы и могут храниться в обычных лабораторных условиях месяцами. [ 19 ] ПД II катализаторы восстанавливаются до Pd 0 в реакционной смеси амином , фосфиновым лигандом или другим реагентом в смеси, позволяющим протекать реакции. [ 20 ] Например, окисление трифенилфосфина до оксида трифенилфосфина может привести к образованию Pd. 0 на месте, когда [Pd(PPh 3 ) 2 Cl 2 ] Используют .
Соли меди(I), такие как CuI , реагируют с концевым алкином и образуют ацетилид меди(I), который действует как активированный компонент в реакциях сочетания. Cu(I) является сокатализатором реакции и используется для увеличения скорости реакции. [ 7 ]
Арилгалогениды и псевдогалогениды
[ редактировать ]Выбор арилгалогенидной или псевдогалогенидной подложки (пр. 2 -углерод) является одним из факторов, в основном влияющих на реакционную способность каталитической системы Соногашира. Реакционная способность галогенидов выше по отношению к йоду, а винилгалогениды более реакционноспособны, чем аналогичные арилгалогениды. Сочетание арилйодидов протекает при комнатной температуре, а арилбромиды требуют нагревания.
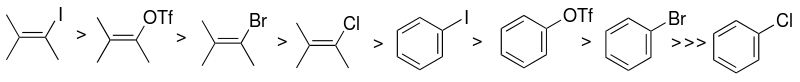
Эту разницу в реакционной способности можно использовать для селективного связывания арилйодида, но не арилбромида, проводя реакцию при комнатной температуре. [ 9 ] Примером может служить симметричное сочетание Соногаширы двух эквивалентов 1-бром-4-иодбензола с триметилсилилацетиленом (с триметилсилильной группы удалением на месте ) с образованием бис (4-бромфенил) ацетилена . [ 21 ]
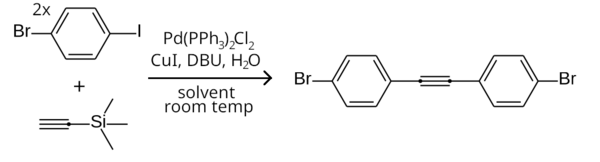
Вместо арилгалогенидов также можно использовать арилтрифлаты.
Предшественники арениазония
[ редактировать ]Сообщалось, что соли арендиазония являются альтернативой арилгалогенидам для реакции сочетания Соногаширы. Хлорид золота (I) использовался в качестве сокатализатора в сочетании с хлоридом палладия (II) при сочетании солей арендиазония с концевыми алкинами, процесс проводился в присутствии хлорида бис-2,6-диизопропилфенилдигидроимидазолия (IPr NHC). (5 мол%) для образования in situ комплекса NHC-палладий и 2,6-ди-трет-бутил-4-метилпиридина (DBMP) в качестве основания в ацетонитриле в качестве растворителя при комнатной температуре. [ 22 ] Это сочетание можно осуществить, начиная с анилинов, путем образования соли диазония с последующим in situ Сочетание Соногашира, при котором анилины превращаются в соль диазония и далее превращаются в алкин путем сочетания с фенилацетиленом.
Алкины
[ редактировать ]Для получения желаемых дизамещенных продуктов с удовлетворительными выходами можно использовать различные ароматические алкины. Алифатические алкины обычно менее реакционноспособны.
Базы
[ редактировать ]Из-за решающей роли основания для продолжения реакции необходимо добавлять определенные амины в избытке или в качестве растворителя. Было обнаружено, что вторичные амины, такие как пиперидин, морфолин или диизопропиламин, в частности, могут эффективно и обратимо реагировать транс- с RPdX(PPh 3 ) 2 комплекса путем замены одного PPh 3 Лиганд . Константа равновесия этой реакции зависит от R, X, фактора основности и стерических затруднений амина. [ 23 ] В результате возникает конкуренция между амином и алкиновой группой за этот лигандный обмен, поэтому амин обычно добавляют в избытке, чтобы способствовать предпочтительному замещению.
Защитные группы
[ редактировать ]Триметилсилилацетилен является широко используемым реагентом в реакциях Соногаширы. [ 24 ] Будучи жидкостью, он является более удобным реагентом, чем газообразный ацетилен , а триметилсилильная группа предотвращает присоединение к другому концу ацетиленовой группы. Затем триметилсилильную группу можно удалить с помощью TBAF , получая монозамещенный ацетилен. Его также можно удалить с помощью DBU in situ, позволяя монозамещенному ацетилену вступить в дальнейшую реакцию с другим арилгалогенидом с образованием дифенилацетилена и его производных. [ 21 ]
Варианты реакции
[ редактировать ]Муфта Соногашира, не содержащая меди
[ редактировать ]Хотя для повышения реакционной способности в реакцию добавляют медный сокатализатор, присутствие меди может привести к образованию алкиновых димеров. Это приводит к так называемой реакции сочетания Глейзера , которая представляет собой нежелательное образование продуктов гомосочетания производных ацетилена при окислении . В результате при проведении реакции Соногаширы с медным сокатализатором необходимо проводить реакцию в инертной атмосфере, чтобы избежать нежелательной димеризации. Безмедийные варианты реакции Соногаширы были разработаны, чтобы избежать образования продуктов гомосочетания. [ 19 ] [ 25 ] Есть и другие случаи, когда следует избегать использования меди, например, реакции сочетания с участием субстратов, которые являются потенциальными медными лигандами, например порфирины свободного основания . [ 9 ]
Обратная связь Соногашира
[ редактировать ]При обратном сочетании Соногаширы реагентами являются арильное или винильное соединение и алкинилгалогенид. [ 26 ]
Варианты катализатора
[ редактировать ]Серебряный сокатализ
[ редактировать ]стехиометрические количества оксида серебра . В некоторых случаях вместо CuI для соединений Соногашира, не содержащих меди, можно использовать [ 9 ]
Никелевые катализаторы
[ редактировать ]Недавно была разработана реакция Соногаширы, катализируемая никелем, которая позволяет связывать неактивированные алкилгалогениды с ацетиленом без использования палладия, хотя медный сокатализатор все еще необходим. [ 27 ] Сообщалось также, что золото можно использовать в качестве гетерогенного катализатора, что было продемонстрировано при сочетании фенилацетилена и иодбензола с катализатором Au/CeO 2 . [ 28 ] [ 29 ] В этом случае катализ происходит гетерогенно на наночастицах Au: [ 29 ] [ 30 ] с Au(0) в качестве активного центра. [ 31 ] Было также обнаружено, что селективность в отношении желаемого продукта кросс-сочетания повышается за счет таких носителей, как CeO 2 и La 2 O 3 . [ 31 ] Кроме того, соединения Соногашира, катализируемые железом, были исследованы как относительно дешевая и нетоксичная альтернатива палладию. Здесь FeCl 3 предлагается действовать в качестве катализатора переходного металла, а Cs 2 CO 3 в качестве основания, таким образом теоретически протекая по механизму, не содержащему палладия и меди. [ 32 ]
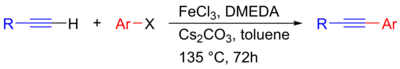 |
| Реакция Соногаширы без палладия, катализируемая железом [ 32 ] |
|---|
Несмотря на то, что безмедийный механизм оказался жизнеспособным, попытки включить различные переходные металлы, упомянутые выше, в качестве менее дорогих альтернатив палладиевым катализаторам, показали плохую репутацию успеха из-за загрязнения реагентов следовыми количествами палладия, что предполагает что достижение этих теоретических путей крайне маловероятно, если не невозможно. [ 33 ]
Исследования показали, что органические и неорганические исходные материалы также могут содержать достаточное количество ( на уровне частей на миллиард ) палладия для связывания. [ 34 ]
Совместный катализ золота и палладия
[ редактировать ]Сообщается о высокоэффективной комбинированной методике с использованием золота и палладия для сочетания Соногаширы широкого спектра электронно и структурно разнообразных арил- и гетероарилгалогенидов. [ 35 ] Ортогональная реакционная способность двух металлов демонстрирует высокую селективность и исключительную толерантность к функциональным группам при сочетании Соногаширы. Краткое механистическое исследование показывает, что промежуточное соединение золото-ацетилид вступает в каталитический цикл палладия на стадии трансметаллирования.
Дендримерные комплексы палладия
[ редактировать ]Проблемы, связанные с восстановлением часто дорогостоящего катализатора после образования продукта, представляют собой серьезный недостаток для крупномасштабного применения гомогенного катализа. [ 9 ] Структуры, известные как металлодендримеры, сочетают в себе преимущества гомогенных и гетерогенных катализаторов, поскольку они растворимы и четко определены на молекулярном уровне, и, тем не менее, их можно восстановить путем осаждения, ультрафильтрации или ультрацентрифугирования. [ 36 ] Можно найти некоторые недавние примеры использования дендритных катализаторов на основе палладия для реакции Соногаширы без меди. Так, несколько поколений полиаминодендритных бидентатных фосфинпалладий(II) катализаторов использовались, солюбилизированные в триэтиламине, для сочетания арилиодидов и бромидов при 25–120 °C, а также арилхлоридов, но с очень низкими выходами. [ 37 ]

Дендримерные катализаторы обычно можно было восстановить путем простого осаждения и фильтрации и повторно использовать до пяти раз, при этом наблюдалось снижение активности из-за разложения дендримеров, а не из-за выщелачивания палладия. Эти дендримерные катализаторы показали отрицательный дендритный эффект; то есть эффективность катализатора снижается по мере увеличения образования дендримеров. Пригодный для повторного использования полимерный фосфиновый лиганд получается в результате метатезисной полимеризации с раскрытием цикла производного норборнена и используется в сокатализируемой медью реакции Соногаширы метил- п -иодбензоата и фенилацетилена с использованием Pd(dba) 2 ·CHCl 3 в качестве источника палладия. [ 38 ] Несмотря на восстановление фильтрованием, каталитическая активность полимера снижалась примерно на 4-8% в каждом эксперименте по повторному использованию.
Азотные лиганды
[ редактировать ]Пиридины и пиримидины продемонстрировали хорошие свойства комплексообразования с палладием и были использованы при создании катализаторов, подходящих для реакций Соногаширы. Комплекс дипиримидил-палладия, показанный ниже, был использован для безмедного сочетания йод-, бром- и хлорбензола с фенилацетиленом с использованием N-бутиламина в качестве основания в растворителе ТГФ при 65 ° C. Более того, все структурные особенности этого комплекса были охарактеризованы обширным рентгеновским анализом, подтвердившим наблюдаемую реакционную способность. [ 39 ]
Совсем недавно был получен комплекс дипиридилпалладия, который использовался в реакции сочетания арилиодидов и бромидов Соногаширы без содержания меди в N -метилпирролидиноне (NMP) с использованием ацетата тетра-н-бутиламмония (ТБАА) в качестве основания при комнатной температуре. Этот комплекс также использовался для связывания арилйодидов и бромидов в кипящей воде в качестве растворителя и в присутствии воздуха с использованием пирролидина в качестве основания и ТБАБ в качестве добавки. [ 40 ] хотя его эффективность была выше при использовании N -метилпирролидинона (NMP) в качестве растворителя.

N -гетероциклические карбеновые (NHC) комплексы палладия
[ редактировать ]N -гетероциклические карбены (NHC) стали одними из важнейших лигандов в катализе переходными металлами. Успех нормальных NHC во многом объясняется их превосходными способностями донора σ по сравнению с фосфинами, которые еще выше у аномальных аналогов NHC. Используемые в качестве лигандов в палладиевых комплексах, NHC вносят большой вклад в стабилизацию и активацию предкатализаторов и поэтому нашли применение во многих областях металлоорганического гомогенного катализа, включая сочетания Соногаширы. [ 9 ] [ 42 ] [ 43 ]
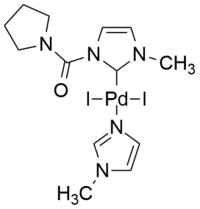 |
 |
| Пример комплекса производного палладия (II) с нормальным лигандом NHC. [ 44 ] | Эффективный катализатор i PEPPSI для реакции Соногашира без меди в воде. [ 42 ] |
Интересные примеры аномальных NHC основаны на мезоионной 1,2,3-триазол-5-илиденовой структуре. - усиленная предкатализационная стабилизация и инициирование Было продемонстрировано , что эффективный катионный палладиевый катализатор типа PEPPSI, т.е. i PEPPSI (внутренняя приготовления предкатализатора ) эффективно , без меди пиридин Соногаширы катализирует реакцию в воде в качестве единственного растворителя. в аэробных условиях, при отсутствии меди, аминов, фосфинов и других добавок. [ 42 ]
Металлоксидные катализаторы
[ редактировать ]Недавние разработки в области гетерогенного катализа позволили использовать материалы оксидов металлов, такие как нанокатализаторы оксида меди , в технологиях проточной обработки, что может обеспечить экономичное производство активных фармацевтических ингредиентов и различных других тонких химикатов. [ 45 ]
Приложения в синтезе
[ редактировать ]Муфты Соногашира используются в широком спектре синтетических реакций, в первую очередь благодаря их успеху в облегчении следующих сложных преобразований:
Реакции алкинилирования
[ редактировать ]Соединение концевого алкина и ароматического кольца является ключевой реакцией, когда речь идет о применении реакции Соногаширы с промотированием меди или без меди. Перечень случаев применения типичной реакции Соногаширы с использованием арилгалогенидов велик, и выбор наглядных примеров затруднен. Ниже показано недавнее использование этой методологии для связывания йодированного фенилаланина с концевым алкином, полученным из d -биотина, с использованием in situ Pd. генерируемого 0 виды в качестве катализатора, что позволило получить алкин-связанное производное фенилаланина для биоаналитических применений. [ 46 ] Есть также примеры того, как партнеры сочетания присоединяются к аллильным смолам, причем Pd 0 катализатор, осуществляющий расщепление субстратов и последующее Соногашира соединение в растворе. [ 47 ]

Натуральные продукты
[ редактировать ]Многие метаболиты, встречающиеся в природе, содержат алкиновые или ениновые фрагменты, и поэтому реакция Соногаширы часто находит применение при их синтезе. [ 48 ] В некоторых из самых последних и многообещающих применений этой методологии сочетания для полного синтеза натуральных продуктов использовалась исключительно типичная реакция, катализируемая медью.
Пример сочетания арилйодида с арилацетиленом можно увидеть в реакции йодированного спирта и трис (изопропил) силилацетилена, которая дает алкин, промежуточный продукт в полном синтезе бензинденоазепинового алкалоида булгарамина. [ 49 ]

Есть и другие недавние примеры использования арилйодидов для получения промежуточных продуктов в типичных условиях Соногаширы, которые после циклизации дают натуральные продукты, такие как бензилизохинолин. [ 50 ] или индольные алкалоиды [ 51 ] Примером может служить синтез бензилизохинолиновых алкалоидов (+)-( S ) -лауданозина и (–)-( S )-ксилопинина. Синтез этих натуральных продуктов включал использование кросс-сочетания Соногашира для построения углеродного остова каждой молекулы. [ 50 ]

Энины и эндиины
[ редактировать ]1,3-ениновая часть является важной структурной единицей биологически активных и природных соединений. [ нужна ссылка ] Его можно получить из виниловых систем и терминальных ацетиленов с помощью стереоспецифической процедуры сохранения конфигурации, такой как реакция Соногаширы. Винилиодиды являются наиболее активными винилгалогенидами по отношению к Pd. 0 окислительное присоединение, поэтому их использование наиболее часто используется для реакций кросс-сочетания Соногашира из-за обычно более мягких условий. Вот некоторые примеры:
- Сочетание 2-иодопроп-2-ен-1-ола с широким спектром ацетиленов. [ 52 ]
- Получение алк-2-инилбута-1,3-диенов перекрестным сочетанием дийодида и фенилацетилена, как показано ниже. [ 53 ]

Фармацевтика
[ редактировать ]Универсальность реакции Соногаширы делает ее широко используемой реакцией при синтезе различных соединений. Одним из таких фармацевтических применений является синтез SIB-1508Y, более известного как алтиниклин . Альтиниклин является агонистом никотиновых ацетилхолиновых рецепторов , который показал потенциал в лечении болезни Паркинсона, болезни Альцгеймера, синдрома Туретта, шизофрении и синдрома дефицита внимания с гиперактивностью (СДВГ). [ 3 ] [ 54 ] По состоянию на 2008 год алтиниклин прошел II фазу клинических испытаний. [ 55 ] [ 56 ]

Реакция кросс-сочетания Соногаширы может быть использована в синтезе производных имидазопиридина. [ 57 ]

Связанные реакции
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Соногашира, К. (2002), «Развитие катализируемой Pd-Cu кросс-сочетания концевых ацетиленов с sp 2 -галогениды углерода», J. Organomet. Chem. , 653 (1–2): 46–49, doi : 10.1016/s0022-328x(02)01158-0.
- ^ Кинг, АО; Ясуда, Н. (2005), «Практический и эффективный процесс получения тазаротена», Org. Процесс Рез. Дев. , 9 (5): 646–650, doi : 10.1021/op050080x
- ^ Jump up to: а б с Кинг, АО; Ясуда, Н. (2004), Катализируемые палладием реакции кросс-сочетания при синтезе фармацевтических препаратов, металлоорганические соединения в технологической химии , Top. Органомет. хим. , том. 6, стр. 205–245, doi : 10.1007/b94551 , ISBN. 978-3-540-01603-8
- ^ Кассар, Л. (1975), «Синтез арил- и винилзамещенных производных ацетилена с использованием комплексов никеля и палладия», J. Organomet. хим. , 93 (2): 253–257, doi : 10.1016/S0022-328X(00)94048-8
- ^ Дик, ХА; Хек, РФ (1975), «Катализируемый палладием синтез арильных, гетероциклических и виниловых производных ацетилена», J. Organomet. хим. , 93 (2): 259–263, doi : 10.1016/S0022-328X(00)94049-X
- ^ Jump up to: а б Соногашира, К.; Тохда, Ю.; Хагихара, Н. (1975), «Удобный синтез ацетиленов: каталитические замещения ацетиленового водорода бромалкенами, йодаренами и бромпиридинами», Tetrahedron Lett. , 16 (50): 4467–4470, doi : 10.1016/s0040-4039(00)91094-3
- ^ Jump up to: а б с д и ж г Шиншилла, Р.; Наджера, К. (2011), «Последние достижения в реакциях Соногаширы», Chem. Соц. Rev. , 40 (10): 5084–5121, doi : 10.1039/c1cs15071e , PMID 21655588
- ^ Зеечерн, CCC; Китчинг, Миссури; Колакот, ТиДжей; Сниекус, В. (2012), «Кросс-сочетание, катализируемое палладием: исторический контекстуальный взгляд на Нобелевскую премию 2010 года», Angew. хим. Межд. Эд. , 51 (21): 5062–5085, doi : 10.1002/anie.201107017 , PMID 22573393
- ^ Jump up to: а б с д и ж г час я Шиншилла, Р.; Наджера, К. (2007), «Реакция Соногаширы: быстро развивающаяся методология в синтетической органической химии», Chem. Rev. , 107 (3): 874–922, doi : 10.1021/cr050992x , PMID 17305399
- ^ Стамбули, Япония; Буль, М.; Хартвиг, Дж. Ф. (2002), «Синтез, характеристика и реакционная способность мономерных галогенидных комплексов арилпалладия со затрудненным фосфином в качестве единственного дативного лиганда», J. Am. хим. Соц. , 124 (32): 9346–9347, doi : 10.1021/ja0264394 , PMID 12167009
- ^ Аматоре, К.; Ютанд, А. (2000), «Анионный Pd 0 и палладий II Промежуточные соединения в реакциях Хека и кросс-сочетания, катализируемых палладием», Acc. Chem. Res. , 33 (5): 314–321, CiteSeerX 10.1.1.612.7347 , doi : 10.1021/ar980063a , PMID 10813876
- ^ Сохейли, А.; Альбанезе-Уокер, Дж.; Марри, Дж.А.; Дормер, П.Г.; Хьюз, Д.Л. (2003), «Эффективный и общий протокол для безмедного сочетания арилбромидов Соногашира при комнатной температуре», Org. Летт. , 5 (22): 4191–4194, doi : 10.1021/ol035632f , PMID 14572282
- ^ Jump up to: а б с д Газвода, М.; Вирант, М.; Пинтер, Б.; Кошмрль, Дж. (2018). «Механизм реакции Соногаширы без меди осуществляется посредством переметаллирования палладия-палладия» . Нат. Коммун. 9 (1): 4814. Бибкод : 2018NatCo...9.4814G . дои : 10.1038/s41467-018-07081-5 . ПМК 6240041 . ПМИД 30446654 .
- ^ Jump up to: а б с д Вирант, Миха (2019). Разработка гомогенных палладиевых каталитических систем для избранных превращений терминальных ацетиленов (доктор философии). Университет Любляны .
- ^ Тугерти, А.; Негри, С.; Ютанд, А. (2007), «Механизм реакций Соногаширы, катализируемых палладием без меди: множественная роль аминов», Chem. Евро. J. , 13 (2): 666–676, номер документа : 10.1002/chem.200600574 , PMID 16991183.
- ^ Пленио, Х. (2008), «Катализаторы соединения Соногашира — безкоронный снова станет королем», Ангью. хим. Межд. Эд. , 47 (37): 6954–6956, doi : 10.1002/anie.200802270 , PMID 18683173
- ^ Конен, А.Л.; Данхайзер, РЛ ; Дания SE; Лю X. (2007), «Синтез терминальных 1,3-диинов посредством сочетания Соногашира винилиденхлорида с последующим отщеплением. Получение 1,3-декадиина», Org. Синтез. , 84 : 77–87, doi : 10.15227/orgsyn.084.0077 , PMC 2901882 , PMID 20628544
- ^ Аль-Зуби, Раед (16 апреля 2020 г.). «Катализируемые палладием высокорегиоселективные моно- и двойные реакции кросс-сочетания Соногаширы 5-замещенного-1,2,3-трииодбензола в условиях окружающей среды †» . РСК Адв. 10 (28): 16376. Бибкод : 2020RSCAd..1016366A . дои : 10.1039/d0ra01569e . ПМК 9053030 .
- ^ Jump up to: а б Бом, VPW; Херрманн, Вашингтон (2000), «Безмедная методика катализируемой палладием реакции Соногаширы арилбромидов с терминальными алкинами при комнатной температуре», Eur. Дж. Орг. хим. , 200 (22): 3679–3681, doi : 10.1002/1099-0690(200011)2000:22<3679::aid-ejoc3679>3.0.co;2-x
- ^ Инь, Л.; Либшер, Дж. (2006), «Реакции углерод-углеродного сочетания, катализируемые гетерогенными палладиевыми катализаторами», Chem. Rev. , 107 (1): 133–173, doi : 10.1021/cr0505674 , PMID 17212474
- ^ Jump up to: а б с Мио, Мэтью Дж.; Копель, Лукас К.; Браун, Джулия Б.; Гаджиква, Тендай Л.; Халл, Ками Л.; Брисбуа, Рональд Г.; Маркворт, Кристофер Дж.; Греко, Пол А. (2002). «Однореакторный синтез симметричных и несимметричных бисарилэтинов путем модификации реакции сочетания Соногаширы». Органические письма . 4 (19): 3199–3202. дои : 10.1021/ol026266n .
- ^ Панда Б., Саркар Т.К. (2010). «Объединение золота и палладия для кросс-сочетания солей арендиазония по типу Соногаширы». хим. Коммун. 46 (18): 3131–3133. дои : 10.1039/c001277g . ПМИД 20361097 .
- ^ Ютанд, А.; Негри, С.; Принципо; А. (2005), «Образование комплексов ArPdXL(амина) путем замены одного фосфанового лиганда амином в комплексах транс-ArPdX(PPh3)2», Eur. Дж. Неорг. хим. , 2005 (4): 631–635, doi : 10.1002/ejic.200400413.
- ^ Годсон К. Нвокогу; Саския Земолка; Флориан Деме (2007). «Триметилсилилацетилен». ЭРОС . дои : 10.1002/047084289X.rt288.pub2 . ISBN 978-0-471-93623-7 .
- ^ Мери, Д.; Хойзе, К.; Астрюк, Д. (2003), «Очень эффективный палладиевый катализатор, не содержащий меди, для реакции Соногаширы с арилгалогенидами», Chem. Коммун. , 15 (15): 1934–1935, doi : 10.1039/B305391C , PMID 12932040
- ^ Дудник А.; Геворкян, В. (2010). «Формальная обратная реакция Соногаширы: прямое алкинилирование аренов и гетероциклов алкинилгалогенидами» . Энджью. хим. Межд. Эд. 49 (12): 2096–2098. дои : 10.1002/anie.200906755 . ПМК 3132814 . ПМИД 20191647 .
- ^ Вечоркин О.; Бармаз Д.; Пруст, В.; Ху, X. (2009), «Ni-катализируемое Соногаширой сочетание неактивированных алкилгалогенидов: ортогональная функционализация алкилйодидов, бромидов и хлоридов», J. Am. хим. Соц. , 131 (34): 12078–12079, doi : 10.1021/ja906040t , PMID 19670863
- ^ Гонсалес-Аральяно, К.; Абад, А.; Корма, А.; Гарсия, Х.; Иглесиас, М.; Санчес, Ф. (2007), «Катализ золотом (I) и золотом (III): параллелизм между гомо- и гетерогенными катализаторами для реакций перекрестного сочетания Соногашира без меди», Angew. хим. Межд. Эд. , 46 (9): 1536–1538, doi : 10.1002/anie.200604746 , PMID 17226890
- ^ Jump up to: а б Корма, А.; Хуарес, Р.; Боронат, М.; Санчес, Ф.; Иглесиас, М.; Гарсия, Х. (2011), «Золото катализирует реакцию сочетания Соногаширы без необходимости примесей палладия», Chem. Коммун. , 47 (5): 1446–1448, doi : 10.1039/C0CC04564K , PMID 21183985
- ^ Кириаку, Г.; Бомонт, СК; Хамфри, С.М.; Антонетти, К.; Ламберт, Р.М. (2010), «Сочетание Соногашира, катализируемое наночастицами золота: доминирует ли гомогенный или гетерогенный катализ?», ChemCatChem , 2 (11): 1444–1449, doi : 10.1002/cctc.201000154 , S2CID 96700925
- ^ Jump up to: а б Бомонт, СК; Кириаку, Г.; Ламберт, Р.М. (2010), «Идентичность активного сайта в катализируемом наночастицами золота Соногаширском сочетании фенилацетилена и йодбензола». (PDF) , Дж. Ам. хим. Соц. , 132 (35): 12246–12248, doi : 10.1021/ja1063179 , PMID 20715838
- ^ Jump up to: а б М. Каррил; А. Корреа; К. Болм (2008), «Реакция Соногашира, катализируемая железом», Ангью. хим. , 120 (26): 4940–4943, Bibcode : 2008AngCh.120.4940C , doi : 10.1002/ange.200801539
- ^ Торстен Лаутербах; Мадлен Ливендал; Антонио Роселлон; Пабло Эспинет; Антонио М. Эчаваррен (2010), «Маловероятность реакций сочетания Соногашира, не содержащих Pd, катализируемых золотом (I)», Org. Летт. , 12 (13): 3006–3009, doi : 10.1021/ol101012n , PMID 20515017
- ^ Толнаи, LG; Гонда, ЗС.; Новак, З. (2010). «Огромное влияние уровней палладия на миллиардные доли на муфту Соногашира, катализируемую медью». хим. Евро. Дж. 16 (39): 11822–11826. дои : 10.1002/chem.201001880 . ПМИД 20821769 .
- ^ Панда, Б.; Саркар, Т.К. (2013), «Сочетание золота и палладия для сочетания Соногашира арил- и гетероарилгалогенидов», Synthesis , 45 (6): 817–829, doi : 10.1055/s-0032-1318119
- ^ Астрюк, Дидье; Хёзе, Карин; Гатард, Сильвен; Мери, Дениз; Нлате, Сильвен; Плаулт, Лориан (февраль 2005 г.). «Металлодендритный катализ окислительно-восстановительных реакций и реакций образования углерод-углеродных связей: шаг к зеленой химии». Адв. Синтез. Катал. 347 (2–3): 329–338. дои : 10.1002/adsc.200404247 .
- ^ Хёзе, Карин; Мери, Дениз; Гаусс, Доминик; Астрюк, Дидье (2003). «Не содержащие меди извлекаемые дендритные палладийные катализаторы для реакции Соногашира». хим. Общий. (18): 2274–2275. дои : 10.1039/B307116M . ПМИД 14518871 .
- ^ Jump up to: а б Ян, Юн-Чин; Лух, Тянь-Яу (декабрь 2003 г.). «Полимерный фосфиновый лиганд в результате метатезисной полимеризации с раскрытием кольца производного норборнена. Применение в реакциях Хека, Соногаширы и Негиши» (PDF) . Дж. Орг. хим. 68 (25): 9870–9873. дои : 10.1021/jo035318z . ПМИД 14656129 .
- ^ Бухмейзер, Майкл Р.; Шарейна, Томас; Кемпе, Ретт; Вурст, Клаус (2001). «Палладиевые катализаторы на основе бис (пиримидина): синтез, рентгеновская структура и применение в реакциях сочетания Хека, Сузуки, Соногаширы-Хагихары и реакций аминирования». Дж. Органомет. хим. 634 : 39–46. дои : 10.1016/S0022-328X(01)01083-X .
- ^ Хиль-Молто, Дж.; Карстрем, С.; Нахера, К. (2005), «Комплекс ди(2-пиридил)метиламин-дихлорид палладия, ковалентно связанный с сополимером стирола и малеинового ангидрида в качестве восстанавливаемого катализатора реакций перекрестного сочетания C–C в воде», Tetrahedron , 61 ( 51): 12168–12176, номер документа : 10.1016/j.tet.2005.08.122.
- ^ Хиль-Молто, Дж.; Наджера, К. (2005), «Хлорид палладия (II) и (дипиридин-2-илметил)амин-производный комплекс палладия (II) хлорида как высокоэффективные катализаторы для синтеза алкинов в воде или в NMP и диинов в отсутствие Реоксиданта», Евр. Дж. Орг. хим. , 2005 (19): 4073–4081, doi : 10.1002/ejoc.200500319.
- ^ Jump up to: а б с Газвода, М.; Вирант, М; Певец, А.; Уранкар, Д.; Лучше, А.; Кочевар, М.; Кошмрль, Дж. (2016), «Мезоионный комплекс бис (Py- tz NHC) палладия (II) катализирует зеленую реакцию Соногаширы по беспрецедентному механизму», Chem. Коммун. , 52 (8): 1571–1574, doi : 10.1039/c5cc08717a , PMID 26575368
- ^ Крадден, Кэтлин М.; Аллен, Дэрил П. (декабрь 2004 г.). «Стабильность и реакционная способность N-гетероциклических карбеновых комплексов». Коорд. хим. Откр. 248 (21–24): 2247–2273. дои : 10.1016/j.ccr.2004.05.013 .
- ^ Бэти, РА; Шен, М.; Лох, AJ (2002), «Карбамоилзамещенные N -гетероциклические карбеновые комплексы палладия (II): применение к реакциям перекрестного сочетания Соногаширы», Org. Летт. , 4 (9): 1411–1414, doi : 10.1021/ol017245g , PMID 11975591
- ^ Рави Теджа Адданки Тирумала.; Андиша П. Дадгар; Фаршид Мохаммадпараст.; Сундарам Бхардвадж Рамакришнан.; Тонг Моу.; Бинь Ван.; Маримуту Андиаппан. (2019), «Гомогенный и гетерогенный катализ в реакциях сочетания C–C, катализируемых наночастицами Cu2O», Green Chemistry , 21 : 5284–5290, doi : 10.1039/C9GC01930H , PMID 19670863
- ^ Jump up to: а б Корона С.; Брайант Б.К.; Артерберн Дж. Б. (2006). «Синтез алкина, полученного из биотина, для реакций сочетания, катализируемых палладием» . Орг. Летт. 8 (9): 1883–1886. дои : 10.1021/ol060458r . ПМЦ 2523258 . ПМИД 16623575 .
- ^ Тулла-Пуче Ж.; Барани Г (2005). «Разработка реакций переноса смолы на смолу (RRTR) с использованием химии Соногаширы». Тетраэдр . 61 (8): 2195. doi : 10.1016/j.tet.2004.12.029 .
- ^ Хонг, Британская Колумбия; Нимдже, РЮ (2006). «Каталитическое образование связей CC при синтезе натуральных продуктов: основные моменты 2000-2005 годов». Курс. Орг. хим. 10 (17): 2191-2225. дои : 10.2174/138527206778742605 .
- ^ Jump up to: а б Шиншилла, Рафаэль; Нахера, Кармен (2007). «Реакция Соногаширы: быстро развивающаяся методология в синтетической органической химии †». Химические обзоры . 107 (3): 874–922. дои : 10.1021/cr050992x .
- ^ Jump up to: а б с Моджахеды, Дидин; Дой, Свен (1 июля 2005 г.). «Энантиоселективный синтез (+)-( S )-лауданозина и (-)-( S )-ксилопинина». Евро. Дж. Орг. хим. 2005 (13): 2689–2693. дои : 10.1002/ejoc.200500095 .
- ^ Педерсен, Дж. М.; Боуман, WR; Элсегуд, MRJ; Флетчер, Эй Джей; Ловелл, П.Дж. (2005). «Синтез эллиптицина: радикальный каскадный протокол к арил- и гетероарил-аннелированным [b] карбазолам». Дж. Орг. хим. 70 (25): 10615–10618. дои : 10.1021/jo0519920 . ПМИД 16323886 .
- ^ Тонгсорнклиб, К.; Данхайзер, РЛ (2005). «Сочетание 2-йод-проп-2-енола с широким спектром ацетиленов, таких как TMSA, с образованием енинилового спирта, который может быть окислен до соответствующих R-алкинилированных акролеинов» . Дж. Орг. хим. 70 (6): 2364–2367. дои : 10.1021/jo047869a . ПМК 2897060 . ПМИД 15760233 .
- ^ Jump up to: а б Шао, Л.-Х.; Ши, М. (2005), «Легкий синтез 2-алкинилбута-1,3-диенов с помощью методологии кросс-сочетания Соногашира», J. Org. хим. , 70 (21): 8635–8637, doi : 10.1021/jo051434l , PMID 16209628
- ^ Блейхер, Л.С.; Косфорд, НДП; Эрбо, А.; МакКаллум, Дж.С.; Макдональд, Айова (1998), «Практический и эффективный синтез селективного нейронального агониста ионного канала, управляемого ацетилхолином ( S )-(-)-5-этинил-3-(1-метил-2-пирролидинил)пиридина малеата (SIB) -1508Y)", J. Org. хим. , 63 (4): 1109–1118, doi : 10.1021/jo971572d
- ^ Ван, Дэвид X.; Бут, Хизер; Лернер-Мармарош, Николь; Осден, Томас С.; Абуд, Лео Г. (1 сентября 1998 г.). «Отношения структура-активность аналогов никотина, сравнивающие конкуренцию за связывание [3H] никотина и психотропную эффективность». Разработчик лекарств. Рез. 45 (1): 10–16. doi : 10.1002/(SICI)1098-2299(199809)45:1<10::AID-DDR2>3.0.CO;2-G .
- ^ Группа исследования Паркинсона (14 февраля 2006 г.). «Рандомизированное плацебо-контролируемое исследование никотинового агониста SIB-1508Y при болезни Паркинсона». Неврология . 66 (3): 408–410. дои : 10.1212/01.wnl.0000196466.99381.5c . ПМИД 16476941 . S2CID 31720763 .
{{cite journal}}:|first1=имеет общее имя ( справка ) - ^ Jump up to: а б Бахерад, М.; Наср-Исфахани, Х.; Кейванлоо, А.; Дустмохаммади, Н. (2008), «Катализируемая Pd-Cu гетероциклизация во время сочетания Соногаширы: синтез 2-бензилимидазо[1,2- а ]пиридина», J. Organomet. хим. , 49 (23): 3819–3822, doi : 10.1016/j.tetlet.2008.03.141