Орбитальная гибридизация
В химии орбитальная гибридизация (или гибридизация ) — это концепция смешивания атомных орбиталей с образованием новых гибридных орбиталей (с разными энергиями, формами и т. д., чем составляющие атомные орбитали), подходящих для спаривания электронов с образованием химических связей в валентной связи. теория . Например, в атоме углерода, который образует четыре одинарные связи, s-орбиталь валентной оболочки соединяется с тремя p-орбиталями валентной оболочки, образуя четыре эквивалентные sp-орбитали. 3 смеси в тетраэдрическом расположении вокруг углерода для связи с четырьмя различными атомами. Гибридные орбитали полезны для объяснения молекулярной геометрии и свойств атомных связей и симметрично расположены в пространстве. Обычно гибридные орбитали образуются путем смешивания атомных орбиталей сравнимых энергий. [1]
История и использование
[ редактировать ]Химик Лайнус Полинг впервые разработал теорию гибридизации в 1931 году, чтобы объяснить структуру простых молекул, таких как метан (CH 4 ), с помощью атомных орбиталей . [2] Полинг отметил, что атом углерода образует четыре связи, используя одну s- и три p-орбитали, так что «можно сделать вывод», что атом углерода будет образовывать три связи под прямым углом (с использованием p-орбиталей) и четвертую более слабую связь с использованием s-орбиталь в некотором произвольном направлении. На самом деле метан имеет четыре связи CH одинаковой силы. Угол между любыми двумя связями представляет собой тетраэдрический валентный угол, равный 109°28'. [3] (около 109,5°). Полинг предположил, что в присутствии четырех атомов водорода s- и p-орбитали образуют четыре эквивалентные комбинации, которые он назвал гибридными орбиталями. Каждый гибрид обозначается sp. 3 для указания его состава и направлен вдоль одной из четырех связей CH. [4] Эта концепция была разработана для таких простых химических систем, но позже подход был применен более широко, и сегодня он считается эффективной эвристикой для рационализации структур органических соединений . Это дает простую орбитальную картину, эквивалентную структурам Льюиса .
Теория гибридизации является неотъемлемой частью органической химии , одним из наиболее убедительных примеров являются правила Болдуина . Для изображения механизмов реакции иногда необходима классическая картина связи, когда два атома имеют два общих электрона. [5] Теория гибридизации объясняет образование связей в алкенах [6] и метан. [7] Количество символов p или s, которое определяется главным образом орбитальной гибридизацией, можно использовать для надежного прогнозирования молекулярных свойств, таких как кислотность или основность. [8]
Обзор
[ редактировать ]Орбитали представляют собой модель поведения электронов внутри молекул. В случае простой гибридизации это приближение основано на атомных орбиталях , аналогичных полученным для атома водорода, единственного нейтрального атома, для которого уравнение Шредингера может быть решено точно. В более тяжелых атомах, таких как углерод, азот и кислород, используются атомные орбитали 2s и 2p, аналогичные орбиталям возбужденного состояния водорода.
Предполагается, что гибридные орбитали представляют собой смеси атомных орбиталей, наложенных друг на друга в различных пропорциях. Например, в метане гибридная орбиталь C, которая образует каждую углерод - водородную связь, состоит на 25% из символов s и на 75% из символов p и поэтому описывается как sp. 3 (читается как sp-3 ) гибридизированный. Квантовая механика описывает этот гибрид как sp. 3 волновая функция вида , где N — константа нормировки (здесь 1/2), а pσ — ap-орбиталь, направленная вдоль оси CH с образованием сигма-связи . Отношение коэффициентов (обычно обозначаемых λ) равно в этом примере. Поскольку плотность электронов , связанная с орбиталью, пропорциональна квадрату волновой функции, отношение p-символа к s-символу равно λ. 2 = 3. Символ p или вес компонента p равен N 2 л 2 = 3/4.
Виды гибридизации
[ редактировать ]сп 3
[ редактировать ]
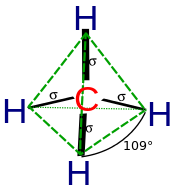
Гибридизация описывает соединение атомов с точки зрения атома. Для тетраэдрически координированного углерода (например, метана CH 4 ) углерод должен иметь 4 орбитали, направленные к 4 атомам водорода.
углерода равна 1 с. основного состояния Конфигурация 2 2 с 2 2р 2 или более легко читать:
| С | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1 с | 2 с | 2р | 2р | 2р |
Эта диаграмма предполагает, что атом углерода мог использовать две свои одиночно занятые орбитали p-типа для образования двух ковалентных связей с двумя атомами водорода в молекуле метилена (CH 2 ), при этом гипотетический валентный угол 90° соответствует углу между двумя p-орбиталями. орбитали одного и того же атома. Однако истинный угол ГХГ в синглетном метилене составляет около 102°. [9] что предполагает наличие некоторой орбитальной гибридизации.
Атом углерода также может связываться с четырьмя атомами водорода в метане путем возбуждения (или продвижения) электрона с дважды занятой 2s-орбитали на пустую 2p-орбиталь, образуя четыре одиночно занятые орбитали.
| С* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | 2 с | 2р | 2р | 2р |
Энергия, выделяющаяся при образовании двух дополнительных связей, с лихвой компенсирует необходимую энергию возбуждения, энергетически благоприятствуя образованию четырех связей CH.
С квантовой механики наименьшая энергия получается, если четыре связи эквивалентны, что требует, чтобы они образовались из эквивалентных орбиталей углерода. Можно получить набор из четырех эквивалентных орбиталей, которые представляют собой линейные комбинации s- и p-волновых функций валентной оболочки (основные орбитали почти никогда не участвуют в связывании), [10] какие четыре sp 3 гибриды.
| С* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | сп 3 | сп 3 | сп 3 | сп 3 |
В CH 4 четыре sp 3 гибридные орбитали перекрываются 1s-орбиталями водорода , образуя четыре σ (сигма) связи (то есть четыре одинарные ковалентные связи) одинаковой длины и прочности.
Следующее :

переводится как:
сп 2
[ редактировать ]

Другие углеродные соединения и другие молекулы можно объяснить аналогичным образом. Например, этилен (C 2 H 4 ) имеет двойную связь между атомами углерода.
Для этой молекулы углерод sp 2 гибридизуется, поскольку одна π (пи)-связь между атомами углерода требуется для двойной связи , а на один атом углерода образуется только три σ-связи. В сп 2 При гибридизации 2s-орбиталь смешивается только с двумя из трех доступных 2p-орбиталей, обычно обозначаемых 2p x и 2p y . Третья 2p-орбиталь (2p z ) остается негибридизированной.
| С* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | сп 2 | сп 2 | сп 2 | 2р |
образуя в общей сложности три sp 2 орбитали с одной оставшейся p-орбиталью. В этилене два атома углерода образуют σ-связь путем перекрывания одного sp. 2 орбитали каждого атома углерода. π-связь между атомами углерода, перпендикулярными плоскости молекулы, образуется путем перекрытия 2p–2p. Каждый атом углерода образует ковалентные связи C–H с двумя атомами водорода путем s–sp. 2 перекрытие, все с валентным углом 120°. Все связи водород-углерод имеют одинаковую прочность и длину, что соответствует экспериментальным данным.
сп
[ редактировать ]
Химическая связь в таких соединениях, как алкины с тройными связями, объясняется sp-гибридизацией. В этой модели 2s-орбиталь смешана только с одной из трех p-орбиталей:
| С* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | сп | сп | 2р | 2р |
в результате чего образуются две sp-орбитали и две оставшиеся p-орбитали. Химическая связь в ацетилене (этине) (C 2 H 2 ) состоит из sp-sp перекрытия между двумя атомами углерода, образующими σ-связь, и двух дополнительных π-связей, образованных p-p-перекрыванием. Каждый углерод также связан с водородом в перекрытии σ s – sp под углами 180 °.
Гибридизация и форма молекулы
[ редактировать ]
Гибридизация помогает объяснить форму молекулы , поскольку углы между связями примерно равны углам между гибридными орбиталями. Это контрастирует с теорией отталкивания электронных пар валентной оболочки (VSEPR) , которую можно использовать для предсказания молекулярной геометрии на основе эмпирических правил, а не теорий валентной связи или орбитальных теорий. [11]
сп х гибридизация
[ редактировать ]Поскольку валентными орбиталями элементов основной группы являются одна s и три p-орбитали с соответствующим правилом октетов , sp х гибридизация используется для моделирования формы этих молекул.
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 2 | Линейный | sp-гибридизация (180°) | СО 2 |
| 3 | Тригональная плоская | сп 2 гибридизация (120°) | БСl 3 |
| 4 | Тетраэдрический | сп 3 гибридизация (109,5°) | ССl 4 |
| Межглазничные углы [12] | |||
сп х д и гибридизация
[ редактировать ]Поскольку валентными орбиталями переходных металлов являются пять d, одна s и три p-орбитали с соответствующим правилом 18 электронов , sp х д и гибридизация используется для моделирования формы этих молекул. Эти молекулы имеют тенденцию иметь несколько форм, соответствующих одной и той же гибридизации, из-за задействования разных d-орбиталей. Плоский квадратный комплекс имеет одну незанятую р-орбиталь и, следовательно, имеет 16 валентных электронов. [13]
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 4 | Квадратный плоский | сп 2 г гибридизация | PtCl 4 2− |
| 5 | Треугольная бипирамида | сп 3 г гибридизация | Fe(CO) 5 |
| Квадратно-пирамидальный | MnClMnCl5 2− | ||
| 6 | Октаэдрический | сп 3 д 2 гибридизация | Мо(СО) 6 |
| 7 | Пятиугольная бипирамида | сп 3 д 3 гибридизация | ZrFЗрФ7 3− |
| Закрытый октаэдр | МФ 7 − | ||
| Треугольно-призматический с крышкой | TaFТаФ7 2− | ||
| 8 | Квадратный антипризматический | сп 3 д 4 гибридизация | Ссылка 8 − |
| Додекаэдрический | Мо(CN) 8 4− | ||
| Двуглавая треугольная призматика | ZrF 8 4− | ||
| 9 | Трехглавая треугольная призматика | сп 3 д 5 гибридизация | РеГ 9 2− |
| Квадратный антипризматический с крышкой |
SD х гибридизация
[ редактировать ]В некоторых комплексах переходных металлов с низким числом d-электронов p-орбитали незаняты и sd х гибридизация используется для моделирования формы этих молекул. [12] [14] [13]
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 3 | Трехугольная пирамидальная | SD 2 гибридизация (90°) | КрО 3 |
| 4 | Тетраэдрический | SD 3 гибридизация (70,5°, 109,5°) | ТиСl 4 |
| 5 | Квадратно-пирамидальный | SD 4 гибридизация (65,9°, 114,1°) | Та(СН 3 ) 5 |
| 6 | C 3v Треугольно-призматический | SD 5 гибридизация (63,4°, 116,6°) | Вт( СН3 ) 6 |
| Межглазничные углы [12] | |||
Гибридизация гипервалентных молекул
[ редактировать ]Расширение октета
[ редактировать ]В некоторых учебниках по общей химии гибридизация представлена для координационного номера основной группы 5 и выше с использованием схемы «расширенного октета» с d-орбиталями, впервые предложенной Полингом. Однако сейчас такая схема считается некорректной в свете расчетов вычислительной химии.
| Координационный номер | Молекулярная форма | Гибридизация | Примеры |
|---|---|---|---|
| 5 | Треугольная бипирамида | сп 3 г гибридизация | ПФ 5 |
| 6 | Октаэдрический | сп 3 д 2 гибридизация | СФ 6 |
| 7 | Пятиугольная бипирамида | сп 3 д 3 гибридизация | ЕСЛИ 7 |
В 1990 году Эрик Альфред Магнуссон из Университета Нового Южного Уэльса опубликовал статью, окончательно исключающую роль d-орбитальной гибридизации в связывании в гипервалентных соединениях элементов второго ряда ( период 3 ), положив конец спорам и путанице. Частично путаница возникает из-за того, что d-функции необходимы в базисных наборах, используемых для описания этих соединений (иначе это приводит к неоправданно высоким энергиям и искаженной геометрии). Кроме того, велик вклад d-функции в волновую функцию молекулы. Эти факты были неправильно интерпретированы как означающие, что в связывании должны участвовать d-орбитали. [15] [16]
Резонанс
[ редактировать ]В свете вычислительной химии лучшим решением было бы вызвать сигма-связи резонанс в дополнение к гибридизации, что означает, что каждая резонансная структура имеет свою собственную схему гибридизации. Все резонансные структуры должны подчиняться правилу октетов . [17]
| Координационный номер | Резонансные структуры |
|---|---|
| 5 | Треугольная бипирамида |
 | |
| 6 | Октаэдрический |
 | |
| 7 | Пятиугольная бипирамида |
 |
Гибридизация в вычислительной теории VB
[ редактировать ]В то время как простая модель орбитальной гибридизации обычно используется для объяснения формы молекул, гибридизация используется по-другому при расчете в современных программах валентных связей. В частности, гибридизация не определяется априори , а вместо этого вариационно оптимизируется для поиска решения с наименьшей энергией, а затем сообщается. Это означает, что все искусственные ограничения, в частности два ограничения, на орбитальную гибридизацию снимаются:
- что гибридизация ограничена целыми значениями (изовалентная гибридизация)
- что гибридные орбитали ортогональны друг другу (дефекты гибридизации)
Это означает, что на практике гибридные орбитали не соответствуют простым идеям, которым обычно учат, и поэтому в научных статьях по вычислительным вычислениям их просто называют sp. х , сп х д и или SD х гибриды для выражения своей природы вместо более конкретных целочисленных значений.
Изовалентная гибридизация
[ редактировать ]Хотя идеальные гибридные орбитали могут быть полезны, в действительности для большинства связей требуются орбитали промежуточного характера. Это требует расширения, включающего гибкие взвешивания атомных орбиталей каждого типа (s, p, d) и позволяющего количественно описать образование связи, когда геометрия молекулы отклоняется от идеальных валентных углов. Количество p-символов не ограничивается целочисленными значениями; т.е. гибридизации типа sp 2.5 также легко описаны.
Гибридизация орбиталей связи определяется правилом Бента : «Атомный характер концентрируется на орбиталях, направленных к электроположительным заместителям».
Для молекул с неподеленными парами связывающие орбитали изовалентны sp. х гибриды. Например, две гибридные орбитали кислорода в воде, образующие связи, можно описать как sp 4.0 чтобы дать межорбитальный угол 104,5 °. [18] Это означает, что они имеют 20% s-характера и 80% p-характера, и это не означает, что гибридная орбиталь образуется из одной s- и четырех p-орбиталей кислорода, поскольку подоболочка кислорода 2p содержит только три p-орбитали.
Дефекты гибридизации
[ редактировать ]Гибридизация s- и p-орбиталей с образованием эффективных sp х гибриды требуют, чтобы они имели сопоставимую радиальную протяженность. В то время как 2p-орбитали в среднем менее чем на 10% больше, чем 2s, что отчасти объясняется отсутствием радиального узла на 2p-орбиталях, 3p-орбитали, имеющие один радиальный узел, превышают 3s-орбитали на 20–33%. [19] Разница в размерах s- и p-орбиталей увеличивается дальше по группе. Гибридизацию атомов в химических связях можно анализировать, рассматривая локализованные молекулярные орбитали, например, используя естественные локализованные молекулярные орбитали в схеме орбиталей естественной связи (NBO). В метане , CH 4 , расчетное соотношение p/s составляет примерно 3, что соответствует «идеальному» sp. 3 гибридизация, тогда как для силана SiH 4 отношение p/s ближе к 2. Аналогичная тенденция наблюдается и для остальных 2p-элементов. Замена водорода на фтор еще больше снижает отношение p/s. [20] Элементы 2p демонстрируют почти идеальную гибридизацию с ортогональными гибридными орбиталями. Для более тяжелых элементов p-блока это предположение об ортогональности не может быть оправдано. назвал дефектами гибридизации Эти отклонения от идеальной гибридизации Куцельнигг . [21]
Однако вычислительные группы VB, такие как Герратт, Купер и Раймонди (SCVB), а также Шайк и Хиберти (VBSCF), идут еще дальше и утверждают, что даже для модельных молекул, таких как метан, этилен и ацетилен, гибридные орбитали уже дефектны и неортогональный, с гибридизациями, такими как sp 1.76 вместо сп 3 для метана. [22]
Фотоэлектронные спектры
[ редактировать ]Одно из заблуждений относительно орбитальной гибридизации состоит в том, что она неправильно предсказывает ультрафиолетовые фотоэлектронные спектры многих молекул. Хотя это верно, если теорема Купманса применяется к локализованным гибридам, квантовая механика требует, чтобы (в данном случае ионизированная) волновая функция подчинялась симметрии молекулы, что подразумевает резонанс в теории валентных связей. Например, в метане ионизированные состояния (CH 4 + ) можно построить из четырех резонансных структур, приписывающих вылетевший электрон каждой из четырех sp 3 орбитали. Линейная комбинация этих четырех структур, сохраняющая число структур, приводит к тройному вырожденному состоянию Т2 и состоянию А1 . [23] [24] Разница в энергии между каждым ионизированным состоянием и основным состоянием будет равна энергии ионизации , которая дает два значения, согласующиеся с экспериментальными результатами.

Локализованные и канонические молекулярные орбитали
[ редактировать ]Связующие орбитали, образованные из гибридных атомных орбиталей, можно рассматривать как локализованные молекулярные орбитали, которые могут быть образованы из делокализованных орбиталей теории молекулярных орбиталей путем соответствующего математического преобразования. Для молекул в основном состоянии такая трансформация орбиталей оставляет неизменной общую многоэлектронную волновую функцию. Таким образом, гибридное орбитальное описание основного состояния эквивалентно делокализованному орбитальному описанию полной энергии и электронной плотности основного состояния, а также геометрии молекулы, которая соответствует минимальному значению полной энергии.
Два локализованных представления
[ редактировать ]
Молекулы с несколькими связями или несколькими неподеленными парами могут иметь орбитали, представленные в терминах сигма- и пи-симметрии, или эквивалентные орбитали. Различные методы валентных связей используют любое из двух представлений, которые имеют математически эквивалентные полные многоэлектронные волновые функции и связаны унитарным преобразованием набора занятых молекулярных орбиталей.
Для кратных связей представление сигма-пи является преобладающим по сравнению с эквивалентным орбитальным представлением ( изогнутая связь ). Напротив, для нескольких неподеленных пар в большинстве учебников используется эквивалентное орбитальное представление. Однако представление сигма-пи также используется, например, Вайнхольдом и Лэндисом в контексте естественных орбиталей связи , теории локализованных орбиталей, содержащей модернизированные аналоги классических (валентная связь / структура Льюиса) связывающих пар и неподеленных пар. [25] Например, для молекулы фторида водорода две неподеленные пары F представляют собой по существу негибридизованные p-орбитали, а другая представляет собой sp-орбитали. х гибридная орбиталь. Аналогичное соображение применимо и к воде (одна неподеленная пара O находится на чистой p-орбитали, другая - на sp х гибридная орбиталь).
См. также
[ редактировать ]- Теория кристаллического поля
- Изовалентная гибридизация
- Теория поля лигандов
- Линейная комбинация атомных орбиталей
- МО-диаграммы
- ВАЛБОНД
Ссылки
[ редактировать ]- ^ Хаускрофт, Кэтрин Э.; Шарп, Алан Г. (2005). Неорганическая химия (2-е изд.). Пирсон Прентис-Хэл. п. 100. ИСБН 0130-39913-2 .
- ^ Полинг, Л. (1931), «Природа химической связи. Применение результатов, полученных из квантовой механики и теории парамагнитной восприимчивости к структуре молекул», Журнал Американского химического общества , 53 (4): 1367–1400, номер документа : 10.1021/ja01355a027.
- ^ Бриттин, МЫ (1945). «Валентный угол тетраэдрического атома углерода». Дж. Хим. Образование. 22 (3): 145. Бибкод : 1945ЖЧЭд..22..145Б . дои : 10.1021/ed022p145 .
- ^ Л. Полинг Природа химической связи (3-е изд., Oxford University Press, 1960), стр. 111–120.
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. п. 105. ИСБН 978-0-19-850346-0 .
- ^ Органическая химия , третье издание Мэри Энн Фокс Джеймс К. Уайтселл 2003 ISBN 978-0-7637-3586-9
- ^ Органическая химия, 3-е изд. 2001 Паула Юрканис Брюс ISBN 978-0-130-17858-9
- ^ «Кислоты и основания» . Орго стало проще . Проверено 23 июня 2015 г.
- ^ Исайя Шавитт (1985), Геометрия и синглет-триплетная энергетическая щель в метилене: критический обзор экспериментальных и теоретических определений . Тетраэдр, том 41, выпуск 8, стр. 1531 два : 10.1016/S0040-4020(01)96393-8
- ^ МакМюррей, Дж. (1995). Издание для инструкторов по химии с аннотациями (4-е изд.). Прентис Холл. п. 272. ISBN 978-0-131-40221-8
- ^ Гиллеспи, Р.Дж. (2004), «Преподавание молекулярной геометрии с помощью модели VSEPR», Журнал химического образования , 81 (3): 298–304, Бибкод : 2004JChEd..81..298G , doi : 10.1021/ed081p298
- ^ Перейти обратно: а б с Вейнхольд, Фрэнк; Лэндис, Кларк Р. (2005). Валентность и связь: взгляд на донорно-акцепторную орбитальную орбиту естественной связи . Кембридж: Издательство Кембриджского университета. стр. 367, 374–376, 381–383. ISBN 978-0-521-83128-4 .
- ^ Перейти обратно: а б Бэйс, Крейг; Холл, Майкл (1999). «Прогнозирование геометрии простых полигидридных комплексов переходных металлов с помощью анализа симметрии». Дж. Ам. хим. Соц. 121 (6): 1348–1358. дои : 10.1021/ja981965+ .
- ^ Каупп, Мартин (2001). « Структуры, не относящиеся к VSEPR, и связи в системах d (0)». Angew Chem Int Ed Engl . 40 (1): 3534–3565. doi : 10.1002/1521-3773(20011001)40:19<3534::AID-ANIE3534>3.0.CO;2-# . ПМИД 11592184 .
- ^ Магнуссон, Э. (1990). «Гиперкоординированные молекулы элементов второго ряда: d-функции или d-орбитали?». Дж. Ам. хим. Соц . 112 (22): 7940–7951. дои : 10.1021/ja00178a014 .
- ^ Дэвид Л. Купер; Терри П. Каннингем; Джозеф Герратт; Петр Борисович Карадаков; Марио Раймонди (1994). «Химическая связь с гиперкоординированными атомами второго ряда: d орбитальное участие против демократии». Журнал Американского химического общества . 116 (10): 4414–4426. дои : 10.1021/ja00089a033 .
- ^ Ричард Д. Харкорт; Томас М. Клапотке (2003). «Повышенная валентность (качественная валентная связь) описания электронных структур богатых электронами фторсодержащих молекул». Журнал химии фтора . 123 (1): 5–20. дои : 10.1016/S0022-1139(03)00012-5 .
- ^ Фрекинг, Гернот; Шайк, Сасон, ред. (2014). «Глава 3: Взгляд NBO на химическую связь». Химическая связь: фундаментальные аспекты химической связи . Джон Уайли и сыновья. ISBN 978-3-527-66471-9 .
- ^ Каупп, Мартин (2007). «Роль радиальных узлов атомных орбиталей для химической связи и таблицы Менделеева» . Журнал вычислительной химии . 28 (1): 320–325. дои : 10.1002/jcc.20522 . ISSN 0192-8651 . ПМИД 17143872 . S2CID 12677737 .
- ^ Каупп, Мартин (2014) [1-й. Паб. 2014]. «Глава 1: Химическая связь элементов основной группы». Во Френкинг, Гернод и Шайк, Сасон (ред.). Химическая связь: химическая связь в периодической таблице . Вайли-ВЧ. ISBN 9781234567897 .
- ^ Куцельнигг, В. (август 1988 г.). «Ортогональные и неортогональные гибриды». Журнал молекулярной структуры: THEOCHEM . 169 : 403–419. дои : 10.1016/0166-1280(88)80273-2 .
- ^ Шайк, Сасон; Данович, Дэвид; Хиберти, Филипп (2022). «О природе химической связи в теории валентной связи». Журнал химической физики . 157 : 090901. дои : 10.1063/5.0095953 .
- ^ Андрей М. Токмачев; Андрей Львович Чугреев; Игорь Алексеевич Мисуркин (2001). «Потенциалы ионизации в полуэмпирическом антисимметричном произведении подхода строго локализованных геминалов». Международный журнал квантовой химии . 85 (3): 109–117. дои : 10.1002/qua.1060 .
- ^ Сасон С. Шейк; Филипп К. Хиберти (2008). Руководство химика по теории валентных связей . Нью-Джерси: Wiley-Interscience. стр. 104–106. ISBN 978-0-470-03735-5 .
- ^ Вейнхольд, Фрэнк; Лэндис, Кларк Р. (2012). Открытие химии с помощью естественных орбиталей связи . Хобокен, Нью-Джерси: Уайли. стр. 67–68. ISBN 978-1-118-11996-9 .



