Раствор (химия)

В химии раствор состоящей — это особый вид гомогенной смеси, из двух или более веществ. В такой смеси вещество растворенное — это вещество, растворенное в другом веществе, известном как растворитель . Если силы притяжения между растворителем и частицами растворенного вещества больше, чем силы притяжения, удерживающие частицы растворенного вещества вместе, частицы растворителя раздвигают частицы растворенного вещества и окружают их. Эти окруженные частицы растворенного вещества затем удаляются от твердого растворенного вещества и попадают в раствор. Процесс смешивания раствора происходит в масштабе, в котором задействованы эффекты химической полярности , что приводит к взаимодействиям, специфичным для сольватации . Раствор обычно имеет состояние растворителя, когда растворитель представляет собой большую часть смеси, как это обычно бывает. Одним из важных параметров раствора является концентрация , которая является мерой количества растворенного вещества в заданном количестве раствора или растворителя. Термин « водный раствор » используется, когда один из растворителей вода . [1]
Характеристики
- Раствор – это однородная смесь двух и более веществ.
- Частицы растворенного вещества в растворе невозможно увидеть невооруженным глазом . Напротив, в суспензии частицы могут быть видны .
- Раствор не вызывает света лучей рассеивания . Напротив, частицы в суспензии или коллоиде могут вызывать рассеяние Тиндаля или рассеяние Рэлея .
- смеси Раствор стабилен, и растворенные вещества не будут осаждаться, если их не добавить в количестве, превышающем растворимость , после чего избыток останется в твердой фазе. Раствор, содержащий больше растворенных веществ, чем в равновесии, называется перенасыщенным .
- Растворенные вещества и растворители в растворе невозможно разделить фильтрацией (или механически).
- Он состоит только из одной фазы .
Этот раздел необходимо дополнить : отличить от других видов смесей (можно отдельный раздел). Вы можете помочь, добавив к нему . ( август 2021 г. ) |
Типы
Гомогенность означает, что компоненты смеси образуют одну фазу. Гетерогенность означает, что компоненты смеси имеют разную фазу. Свойства смеси (такие как концентрация, температура и плотность) могут быть равномерно распределены по объему, но только при отсутствии диффузионных явлений или после их завершения. Обычно растворителем считают вещество, присутствующее в наибольшем количестве. Растворителями могут быть газы, жидкости или твердые вещества. Один или несколько компонентов, присутствующих в растворе, кроме растворителя, называются растворенными веществами. Раствор имеет то же физическое состояние , что и растворитель.
Газовые смеси
Если растворителем является газ , то при заданном наборе условий растворяются только газы (неконденсирующиеся) или пары (конденсирующиеся). Примером газообразного раствора является воздух (кислород и другие газы, растворенные в азоте). Поскольку взаимодействия между молекулами газа практически не играют роли, неконденсирующиеся газы образуют достаточно тривиальные решения. В литературе их даже не относят к растворам, а просто называют однородными смесями газов. Броуновское движение и постоянное молекулярное движение молекул газа гарантируют однородность газовых систем. Неконденсирующиеся газовые смеси (например, воздух/CO 2 или воздух/ксенон) не расслаиваются самопроизвольно и не оседают, а четко расслаиваются и разделяют слои газа в зависимости от их относительной плотности . Силы диффузии эффективно противодействуют силам гравитации в обычных условиях, преобладающих на Земле. В случае конденсируемых паров ситуация иная: как только давление насыщенного пара при данной температуре достигается, избыток пара конденсируется в жидкое состояние .
Жидкие растворы
Если растворитель является жидкостью , то растворяются почти все газы, жидкости и твердые тела. Вот несколько примеров:
- Газ в жидкости:
- Кислород в воде
- Углекислый газ в воде – менее простой пример, поскольку растворение сопровождается химической реакцией (образованием ионов). Видимые пузырьки в газированной воде — это не растворенный газ, а лишь шипение углекислого газа, вышедшее из раствора; сам растворенный газ не виден, поскольку он растворен на молекулярном уровне.
- Жидкость в жидкости:
- Смешивание двух или более веществ одного и того же химического состава, но разных концентраций с образованием константы. (Гомогенизация растворов)
- Алкогольные напитки по сути представляют собой растворы этанола в воде.
- Твердое вещество в жидкости:
- Сахароза (столовый сахар ) в воде
- Хлорид натрия (NaCl) (поваренная соль ) или любая другая соль в воде, образующая электролит : При растворении соль диссоциирует на ионы .
- Растворы в воде особенно распространены и называются водными растворами .
- Неводные растворы – это когда в качестве жидкого растворителя не используется вода. [1]
Контрпримерами служат неоднородные жидкие смеси : коллоиды , суспензии , эмульсии не считаются растворами.
Жидкости организма представляют собой примеры сложных жидких растворов, содержащих множество растворенных веществ. Многие из них являются электролитами, поскольку содержат растворенные ионы, такие как калий . Кроме того, они содержат растворенные молекулы, такие как сахар и мочевина . Кислород и углекислый газ также являются важными компонентами химического состава крови , значительные изменения их концентрации могут быть признаком тяжелого заболевания или травмы.
Твердые решения
Если растворитель является твердым веществом , то растворяться могут газы, жидкости и твердые вещества.
- Газ в твердых телах:
- Водород довольно хорошо растворяется в металлах, особенно в палладии ; это изучается как средство хранения водорода .
- Жидкое в твердом состоянии:
- Твердый в твердом:
- Сталь , по сути, раствор атомов углерода в кристаллической матрице атомов железа. [ нужны разъяснения ]
- Сплавы, такие как бронза и многие другие.
- радия Сульфат , растворенный в сульфате бария : настоящий твердый раствор Ra в BaSO 4
Растворимость
Способность одного соединения растворяться в другом называется растворимостью . [ нужны разъяснения ] Когда одна жидкость может полностью раствориться в другой жидкости, эти две жидкости смешиваются . Два вещества, которые никогда не могут смешаться с образованием раствора, называются несмешивающимися .
Все растворы имеют положительную энтропию смешения. Взаимодействия между различными молекулами или ионами могут быть энергетически выгодными или нет. Если взаимодействия неблагоприятны, то свободная энергия уменьшается с увеличением концентрации растворенного вещества. В какой-то момент потеря энергии перевешивает прирост энтропии, и растворенных частиц больше нет. [ нужны разъяснения ] можно растворить; раствор называется насыщенным . Однако точка, в которой раствор может стать насыщенным, может существенно меняться в зависимости от различных факторов окружающей среды, таких как температура , давление и загрязнение. Для некоторых комбинаций растворенного вещества и растворителя пересыщенный раствор можно приготовить путем повышения растворимости (например, путем повышения температуры) для растворения большего количества растворенного вещества, а затем ее снижения (например, путем охлаждения).
Обычно, чем выше температура растворителя, тем больше данного твердого растворенного вещества он может растворить. Однако растворимость большинства газов и некоторых соединений снижается с повышением температуры. Такое поведение является результатом экзотермической энтальпии раствора . Некоторые поверхностно-активные вещества демонстрируют такое поведение. Растворимость жидкостей в жидкостях обычно менее чувствительна к температуре, чем растворимость твердых веществ или газов.
Характеристики
Физические свойства соединений, такие как температура плавления и точка кипения, изменяются при добавлении других соединений. Вместе они называются коллигативными свойствами . Существует несколько способов количественного определения количества одного соединения, растворенного в других соединениях, которые в совокупности называются концентрацией . Примеры включают молярность , объемную долю и мольную долю .
Свойства идеальных растворов можно рассчитать по линейной комбинации свойств его компонентов. Если и растворенное вещество, и растворитель существуют в равных количествах (например, в 50-процентном растворе этанола и 50-процентном водном растворе), понятия «растворенное вещество» и «растворитель» становятся менее актуальными, но в качестве растворителя чаще всего используется вещество. обычно обозначается как растворитель (в данном примере вода).
Характеристики жидкого раствора
В принципе, все типы жидкостей могут вести себя как растворители: жидкие благородные газы , расплавленные металлы, расплавленные соли, расплавленные ковалентные сетки и молекулярные жидкости. В практике химии и биохимии большинство растворителей представляют собой молекулярные жидкости. Их можно разделить на полярные и неполярные в зависимости от того, обладают ли их молекулы постоянным электрическим дипольным моментом . Другое различие заключается в том, могут ли их молекулы образовывать водородные связи ( протонные и апротонные растворители). Вода , наиболее часто используемый растворитель, является полярной и поддерживает водородные связи.
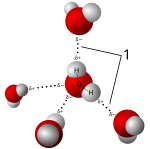
Соли растворяются в полярных растворителях, образуя положительные и отрицательные ионы, которые притягиваются к отрицательному и положительному концам молекулы растворителя соответственно. Если растворителем является вода, гидратация происходит, когда заряженные ионы растворенного вещества окружаются молекулами воды. Стандартным примером является водная соленая вода. Такие растворы называются электролитами . Всякий раз, когда соль растворяется в воде, ионную ассоциацию необходимо учитывать .
Полярные растворенные вещества растворяются в полярных растворителях, образуя полярные или водородные связи. Например, все алкогольные напитки представляют собой водные этанола растворы . С другой стороны, неполярные растворенные вещества лучше растворяются в неполярных растворителях. Примерами являются углеводороды, такие как масло и жир , которые легко смешиваются, но несовместимы с водой.
Примером несмешиваемости нефти и воды является утечка нефти из поврежденного танкера, которая не растворяется в океанской воде, а плавает на поверхности.
Приготовление из составляющих ингредиентов
В лабораториях принято готовить раствор непосредственно из входящих в его состав ингредиентов. В практических расчетах возможны три случая:
- Случай 1: указан объем растворителя.
- Случай 2: задано количество растворенного вещества.
- Случай 3: указан объем конечного раствора.
В следующих уравнениях A — растворитель, B — растворенное вещество, а C — концентрация. Объем растворенного вещества рассматривается в рамках модели идеального раствора.
- количество (мл) растворителя V A. Случай 1: указано Масса растворенного вещества m B = CV A d A /(100-C/d B )
- количество растворенного вещества m B. Случай 2: указано Объем растворителя V A = м B (100/C-1/d B )
- Случай 3: указано количество (мл) конечного объема раствора Vt. Масса растворенного вещества m B = C Vt/100; Объем растворителя V A =(100/C-1/d B ) м B
- Случай 2: масса растворенного вещества известна, V A = m B 100/C.
- Случай 3: известен общий объем раствора, то же уравнение, что и в случае 1. V A =Vt; м B = CV A /100
Пример: приготовьте 2 г/100 мл раствора NaCl с 1 л воды . Плотность полученного раствора считается равной плотности воды, причем утверждение справедливо, особенно для разбавленных растворов, поэтому информация о плотности не требуется.
- м B = CV A = (2/100) г/мл × 1000 мл = 20 г
Химики часто готовят концентрированные исходные растворы , которые затем можно разбавлять по мере необходимости для лабораторных применений. Стандартные растворы – это растворы, концентрации растворенных веществ в которых точно известны.
См. также
- Молярный раствор – мера концентрации химического вещества.
- Процентное решение (значения)
- Равновесие растворимости - термодинамическое равновесие между твердым веществом и раствором одного и того же соединения.
- Общее количество растворенных твердых веществ . Измерение в химии окружающей среды является общим термином в ряде дисциплин и может иметь разные значения в зависимости от используемого аналитического метода. В отношении качества воды это относится к количеству остатков, остающихся после испарения воды из образца.
- Верхняя критическая температура раствора – критическая температура смешиваемости в смеси.
- Нижняя критическая температура раствора - критическая температура, ниже которой компоненты смеси смешиваются для всех составов.
- Переход клубок-глобула - коллапс макромолекулы из состояния расширенного клубка в состояние сжатой глобулы.
Ссылки
- ^ Jump up to: а б «Решения» . Химический факультет Вашингтонского университета . Вашингтонский университет . Проверено 13 апреля 2018 г.
- ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Решение ». два : 10.1351/goldbook.S05746
Внешние ссылки
 СМИ, связанные с решениями, на Викискладе?
СМИ, связанные с решениями, на Викискладе?