Фагосома
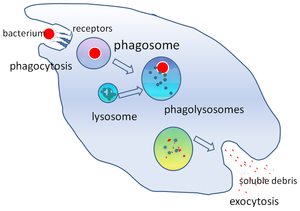
В клеточной биологии фагосома , представляет собой везикулу образующуюся вокруг частицы, поглощенной фагоцитом посредством фагоцитоза . Профессиональные фагоциты включают макрофаги , нейтрофилы и дендритные клетки (ДК). [ 1 ]
Фагосома образуется в результате слияния клеточной мембраны вокруг микроорганизма , стареющей клетки или апоптотической клетки . Фагосомы имеют мембраносвязанные белки , которые рекрутируются и сливаются с лизосомами с образованием зрелых фаголизосом . Лизосомы содержат гидролитические ферменты и активные формы кислорода (АФК), которые убивают и переваривают патогены . Фагосомы также могут образовываться в непрофессиональных фагоцитах, но они могут поглощать лишь меньший круг частиц и не содержат АФК. Полезные материалы (например, аминокислоты ) из переваренных частиц перемещаются в цитозоль , а отходы удаляются путем экзоцитоза . Формирование фагосом имеет решающее значение для гомеостаза тканей и как врожденной, так и адаптивной защиты хозяина от патогенов.
Однако некоторые бактерии могут использовать фагоцитоз в качестве стратегии инвазии. Они либо размножаются внутри фаголизосомы ( , либо размножаются внутри фаголизосомы ( например, Coxiella spp.) например, Coxiella spp.) [ 2 ] или проникнуть в цитоплазму до того, как фагосома сливается с лизосомой (например, Rickettsia spp.). [ 3 ] Многие микобактерии, включая микобактерии туберкулеза. [ 4 ] [ 5 ] и Mycobacterium avium paratuberculosis , [ 6 ] хозяина могут манипулировать макрофагами , чтобы предотвратить слияние лизосом с фагосомами и образование зрелых фаголизосом. Такое неполное созревание фагосомы сохраняет внутри нее благоприятную для патогенов среду. [ 7 ]
Формирование
[ редактировать ]Фагосомы достаточно велики, чтобы разрушать целые бактерии или апоптотические и стареющие клетки, диаметр которых обычно превышает 0,5 мкм. [ 8 ] Это означает, что фагосома на несколько порядков больше эндосомы , размер которой измеряется в нанометрах .
Фагосомы образуются, когда патогены или опсонины связываются с трансмембранным рецептором, которые случайным образом распределяются по поверхности клеток-фагоцитов. При связывании передача сигналов «снаружи внутрь» запускает полимеризацию актина и образование псевдоподий , которые окружают микроорганизм и сливаются с ним. Протеинкиназа C , фосфоинозитид-3-киназа и фосфолипаза C (PLC) необходимы для передачи сигналов и контроля интернализации частиц. [ 9 ] Больше рецепторов клеточной поверхности могут связываться с частицей по механизму, подобному застежке-молнии, когда патоген окружен, увеличивая авидность связывания . [ 10 ] Рецептор Fc (FcR), рецепторы комплемента (CR), рецептор маннозы и дектин-1 являются фагоцитарными рецепторами, что означает, что они могут индуцировать фагоцитоз, если они экспрессируются в нефагоцитарных клетках, таких как фибробласты . [ 11 ] Другие белки, такие как Toll-подобные рецепторы, участвуют в распознавании образов патогенов и часто рекрутируются в фагосомы, но не вызывают специфически фагоцитоз в нефагоцитарных клетках, поэтому они не считаются фагоцитирующими рецепторами.
Опсонизация
[ редактировать ]Опсонины — это молекулярные метки, такие как антитела и комплементы , которые прикрепляются к патогенам и активируют фагоцитоз. Иммуноглобулин G (IgG) является основным типом антител, присутствующих в сыворотке . Это часть адаптивной иммунной системы , но она связана с врожденным ответом , привлекая макрофаги к фагоцитозу патогенов. Антитело связывается с микробами с помощью вариабельного домена Fab , а домен Fc связывается с рецепторами Fc (FcR), индуцируя фагоцитоз.
Интернализация, опосредованная комплементом, имеет гораздо менее значительные выпячивания мембраны, но передача сигналов обоих путей сходится, чтобы активировать Rho GTPases . [ 12 ] Они контролируют полимеризацию актина, необходимую для слияния фагосомы с эндосомами и лизосомами.
Нефагоцитарные клетки
[ редактировать ]Другие непрофессиональные фагоциты обладают некоторой степенью фагоцитарной активности, например, эпителиальные клетки щитовидной железы и мочевого пузыря, которые могут поглощать эритроциты, и эпителиальные клетки сетчатки, интернализирующие палочки сетчатки. [ 8 ] Однако непрофессиональные фагоциты не экспрессируют специфические фагоцитарные рецепторы, такие как FcR, и имеют гораздо более низкую скорость интернализации.
Некоторые инвазивные бактерии могут также индуцировать фагоцитоз в нефагоцитарных клетках, опосредуя захват хозяина. Например, шигеллы могут секретировать токсины, которые изменяют цитоскелет хозяина и проникают на базолатеральную сторону энтероцитов . [ 13 ]
Структура
[ редактировать ]Поскольку мембрана фагосомы образуется путем слияния плазматической мембраны, основной состав фосфолипидного бислоя одинаков. Эндосомы и лизосомы затем сливаются с фагосомой, образуя мембрану, особенно когда поглощаемая частица очень велика, например, паразит . [ 14 ] Они также доставляют в фагосому различные мембранные белки и модифицируют структуру органелл.
шарики низкой плотности Фагосомы могут поглощать искусственные латексные , а затем очищать их по градиенту концентрации сахарозы , что позволяет изучить структуру и состав. [ 15 ] Очищая фагосомы в разные моменты времени, можно также охарактеризовать процесс созревания. Ранние фагосомы характеризуются Rab5, которые переходят в Rab7 по мере того, как везикула созревает в поздние фагосомы.
Процесс созревания
[ редактировать ]Возникающая фагосома по своей сути не обладает бактерицидными свойствами. По мере созревания он становится более кислым от pH 6,5 до pH 4 и приобретает характерные белковые маркеры и гидролитические ферменты. Различные ферменты функционируют при различных оптимальных значениях pH, образуя определенный диапазон, поэтому каждый из них работает на узких стадиях процесса созревания. Активность фермента можно точно настроить путем изменения уровня pH, что обеспечивает большую гибкость. Фагосома движется вдоль , последовательно микротрубочек цитоскелета сливаясь с эндосомами и лизосомами в динамическом режиме «поцелуй и беги» . [ 16 ] Этот внутриклеточный транспорт зависит от размера фагосом. Органеллы большего размера (диаметром около 3 мкм) очень устойчиво транспортируются от периферии клетки к перинуклеарной области, тогда как органеллы меньшего размера (диаметром около 1 мкм) транспортируются более двунаправленно туда и обратно между центром клетки и периферией клетки. [ 17 ] Вакуолярные протонные насосы (v-АТФаза) доставляются в фагосому для подкисления отсека органелл, создавая более агрессивную среду для патогенов и способствуя деградации белков. Бактериальные белки денатурируются при низком pH и становятся более доступными для протеаз, на которые не влияет кислая среда. Ферменты позже перерабатываются из фаголизосомы перед выделением, поэтому они не тратятся впустую. Состав фосфолипидной мембраны также меняется по мере созревания фагосомы. [ 15 ]
Слияние может занять от нескольких минут до нескольких часов в зависимости от содержимого фагосомы; FcR или слияние, опосредованное рецептором маннозы, длится менее 30 минут, но фагосомам, содержащим латексные шарики, может потребоваться несколько часов, чтобы слиться с лизосомами. [ 8 ] Предполагается, что состав мембраны фагосом влияет на скорость созревания. Микобактерия туберкулеза имеет очень гидрофобную клеточную стенку , которая, как предполагается, предотвращает рециркуляцию мембраны и рекрутирование факторов слияния, поэтому фагосома не сливается с лизосомами, и бактерия избегает деградации. [ 18 ]
Молекулы меньшего размера в просвете передаются путем слияния быстрее, чем молекулы большего размера, что предполагает, что между фагосомой и другими везикулами во время «поцелуй и беги» образуется небольшой водный канал, через который возможен только ограниченный обмен. [ 8 ]
Регулирование плавления
[ редактировать ]Вскоре после интернализации F-актин деполимеризуется из новообразованной фагосомы и становится доступным для эндосом для слияния и доставки белков. [ 8 ] Процесс созревания разделяется на раннюю и позднюю стадии в зависимости от характерных белков-маркеров, регулируемых малыми Rab-ГТФазами. Rab5 присутствует на ранних фагосомах и контролирует переход к поздним фагосомам, отмеченным Rab7. [ 19 ]
Rab5 рекрутирует киназу PI-3 и другие привязывающие белки, такие как Vps34, к мембране фагосомы, поэтому эндосомы могут доставлять белки в фагосому. Rab5 частично участвует в переходе к Rab7 через комплекс CORVET и комплекс HOPS у дрожжей. [ 19 ] Точный путь созревания у млекопитающих не совсем понятен, но предполагается, что HOPS может связывать Rab7 и вытеснять ингибитор диссоциации гуанозиновых нуклеотидов (GDI). [ 20 ] Rab11 участвует в переработке мембран. [ 21 ]
Фаголизосома
[ редактировать ]Фагосома сливается с лизосомами, образуя фаголизосому, обладающую различными бактерицидными свойствами. Фаголизосома содержит активные формы кислорода и азота (АФК и РНС), а также гидролитические ферменты. Компартмент также кислый из-за протонных насосов (v-АТФазы), которые транспортируют H. + через мембрану, используемый для денатурации бактериальных белков.
Точные свойства фаголизосом варьируются в зависимости от типа фагоцита. Те, что находятся в дендритных клетках, обладают более слабыми бактерицидными свойствами, чем в макрофагах и нейтрофилах. Также макрофаги делятся на провоспалительные «киллеры» М1 и «ремонтники» М2. Фаголизосомы М1 могут метаболизировать аргинин в высокореактивный оксид азота , тогда как М2 используют аргинин для производства орнитина , который способствует пролиферации клеток и восстановлению тканей. [ 22 ]
Функция
[ редактировать ]Деградация патогена
[ редактировать ]Макрофаги и нейтрофилы являются профессиональными фагоцитами, отвечающими за большую часть деградации патогенов, но у них разные бактерицидные методы. Нейтрофилы имеют гранулы, которые сливаются с фагосомой. Гранулы содержат НАДФН-оксидазу и миелопероксидазу , которые производят токсичные производные кислорода и хлора для уничтожения патогенов в результате окислительного взрыва . Протеазы и антимикробные пептиды также высвобождаются в фаголизосому. У макрофагов отсутствуют гранулы, и для переваривания микробов они больше полагаются на подкисление фаголизосом, гликозидазы и протеазы. [ 21 ] Фагосомы в дендритных клетках менее кислые и обладают гораздо более слабой гидролитической активностью из-за меньшей концентрации лизосомальных протеаз и даже присутствия ингибиторов протеаз.
Воспаление
[ редактировать ]Формирование фагосом связано с воспалением посредством общих сигнальных молекул. Киназа PI-3 и PLC участвуют как в механизме интернализации, так и в запуске воспаления. [ 9 ] Эти два белка, наряду с Rho GTPases, являются важными компонентами врожденного иммунного ответа, индуцируя выработку цитокинов и активируя сигнальный каскад MAP-киназы . провоспалительные цитокины, включая IL-1β , IL-6 , TNFα и IL-12 . Вырабатываются [ 8 ]
Процесс жестко регулируется, и воспалительная реакция варьируется в зависимости от типа частиц внутри фагосомы. Апоптозные клетки, инфицированные патогеном, вызывают воспаление, но поврежденные клетки, которые деградируют в ходе нормального тканевого обмена, этого не делают. Реакция также различается в зависимости от фагоцитоза, опосредованного опсонином. Реакции, опосредованные FcR и рецептором маннозы, производят провоспалительные активные формы кислорода и молекулы арахидоновой кислоты , но реакции, опосредованные CR, не приводят к образованию этих продуктов. [ 8 ]
Презентация антигена
[ редактировать ]Незрелые дендритные клетки (ДК) могут фагоцитировать, но зрелые ДК не могут из-за изменений в Rho GTPases, участвующих в ремоделировании цитоскелета. [ 21 ] Фагосомы ДК менее гидролитические и кислые, чем фагосомы макрофагов и нейтрофилов, поскольку ДК в основном участвуют в презентации антигена , а не в деградации патогена. Им необходимо сохранять фрагменты белка подходящего размера для специфического распознавания бактерий, поэтому пептиды расщепляются лишь частично. [ 21 ] Пептиды бактерий передаются в главный комплекс гистосовместимости (MHC). Пептидные антигены презентируются лимфоцитам , где они связываются с рецепторами Т-клеток и активируют Т-клетки , устраняя разрыв между врожденным и адаптивным иммунитетом. [ 9 ] Это характерно для млекопитающих , птиц и челюстных рыб, поскольку у насекомых нет адаптивного иммунитета. [ 23 ]

Питательное вещество
[ редактировать ]Древние одноклеточные организмы, такие как амеба, используют фагоцитоз как способ приобретения питательных веществ, а не как иммунную стратегию. Они поглощают другие более мелкие микробы и переваривают их в фагосоме со скоростью примерно одна бактерия в минуту, что намного быстрее, чем профессиональные фагоциты. [ 24 ] Для почвенной амебы Dictyostelium discoideum основным источником питания являются бактерии Legionella pneumophila , вызывающие болезнь легионеров . у человека [ 25 ] Созревание фагосом у амебы очень похоже на таковое у макрофагов, поэтому их используют в качестве модельного организма для изучения этого процесса. [ 16 ]
Очистка тканей
[ редактировать ]Фагосомы разрушают стареющие клетки и апоптотические клетки для поддержания гомеостаза тканей. Эритроциты имеют одну из самых высоких скоростей оборота в организме и фагоцитируются макрофагами в печени и селезенке . У эмбриона процесс удаления мертвых клеток недостаточно изучен, но он не осуществляется макрофагами или другими клетками, полученными из гемопоэтических стволовых клеток . [ 26 ] Только у взрослых апоптотические клетки фагоцитируются профессиональными фагоцитами. Воспаление запускается только определенными молекулярными паттернами, связанными с патогеном или повреждением (PAMP или DAMP), удаление стареющих клеток не является воспалительным. [ 14 ]
Аутофагосома
[ редактировать ]Аутофагосомы отличаются от фагосом тем, что они в основном используются для избирательного разрушения поврежденных цитозольных органелл, таких как митохондрии ( митофагия ). Однако, когда клетка голодает или испытывает стресс, аутофагосомы также могут неселективно разрушать органеллы, чтобы обеспечить клетку аминокислотами и другими питательными веществами. [ 27 ] Аутофагия не ограничивается профессиональными фагоцитами, она впервые обнаружена в гепатоцитах крысы клеточным биологом Кристианом де Дювом . [ 28 ] Аутофагосомы имеют двойную мембрану: внутренняя из поглощенной органеллы, а внешняя мембрана, как предполагается, образована из эндоплазматического ретикулума или промежуточного компартмента ER-Гольджи (ERGIC). [ 29 ] Аутофагосома также сливается с лизосомами, разрушая ее содержимое. Когда M.tuberculosis подавляет закисление фагосом, гамма-интерферон может вызвать аутофагию и спасти процесс созревания. [ 30 ]
Уклонение от бактерий и манипуляции
[ редактировать ]Многие бактерии научились уклоняться от бактерицидных свойств фагосом или даже использовать фагоцитоз в качестве стратегии инвазии.
- Микобактерии туберкулеза нацелены на макрофаги М2 нижних отделов дыхательных путей, которые не продуцируют АФК. [ 31 ] M.tuberculosis также может манипулировать сигнальными путями, секретируя фосфатазы, такие как PtpA и SapM, которые нарушают рекрутирование белков и блокируют подкисление фагосом. [ 8 ] [ 32 ]
- Legionella pneumophila может ремоделировать мембрану фагосомы, имитируя пузырьки в других частях секреторного пути, поэтому лизосомы не распознают фагосому и не сливаются с ней. Бактерия секретирует токсины, которые мешают транспортировке хозяина, поэтому вакуоль, содержащая легионеллу , рекрутирует мембранные белки, обычно находящиеся в эндоплазматическом ретикулуме или ERGIC. [ 33 ] Это перенаправляет секреторные везикулы на модифицированную фагосому и доставляет питательные вещества бактериям.
- Listeria monocytogenes секретирует порообразующий белок листериолизин О, поэтому бактерия может покинуть фагосому и попасть в цитозоль. Листериолизин активируется кислой средой фагосомы. [ 34 ] Кроме того, листерии секретируют два фермента фосфолипазы С, которые способствуют выходу из фагосом.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Робинсон и Бэбкок 1998 , с. 187 и Ernst & Stendahl 2006 , стр. 7–10.
- ^ Хакштадт Т., Уильямс Дж. К. (май 1981 г.). «Биохимическая стратегия борьбы с облигатным паразитизмом эукариотических клеток Coxiella burnetii» . Труды Национальной академии наук Соединенных Штатов Америки . 78 (5): 3240–4. дои : 10.1073/pnas.78.5.3240 . ПМК 319537 . ПМИД 6942430 .
- ^ Винклер Х.Х. (1990). «Виды риккетсий (как организмы)». Ежегодный обзор микробиологии . 44 : 131–153. дои : 10.1146/аннурев.микро.44.1.131 . ПМИД 2252380 .
- ^ МакМикинг Дж.Д., Тейлор Г.А., МакКинни Дж.Д. (октябрь 2003 г.). «Иммунный контроль туберкулеза с помощью IFN-гамма-индуцируемого LRG-47». Наука . 302 (5645): 654–9. Бибкод : 2003Sci...302..654M . дои : 10.1126/science.1088063 . ПМИД 14576437 . S2CID 83944695 .
- ^ Вандал О.Г., Пьерини Л.М., Шнаппингер Д., Натан К.Ф., Эрт С. (август 2008 г.). «Мембранный белок сохраняет внутрибактериальный pH при внутрифагосомной микобактерии туберкулеза» . Природная медицина . 14 (8): 849–54. дои : 10.1038/нм.1795 . ПМЦ 2538620 . ПМИД 18641659 .
- ^ Кюнель М.П., Гете Р., Хаберманн А., Мюллер Э., Роде М., Гриффитс Г., Валентин-Вейганд П. (август 2001 г.). «Характеристика внутриклеточной выживаемости Mycobacterium avium ssp. paratuberculosis: рН фагосом и фузогенность макрофагов J774 по сравнению с другими микобактериями» . Клеточная микробиология . 3 (8): 551–66. дои : 10.1046/j.1462-5822.2001.00139.x . ПМИД 11488816 . S2CID 8962102 .
- ^ Тессема М.З., Коец А.П., Руттен В.П., Грюйс Э. (ноябрь 2001 г.). «Как Mycobacterium avium subsp. paratuberculosis сопротивляется внутриклеточной деградации?». Ветеринарный ежеквартальный журнал . 23 (4): 153–62. дои : 10.1080/01652176.2001.9695105 . ПМИД 11765232 .
- ^ Jump up to: а б с д и ж г час Адерем А., Андерхилл DM (апрель 1999 г.). «Механизмы фагоцитоза в макрофагах». Ежегодный обзор иммунологии . 17 (1): 593–623. doi : 10.1146/annurev.immunol.17.1.593 . ПМИД 10358769 .
- ^ Jump up to: а б с Адерем А (июнь 2003 г.). «Фагоцитоз и воспалительная реакция» . Журнал инфекционных болезней . 187 Приложение 2 (с2): S340-5. дои : 10.1086/374747 . ПМИД 12792849 .
- ^ Дюпюи АГ, Кэрон Э (июнь 2008 г.). «Интегрин-зависимый фагоцитоз: распространение от микроадгезии к новым концепциям». Журнал клеточной науки . 121 (11): 1773–83. дои : 10.1242/jcs.018036 . ПМИД 18492791 .
- ^ Андерхилл Д.М., Озинский А. (апрель 2002 г.). «Фагоцитоз микробов: сложность в действии». Ежегодный обзор иммунологии . 20 (1): 825–52. doi : 10.1146/annurev.immunol.20.103001.114744 . ПМИД 11861619 .
- ^ Каплан Г. (август 1977 г.). «Различия в режиме фагоцитоза с рецепторами Fc и C3 в макрофагах». Скандинавский журнал иммунологии . 6 (8): 797–807. дои : 10.1111/j.1365-3083.1977.tb02153.x . ПМИД 561436 . S2CID 25373560 .
- ^ Кёлер Х., Родригес С.П., Маккормик Б.А. (март 2002 г.). «Взаимодействие Shigella flexneri с базолатеральным мембранным доменом поляризованной модели кишечного эпителия: роль липополисахарида в клеточной инвазии и в активации митоген-активируемой протеинкиназы ERK» . Инфекция и иммунитет . 70 (3): 1150–8. дои : 10.1128/IAI.70.3.1150-1158.2002 . ПМК 127798 . ПМИД 11854195 .
- ^ Jump up to: а б Дежарден М., Уд М., Ганьон Э. (октябрь 2005 г.). «Фагоцитоз: запутанный путь от питания к адаптивному иммунитету». Иммунологические обзоры . 207 (1): 158–65. дои : 10.1111/j.0105-2896.2005.00319.x . ПМИД 16181334 . S2CID 30191200 .
- ^ Jump up to: а б Дежарден М., Селис Дж. Э., ван Меер Г., Диплингер Х., Джараус А., Гриффитс Г., Хубер Л. А. (декабрь 1994 г.). «Молекулярная характеристика фагосом» . Журнал биологической химии . 269 (51): 32194–200. дои : 10.1016/S0021-9258(18)31620-X . ПМИД 7798218 .
- ^ Jump up to: а б Готхардт Д., Варнац Х.Дж., Хеншель О., Брюкерт Ф., Шляйхер М., Солдати Т. (октябрь 2002 г.). «Вскрытие процесса созревания фагосом в высоком разрешении выявляет отдельные фазы мембранного транспорта» . Молекулярная биология клетки . 13 (10): 3508–20. дои : 10.1091/mbc.E02-04-0206 . ПМК 129962 . ПМИД 12388753 .
- ^ Келлер С., Бергхофф К., Кресс Х. (декабрь 2017 г.). «Фагосомный транспорт сильно зависит от размера фагосомы» . Научные отчеты . 7 (1): 17068. Бибкод : 2017НатСР...717068К . дои : 10.1038/s41598-017-17183-7 . ПМК 5719076 . ПМИД 29213131 .
- ^ де Шателье С., Тило Л. (сентябрь 1997 г.). «Созревание и слияние фагосом с лизосомами в зависимости от свойств поверхности и размера фагоцитарной частицы». Европейский журнал клеточной биологии . 74 (1): 49–62. ПМИД 9309390 .
- ^ Jump up to: а б Фэрн Г.Д., Гринштейн С. (август 2012 г.). «Как зарождающиеся фагосомы созревают и становятся фаголизосомами». Тенденции в иммунологии . 33 (8): 397–405. дои : 10.1016/j.it.2012.03.003 . ПМИД 22560866 .
- ^ Кинчен Дж. М., Равичандран К. С. (апрель 2010 г.). «Идентификация двух эволюционно консервативных генов, регулирующих процессинг поглощенных апоптотических клеток» . Природа . 464 (7289): 778–82. Бибкод : 2010Natur.464..778K . дои : 10.1038/nature08853 . ПМК 2901565 . ПМИД 20305638 .
- ^ Jump up to: а б с д Савина А., Амигорена С (октябрь 2007 г.). «Фагоцитоз и презентация антигена в дендритных клетках». Иммунологические обзоры . 219 (1): 143–56. дои : 10.1111/j.1600-065X.2007.00552.x . ПМИД 17850487 . S2CID 1267478 .
- ^ Компакт-диск Миллса (5 мая 2015 г.). «Анатомия открытия: макрофаги m1 и m2» . Границы в иммунологии . 6 : 212. дои : 10.3389/fimmu.2015.00212 . ПМЦ 4419847 . ПМИД 25999950 .
- ^ Уорр Г.В. (1997). «Адаптивная иммунная система рыб». Развитие биологической стандартизации . 90 : 15–21. ПМИД 9270830 .
- ^ Коссон П., Солдати Т. (июнь 2008 г.). «Ешь, убей или умри: когда амеба встречается с бактериями». Современное мнение в микробиологии . 11 (3): 271–6. дои : 10.1016/j.mib.2008.05.005 . ПМИД 18550419 .
- ^ Соломон Дж. М., Руппер А., Карделли Дж. А., Исберг Р. Р. (май 2000 г.). «Внутриклеточный рост Legionella pneumophila в Dictyostelium discoideum, системе генетического анализа взаимодействий хозяина и патогена» . Инфекция и иммунитет . 68 (5): 2939–47. дои : 10.1128/iai.68.5.2939-2947.2000 . ПМЦ 97507 . ПМИД 10768992 .
- ^ Личанская А.М., Хьюм Д.А. (июнь 2000 г.). «Происхождение и функции фагоцитов эмбриона» (PDF) . Экспериментальная гематология . 28 (6): 601–11. дои : 10.1016/s0301-472x(00)00157-0 . hdl : 20.500.11820/b865effa-680c-4f60-905e-ba9137f57613 . ПМИД 10880746 . S2CID 13336661 .
- ^ Дин WX, Инь XM (июль 2012 г.). «Митофагия: механизмы, патофизиологические роли и анализ» . Биологическая химия . 393 (7): 547–64. дои : 10.1515/hsz-2012-0119 . ПМЦ 3630798 . ПМИД 22944659 .
- ^ Кастро-Обрегон С (2010). «Открытие лизосом и аутофагии» . Природное образование . 3 (9): 49.
- ^ Ге Л., Шекман Р. (январь 2014 г.). «Промежуточный отсек ЭР-Гольджи питает мембрану фагофора» . Аутофагия . 10 (1): 170–2. дои : 10.4161/auto.26787 . ПМЦ 4389871 . ПМИД 24220263 .
- ^ Гутьеррес М.Г., Мастер СС, Сингх С.Б., Тейлор Г.А., Коломбо М.И., Деретик В. (декабрь 2004 г.). «Аутофагия — это защитный механизм, препятствующий выживанию БЦЖ и микобактерий туберкулеза в инфицированных макрофагах» . Клетка . 119 (6): 753–66. дои : 10.1016/j.cell.2004.11.038 . ПМИД 15607973 .
- ^ Камбье С.Дж., Такаки К.К., Ларсон Р.П., Эрнандес Р.Э., Тобин Д.М., Урдал К.Б., Косма К.Л., Рамакришнан Л. (январь 2014 г.). «Микобактерии манипулируют набором макрофагов посредством скоординированного использования мембранных липидов» . Природа . 505 (7482): 218–22. дои : 10.1038/nature12799 . ПМЦ 3961847 . ПМИД 24336213 .
- ^ Вонг Д., Чао Дж.Д., Ав-Гей Ю. (февраль 2013 г.). «Фосфатазы, секретируемые микобактериями туберкулеза: от патогенеза к мишеням для разработки противотуберкулезных препаратов». Тенденции в микробиологии . 21 (2): 100–9. дои : 10.1016/j.tim.2012.09.002 . ПМИД 23084287 .
- ^ Рой Ч.Р., Каган Дж.К. (1 января 2013 г.). Уклонение от слияния фагосом с лизосомами и создание репликативной органеллы внутриклеточным патогеном Legionella pneumophila . Ландес Бионаука.
- ^ Портной Д.А., Ауэрбух В., Гломский И.Ю. (август 2002 г.). «Клеточная биология инфекции Listeria monocytogenes: пересечение бактериального патогенеза и клеточного иммунитета» . Журнал клеточной биологии . 158 (3): 409–14. дои : 10.1083/jcb.200205009 . ПМК 2173830 . ПМИД 12163465 .