Молекулярная нейробиология
Молекулярная нейробиология — это раздел нейробиологии , который изучает концепции молекулярной биологии применительно к нервной системе животных. Объем этого предмета охватывает такие темы, как молекулярная нейроанатомия , механизмы молекулярной передачи сигналов в нервной системе , влияние генетики и эпигенетики на развитие нейронов, а также молекулярные основы нейропластичности и нейродегенеративных заболеваний . [1] Как и молекулярная биология, молекулярная нейробиология — относительно новая область, которая весьма динамична.
Поиск нейромедиаторов
[ редактировать ]В молекулярной биологии связь между нейронами обычно происходит посредством химической передачи через промежутки между клетками, называемые синапсами . Передаваемые химические вещества, известные как нейротрансмиттеры , регулируют значительную часть жизненно важных функций организма. [2] Анатомически локализовать нейротрансмиттеры можно с помощью методов маркировки. химически идентифицировать, Определенные нейротрансмиттеры, такие как катехоламины, срезы фиксируя нервной ткани формальдегидом можно . Это может привести к флуоресценции, индуцированной формальдегидом, при воздействии ультрафиолетового света . был идентифицирован дофамин , катехоламин. у нематоды C. elegans С помощью этого метода [3] Иммуноцитохимия , которая включает в себя выработку антител против целевых химических или биологических объектов, включает в себя несколько других интересных методов. Целевой нейромедиатор может быть специфически помечен первичными и вторичными антителами с радиоактивной меткой, чтобы идентифицировать нейромедиатор с помощью ауторадиографии . Присутствие нейротрансмиттеров (хотя не обязательно их местоположение) можно наблюдать с помощью иммуноферментной иммуноцитохимии или иммуноферментного анализа (ELISA), в которых связывание субстрата в ферментативных анализах может индуцировать преципитаты , флуорофоры или хемилюминесценцию . В случае, если нейротрансмиттеры не могут быть идентифицированы гистохимически, альтернативным методом является определение их местонахождения по механизмам нейронного поглощения. [1]
Потенциал-управляемые ионные каналы
[ редактировать ]
Возбудимые клетки живых организмов имеют потенциалзависимые ионные каналы . Их можно наблюдать по всей нервной системе в нейронах. Первыми ионными каналами, которые были охарактеризованы, были ионные каналы натрия и калия, предложенные А. Л. Ходжкиным и А. Ф. Хаксли в 1950-х годах при изучении гигантского аксона кальмаров рода Loligo . Их исследования продемонстрировали избирательную проницаемость клеточных мембран, зависящую от физиологических условий, и электрические эффекты, возникающие в результате этой проницаемости, для создания потенциалов действия . [4]
Натриевые ионные каналы
[ редактировать ]Натриевые каналы были первыми потенциалзависимыми ионными каналами, выделенными в 1984 году у угря Electrophorus electricus Сёсаку Нумой . Токсин рыбы фугу тетродотоксин (ТТХ) , блокатор натриевых каналов, использовался для выделения белка натриевых каналов путем связывания его с использованием метода колоночной хроматографии для химического разделения. Аминокислотную , последовательность белка анализировали методом деградации по Эдману , а затем использовали для создания библиотеки кДНК которую можно было использовать для клонирования белка канала. Клонирование самого канала позволило использовать такие приложения, как идентификацию тех же каналов у других животных. [1] Натриевые каналы известны тем, что работают совместно с калиевыми каналами во время развития градуированных потенциалов и потенциалов действия. Натриевые каналы обеспечивают приток Na + ионы попадают в нейрон, что приводит к деполяризации нейрона мембранного потенциала покоя , что приводит к градуированному потенциалу или потенциалу действия, в зависимости от степени деполяризации. [5]
Калийные ионные каналы
[ редактировать ]Калиевые каналы бывают разных форм, присутствуют в большинстве эукариотических клеток и обычно имеют тенденцию стабилизировать клеточную мембрану при равновесном потенциале калия . Как и в случае с ионами натрия, градуированные потенциалы и потенциалы действия также зависят от калиевых каналов. В то время как приток Na + ионы в нейрон вызывают деполяризацию клетки, отток K + ионы, выходящие из нейрона, вызывают реполяризацию клетки до мембранного потенциала покоя. Активация ионных каналов калия сама по себе зависит от деполяризации, вызываемой Na. + приток во время потенциала действия. [1] Как и в случае с натриевыми каналами, калиевые каналы имеют свои собственные токсины, которые блокируют действие белков каналов. Примером такого токсина является большой катион тетраэтиламмоний (TEA) , но примечательно, что токсин не имеет одинакового механизма действия на все калиевые каналы, учитывая разнообразие типов каналов у разных видов. Присутствие калиевых каналов было впервые обнаружено у Drosophila melanogaster мух-мутантов , которые бесконтрольно тряслись во время анестезии из-за проблем с реполяризацией клеток, что приводило к аномальной электрофизиологии нейронов и мышц. Калийные каналы были впервые идентифицированы путем манипулирования молекулярной генетикой (мух) вместо очистки белков каналов, поскольку на момент открытия не было известных лигандов с высоким сродством к калиевым каналам (таких как TEA). [1] [6]
Каналы ионов кальция
[ редактировать ]Кальциевые каналы важны для определенных сигнальных каскадов клеток, а также для высвобождения нейромедиаторов в окончаниях аксонов . В возбудимых клетках обнаружено множество различных типов каналов ионов кальция. Как и каналы ионов натрия, каналы ионов кальция были выделены и клонированы с помощью методов хроматографической очистки. Примечательно, что, как и в случае с высвобождением нейромедиаторов, кальциевые каналы могут взаимодействовать с внутриклеточными белками и играют важную роль в передаче сигналов, особенно в таких местах, как саркоплазматический ретикулум мышечных клеток. [1]
Рецепторы
[ редактировать ]Для передачи сигналов и коммуникации клеток можно использовать различные типы рецепторов, которые могут включать ионотропные рецепторы и метаботропные рецепторы. Эти типы рецепторов клеточной поверхности различаются по механизму и продолжительности действия: ионотропные рецепторы связаны с быстрой передачей сигнала, а метаботропные рецепторы связаны с медленной передачей сигнала. Метаботропные рецепторы охватывают широкий спектр рецепторов клеточной поверхности с совершенно разными сигнальными каскадами . [1] [5]
Ионотропные рецепторы
[ редактировать ]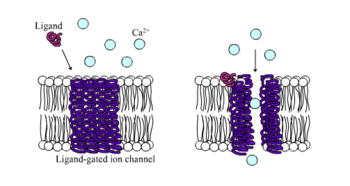
Ионотропные рецепторы , также известные как лиганд-управляемые ионные каналы , представляют собой быстродействующие рецепторы, которые опосредуют нервные и физиологические функции посредством потока ионных каналов со связыванием лиганда. Никотиновые, ГАМК- и глутаматные рецепторы относятся к числу некоторых рецепторов клеточной поверхности, регулируемых лиганд-зависимым потоком ионных каналов. ГАМК является основным тормозным нейромедиатором мозга, а глутамат — основным возбуждающим нейромедиатором мозга. [1]
ГАМК-рецепторы
[ редактировать ]ГАМК А и ГАМК С Известно, что рецепторы являются ионотропными, тогда как рецептор ГАМК В является метаботропным. Рецепторы ГАМК А опосредуют быстрые тормозные реакции в центральной нервной системе (ЦНС) и обнаруживаются на нейронах, глиальных клетках и клетках мозгового вещества надпочечников . Он отвечает за индукцию Cl − приток ионов в клетки, тем самым уменьшая вероятность того, что деполяризация мембраны произойдет при появлении градуированного потенциала или потенциала действия. Рецепторы ГАМК также могут взаимодействовать с неэндогенными лигандами, влияя на активность. Например, соединение диазепам (продаваемое под названием «Валиум») является аллостерическим агонистом, который увеличивает сродство рецептора к ГАМК. Повышенное физиологическое ингибирующее действие, возникающее в результате увеличения связывания ГАМК, делает диазепам полезным транквилизатором или противосудорожным средством (противоэпилептическими препаратами). С другой стороны, на рецепторы ГАМК также можно воздействовать путем снижения уровня Cl. − клеточный приток с эффектом конвульсантов, таких как пикротоксин . Антагонистический механизм действия этого соединения не направлен непосредственно на рецептор ГАМК, но существуют и другие соединения, способные к аллостерической инактивации, включая Т-бутилбициклофоротионат (ТБПС) и пентилентетразол (ЦТ). По сравнению с ГАМК А , рецепторы ГАМК С обладают более высоким сродством к ГАМК, их активность, вероятно, будет более продолжительной, и их ответы, вероятно, будут вызваны более низкими концентрациями ГАМК. [1]
Глутаматные рецепторы
[ редактировать ]Ионотропные рецепторы глутамата могут включать NMDA , AMPA и каинатные рецепторы . Эти рецепторы названы в честь агонистов, которые способствуют активности глутамата. Рецепторы NMDA известны своими возбуждающими механизмами, влияющими на пластичность нейронов при обучении и памяти, а также на нейропатологии, такие как инсульт и эпилепсия. Рецепторы NDMA имеют несколько сайтов связывания, как и ионотропные рецепторы ГАМК, и на них могут влиять коагонисты, такие как глицин нейротрансмиттер или фенциклидин (PCP). Рецепторы NMDA переносят ток Ca. 2+ ионы и могут блокироваться внеклеточным Mg 2+ ионов в зависимости от напряжения и мембранного потенциала. Это Калифорния 2+ приток увеличивается за счет возбуждающих постсинаптических потенциалов (ВПСП), продуцируемых NMDA-рецепторами, активирующих Ca 2+ сигнальные каскады (например, высвобождение нейромедиаторов). АМРА генерируют более короткие и сильные возбуждающие постсинаптические токи, чем другие ионотропные рецепторы глутамата. [5]
Никотиновые АХ-рецепторы
[ редактировать ]Никотиновые рецепторы связывают нейромедиатор ацетилхолин (АХ), создавая неселективный поток катионных каналов, который генерирует возбуждающие постсинаптические реакции. Активность рецепторов, на которую может влиять потребление никотина, вызывает чувство эйфории, расслабления и неизбежно высокую степень зависимости. [5]
Метаботропные рецепторы
[ редактировать ]
Метаботропные рецепторы — это рецепторы медленного ответа в постсинаптических клетках. Обычно эти медленные реакции характеризуются более сложными внутриклеточными изменениями биохимии. Ответы на поглощение нейромедиатора метаботропными рецепторами могут приводить к активации внутриклеточных ферментов и каскадов с участием вторичных мессенджеров, как в случае с рецепторами, связанными с G-белком . Различные метаботропные рецепторы могут включать определенные рецепторы глутамата, мускариновые рецепторы АХ, рецепторы ГАМК В и рецепторные тирозинкиназы .
Рецепторы, связанные с G-белком
[ редактировать ]Сигнальный каскад , связанный с G-белком, может значительно усиливать сигнал определенного нейромедиатора, производя в клетке от сотен до тысяч вторичных мессенджеров. Механизм действия, посредством которого рецепторы, связанные с G-белком, вызывают сигнальный каскад, заключается в следующем:
- Нейромедиатор связывается с рецептором
- Рецептор претерпевает конформационные изменения, позволяющие G-белка. связываться с комплексом
- GDP обменивается с GTP при связывании комплекса G-белка с рецептором.
- α-субъединица комплекса G-белка связывается с GTP и отделяется для связывания с белком-мишенью, таким как аденилатциклаза.
- Связывание с целевым белком либо увеличивает, либо снижает скорость вторичного мессенджера (например, циклического АМФ ). выработки
- ГТФаза гидролизует α-субъединицу, так что она связывается с GDP, а α-субъединица возвращается в комплекс G-белка в неактивном состоянии.
Высвобождение нейротрансмиттера
[ редактировать ]
Нейротрансмиттеры высвобождаются дискретными пакетами, известными как кванты, от окончания аксона одного нейрона к дендритам другого через синапс . Эти кванты были идентифицированы с помощью электронной микроскопии как синаптические пузырьки . Двумя типами везикул являются малые синаптические везикулы (SSV) диаметром около 40-60 нм и большие везикулы с плотным ядром (LDCV), электронно-плотные везикулы примерно 120-200 нм . диаметром [1] Первый происходит из эндосом и содержит нейротрансмиттеры, такие как ацетилхолин , глутамат , ГАМК и глицин . Последний происходит из аппарата Гольджи и содержит более крупные нейротрансмиттеры, такие как катехоламины и другие пептидные нейротрансмиттеры . [7] Нейромедиаторы высвобождаются из окончания аксона и связываются с постсинаптическими дендритами в следующем порядке: [5]
- Мобилизация/рекрутирование синаптических пузырьков из цитоскелета
- Стыковка пузырька (связывание) с пресинаптической мембраной
- Праймирование пузырька АТФ (относительно медленный этап)
- Слияние праймированного пузырька с пресинаптической мембраной и экзоцитоз размещенного в нем нейромедиатора.
- Поглощение нейромедиаторов рецепторами постсинаптической клетки.
- Инициирование или торможение потенциала действия в постсинаптической клетке в зависимости от того, являются ли нейротрансмиттеры возбуждающими или тормозящими (возбуждающее действие приводит к деполяризации постсинаптической мембраны)
Высвобождение нейромедиаторов зависит от кальция.
[ редактировать ]Высвобождение нейромедиаторов зависит от внешнего поступления Ca. 2+ Ионы, которые попадают в терминали аксонов через потенциалзависимые кальциевые каналы . Слияние везикул с терминальной мембраной и высвобождение нейромедиатора обусловлено генерацией Са. 2+ градиенты, вызванные поступающими потенциалами действия . Калифорния 2+ ионы вызывают мобилизацию вновь синтезированных везикул из резервного пула для слияния мембран. Этот механизм действия был обнаружен в гигантских аксонах кальмаров. [8] Снижение внутриклеточного кальция 2+ ионы оказывают прямое ингибирующее действие на высвобождение нейромедиаторов. [1] После высвобождения нейромедиатора мембраны везикул возвращаются к местам их производства. Каналы ионов кальция могут различаться в зависимости от места попадания. Например, каналы на окончаниях аксона отличаются от типичных кальциевых каналов тела клетки ( нейральной или нет). Даже на окончаниях аксонов типы кальциевых ионных каналов могут различаться, как в случае с кальциевыми каналами P-типа, расположенными в нервно-мышечных соединениях . [1]
Экспрессия нейрональных генов
[ редактировать ]Половые различия
[ редактировать ]Различия в определении пола контролируются половыми хромосомами . Выбросы половых гормонов оказывают существенное влияние на половые диморфизмы (фенотипическую дифференциацию половых признаков) мозга. Недавние исследования, по-видимому, предполагают, что регулирование этих диморфизмов имеет значение для понимания нормальной и аномальной функции мозга. На половой диморфизм может существенно влиять экспрессия генов мозга в зависимости от пола, которая варьируется от вида к виду.
Животные модели, такие как грызуны, Drosophila melanogaster и Caenorhabditis elegans , использовались для наблюдения за происхождением и/или степенью половой предвзятости в мозге по сравнению с гормонопроизводящими гонадами животного. На грызунах исследования по генетической манипуляции половыми хромосомами привели к эффекту у одного пола, совершенно противоположному эффекту у другого пола. Например, нокаут определенного гена приводил к тревожным эффектам только у мужчин. В ходе исследований на D. menlanogaster было обнаружено, что значительная предвзятость экспрессии в мозге в отношении пола произошла даже после удаления гонад, что позволяет предположить, что в некоторых аспектах половая предвзятость может быть независимой от гормонального контроля. [9]
Наблюдение за генами, связанными с полом, может иметь клиническое значение для наблюдения за физиологией мозга и потенциально связано с (прямо или косвенно) неврологическими расстройствами. Примеры заболевания с половыми отклонениями в развитии включают болезнь Хантингтона , церебральную ишемию и болезнь Альцгеймера . [9]
Эпигенетика головного мозга
[ редактировать ]На многие функции мозга можно влиять на клеточном и молекулярном уровне за счет вариаций и изменений экспрессии генов без изменения последовательности ДНК в организме. Это иначе известно как эпигенетическая регуляция. Примеры эпигенетических механизмов включают модификации гистонов и метилирование ДНК . Было обнаружено, что такие изменения сильно влияют на частоту заболеваний головного мозга, психических заболеваний и зависимостей. [10] Было показано, что эпигенетический контроль участвует в высоком уровне пластичности на раннем этапе развития, тем самым определяя его важность в критический период существования организма. [11] Примеры того, как эпигенетические изменения могут повлиять на мозг человека:
- Более высокие уровни метилирования генов рРНК в гиппокампе головного мозга приводят к снижению выработки белков и, таким образом, ограниченная функция гиппокампа может привести к ухудшению обучения и памяти и, как следствие, к суицидальным тенденциям. [12]
- В исследовании, сравнивающем генетические различия между здоровыми людьми и психиатрическими пациентами, было обнаружено 60 различных эпигенетических маркеров, связанных с передачей сигналов клетками головного мозга. [12]
- Факторы окружающей среды, такие как жестокое обращение с детьми, по-видимому, вызывают экспрессию эпигенетической метки на глюкокортикоидных рецепторах (связанной с реакциями на стресс), которая не была обнаружена у жертв самоубийства. [12] Это пример пластичности, зависящей от опыта.
- Обогащение окружающей среды у людей связано с увеличением ацетилирования гистонов генов гиппокампа и, таким образом, с улучшением консолидации памяти (особенно пространственной памяти ). [11]
Молекулярные механизмы нейродегенеративных заболеваний
[ редактировать ]Эксайтотоксичность и глутаматные рецепторы
[ редактировать ]Эксайтотоксичность – это явление, при котором рецепторы глутамата активируются ненадлежащим образом. Это может быть вызвано длительной возбуждающей синаптической передачей, при которой высокие уровни нейромедиатора глутамата вызывают чрезмерную активацию постсинаптического нейрона, что может привести к гибели постсинаптического нейрона. после травмы головного мозга (например, в результате ишемии Было обнаружено, что ) эксайтотоксичность является важной причиной повреждения нейронов. Это можно понять в случае, когда внезапная перфузия крови после снижения притока крови к мозгу может привести к избыточной синаптической активности, вызванной наличием повышенного содержания глутамата и аспартата в период ишемии. [5] [13]
болезнь Альцгеймера
[ редактировать ]Болезнь Альцгеймера — наиболее распространенное нейродегенеративное заболевание и наиболее распространенная форма деменции у пожилых людей. Расстройство характеризуется прогрессирующей потерей памяти и различных когнитивных функций. Предполагается , что отложение пептида β-амилоида (40-42 аминокислотных остатка) в мозге является неотъемлемой частью заболеваемости болезнью Альцгеймера. Предполагается, что накопление блокирует гиппокампа долговременную потенциацию . Также возможно, что рецептором олигомеров β-амилоида может быть прионный белок. [14]
болезнь Паркинсона
[ редактировать ]Болезнь Паркинсона является вторым по распространенности нейродегенеративным заболеванием после болезни Альцгеймера. Это заболевание базальных ганглиев с гипокинетическими движениями, вызванное потерей дофаминергических нейронов в черной субстанции головного мозга человека. Таким образом, тормозной отток базальных ганглиев не уменьшается, и поэтому верхние мотонейроны , опосредованные таламусом , не активируются своевременно. Конкретные симптомы включают ригидность, проблемы с осанкой, замедленные движения и тремор. Блокирование входа рецептора ГАМК от средних шипистых нейронов к ретикулатным клеткам вызывает торможение верхних мотонейронов, подобное торможению, которое происходит при болезни Паркинсона. [5]
болезнь Хантингтона
[ редактировать ]Болезнь Хантингтона с гиперкинетическими движениями, — это заболевание базальных ганглиев вызванное отсутствием нормальных тормозных импульсов от средних шипистых нейронов базальных ганглиев. Это приводит к противоположным эффектам, связанным с болезнью Паркинсона, включая неадекватную активацию верхних мотонейронов . Как и в случае с ГАМКергическими механизмами, наблюдаемыми при болезни Паркинсона, агонист ГАМК, введенный в сетчатую часть черной субстанции, уменьшает торможение верхних мотонейронов, что приводит к баллистическим непроизвольным двигательным движениям, сходным с симптомами болезни Хантингтона. [5]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л Лонгстафф, Алан; Ревест, Патрисия (1998). Молекулярная нейронаука . Гирляндная наука. ISBN 978-1859962503 .
- ^ «Что такое нейротрансмиттеры?» . Архивировано из оригинала 25 сентября 2019 года . Проверено 1 ноября 2013 г.
- ^ Риддл, Дональд (1998). К. Элеганс II . Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. ISBN 978-0879695323 .
- ^ Ходжкин, Аллан Л.; Эндрю Ф. Хаксли (1952). «Двойное влияние мембранного потенциала на натриевую проводимость в гигантском аксоне Лолиго» . Журнал физиологии . 116 (4): 497–506. doi : 10.1113/jphysicalol.1952.sp004719 . ПМЦ 1392212 . ПМИД 14946715 .
- ^ Jump up to: а б с д и ж г час Первс, Дейл (2012). Нейронаука (5-е изд.). Массачусетс, США: Sinauer Associates, Inc., с. 80. ИСБН 978-0-87893-695-3 .
- ^ Камб, Александр; Линда Э. Айверсон; Марк А. Тануйе (31 июля 1987 г.). «Молекулярная характеристика шейкера, гена дрозофилы, кодирующего калиевый канал». Клетка . 50 (3): 405–413. дои : 10.1016/0092-8674(87)90494-6 . ПМИД 2440582 . S2CID 31247228 .
- ^ Дэвис, Р. Уэйн; Брайан Дж. Моррис (1997). Молекулярная биология нейрона . BIOS Scientific Publishers Ltd. Оксфорд, Великобритания: ISBN 978-1859962404 .
- ^ Диполо, Р.; К. Капуто; Ф. Безанилья (март 1983 г.). «Вольтаж-зависимый кальциевый канал в аксоне кальмара» . Proc Natl Acad Sci США . 80 (6): 1743–1745. Бибкод : 1983PNAS...80.1743D . дои : 10.1073/pnas.80.6.1743 . ПМК 393680 . ПМИД 6300873 .
- ^ Jump up to: а б Джазин, Э.; Кэхилл, Л. (январь 2010 г.). «Половые различия в молекулярной нейробиологии: от плодовых мух до человека». Обзоры природы Неврология . 11 (1): 9–17. дои : 10.1038/nrn2754 . ПМИД 20019686 . S2CID 2545405 .
- ^ «Эпигенетика и человеческий мозг» . Центр генетики и обучения при Университете Юты . Проверено 10 ноября 2013 г.
- ^ Jump up to: а б Фаджолини, Микела; Кэтрин Л. Дженсен; Фрэнсис А. Шампань (2009). «Эпигенетические влияния на развитие и пластичность мозга» (PDF) . Современное мнение в нейробиологии . 19 (2): 1–6. дои : 10.1016/j.conb.2009.05.009 . ПМЦ 2745597 . ПМИД 19545993 . Архивировано из оригинала (PDF) 22 июня 2010 года . Проверено 14 ноября 2013 г.
- ^ Jump up to: а б с Цанкова, Надя; Рентал, Уильям; Кумар, Арвинд; Нестлер, Эрик Дж. (2007). «Эпигенетическая регуляция психических расстройств». Обзоры природы Неврология . 8 (5): 355–367. дои : 10.1038/nrn2132 . ПМИД 17453016 . S2CID 34125955 .
- ^ Лау, А.; М. Тимянски (2010). «Глутаматные рецепторы, нейротоксичность и нейродегенерация». Арка Пфлюгерса . 460 (2): 525–542. дои : 10.1007/s00424-010-0809-1 . ПМИД 20229265 . S2CID 12421120 .
- ^ Ларен, Юха; Дэвид А. Гимбел; Хокон Б. Найгаард; Джон В. Гилберт (февраль 2009 г.). «Клеточный прионный белок опосредует нарушение синаптической пластичности олигомерами β-амилоида» . Природа . 457 (7233): 1128–1132. Бибкод : 2009Natur.457.1128L . дои : 10.1038/nature07761 . ПМЦ 2748841 . ПМИД 19242475 .
