NMDA-рецептор

Рецептор N -метил- D -аспартата Ca (также известный как рецептор NMDA или NMDAR ) представляет собой рецептор глутамата и преимущественно содержит 2+ ионный канал , обнаруженный в нейронах . [ 3 ] [ 4 ] Рецептор NMDA — один из трех типов ионотропных рецепторов глутамата , два других — AMPA и каинатные рецепторы . В зависимости от субъединичного состава его лигандами являются глутамат и глицин (или D -серин ). Однако связывания лигандов обычно недостаточно для открытия канала, поскольку он может быть заблокирован Mg. 2+ ионы, которые удаляются только тогда, когда нейрон достаточно деполяризован. Таким образом, канал действует как «детектор совпадений», и только при выполнении обоих этих условий канал открывается и позволяет положительно заряженным ионам (катионам) проходить через клеточную мембрану . [ 5 ] Считается, что рецептор NMDA очень важен для контроля синаптической пластичности и реализации функций обучения и памяти . [ 6 ]
Рецептор NMDA является ионотропным , то есть представляет собой белок, который позволяет ионам проходить через клеточную мембрану. [ 7 ] Рецептор NMDA назван так потому, что -агонист молекула N -метил- D -аспартат (NMDA) избирательно связывается с ним, а не с другими глутаматными рецепторами . Активация NMDA-рецепторов приводит к открытию ионного канала, неселективного по отношению к катионам , с комбинированным реверсивным потенциалом около 0 мВ. Хотя открытие и закрытие ионного канала в первую очередь регулируется связыванием лиганда, ток через ионный канал зависит от напряжения. Внеклеточный магний (Mg 2+ ) и цинк (Zn 2+ ) ионы могут связывать и препятствовать прохождению других катионов через открытый ионный канал. Зависимый от напряжения поток преимущественно кальция (Ca 2+ ), sodium (Na + ) и калий (K + ) ионов в клетку и из клетки становится возможным благодаря деполяризации клетки, которая вытесняет и отталкивает Mg 2+ и цинк 2+ ионы из поры. [ 8 ] [ 9 ] [ 10 ] [ 11 ] Что 2+ Считается, что поток через NMDA-рецепторы, в частности, имеет решающее значение для синаптической пластичности, клеточного механизма обучения и памяти, благодаря белкам, которые связываются с Ca и активируются им. 2+ ионы.
Активность рецептора NMDA блокируется многими психоактивными препаратами, такими как фенциклидин (PCP), алкоголь ( этанол ) и декстрометорфан (DXM). Анестезирующее обезболивающее и действие препаратов кетамина и закиси азота также частично обусловлено их действием на блокирование активности рецепторов NMDA. Напротив, чрезмерная активация NMDAR агонистами NMDA увеличивает цитозольные концентрации кальция и цинка , что значительно способствует нейронов гибели , эффект, который, как известно, предотвращается каннабиноидами , опосредованный активацией рецептора 1 , CB что заставляет белок HINT1 противодействовать токсические эффекты NMDAR-опосредованного производства NO и высвобождения цинка. [ 12 ] Помимо предотвращения метамфетамином, вызванной нейротоксичности, посредством ингибирования экспрессии синтазы оксида азота (nNOS) и активации астроцитов , он, как видно, уменьшает повреждение головного мозга, вызванное метамфетамином, посредством CB1-зависимых и независимых механизмов, соответственно, а ингибирование вызванного метамфетамином астроглиоза , вероятно, происходят через CB 2 механизм, зависимый от рецептора для ТГК . [ 13 ] С 1989 года мемантин признан неконкурентным антагонистом рецептора NMDA, попадая в канал рецептора после его активации и тем самым блокируя поток ионов. [ 14 ] [ 15 ] [ 16 ]
Гиперактивация рецептора, вызывающая чрезмерный приток Ca 2+ может привести к эксайтотоксичности , которая, как предполагается, связана с некоторыми нейродегенеративными расстройствами. Таким образом, блокирование рецепторов NMDA теоретически может быть полезно при лечении таких заболеваний. [ 16 ] [ 17 ] [ 18 ] [ 19 ] Однако гипофункция NMDA-рецепторов (из-за дефицита глутатиона или по другим причинам) может быть связана с нарушением синаптической пластичности. [ 20 ] и может иметь другие негативные последствия. Основная проблема использования антагонистов рецепторов NMDA для нейропротекции заключается в том, что физиологические действия рецептора NMDA необходимы для нормальной функции нейронов. Чтобы быть клинически полезными, антагонисты NMDA должны блокировать чрезмерную активацию, не нарушая нормальных функций. Мемантин обладает этим свойством. [ 21 ]
История
[ редактировать ]За открытием NMDA-рецепторов последовал синтез и исследование N -метил- D -аспарагиновой кислоты (NMDA) в 1960-х годах Джеффом Уоткинсом и его коллегами. В начале 1980-х годов было показано, что NMDA-рецепторы участвуют в нескольких центральных синаптических путях. [ 22 ] [ 23 ] Селективность субъединиц рецепторов была открыта в начале 1990-х годов, что привело к открытию нового класса соединений, избирательно ингибирующих субъединицу NR2B . Эти открытия привели к энергичной кампании в фармацевтической промышленности. [ 11 ] На основании этого считалось, что рецепторы NMDA связаны с различными неврологическими расстройствами, такими как эпилепсия , болезнь Паркинсона , болезнь Альцгеймера , болезнь Хантингтона и другие расстройства ЦНС. [ 8 ]
и его коллеги обнаружили В 2002 году Хилмар Бадинг , что клеточные последствия стимуляции рецептора NMDA зависят от местоположения рецептора на поверхности нейрональных клеток. [ 24 ] [ 25 ] Синаптические NMDA-рецепторы способствуют экспрессии генов, событиям, связанным с пластичностью, и приобретенной нейропротекции . Внесинаптические рецепторы NMDA способствуют передаче сигналов смерти; они вызывают отключение транскрипции, митохондриальную дисфункцию и структурный распад. [ 24 ] [ 25 ] Эта патологическая триада внесинаптической передачи сигналов рецептора NMDA представляет собой общую точку конверсии в этиологии нескольких острых и хронических нейродегенеративных состояний. [ 26 ] Молекулярная основа передачи сигналов токсичных внесинаптических рецепторов NMDA была открыта Хилмаром Бадингом и его коллегами в 2020 году. [ 27 ] Внесинаптические NMDA-рецепторы образуют сигнальный комплекс смерти с TRPM4. Ингибиторы интерфейса взаимодействия NMDAR/TRPM4 (также известные как ингибиторы интерфейса) разрушают комплекс NMDAR/TRPM4 и детоксицируют экстрасинаптические рецепторы NMDA. [ 27 ]
Случайное открытие было сделано в 1968 году, когда женщина, принимавшая амантадин в качестве лекарства от гриппа, испытала значительную ремиссию симптомов болезни Паркинсона. Это открытие, о котором сообщили Скаваб и др., положило начало медицинской химии производных адамантана в контексте заболеваний, поражающих ЦНС. [ 28 ] До этого открытия мемантин, еще одно производное адамантана, был синтезирован компанией Eli Lilly and Company в 1963 году. Целью была разработка гипогликемического препарата, но он не показал такой эффективности . Лишь в 1972 году была открыта возможная терапевтическая значимость мемантина для лечения нейродегенеративных заболеваний. С 1989 года мемантин признан неконкурентным антагонистом рецептора NMDA. [ 15 ]
Структура
[ редактировать ]
Функциональные NMDA-рецепторы представляют собой гетеротетрамеры, содержащие различные комбинации субъединиц GluN1, GluN2 (AD) и GluN3 (AB), происходящих из разных семейств генов ( Grin1 - Grin3 ). Все NMDAR содержат две обязательные субъединицы GluN1, которые при сборке с субъединицами GluN2 того же типа дают канонические дигетеромерные ( d- ) NMDAR (например, GluN1-2A-1-2A). Тригетеромерные NMDAR, напротив, содержат три различных типа субъединиц (например, GluN1-2A-1-2B) и включают рецепторы, состоящие из одной или нескольких субъединиц каждого из трех семейств генов, обозначенных t -NMDAR (например, ГлуН1-2А-3А-2А). [ 29 ] Существует один ген GluN1, четыре GluN2 и два гена, кодирующих субъединицу GluN3, и каждый ген может производить более одного варианта сплайсинга.
- GluN1 – GRIN1
- ГлюН2
- ГлюН3
ворота
[ редактировать ]
Рецептор NMDA представляет собой белковый рецептор глутамата и ионного канала , который активируется, когда глицин и глутамат. с ним связываются [ 5 ] Рецептор представляет собой очень сложный и динамичный гетеромерный белок, который взаимодействует со множеством внутриклеточных белков через три отдельные субъединицы, а именно GluN1, GluN2 и GluN3. Субъединица GluN1, кодируемая геном GRIN1, благодаря альтернативному сплайсингу имеет восемь различных изоформ. С другой стороны, субъединица GluN2, имеющая четыре различных типа (AD), а также субъединица GluN3, имеющая два типа (A и B), каждая кодируется шестью отдельными генами. Эта сложная молекулярная структура и генетическое разнообразие позволяют рецептору выполнять широкий спектр физиологических функций в нервной системе . [ 30 ] [ 31 ] Все субъединицы имеют общую топологию мембраны, в которой преобладает большой внеклеточный N-конец, область мембраны, состоящая из трех трансмембранных сегментов, возвратная поровая петля, внеклеточная петля между трансмембранными сегментами, которые структурно недостаточно изучены, и внутриклеточные С-концы, которые различаются по размеру в зависимости от субъединицы и обеспечивают множество сайтов взаимодействия со многими внутриклеточными белками. [ 30 ] [ 32 ] На рисунке 1 показана базовая структура субъединиц GluN1/GluN2, которая образует сайт связывания мемантина, Mg. 2+ и кетамин .

мг 2+ блокирует канал рецептора NMDA в зависимости от напряжения. Каналы также обладают высокой проницаемостью для Ca. 2+ . Активация рецептора зависит от связывания глутамата, связывания D -серина или глицина в его сайте связывания, связанного с GluN1, и рецептором AMPA опосредованной деполяризации постсинаптической мембраны, которая снимает потенциалзависимую блокировку каналов магнием. 2+ . Таким образом, активация и открытие рецепторного канала обеспечивает поток K + , уже + и Ca 2+ ионы и приток Ca 2+ запускает внутриклеточные сигнальные пути. [ 14 ] [ 33 ] Сайты связывания аллостерических рецепторов цинка, белков и полиаминов спермидина и спермина также являются модуляторами каналов рецепторов NMDA. [ 34 ]
Субъединица GluN2B участвует в модуляции активности, такой как обучение, память, обработка информации и пищевое поведение, а также участвует в ряде человеческих расстройств. Основная структура и функции, связанные с рецептором NMDA, могут быть отнесены к субъединице GluN2B. Например, сайт связывания глутамата и контроль Mg 2+ блок образован субъединицей GluN2B. Сайты с высоким сродством к антагонисту глицина также обнаруживаются исключительно рецептором GluN1/GluN2B. [ 31 ]
Трансмембранные сегменты GluN1/GluN2B считаются частью рецептора, которая образует карманы связывания для неконкурентных антагонистов рецепторов NMDA, но структуры трансмембранных сегментов, как указано выше, полностью не известны. Утверждается, что три сайта связывания внутри рецептора: A644 на субъединице GluNB и A645 и N616 на субъединице GluN1, важны для связывания мемантина и родственных соединений, как показано на рисунке 2. [ 32 ]
Рецептор NMDA образует гетеротетрамер между двумя субъединицами GluN1 и двумя субъединицами GluN2 (субъединицы ранее обозначались как GluN1 и GluN2), двумя обязательными субъединицами GluN1 и двумя регионально локализованными субъединицами GluN2. Родственное семейство генов субъединиц A и B GluN3 оказывает ингибирующее действие на активность рецепторов. Множественные изоформы рецепторов с различным распределением в мозге и функциональными свойствами возникают в результате селективного сплайсинга транскриптов GluN1 и дифференциальной экспрессии субъединиц GluN2.
Каждая субъединица рецептора имеет модульную конструкцию и каждый структурный модуль также представляет собой функциональную единицу:
- Внеклеточный домен лиганд содержит две глобулярные структуры: модуляторный домен и - связывающий домен. Субъединицы GluN1 связывают коагонист глицин, а субъединицы GluN2 связывают нейромедиатор глутамат. [ 1 ] [ 2 ]
- Модуль связывания агониста связан с мембранным доменом, который состоит из трех трансмембранных сегментов и возвратной петли, напоминающей селективный фильтр калиевых каналов .
- Мембранный домен рецептора вносит остатки в поры канала и отвечает за высокую унитарную проводимость , высокую проницаемость для кальция и зависимый от напряжения блок магния.
- Каждая субъединица имеет обширный цитоплазматический домен , который содержит остатки, которые могут быть непосредственно модифицированы рядом протеинкиназ и протеинфосфатаз , а также остатки, которые взаимодействуют с большим количеством структурных, адапторных и каркасных белков.
Глицин-связывающие модули субъединиц GluN1 и GluN3 и глутамат-связывающий модуль субъединицы GluN2A были выражены в виде растворимых белков, а их трехмерная структура была решена с атомным разрешением с помощью рентгеновской кристаллографии . Это выявило общую складку со связывающими аминокислоты бактериальными белками и с глутаматсвязывающим модулем АМРА-рецепторов и каинатных рецепторов.
Механизм действия
[ редактировать ]NMDA-рецепторы играют важную роль в развитии центральной нервной системы. Процессы обучения, памяти и нейропластичности зависят от механизма NMDA-рецепторов. NMDA-рецепторы представляют собой катионные каналы, управляемые глутаматом, которые позволяют увеличить проницаемость кальция . Активация каналов NMDA-рецепторов происходит в результате связывания двух коагонистов глицина и глутамата .
Гиперактивация рецепторов NMDA, вызывающая чрезмерный приток Ca 2+ может привести к эксайтотоксичности. Предполагается, что эксайтотоксичность связана с некоторыми нейродегенеративными расстройствами, такими как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. [ 16 ] [ 17 ] [ 18 ] [ 19 ] Таким образом, блокирование рецепторов NMDA теоретически может быть полезно при лечении таких заболеваний. [ 16 ] [ 17 ] [ 18 ] Однако важно сохранить физиологическую активность NMDA-рецептора, одновременно пытаясь блокировать его чрезмерную эксайтотоксическую активность. Возможно, этого можно достичь с помощью неконкурентных антагонистов, блокирующих ионный канал рецептора, когда он чрезмерно открыт. [ 18 ]
Неконкурентные антагонисты рецептора NMDA, или блокаторы каналов, попадают в канал рецептора NMDA после его активации и тем самым блокируют поток ионов. [ 14 ] [ 16 ] МК-801 , кетамин , амантадин и мемантин являются примерами таких антагонистов. [ 14 ] см. рисунок 1. Скорость отключения антагониста из рецепторного канала является важным фактором, поскольку слишком медленная скорость отключения может мешать нормальной функции рецептора, а слишком быстрая скорость отключения может привести к неэффективной блокаде чрезмерно открытого рецептора. [ 18 ]
Мемантин является примером неконкурентного блокатора каналов рецептора NMDA с относительно быстрым действием и низким сродством. При физиологическом pH его аминогруппа заряжена положительно, а ее антагонизм к рецепторам зависит от напряжения. [ 18 ] Таким образом, он имитирует физиологическую функцию Mg. 2+ как блокировщик каналов. [ 15 ] Мемантин блокирует каналы, связанные с NMDA-рецептором, только во время длительной активации рецептора, как это происходит в эксайтотоксических условиях, путем замены магния в месте связывания. При нормальной активности рецепторов каналы остаются открытыми только в течение нескольких миллисекунд, и в этих обстоятельствах мемантин не может связываться внутри каналов и, следовательно, не мешает нормальной синаптической активности. [ 21 ]
Варианты
[ редактировать ]ГлюН1
[ редактировать ]Существует восемь вариантов субъединицы GluN1, получаемых путем альтернативного сплайсинга GRIN1 : [ 35 ]
- GluN1-1a, GluN1-1b; GluN1-1a является наиболее широко экспрессируемой формой.
- ГлуН1-2а, ГлуН1-2b;
- GluN1-3a, GluN1-3b;
- GluN1-4a, GluN1-4b;
ГлюН2
[ редактировать ]
обнаружена одна субъединица GluN2 Хотя у беспозвоночных организмов экспрессируются четыре различные изоформы субъединицы GluN2 , у позвоночных , которые обозначаются номенклатурой от GluN2A до GluN2D (кодируются GRIN2A , GRIN2B , GRIN2C , GRIN2D ). Убедительные доказательства показывают, что гены, кодирующие субъединицы GluN2 у позвоночных, претерпели как минимум два раунда генной дупликации . [ 36 ] Они содержат сайт связывания глутамата . Что еще более важно, каждая субъединица GluN2 имеет отдельный внутриклеточный С-концевой домен, который может взаимодействовать с разными наборами сигнальных молекул. [ 37 ] В отличие от субъединиц GluN1, субъединицы GluN2 экспрессируются по-разному в разных типах клеток и в разные моменты развития и контролируют электрофизиологические свойства рецептора NMDA. В классических схемах GluN2B в основном присутствует в незрелых нейронах и во внесинаптических местах, таких как конусы роста . [ 38 ] и содержит сайт связывания селективного ингибитора ифенпродил . [ 39 ] Однако в пирамидальных клеток синапсах недавно развившейся дорсолатеральной префронтальной коры приматов GluN2B находится исключительно в пределах постсинаптической плотности и опосредует высшие когнитивные операции, такие как рабочая память . [ 40 ] Это согласуется с расширением действия и экспрессии GluN2B по всей кортикальной иерархии у обезьян. [ 41 ] и люди [ 42 ] и в приматов коры головного мозга эволюции . [ 43 ]
Переключатель GluN2B на GluN2A
[ редактировать ]
Хотя GluN2B преобладает в раннем постнатальном мозге, количество субъединиц GluN2A увеличивается во время раннего развития; со временем субъединиц GluN2A становится больше, чем GluN2B. Это называется переключением развития GluN2B-GluN2A, и оно примечательно разной кинетикой, которую каждая субъединица GluN2 вносит в функцию рецептора. [ 45 ] Например, большее соотношение субъединицы GluN2B приводит к тому, что рецепторы NMDA остаются открытыми дольше по сравнению с рецепторами с большим количеством GluN2A. [ 46 ] Частично это может объяснить более высокие способности памяти в ближайшем послеродовом периоде по сравнению с поздним возрастом, что является принципом генетически измененных « мышей-дуги ». Подробный временной ход этого переключения в мозжечке человека был оценен с использованием экспрессионного микрочипа и секвенирования РНК и показан на рисунке справа.
Существует три гипотетические модели, описывающие этот механизм переключения:
- Увеличение синаптического GluN2A наряду со снижением GluN2B
- Внесинаптическое вытеснение GluN2B из синапса с увеличением GluN2A.
- Увеличение количества GluN2A при разбавлении количества GluN2B без уменьшения последнего.
Субъединицы GluN2B и GluN2A также играют различную роль в обеспечении эксайтотоксической гибели нейронов. [ 47 ] Считается, что изменение в составе субъединиц в процессе развития объясняет изменения нейротоксичности NMDA в процессе развития. [ 48 ] Гомозиготное нарушение гена GluN2B у мышей вызывает перинатальную летальность , тогда как нарушение гена GluN2A приводит к жизнеспособным мышам, хотя и с нарушенной пластичностью гиппокампа. [ 49 ] Одно исследование предполагает, что рилин может играть роль в созревании рецептора NMDA за счет увеличения подвижности субъединицы GluN2B. [ 50 ]
Переключатель GluN2B на GluN2C
[ редактировать ]Предшественники гранулярных клеток (GCP) мозжечка после симметричного деления клеток. [ 51 ] во внешнем слое гранулярных клеток (EGL) мигрируют во внутренний слой гранулярных клеток (IGL), где они подавляют GluN2B и активируют GluN2C, процесс, который не зависит от передачи сигналов нейрегулина бета через рецепторы ErbB2 и ErbB4. [ 52 ]
Роль в эксайтотоксичности
[ редактировать ]Ряд исследований показал, что NMDA-рецепторы тесно связаны с эксайтотоксичностью . [ 53 ] [ 54 ] [ 55 ] Поскольку NMDA-рецепторы играют важную роль в здоровье и функционировании нейронов , было много дискуссий о том, как эти рецепторы могут влиять как на выживание клеток, так и на их гибель. [ 56 ] Недавние данные подтверждают гипотезу о том, что чрезмерная стимуляция экстрасинаптических NMDA-рецепторов больше связана с эксайтотоксичностью, чем со стимуляцией их синаптических аналогов. [ 53 ] [ 24 ] Кроме того, хотя стимуляция экстрасинаптических NMDA-рецепторов, по-видимому, способствует гибели клеток, есть данные, позволяющие предположить, что стимуляция синаптических NMDA-рецепторов способствует здоровью и долговечности клетки. Существует множество доказательств в поддержку двойственной природы рецепторов NMDA в зависимости от местоположения, а гипотеза, объясняющая два различных механизма, известна как «гипотеза локализации». [ 53 ] [ 56 ]
Различные каскадные пути
[ редактировать ]Чтобы поддержать гипотезу локализации, было бы необходимо показать, что различные клеточные сигнальные пути активируются рецепторами NMDA в зависимости от их местоположения внутри клеточной мембраны. [ 53 ] Были разработаны эксперименты для стимуляции исключительно синаптических или несинаптических NMDA-рецепторов. Эксперименты такого типа показали, что в зависимости от места происхождения сигнала активируются или регулируются разные пути. [ 57 ] Многие из этих путей используют одни и те же белковые сигналы , но регулируются NMDAR по-разному в зависимости от их местоположения. Например, синаптическое возбуждение NMDA вызывало снижение внутриклеточной концентрации митоген-активируемой протеинкиназы р38 ( p38MAPK ). Внесинаптическая стимуляция NMDAR регулирует p38MAPK противоположным образом, вызывая увеличение внутриклеточной концентрации. [ 58 ] [ 59 ] С тех пор эксперименты этого типа были повторены, и результаты показали, что эти различия распространяются на многие пути, связанные с выживанием клеток и эксайтотоксичностью. [ 53 ]
Два специфических белка были идентифицированы как основной путь, ответственный за эти различные клеточные ответы: ERK1/2 и Jacob. [ 53 ] ERK1/2 отвечает за фосфорилирование Jacob при возбуждении синаптическими NMDAR. Эта информация затем переносится в ядро . Фосфорилирование Джейкоба не происходит при внесинаптической стимуляции NMDA. Это позволяет факторам транскрипции в ядре реагировать по-разному в зависимости от состояния фосфорилирования Джейкоба. [ 60 ]
Нейронная пластичность
[ редактировать ]Рецепторы NMDA (NMDAR) критически влияют на индукцию синаптической пластичности. NMDAR вызывают как долговременную потенциацию (LTP), так и долговременную депрессию (LTD) посредством быстрой синаптической передачи. [ 61 ] Экспериментальные данные свидетельствуют о том, что внесинаптические NMDA-рецепторы ингибируют LTP, одновременно производя LTD. [ 62 ] Ингибирование LTP можно предотвратить введением антагониста NMDA . [ 53 ] Стимуляция тета-всплеска , которая обычно вызывает LTP с помощью синаптических NMDAR, при избирательном применении к внесинаптическим NMDAR вызывает LTD. [ 63 ] Эксперименты также показывают, что для образования LTP не требуется внесинаптическая активность. Кроме того, в экспрессии полной LTD участвует как синаптическая, так и внесинаптическая активность. [ 64 ]
Роль различных субъединиц
[ редактировать ]Еще одним фактором, который, по-видимому, влияет на токсичность, вызванную NMDAR, является наблюдаемое изменение состава субъединиц . Рецепторы NMDA представляют собой гетеротетрамеры с двумя субъединицами GluN1 и двумя вариабельными субъединицами. [ 53 ] [ 65 ] Было показано, что две из этих вариабельных субъединиц, GluN2A и GluN2B, преимущественно приводят к каскадам выживания и гибели клеток соответственно. Хотя обе субъединицы обнаружены в синаптических и экстрасинаптических NMDAR, есть некоторые свидетельства того, что субъединица GluN2B чаще встречается во внесинаптических рецепторах. Это наблюдение может помочь объяснить двойственную роль, которую NMDA-рецепторы играют в эксайтотоксичности. [ 66 ] [ 67 ] Рецепторы t-NMDA участвуют в эксайтотоксичности, опосредованной гибелью нейронов при височной эпилепсии . [ 68 ]
Несмотря на убедительные доказательства и относительную простоту этих двух теорий, работающих в тандеме, до сих пор существуют разногласия по поводу значимости этих утверждений. Некоторые проблемы в доказательстве этих теорий возникают из-за сложности использования фармакологических средств для определения подтипов конкретных NMDAR. [ 53 ] [ 69 ] Кроме того, теория вариаций субъединиц не объясняет, почему этот эффект может преобладать, поскольку широко распространено мнение, что наиболее распространенный тетрамер, состоящий из двух субъединиц GluN1 и по одному из каждой субъединицы GluN2A и GluN2B, составляет высокий процент NMDAR. . [ 53 ] Субъединичный состав t -NMDA-рецепторов недавно был обнаружен в тканях головного мозга. [ 70 ]
Эксайтотоксичность в клинических условиях
[ редактировать ]считалось, что эксайтотоксичность играет роль в дегенеративных свойствах нейродегенеративных состояний. С конца 1950-х годов [ 71 ] Рецепторы NMDA, по-видимому, играют важную роль во многих из этих дегенеративных заболеваний, поражающих мозг. В частности, эксайтотоксические явления, связанные с NMDA-рецепторами, связаны с болезнью Альцгеймера и болезнью Хантингтона, а также с другими заболеваниями, такими как инсульты и эпилепсия. [ 53 ] [ 72 ] Однако лечение этих состояний одним из многих известных антагонистов рецепторов NMDA приводит к множеству нежелательных побочных эффектов, некоторые из которых могут быть серьезными. Эти побочные эффекты частично наблюдаются потому, что рецепторы NMDA не только сигнализируют о гибели клеток, но и играют важную роль в их жизнеспособности. [ 56 ] Лечение этих состояний можно найти в блокировании рецепторов NMDA, которых нет в синапсе. [ 53 ] [ 25 ] Один класс эксайтотоксичности при заболевании включает мутации усиления функции в GRIN2B и GRIN1, связанные с кортикальными пороками развития, такими как полимикрогирия . [ 73 ] D-серин, антагонист/обратный коагонист t Было показано, что -NMDA-рецепторов, который вырабатывается в головном мозге, смягчает потерю нейронов на животной модели височной эпилепсии . [ 68 ]
Лиганды
[ редактировать ]Агонисты
[ редактировать ]
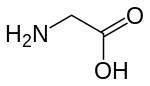
Активация рецепторов NMDA требует связывания глутамата или аспартата (аспартат не так сильно стимулирует рецепторы). [ 74 ] Кроме того, NMDAR также требуют связывания коагониста глицина для эффективного открытия ионного канала, который является частью этого рецептора.
Также было обнаружено, что D -серин коагонизирует рецептор NMDA с еще большей эффективностью, чем глицин. [ 75 ] Он вырабатывается серинрацемазой и обогащен в тех же областях, что и NMDA-рецепторы. Удаление D -серина может блокировать NMDA-опосредованную возбуждающую нейротрансмиссию во многих областях. Недавно было показано, что D -серин может высвобождаться как нейронами, так и астроцитами для регулирования NMDA-рецепторов. Обратите внимание, что D-серин также действует как антагонист/обратный коагонист t -NMDA-рецепторов. [ 76 ] [ 68 ]
Токи, опосредованные NMDA-рецептором (NMDAR), напрямую связаны с деполяризацией мембраны. Таким образом, агонисты NMDA демонстрируют быстрый Mg. 2+ кинетика развязывания, увеличение вероятности открытия канала с деполяризацией. Это свойство имеет фундаментальное значение для роли рецептора NMDA в памяти и обучении , и было высказано предположение, что этот канал является биохимическим субстратом Хеббианского обучения , где он может действовать как детектор совпадений для деполяризации мембраны и синаптической передачи.
Примеры
[ редактировать ]Некоторые известные агонисты рецепторов NMDA включают:
- Аминокислоты и производные аминокислот
- Аспарагиновая кислота (аспартат) ( D -аспарагиновая кислота , L -аспарагиновая кислота ) – эндогенный агонист глутаматного сайта. Слово N -метил- D -аспартат (NMDA) частично происходит от слова D -аспартат.
- Глутаминовая кислота (глутамат) – агонист эндогенного глутаматного участка.
- Тетразолилглицин - синтетический агонист глутаматного сайта.
- Гомоцистеиновая кислота - агонист эндогенного глутаматного сайта.
- Иботеновая кислота - природный агонист глутаматного сайта, обнаруженный в Amanita muscaria.
- Хинолиновая кислота (хинолинат) – агонист эндогенного глутаматного участка.
- Глицин - эндогенный агонист глицинового сайта.
- Положительные аллостерические модуляторы
- Церебростерин – эндогенный слабоположительный аллостерический модулятор.
- Холестерин – эндогенный слабоположительный аллостерический модулятор.
- Дегидроэпиандростерон (ДГЭА) – эндогенный слабоположительный аллостерический модулятор.
- Дегидроэпиандростерона сульфат (ДГЭА-С) – эндогенный слабоположительный аллостерический модулятор.
- Небостинел (небогламин) – синтетический положительный аллостерический модулятор глицинового сайта.
- Прегненолона сульфат – эндогенный слабоположительный аллостерический модулятор.
- Полиамины
Нерамексан
[ редактировать ]
Примером производного мемантина является нерамексан , который был открыт путем изучения ряда аминоалкилциклогексанов с мемантином в качестве матрицы в качестве антагонистов рецептора NMDA. Нерамексан связывается с тем же сайтом, что и мемантин, в канале, связанном с рецептором NMDA, и с сопоставимым сродством. Он также демонстрирует очень схожую биодоступность и кинетику блокирования in vivo с мемантином. Нерамексан прошел клинические испытания по четырем показаниям, включая болезнь Альцгеймера. [ 28 ]
Частичные агонисты
[ редактировать ]
N -Метил- D -аспарагиновая кислота (NMDA), в честь которой был назван рецептор NMDA, является частичным агонистом активного сайта узнавания глутамата.
3,5-Дибром- L -фенилаланин, встречающееся в природе галогенированное производное L- фенилаланина , является слабым частичным агонистом рецептора NMDA, действующим на глициновый сайт. [ 77 ] 3,5-Дибром- L -фенилаланин был предложен в качестве нового потенциального терапевтического препарата для лечения нервно-психических расстройств и заболеваний, таких как шизофрения , [ 78 ] и неврологические расстройства, такие как ишемический инсульт и эпилептические припадки . [ 79 ]
Другие частичные агонисты рецептора NMDA, действующие на новые сайты, такие как рапастинел (GLYX-13) и апимостинел (NRX-1074), в настоящее время рассматриваются для разработки новых препаратов с антидепрессивным и анальгетическим действием без явной психотомиметической активности. [ 80 ]
Примеры
[ редактировать ]- Аминоциклопропанкарбоновая кислота (АСС) - синтетический частичный агонист глицинового сайта.
- Циклосерин ( D -циклосерин ) – природный частичный агонист участка глицина, обнаруженный у Streptomyces orchidaceus.
- HA-966 - слабый частичный агонист синтетического участка глицина.
- Гомохинолиновая кислота - синтетический частичный агонист глутаматного сайта.
- N -Метил- D -аспарагиновая кислота (NMDA) – синтетический частичный агонист глутаматного сайта.
К положительным аллостерическим модуляторам относятся:
- Зелкистинел (AGN-241751) - синтетический частичный агонист нового сайта.
- Апимостинел (NRX-1074) – синтетический частичный агонист нового сайта.
- Рапастинел (GLYX-13) - синтетический частичный агонист нового сайта. [ 81 ]
Антагонисты
[ редактировать ]
Антагонисты рецептора NMDA используются в качестве анестетиков для животных, а иногда и для людей, и часто используются в качестве рекреационных наркотиков из-за их галлюциногенных свойств, а также их уникальных эффектов при повышенных дозах, таких как диссоциация . Когда определенные антагонисты рецепторов NMDA вводятся грызунам в больших дозах, они могут вызвать форму повреждения головного мозга, называемую поражениями Олни . Антагонисты рецепторов NMDA, которые, как было показано, вызывают поражения Олни, включают кетамин , фенциклидин и декстрорфан (метаболит декстрометорфана ), а также некоторые антагонисты рецепторов NMDA, используемые только в исследовательских условиях. На данный момент опубликованные исследования поражений Олни не дают окончательных результатов в отношении их возникновения в тканях мозга человека или обезьяны в отношении увеличения присутствия антагонистов рецепторов NMDA. [ 82 ]
Большинство антагонистов NMDAR являются неконкурентными или неконкурентными блокаторами пор канала или являются антагонистами центра корегуляции глицина, а не антагонистами активного/глутаматного сайта.
Примеры
[ редактировать ]Распространенные агенты, у которых антагонизм к рецептору NMDA является основным или основным механизмом действия:
- 4-Хлорокинуренин (АВ-101) – антагонист глицина; пролекарство 7-хлоркинуреновой кислоты [ 83 ] [ 84 ]
- 7-хлорокинуреновая кислота – антагонист глицина.
- Агматин - антагонист эндогенного полиаминного сайта. [ 85 ] [ 86 ]
- Аргиотоксин-636 - природный дизоцилпин или антагонист родственного сайта, обнаруженный в аргиопы. яде
- AP5 - антагонист глутаматного сайта
- AP7 - антагонист глутаматного сайта
- CGP-37849 - антагонист глутаматного сайта
- Антагонист D-серин - т - NMDA-рецепторов/обратный коагонист [ 76 ] [ 68 ]
- Делюцемин (NPS-1506) – дизоцилпин или антагонист родственного сайта; производное аргиотоксина-636 [ 87 ] [ 88 ]
- Декстрометорфан (ДХМ) – антагонист дизоцилпинового сайта; пролекарство декстрорфана
- Декстрорфан (DXO) - антагонист сайта дизоцилпина.
- Дексанабинол - антагонист сайта, связанного с дизоцилпином. [ 89 ] [ 90 ] [ 91 ]
- Диэтиловый эфир - антагонист неизвестного сайта.
- Дифенидин - антагонист сайта дизоцилпина.
- Дизоцилпин (МК-801) - антагонист сайта дизоцилпина.
- Элипродил – антагонист сайта ифенпроила.
- Эскетамин - антагонист сайта дизоцилпина.
- Ходжкинзин - неопределенный антагонист сайта
- Ифенпродил - антагонист сайта ифенпродила. [ 92 ]
- Кайтоцефалин - природный антагонист глутаматного сайта, обнаруженный в Eupenicillium shearii.
- Кетамин – антагонист сайта дизоцилпина.
- Кинуреновая кислота – антагонист эндогенного участка глицина.
- Ланицемин - антагонист сайта дизоцилпина с низким захватом
- LY-235959 - антагонист глутаматного сайта
- Мемантин - антагонист дизоцилпинового сайта с низким захватом.
- Метокситамин – антагонист сайта дизоцилпина.
- Мидафотел – антагонист глутаматного сайта.
- Закись азота (N 2 O) – антагонист неопределенного сайта
- PEAQX - антагонист глутаматного сайта
- Перзинфотел - антагонист глутаматного сайта
- Фенциклидин (PCP) - антагонист дизоцилпинового сайта.
- Фенилаланин — встречающаяся в природе аминокислота, антагонист участка глицина. [ 93 ] [ 94 ]
- Психотридин – неопределенный антагонист сайта
- Selfotel - антагонист глутаматного сайта
- Тилетамин - антагонист сайта дизоцилпина.
- Траксопродил – антагонист сайта ифенпродил
- Ксенон - неизвестный антагонист сайта
Некоторые распространенные агенты, у которых слабый антагонизм к рецептору NMDA является вторичным или дополнительным действием, включают:
- Амантадин – противовирусный и противопаркинсонический препарат; антагонист сайта дизоцилпина с низким захватом [ 95 ]
- Атомоксетин – ингибитор обратного захвата норадреналина, используемый для лечения . [ 96 ]
- Декстропропоксифен – опиоидный анальгетик.
- Этанол ( алкоголь ) – эйфорическое , седативное и анксиолитическое средство , используемое в рекреационных целях; неизвестный антагонист сайта
- Гвайфенезин – отхаркивающее средство
- Гиперзин А – природный ингибитор ацетилхолинэстеразы и потенциальное против деменции . средство
- Ибогаин – природный галлюциноген и вызывающее привыкание. средство,
- Кетобемидон – опиоидный анальгетик.
- Метадон – опиоидный анальгетик
- Миноциклин – антибиотик [ 97 ]
- Трамадол - атипичный опиоидный анальгетик и агент, высвобождающий серотонин.
Нитромемантин
[ редактировать ]Рецептор NMDA регулируется посредством нитрозилирования , а аминоадамантан можно использовать в качестве целенаправленного челнока для доставки оксида азота (NO) близко к участку внутри рецептора NMDA, где он может нитрозилировать и регулировать проводимость ионного канала. [ 28 ] Донором NO, который можно использовать для снижения активности рецептора NMDA, является алкилнитрат нитроглицерин. В отличие от многих других доноров NO, алкилнитраты не обладают потенциальными нейротоксическими эффектами, связанными с NO. Алкилнитраты отдают NO в форме нитрогруппы, как показано на рисунке 7, -NO 2 -, который является безопасным донором, позволяющим избежать нейротоксичности. Нитрогруппа должна быть направлена на рецептор NMDA, в противном случае могут возникнуть другие эффекты NO, такие как расширение кровеносных сосудов и последующая гипотония . [ 98 ] Нитромемантин является производным мемантина второго поколения. Он снижает эксайтотоксичность, опосредованную сверхактивацией глутаматергической системы, путем блокирования рецептора NMDA, не жертвуя при этом безопасностью. Предварительные исследования на животных моделях показывают, что нитромантины более эффективны, чем мемантин, в качестве нейропротекторов как in vitro , так и in vivo. Мемантин и новые его производные могут стать очень важным оружием в борьбе с повреждением нейронов. [ 18 ]

К отрицательным аллостерическим модуляторам относятся:
- 25-гидроксихолестерин – эндогенный слабый отрицательный аллостерический модулятор.
- Конантокины - встречающиеся в природе негативные аллостерические модуляторы полиаминного сайта, обнаруженные у Conus geographus. [ 99 ]
Модуляторы
[ редактировать ]Примеры
[ редактировать ]Рецептор NMDA модулируется рядом эндогенных и экзогенных соединений: [ 100 ]
- аминогликозиды оказывают эффект, аналогичный полиаминам, и это может объяснить их нейротоксический эффект. Было показано, что
- CDK5 регулирует количество NR2B -содержащих NMDA-рецепторов на синаптической мембране, влияя тем самым на синаптическую пластичность . [ 101 ] [ 102 ]
- Полиамины не активируют напрямую NMDA-рецепторы, а вместо этого усиливают или подавляют реакции, опосредованные глутаматом.
- Рилин модулирует функцию NMDA через киназы семейства Src и DAB1 . [ 103 ] значительно усиливая ДП в гиппокампе .
- Киназа Src усиливает токи рецепторов NMDA. [ 104 ]
- Уже + , К + и Ca 2+ не только проходят через канал рецептора NMDA, но и модулируют активность рецепторов NMDA. [ 105 ]
- Зн 2+ и Cu 2+ обычно блокируют текущую активность NMDA неконкурентным и независимым от напряжения способом. Однако цинк может усиливать или подавлять ток в зависимости от активности нейронов. [ 106 ]
- Pb 2+ [ 107 ] является мощным антагонистом NMDAR. Пресинаптический дефицит, вызванный Pb 2+ Воздействие во время синаптогенеза опосредовано нарушением NMDAR-зависимой передачи сигналов BDNF.
- Белки I класса главного комплекса гистосовместимости являются эндогенными негативными регуляторами NMDAR-опосредованных токов в гиппокампе взрослого человека. [ 108 ] и необходимы для соответствующих изменений, вызванных NMDAR, в AMPAR. торговле [ 108 ] и NMDAR-зависимая синаптическая пластичность , обучение и память . [ 109 ] [ 110 ]
- Активность NMDA-рецепторов также поразительно чувствительна к изменениям pH и частично ингибируется концентрацией H в окружающей среде. + в физиологических условиях. [ 111 ] Уровень ингибирования H + значительно снижается в рецепторах, содержащих подтип NR1a, который содержит положительно заряженную вставку экзона 5. Эффект этой вставки может быть имитирован положительно заряженными полиаминами и аминогликозидами, что объясняет их механизм действия.
- Функция рецептора NMDA также строго регулируется путем химического восстановления и окисления через так называемый «редокс-модулирующий сайт». [ 112 ] Через этот сайт восстановители резко усиливают активность каналов NMDA, тогда как оксиданты либо обращают вспять эффекты восстановителей, либо подавляют нативные реакции. Обычно считается, что NMDA-рецепторы модулируются эндогенными окислительно-восстановительными агентами, такими как глутатион , липоевая кислота и незаменимое питательное вещество пирролохинолинхинон. [ нужна ссылка ] .
Разработка антагонистов рецепторов NMDA
[ редактировать ]Основная проблема при разработке антагонистов NMDA для нейропротекции заключается в том, что физиологическая активность рецепторов NMDA необходима для нормальной функции нейронов. Полная блокада активности всех рецепторов NMDA приводит к таким побочным эффектам, как галлюцинации , возбуждение и анестезия . Чтобы быть клинически значимым, антагонист рецептора NMDA должен ограничивать свое действие блокадой чрезмерной активации, не ограничивая нормальную функцию рецептора. [ 21 ]
Конкурентные антагонисты рецепторов NMDA
[ редактировать ]Конкурентные антагонисты рецептора NMDA, которые были разработаны первыми, не являются хорошим вариантом, поскольку они конкурируют и связываются с тем же сайтом (субъединицей NR2) на рецепторе, что и агонист, глутамат, и, следовательно, также блокируют нормальную функцию. [ 21 ] [ 113 ] Они будут блокировать здоровые области мозга, прежде чем оказать воздействие на патологические области, поскольку здоровые области содержат более низкие уровни агониста , чем патологические области. Эти антагонисты могут быть вытеснены из рецептора высокой концентрацией глутамата, который может существовать в условиях эксайтотоксичности. [ 16 ]
Неконкурентные антагонисты рецепторов NMDA
[ редактировать ]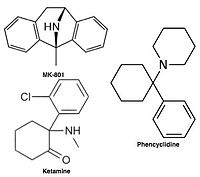
Неконкурентные антагонисты NMDA-рецепторов блокируют ионный канал Mg. 2+ место (область пор) и предотвращать чрезмерный приток Ca 2+ . Неконкурентный антагонизм относится к типу блокады, которую не может преодолеть повышенная концентрация глутамата, и зависит от предварительной активации рецептора агонистом, т.е. он входит в канал только тогда, когда он открывается агонистом. [ 21 ] [ 114 ]
Мемантин и родственные соединения
[ редактировать ]
Из-за этих неблагоприятных побочных эффектов блокаторов с высоким сродством поиск клинически успешных антагонистов рецепторов NMDA для лечения нейродегенеративных заболеваний продолжился и был сосредоточен на разработке блокаторов с низким сродством. Однако сродство не должно быть слишком низким, а время пребывания не слишком коротким (как видно на примере Mg 2+ ), где деполяризация мембраны снимает блок. Таким образом, открытием стало создание неконкурентного антагониста с более длительным временем существования, чем у Mg. 2+ в канале но короче МК-801. Таким образом, полученное лекарство будет блокировать только чрезмерно открытые каналы, связанные с рецептором NMDA, но не нормальную нейротрансмиссию. [ 21 ] [ 114 ] Мемантин и есть этот препарат. Это производное амантадина, который сначала был противогриппозным средством, но позже по совпадению обнаружил, что он эффективен при болезни Паркинсона. Химическую структуру мемантина и амантадина можно увидеть на рисунке 5. Сначала считалось, что это соединение является дофаминергическим или антихолинергическим , но позже было обнаружено, что оно является антагонистом рецептора NMDA. [ 15 ] [ 21 ]
Мемантин — первый препарат, одобренный для лечения тяжелой и более запущенной болезни Альцгеймера , для которой, например, антихолинергические препараты не приносят особой пользы. [ 114 ] Он помогает восстановить синаптические функции и, таким образом, улучшает нарушенную память и обучение. [ 19 ] В 2015 году мемантин также проходит испытания на предмет его терапевтического значения при других неврологических расстройствах. [ 98 ]
В настоящее время разрабатываются многие производные мемантина второго поколения, которые могут показать еще лучшие нейропротекторные эффекты, при этом основная идея заключается в использовании других безопасных, но эффективных модулирующих участков на рецепторе NMDA в дополнение к связанному с ним ионному каналу. [ 98 ]
Отношения структура-активность (SAR)
[ редактировать ]
Мемантин (1-амино-3,5-диметиладамантан) представляет собой производное аминоалкилциклогексана и атипичное лекарственное соединение с неплоской трехмерной трициклической структурой. На рисунке 8 показан SAR для производного аминоалкилциклогексана. Мемантин имеет несколько важных особенностей в своей структуре, обеспечивающих его эффективность:
- Трехкольцевая структура с плацдармовым амином -NH 2
- Группа -NH 2 протонируется при физиологическом pH организма и несет положительный заряд, -NH. 3+
- Две боковые группы метила (CH 3 ), которые служат для продления времени пребывания и повышения стабильности, а также сродства к каналу рецептора NMDA по сравнению с амантадином (1-адамантанамином). [ 18 ] [ 114 ]
Несмотря на небольшую структурную разницу между мемантином и амантадином, двумя производными адамантана, сродство к сайту связывания субъединицы NR1/NR2B у мемантина намного выше. При измерениях с использованием патч-клампа мемантин имеет IC 50 (2,3+0,3) мкМ, тогда как амантадин имеет IC 50 (71,0+11,1) мкМ. [ 28 ] Сайт связывания с самым высоким сродством называется доминантным сайтом связывания. Он включает соединение между аминогруппой мемантина и связывающим карманом NR1-N161 субъединицы NR1/NR2B. Боковые метильные группы играют важную роль в увеличении сродства к открытым каналам рецептора NMDA и делают его гораздо лучшим нейропротекторным препаратом, чем амантадин. Считается, что карманы связывания метильных групп находятся в NR1-A645 и NR2B-A644 NR1/NR2B. [ 32 ] Карманы для переплета показаны на рисунке 2. Мемантин связывается с магнием или рядом с ним. 2+ сайт внутри канала, связанного с рецептором NMDA. Группа -NH 2 мемантина, которая протонируется при физиологическом pH организма, представляет собой область, которая связывается с Mg или рядом с ним. 2+ сайт. [ 18 ] Добавление двух метильных групп к -N в структуре мемантина показало снижение сродства, в результате чего значение IC 50 составило (28,4+1,4) мкМ. [ 28 ]
Производное мемантина второго поколения; нитромемантин
[ редактировать ]Несколько производных нитромемантина, производного мемантина второго поколения, были синтезированы для того, чтобы установить детальную взаимосвязь структура-активность (SAR) этих новых препаратов. Один класс, содержащий нитрогруппу (NO 2 ), противоположную плацдармовому амину (NH 2 ), показал многообещающий результат. Нитромемантин использует сайт связывания мемантина на рецепторе NMDA для нацеливания на группу NO x (X = 1 или 2) для взаимодействия с сайтом S-нитрозилирования/окислительно-восстановительного процесса, внешним по отношению к сайту связывания мемантина. Удлинение боковых цепей мемантина компенсирует худшее сродство препарата в канале, связанное с добавлением –ONO 2. группы [ 115 ]
Терапевтическое применение
[ редактировать ]Предполагается, что эксайтотоксичность связана с некоторыми нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз . [ 16 ] [ 17 ] [ 18 ] [ 19 ] Таким образом, блокирование рецепторов NMDA теоретически может быть полезно при лечении таких заболеваний. [ 16 ] [ 17 ] [ 18 ] Однако важно сохранить физиологическую активность NMDA-рецептора, одновременно пытаясь блокировать его чрезмерную эксайтотоксическую активность. Возможно, этого можно достичь с помощью неконкурентных антагонистов, блокирующих ионный канал рецептора, когда он чрезмерно открыт. [ 18 ]
Мемантин является примером неконкурентного антагониста рецептора NMDA, который одобрен для лечения нейродегенеративного заболевания — болезни Альцгеймера. В 2015 году мемантин все еще находится на стадии клинических испытаний при лечении других неврологических заболеваний. [ 32 ] [ 98 ]
Модуляция рецепторов
[ редактировать ]Рецептор NMDA представляет собой неспецифический катионный канал, который может обеспечивать прохождение кальция. 2+ и На + в клетку и К + из клетки. Возбуждающий постсинаптический потенциал (ВПСП), создаваемый активацией рецептора NMDA, увеличивает концентрацию Са. 2+ в клетке. Ка 2+ может, в свою очередь, функционировать как второй мессенджер в различных сигнальных путях . Однако катионный канал рецептора NMDA блокируется Mg. 2+ при мембранном потенциале покоя. [ 116 ] Разблокировка магния не мгновенная; чтобы разблокировать все доступные каналы, постсинаптическая клетка должна быть деполяризована на достаточно длительный период времени (в масштабах миллисекунд). [ 117 ]
Таким образом, рецептор NMDA функционирует как « детектор молекулярных совпадений ». Его ионный канал открывается только при выполнении следующих двух условий: глутамат связывается с рецептором и постсинаптическая клетка деполяризуется (что удаляет Mg 2+ блокировка канала). Это свойство рецептора NMDA объясняет многие аспекты долговременной потенциации (ДП) и синаптической пластичности . [ 118 ]
В состоянии покоя мембраны поры рецептора NMDA открываются, обеспечивая приток внешних ионов магния, связывающихся для предотвращения дальнейшего проникновения ионов. [ 119 ] Внешние ионы магния находятся в миллимолярном диапазоне, тогда как внутриклеточные ионы магния находятся в микромолярном диапазоне, что приводит к отрицательному мембранному потенциалу. NMDA-рецепторы модулируются рядом эндогенных и экзогенных соединений и играют ключевую роль в широком спектре физиологических (например, память ) и патологических процессов (например, эксайтотоксичность ). Магний усиливает NMDA-индуцированные реакции при положительных мембранных потенциалах, блокируя при этом канал NMDA. Использование кальция, калия и натрия используется для модуляции активности NMDAR, проходящих через мембрану NMDA. Изменения в H + концентрации могут частично ингибировать активность NMDA-рецепторов в различных физиологических условиях.
Клиническое значение
[ редактировать ]Антагонисты NMDAR, такие как кетамин , эскетамин , тилетамин , фенциклидин , закись азота и ксенон , используются в качестве общих анестетиков . Эти и подобные наркотики, такие как декстрометорфан и метоксетамин, также производят диссоциативные , галлюциногенные и эйфорические эффекты и используются в качестве рекреационных наркотиков .
Соединения, нацеленные на NMDAR, включая кетамин, эскетамин (JNJ-54135419), рапастинель (GLYX-13), апимостинел (NRX-1074), зелквистинел (AGN-241751), 4-хлоркинуренин (AV-101) и рисленемдаз (CERC- 301, МК-0657), находятся в стадии разработки для лечение расстройств настроения , включая большое депрессивное расстройство и резистентную к лечению депрессию . [ 83 ] [ 84 ] [ 120 ] Кроме того, в некоторых клиниках для этой цели уже используется кетамин в качестве терапии, не указанной в инструкции. [ 121 ] [ 122 ]
Исследования показывают, что тианептин оказывает антидепрессивное действие посредством непрямого изменения и ингибирования активности рецепторов глутамата и высвобождения BDNF Tooltip , что, в свою очередь, влияет на пластичность нейронов . [ 123 ] [ 124 ] [ 125 ] [ 126 ] [ 127 ] Тианептин также действует на рецепторы NMDA и AMPA . [ 123 ] [ 127 ] На животных моделях тианептин ингибирует вызванные стрессом патологические изменения глутаматергической нейротрансмиссии в миндалевидном теле и гиппокампе.
Мемантин , антагонист NMDAR с низким уровнем улавливания, одобрен в США и Европе для лечения болезни Альцгеймера от умеренной до тяжелой степени. [ 128 ] Великобритании и теперь получил ограниченную рекомендацию Национального института здравоохранения и передового опыта для пациентов, которым другие варианты лечения не помогли. [ 129 ]
Кохлеарные NMDAR являются объектом интенсивных исследований с целью поиска фармакологических решений для лечения шума в ушах . NMDAR связаны с редким аутоиммунным заболеванием — анти-NMDA-рецепторным энцефалитом (также известным как NMDAR-энцефалит). [ 130 ] ), что обычно происходит из-за перекрестной реактивности антител, вырабатываемых иммунной системой против эктопических тканей головного мозга, например, обнаруженных при тератоме . Они известны как антитела к рецепторам глутамата .
По сравнению с дофаминергическими стимуляторами, такими как метамфетамин , антагонист NMDAR фенциклидин может вызывать более широкий спектр симптомов, напоминающих шизофрению, у здоровых добровольцев, что привело к глутаматной гипотезе шизофрении . [ 131 ] Эксперименты, в которых грызунов лечат антагонистом NMDA-рецепторов, сегодня являются наиболее распространенной моделью, когда речь идет об испытаниях новых методов лечения шизофрении или изучении точного механизма действия препаратов, уже одобренных для лечения шизофрении.
Антагонисты NMDAR, например , элипродил , гавестинел , ликостинел и селфотел, широко исследовались для лечения эксайтотоксичностью , опосредованной нейротоксичности , в таких ситуациях, как ишемический инсульт и черепно-мозговая травма , но в клинических испытаниях, применявшихся в малых дозах во избежание седативного эффекта, они оказались безуспешными. Антагонисты NMDAR могут блокировать распространяющуюся деполяризацию у животных и пациентов с травмой головного мозга. [ 132 ] Это использование еще не было проверено в клинических испытаниях.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Лаубе Б., Хираи Х., Стерджесс М., Бетц Х., Кузе Дж. (март 1997 г.). «Молекулярные детерминанты дискриминации агонистов субъединицами рецептора NMDA: анализ сайта связывания глутамата на субъединице NR2B» . Нейрон . 18 (3): 493–503. дои : 10.1016/S0896-6273(00)81249-0 . ПМИД 9115742 .
Поскольку считается, что для активации канала необходимы по две молекулы глутамата и глицина (3, 6), это означает, что рецептор NMDA должен состоять как минимум из четырех субъединиц.
- ^ Перейти обратно: а б Ансон Л.К., Чен П.Е., Уилли Д.Д., Колкухун Д., Шопфер Р. (январь 1998 г.). «Идентификация аминокислотных остатков субъединицы NR2A, которые контролируют активность глутамата в рекомбинантных NR1/NR2A NMDA-рецепторах» . Журнал неврологии . 18 (2): 581–589. doi : 10.1523/JNEUROSCI.18-02-00581.1998 . ПМК 6792534 . ПМИД 9425000 .
- ^ Выклицкий, В.; Коринек, М.; Смейкалова Т.; Балик, А.; Краусова, Б.; Канякова М.; Личнерова К.; Черни, Дж.; Крусек, Дж.; Диттерт, И.; Горак, М.; Виклицкий, Л. (2014). «Структура, функции и фармакология каналов рецепторов NMDA» . Физиологические исследования . 63 (Приложение 1): S191–203. дои : 10.33549/phyolres.932678 . ISSN 1802-9973 . ПМИД 24564659 .
- ^ Джуэтт, Бенджамин Э.; Тапа, Бики (2024 г.), «Физиология, рецептор NMDA» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 30137779 , получено 4 марта 2024 г.
- ^ Перейти обратно: а б Фурукава Х., Сингх С.К., Манкуссо Р., Гуо Э. (ноябрь 2005 г.). «Расположение и функция субъединиц в NMDA-рецепторах». Природа . 438 (7065): 185–192. Бибкод : 2005Natur.438..185F . дои : 10.1038/nature04089 . ПМИД 16281028 . S2CID 4400777 .
- ^ Ли Ф, Цянь Дж.З. (июль 2009 г.). «Память и NMDA-рецепторы» . Медицинский журнал Новой Англии . 361 (3): 302–303. doi : 10.1056/NEJMcibr0902052 . ПМЦ 3703758 . ПМИД 19605837 .
- ^ Мориёси К., Масу М., Исии Т., Сигэмото Р., Мизуно Н., Наканиси С. (ноябрь 1991 г.). «Молекулярное клонирование и характеристика крысиного рецептора NMDA». Природа . 354 (6348): 31–37. Бибкод : 1991Natur.354...31M . дои : 10.1038/354031a0 . ПМИД 1834949 . S2CID 4368947 .
- ^ Перейти обратно: а б Дингледин Р., Борхес К., Боуи Д., Трайнелис С.Ф. (март 1999 г.). «Ионные каналы глутаматных рецепторов» . Фармакологические обзоры . 51 (1): 7–61. ПМИД 10049997 .
- ^ Лю Ю, Чжан Дж (октябрь 2000 г.). «Недавние разработки рецепторов NMDA». Китайский медицинский журнал . 113 (10): 948–956. ПМИД 11775847 .
- ^ Калл-Кэнди С., Брикли С., Фаррант М. (июнь 2001 г.). «Субъединицы рецептора NMDA: разнообразие, развитие и болезни». Современное мнение в нейробиологии . 11 (3): 327–335. дои : 10.1016/S0959-4388(00)00215-4 . ПМИД 11399431 . S2CID 11929361 .
- ^ Перейти обратно: а б Паолетти П., Нейтон Дж (февраль 2007 г.). «Субъединицы рецептора NMDA: функция и фармакология» (PDF) . Современное мнение в фармакологии . 7 (1): 39–47. дои : 10.1016/j.coph.2006.08.011 . ПМИД 17088105 .
- ^ Санчес-Бласкес П., Родригес-Муньос М., Висенте-Санчес А., Гарсон Х. (ноябрь 2013 г.). «Каннабиноидные рецепторы соединяются с рецепторами NMDA, чтобы уменьшить выработку NO и мобилизацию цинка, индуцированную глутаматом» . Антиоксиданты и окислительно-восстановительная сигнализация . 19 (15): 1766–1782. дои : 10.1089/ars.2012.5100 . ПМЦ 3837442 . ПМИД 23600761 .
- ^ Кастелли М.П., Мадедду С., Касти А., Касу А., Касти П., Шерма М. и др. (20 мая 2014 г.). «Δ9-тетрагидроканнабинол предотвращает нейротоксичность, вызванную метамфетамином» . ПЛОС ОДИН . 9 (5): e98079. Бибкод : 2014PLoSO...998079C . дои : 10.1371/journal.pone.0098079 . ПМК 4028295 . ПМИД 24844285 .
- ^ Перейти обратно: а б с д Джонсон Дж.В., Котермански С.Е. (февраль 2006 г.). «Механизм действия мемантина». Современное мнение в фармакологии . 6 (1): 61–67. дои : 10.1016/j.coph.2005.09.007 . ПМИД 16368266 .
- ^ Перейти обратно: а б с д Домингес Э., Чин Тай, Чен С.П., Ву Тай (декабрь 2011 г.). «Лечение болезни Альцгеймера от умеренной до тяжелой степени: фокус на мемантине» . Тайваньский журнал акушерства и гинекологии . 50 (4): 415–423. дои : 10.1016/j.tjog.2011.10.004 . ПМИД 22212311 .
- ^ Перейти обратно: а б с д и ж г час Чен Х.С., Lipton SA (июнь 2006 г.). «Химическая биология клинически переносимых антагонистов рецепторов NMDA» . Журнал нейрохимии . 97 (6): 1611–1626. дои : 10.1111/j.1471-4159.2006.03991.x . ПМИД 16805772 . S2CID 18376541 .
- ^ Перейти обратно: а б с д и Кемп Дж.А., МакКернан Р.М. (ноябрь 2002 г.). «Пути рецепторов NMDA как мишени для лекарств». Природная неврология . 5 (11): 1039–1042. дои : 10.1038/nn936 . ПМИД 12403981 . S2CID 41383776 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Lipton SA (февраль 2006 г.). «Смена парадигмы нейропротекции путем блокады рецепторов NMDA: мемантин и не только». Обзоры природы. Открытие наркотиков . 5 (2): 160–170. дои : 10.1038/nrd1958 . ПМИД 16424917 . S2CID 21379258 .
- ^ Перейти обратно: а б с д Кох Х.Дж., Сече А., Хаен Э. (1 января 2004 г.). «NMDA-антагонизм (мемантин): альтернативный фармакологический терапевтический принцип при болезни Альцгеймера и сосудистой деменции». Текущий фармацевтический дизайн . 10 (3): 253–259. дои : 10.2174/1381612043386392 . ПМИД 14754385 .
- ^ Стёллет П., Нейт ХК, Куэно М., До К.К. (февраль 2006 г.). «Нарушение синаптической пластичности и гипофункция рецепторов NMDA, вызванное дефицитом глутатиона: значение для шизофрении». Нейронаука . 137 (3): 807–819. doi : 10.1016/j.neuroscience.2005.10.014 . ПМИД 16330153 . S2CID 1417873 .
- ^ Перейти обратно: а б с д и ж г Lipton SA (январь 2004 г.). «Неудачи и успехи антагонистов рецепторов NMDA: молекулярная основа использования блокаторов открытых каналов, таких как мемантин, в лечении острых и хронических неврологических инсультов» . НейроРкс . 1 (1): 101–110. дои : 10.1602/neurorx.1.1.101 . ПМК 534915 . ПМИД 15717010 .
- ^ Ямакура Т., Симодзи К. (октябрь 1999 г.). «Субъединичная и сайт-специфическая фармакология канала рецептора NMDA». Прогресс нейробиологии . 59 (3): 279–298. дои : 10.1016/S0301-0082(99)00007-6 . ПМИД 10465381 . S2CID 24726102 .
- ^ Уоткинс Дж. К., Джейн Д. Е. (январь 2006 г.). «История глутамата» . Британский журнал фармакологии . 147 (С1): С100–С108. дои : 10.1038/sj.bjp.0706444 . ПМЦ 1760733 . ПМИД 16402093 .
- ^ Перейти обратно: а б с Хардингем Г.Е., Фукунага Ю., Бадинг Х. (май 2002 г.). «Внесинаптические NMDAR противостоят синаптическим NMDAR, вызывая отключение CREB и пути гибели клеток». Природная неврология . 5 (5): 405–414. дои : 10.1038/nn835 . ПМИД 11953750 . S2CID 659716 .
- ^ Перейти обратно: а б с Хардингем Дж. Э., Бадинг Х. (октябрь 2010 г.). «Синаптическая и внесинаптическая передача сигналов рецептором NMDA: последствия нейродегенеративных расстройств» . Обзоры природы. Нейронаука . 11 (10): 682–696. дои : 10.1038/nrn2911 . ПМЦ 2948541 . ПМИД 20842175 .
- ^ Бадинг Х. (март 2017 г.). «Терапевтическое воздействие на патологическую триаду внесинаптической передачи сигналов рецептора NMDA при нейродегенерациях» . Журнал экспериментальной медицины . 214 (3): 569–578. дои : 10.1084/jem.20161673 . ПМЦ 5339681 . ПМИД 28209726 .
- ^ Перейти обратно: а б Ян Дж., Бенгтсон С.П., Бухтал Б., Хагенстон А.М., Бадинг Х. (октябрь 2020 г.). «Сочетание рецепторов NMDA и TRPM4 способствует открытию нетрадиционных нейропротекторов». Наука . 370 (6513): eaay3302. дои : 10.1126/science.aay3302 . ПМИД 33033186 . S2CID 222210921 .
- ^ Перейти обратно: а б с д и Ванка Л., Икбал К., Шрайнер П.Р. (май 2013 г.). «Липофильная пуля попадает в цель: медицинская химия производных адамантана» . Химические обзоры . 113 (5): 3516–3604. дои : 10.1021/cr100264t . ПМК 3650105 . ПМИД 23432396 .
- ^ Бисли С., Кумар С.С. (ноябрь 2023 г.). «Рецептор tN-метил-d-аспартата: доводы в пользу того, что d-серин следует считать его обратным коагонистом» . Нейрофармакология . 238 : 109654. doi : 10.1016/j.neuropharm.2023.109654 . ПМИД 37437688 .
- ^ Перейти обратно: а б Лофтис Дж. М., Яновский А. (январь 2003 г.). «Субъединица рецептора N-метил-D-аспартата NR2B: локализация, функциональные свойства, регуляция и клиническое значение». Фармакология и терапия . 97 (1): 55–85. дои : 10.1016/s0163-7258(02)00302-9 . ПМИД 12493535 .
- ^ Перейти обратно: а б Кристиансен Л.В., Уэрта И., Бенейто М., Мидор-Вудрафф Дж.Х. (февраль 2007 г.). «NMDA-рецепторы и шизофрения». Современное мнение в фармакологии . 7 (1): 48–55. дои : 10.1016/j.coph.2006.08.013 . ПМИД 17097347 .
- ^ Перейти обратно: а б с д Лимапичат В., Ю. Вайоминг, Браниган Э., Лестер Х.А., Догерти Д.А. (февраль 2013 г.). «Ключевые взаимодействия мемантина с рецептором NMDA» . ACS Химическая нейронаука . 4 (2): 255–260. дои : 10.1021/cn300180a . ПМЦ 3751542 . ПМИД 23421676 .
- ^ Махер Т.Дж. (2013). «Глава 16: Анестетики: общие и местные анестетики». (PDF) . В Лемке Т.Л., Уильямс Д.А. (ред.). Принципы медицинской химии Фоя . Филадельфия: Липпинкотт Уильямс и Уилкинс. ISBN 978-1-60913-345-0 .
- ^ Даниш В., Парсонс CG (сентябрь 2003 г.). «Антагонист рецепторов NMDA мемантин как симптоматическое и нейропротекторное лечение болезни Альцгеймера: доклинические данные». Международный журнал гериатрической психиатрии . 18 (Приложение 1): С23–С32. дои : 10.1002/gps.938 . ПМИД 12973747 . S2CID 14852616 .
- ^ Стивенсон Ф.А. (ноябрь 2006 г.). «Структура и торговля рецепторами NMDA и GABAA». Труды Биохимического общества . 34 (Часть 5): 877–881. дои : 10.1042/BST0340877 . ПМИД 17052219 . S2CID 24875113 .
- ^ Дэн Х., Цай В., Чжоу Л., Чжан Дж., Лю Ц., Ван Ю. и др. (октябрь 2010 г.). «Эволюционный режим и функциональное расхождение генов субъединицы 2 рецептора NMDA позвоночных» . ПЛОС ОДИН . 5 (10): е13342. Бибкод : 2010PLoSO...513342T . дои : 10.1371/journal.pone.0013342 . ПМЦ 2954789 . ПМИД 20976280 .
- ^ Райан Т.Дж., Грант С.Г. (октябрь 2009 г.). «Происхождение и эволюция синапсов». Обзоры природы. Нейронаука . 10 (10): 701–712. дои : 10.1038/nrn2717 . ПМИД 19738623 . S2CID 5164419 .
- ^ Георгиев Д., Таниура Х., Камбе Ю., Такарада Т., Йонеда Ю. (август 2008 г.). «Критическая важность полиаминного сайта в NMDA-рецепторах для роста нейритов и фасцикуляции на ранних стадиях дифференцировки нейронов P19». Экспериментальные исследования клеток . 314 (14): 2603–2617. дои : 10.1016/j.yexcr.2008.06.009 . ПМИД 18586028 .
- ^ Банк Э.К., Кениг Х.Г., Прен Дж.Х., Кирби Б.П. (июнь 2014 г.). «Влияние антагониста субъединицы NR2B N-метил-D-аспартата ифенпродила на пролиферацию клеток-предшественников в гиппокампе» . Журнал нейробиологических исследований . 92 (6): 679–691. дои : 10.1002/jnr.23347 . ПМИД 24464409 . S2CID 18582691 .
- ^ Ван М., Ян Й., Ван С.Дж., Гамо Н.Дж., Джин Л.Е., Мазер Дж.А. и др. (февраль 2013 г.). «NMDA-рецепторы обеспечивают постоянную активацию нейронов во время рабочей памяти в дорсолатеральной префронтальной коре» . Нейрон . 77 (4): 736–749. дои : 10.1016/j.neuron.2012.12.032 . ПМЦ 3584418 . ПМИД 23439125 .
- ^ Ян С.Т., Ван М., Паспалас К.Д., Криминс Дж.Л., Альтман М.Т., Мазер Дж.А., Арнстен А.Ф. (апрель 2018 г.). «Основные различия в синаптической передаче сигналов между первичной зрительной и дорсолатеральной префронтальной корой» . Кора головного мозга . 28 (4): 1458–1471. дои : 10.1093/cercor/bhx357 . ПМК 6041807 . ПМИД 29351585 .
- ^ Берт Дж.Б., Демирташ М., Экнер В.Дж., Навехар Н.М., Джи Дж.Л., Мартин У.Дж. и др. (сентябрь 2018 г.). «Иерархия транскриптомной специализации в коре головного мозга человека, зафиксированная с помощью структурной топографии нейровизуализации» . Природная неврология . 21 (9): 1251–1259. дои : 10.1038/s41593-018-0195-0 . ПМК 6119093 . ПМИД 30082915 .
- ^ Мунтане Дж., Хорват Дж.Э., Хоф П.Р., Эли Дж.Дж., Хопкинс В.Д., Раганти М.А. и др. (июнь 2015 г.). «Анализ экспрессии синаптических генов в неокортексе приматов выявляет эволюционные изменения в глутаматергической нейротрансмиссии» . Кора головного мозга . 25 (6): 1596–1607. дои : 10.1093/cercor/bht354 . ПМЦ 4428301 . ПМИД 24408959 .
- ^ Бар-Шира О., Маор Р., Чечик Г. (декабрь 2015 г.). «Переключение экспрессии генов субъединиц рецепторов в развитии мозга человека» . PLOS Вычислительная биология . 11 (12): e1004559. Бибкод : 2015PLSCB..11E4559B . дои : 10.1371/journal.pcbi.1004559 . ПМЦ 4670163 . ПМИД 26636753 .
- ^ Лю XB, Мюррей К.Д., Джонс Э.Г. (октябрь 2004 г.). «Переключение субъединиц рецептора NMDA 2A и 2B в таламических и корковых синапсах во время раннего постнатального развития» . Журнал неврологии . 24 (40): 8885–8895. doi : 10.1523/JNEUROSCI.2476-04.2004 . ПМК 6729956 . ПМИД 15470155 .
- ^ Цянь Дж.З. (апрель 2000 г.). «Создание более умной мыши». Научный американец . 282 (4): 62–68. Бибкод : 2000SciAm.282d..62T . doi : 10.1038/scientificamerican0400-62 . ПМИД 10789248 .
- ^ Лю Ю, Вонг Т.П., Аартс М., Руяккерс А., Лю Л., Лай Т.В. и др. (март 2007 г.). «Субъединицы NMDA-рецептора играют различную роль в обеспечении эксайтотоксической гибели нейронов как in vitro, так и in vivo» . Журнал неврологии . 27 (11): 2846–2857. doi : 10.1523/JNEUROSCI.0116-07.2007 . ПМК 6672582 . ПМИД 17360906 .
- ^ Чжоу М., Бодри М. (март 2006 г.). «Изменения нейротоксичности NMDA в процессе развития отражают изменения в составе субъединиц рецепторов NMDA» . Журнал неврологии . 26 (11): 2956–2963. doi : 10.1523/JNEUROSCI.4299-05.2006 . ПМК 6673978 . ПМИД 16540573 .
- ^ Шпренгель Р., Суханек Б., Амико С., Бруса Р., Бурнашев Н., Розов А. и др. (январь 1998 г.). «Важность внутриклеточного домена субъединиц NR2 для функции рецептора NMDA in vivo» . Клетка . 92 (2): 279–289. дои : 10.1016/S0092-8674(00)80921-6 . ПМИД 9458051 . S2CID 9791935 .
- ^ Грок Л., Шоке Д., Стивенсон Ф.А., Веррье Д., Манцони О.Дж., Чавис П. (сентябрь 2007 г.). «Поверхностный транспорт рецептора NMDA и состав синаптических субъединиц регулируются в процессе развития белком внеклеточного матрикса Рилин» . Журнал неврологии . 27 (38): 10165–10175. doi : 10.1523/JNEUROSCI.1772-07.2007 . ПМК 6672660 . ПМИД 17881522 .
- ^ Эспиноза Дж.С., Луо Л. (март 2008 г.). «Время нейрогенеза и дифференциации: результаты количественного клонального анализа гранулярных клеток мозжечка» . Журнал неврологии . 28 (10): 2301–2312. doi : 10.1523/JNEUROSCI.5157-07.2008 . ПМК 2586640 . ПМИД 18322077 .
- ^ Гаджендран Н., Капфхаммер Дж.П., Лэйн Э., Канепари М., Фогт К., Висден В., Бреннер Х.Р. (февраль 2009 г.). «Передача сигналов нейрегулина необязательна для экспрессии NMDA- и GABA(A)-рецепторов в мозжечке in vivo» . Журнал неврологии . 29 (8): 2404–2413. doi : 10.1523/JNEUROSCI.4303-08.2009 . ПМК 6666233 . ПМИД 19244516 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Член парламента Парсонса, Раймонд Л.А. (апрель 2014 г.). «Вовлечение экстрасинаптических рецепторов NMDA в расстройства центральной нервной системы» . Нейрон . 82 (2): 279–293. дои : 10.1016/j.neuron.2014.03.030 . ПМИД 24742457 .
- ^ Чой Д.В., Ко Дж.Й., Питерс С. (январь 1988 г.). «Фармакология нейротоксичности глутамата в культуре кортикальных клеток: ослабление антагонистами NMDA» . Журнал неврологии . 8 (1): 185–196. doi : 10.1523/JNEUROSCI.08-01-00185.1988 . ПМК 6569373 . ПМИД 2892896 .
- ^ Хенклифф С (2007). Справочник по клинической неврологии . Нью-Йорк, штат Нью-Йорк, США: Медицинский колледж Вейля Корнелльского университета, факультет неврологии и неврологии. стр. 553–569.
- ^ Перейти обратно: а б с Хардингем Дж. Э., Бадинг Х. (февраль 2003 г.). «Инь и Ян передачи сигналов рецептора NMDA». Тенденции в нейронауках . 26 (2): 81–89. дои : 10.1016/s0166-2236(02)00040-1 . ПМИД 12536131 . S2CID 26207057 .
- ^ Ся П., Чен Х.С., Чжан Д., Липтон С.А. (август 2010 г.). «Мемантин преимущественно блокирует внесинаптические, а не синаптические токи рецепторов NMDA при аутапсе гиппокампа» . Журнал неврологии . 30 (33): 11246–11250. doi : 10.1523/JNEUROSCI.2488-10.2010 . ПМЦ 2932667 . ПМИД 20720132 .
- ^ Ван Ю, Бриз В, Чишти А, Би Х, Бодри М (ноябрь 2013 г.). «Различные роли мю-кальпаина и м-кальпаина в синаптической нейропротекции, опосредованной NMDAR, и экстрасинаптической нейродегенерации, опосредованной NMDAR» . Журнал неврологии . 33 (48): 18880–18892. doi : 10.1523/JNEUROSCI.3293-13.2013 . ПМЦ 3841454 . ПМИД 24285894 .
- ^ Сюй Дж., Куруп П., Чжан Ю., Гебель-Гуди С.М., Ву П.Х., Хавасли А.Х. и др. (июль 2009 г.). «Экстрасинаптические NMDA-рецепторы преимущественно взаимодействуют с эксайтотоксичностью посредством кальпаин-опосредованного расщепления STEP» . Журнал неврологии . 29 (29): 9330–9343. doi : 10.1523/JNEUROSCI.2212-09.2009 . ПМЦ 2737362 . ПМИД 19625523 .
- ^ Карпова А., Михайлова М., Бера С., Бэр Дж., Редди П.П., Бениш Т. и др. (февраль 2013 г.). «Кодирование и передача синаптического или внесинаптического происхождения сигналов рецептора NMDA в ядро» . Клетка . 152 (5): 1119–1133. дои : 10.1016/j.cell.2013.02.002 . ПМИД 23452857 .
- ^ Хант Д.Л., Кастильо ЧП (июнь 2012 г.). «Синаптическая пластичность NMDA-рецепторов: механизмы и функциональные последствия» . Современное мнение в нейробиологии . 22 (3): 496–508. дои : 10.1016/j.conb.2012.01.007 . ПМЦ 3482462 . ПМИД 22325859 .
- ^ Ли С., Джин М., Кёглспергер Т., Шепардсон Н.Е., Шанкар Г.М., Селькое DJ (май 2011 г.). «Растворимые олигомеры Aβ ингибируют долговременную потенциацию посредством механизма, включающего чрезмерную активацию внесинаптических NR2B-содержащих NMDA-рецепторов» . Журнал неврологии . 31 (18): 6627–6638. doi : 10.1523/JNEUROSCI.0203-11.2011 . ПМК 3100898 . ПМИД 21543591 .
- ^ Лю Д.Д., Ян Ц, Ли С.Т. (апрель 2013 г.). «Активация экстрасинаптических рецепторов NMDA индуцирует LTD в нейронах CA1 гиппокампа крысы». Бюллетень исследований мозга . 93 : 10–16. дои : 10.1016/j.brainresbull.2012.12.003 . ПМИД 23270879 . S2CID 7836184 .
- ^ Папуэн Т., Ладепеш Л., Рюэль Дж., Сакки С., Лабаск М., Ханини М. и др. (август 2012 г.). «Синаптические и внесинаптические NMDA-рецепторы контролируются различными эндогенными коагонистами» . Клетка . 150 (3): 633–646. дои : 10.1016/j.cell.2012.06.029 . hdl : 11383/1788727 . ПМИД 22863013 .
- ^ Санс-Клементе А., Николл Р.А., Рош К.В. (февраль 2013 г.). «Разнообразие состава рецепторов NMDA: много регуляторов, много последствий» . Нейробиолог . 19 (1): 62–75. дои : 10.1177/1073858411435129 . ПМЦ 3567917 . ПМИД 22343826 .
- ^ Петралия Р.С., Ван Икс, Хуа Ф, Йи З, Чжоу А, Ге Л и др. (апрель 2010 г.). «Организация NMDA-рецепторов во внесинаптических местах» . Нейронаука . 167 (1): 68–87. doi : 10.1016/j.neuroscience.2010.01.022 . ПМК 2840201 . ПМИД 20096331 .
- ^ Лай Т.В., Шю В.К., Ван Ю.Т. (май 2011 г.). «Пути вмешательства при инсульте: рецепторы NMDA и не только». Тенденции молекулярной медицины . 17 (5): 266–275. doi : 10.1016/j.molmed.2010.12.008 . ПМИД 21310659 .
- ^ Перейти обратно: а б с д Бисли С., Салленбергер Т., Кротти К., Айлани Р., Д'Орио С., Эванс К. и др. (октябрь 2020 г.). «D-серин смягчает потерю клеток, связанную с височной эпилепсией» . Природные коммуникации . 11 (1): 4966. Бибкод : 2020NatCo..11.4966B . дои : 10.1038/s41467-020-18757-2 . ПМЦ 7532172 . ПМИД 33009404 .
- ^ Фури С., Ли Д., Монтгомери Дж. М. (февраль 2014 г.). «Якорный белок SAP97 влияет на перемещение и локализацию множества мембранных каналов» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1838 (2): 589–594. дои : 10.1016/j.bbamem.2013.03.015 . ПМИД 23535319 .
- ^ Бисли С., Гунджан А., Кумар С.С. (2023). «Визуализация состава субъединиц тригетеромерного N-метил-D-аспартатного рецептора» . Границы синаптической нейронауки . 15 : 1156777. дои : 10.3389/fnsyn.2023.1156777 . ПМЦ 10244591 . ПМИД 37292368 .
- ^ Лукас Д.Р., Newhouse JP (август 1957 г.). «Токсическое действие L-глутамата натрия на внутренние слои сетчатки». Архив офтальмологии АМА . 58 (2): 193–201. doi : 10.1001/archopht.1957.00940010205006 . ПМИД 13443577 .
- ^ Милнервуд А.Дж., Гладдинг СМ, Пулади М.А., Кауфман А.М., Хайнс Р.М., Бойд Дж.Д. и др. (январь 2010 г.). «Раннее увеличение экстрасинаптической передачи сигналов и экспрессии рецептора NMDA способствует возникновению фенотипа у мышей с болезнью Хантингтона» . Нейрон . 65 (2): 178–190. дои : 10.1016/j.neuron.2010.01.008 . ПМИД 20152125 . S2CID 12987037 .
- ^ Смит Р.С., Уолш, Калифорния (февраль 2020 г.). «Функции ионных каналов в раннем развитии мозга» . Тенденции в нейронауках . 43 (2): 103–114. дои : 10.1016/j.tins.2019.12.004 . ПМЦ 7092371 . ПМИД 31959360 .
- ^ Чен П.Е., Гебалле М.Т., Стэнсфельд П.Дж., Джонстон А.Р., Юань Х., Джейкоб А.Л. и др. (май 2005 г.). «Структурные особенности сайта связывания глутамата в рекомбинантных рецепторах N-метил-D-аспартата NR1 / NR2A, определенные с помощью сайт-направленного мутагенеза и молекулярного моделирования». Молекулярная фармакология . 67 (5): 1470–1484. дои : 10.1124/моль.104.008185 . ПМИД 15703381 . S2CID 13505187 .
- ^ Волоскер Х (октябрь 2006 г.). «D-сериновая регуляция активности рецептора NMDA». СТКЭ науки . 2006 (356): пе41. дои : 10.1126/stke.3562006pe41 . ПМИД 17033043 . S2CID 39125762 .
- ^ Перейти обратно: а б Бисли С., Кумар С.С. (ноябрь 2023 г.). «Рецептор tN-метил-d-аспартата: доводы в пользу того, что d-серин следует считать его обратным коагонистом» . Нейрофармакология . 238 : 109654. doi : 10.1016/j.neuropharm.2023.109654 . ПМИД 37437688 .
- ^ Яроцкий В., Глушаков А.В., Самнерс С., Гравенштейн Н., Деннис Д.М., Зойберт К.Н., Мартынюк А.Е. (май 2005 г.). «Дифференциальная модуляция глутаматергической передачи 3,5-дибром-L-фенилаланином». Молекулярная фармакология . 67 (5): 1648–1654. дои : 10.1124/моль.104.005983 . ПМИД 15687225 . S2CID 11672391 .
- ^ Мартынюк А.Е., Зойберт К.Н., Яроцкий В., Глушаков А.В., Гравенштейн Н., Самнерс С., Деннис Д.М. (ноябрь 2006 г.). «Галогенированные производные ароматических аминокислот проявляют сбалансированное антиглутаматергическое действие: потенциальное применение для лечения неврологических и нервно-психических расстройств». Недавние патенты на открытие лекарств для ЦНС . 1 (3): 261–270. дои : 10.2174/157488906778773706 . ПМИД 18221208 .
- ^ Цао В., Шах Х.П., Глушаков А.В., Мекка А.П., Ши П., Самнерс С. и др. (декабрь 2009 г.). «Эффективность 3,5-дибром-L-фенилаланина на моделях инсульта, судорог и сенсомоторного дефицита у крыс» . Британский журнал фармакологии . 158 (8): 2005–2013. дои : 10.1111/j.1476-5381.2009.00498.x . ПМК 2807662 . ПМИД 20050189 .
- ^ Дж. Москаль, Д. Леандер, Р. Берч (2010). Раскрытие терапевтического потенциала рецептора NMDA. Новости открытия и разработки лекарств . Проверено 19 декабря 2013 г.
- ^ Донелло Дж.Э., Банерджи П., Ли YX, Го YX, Ёситаке Т., Чжан XL и др. (март 2019 г.). «Положительная модуляция рецептора N-метил-D-аспартата с помощью рапастинела способствует быстрому и устойчивому эффекту, подобному антидепрессанту» . Международный журнал нейропсихофармакологии . 22 (3): 247–259. дои : 10.1093/ijnp/pyy101 . ПМК 6403082 . ПМИД 30544218 .
- ^ Андерсон С. (01.06.2003). «Плохих новостей нет: взгляд на диссоциативно-индуцированные повреждения головного мозга и когнитивные нарушения» . Хранилища Erowid DXM: Здоровье . Проверено 17 декабря 2008 г.
- ^ Перейти обратно: а б Рейс МХ (декабрь 2013 г.). «Испытательное наблюдение: усиление фазы II антидепрессантов, нацеленных на глутамат» . Обзоры природы. Открытие наркотиков . 12 (12): 897. дои : 10.1038/nrd4178 . ПМИД 24287771 . S2CID 33113283 .
- ^ Перейти обратно: а б Вечеи Л., Саларди Л., Фюлёп Ф., Толди Дж. (январь 2013 г.). «Кинуренины в ЦНС: последние достижения и новые вопросы». Обзоры природы. Открытие наркотиков . 12 (1): 64–82. дои : 10.1038/nrd3793 . ПМИД 23237916 . S2CID 31914015 .
- ^ Рейс DJ, Регунатан С. (май 2000 г.). «Является ли агматин новым нейромедиатором в мозге?» . Тенденции в фармакологических науках . 21 (5): 187–193. дои : 10.1016/s0165-6147(00)01460-7 . ПМИД 10785653 .
- ^ Гибсон Д.А., Харрис Б.Р., Роджерс Д.Т., Литтлтон Дж.М. (октябрь 2002 г.). «Исследования связывания радиолигандов показывают, что агматин является более селективным антагонистом полиаминного участка рецептора NMDA, чем аркаин или ифенпродил». Исследования мозга . 952 (1): 71–77. дои : 10.1016/s0006-8993(02)03198-0 . ПМИД 12363406 . S2CID 38065910 .
- ^ Мюллер А.Л., Артман Л.Д., Баландрин М.Ф., Брейди Э., Чиен Ю., ДельМар Э.Г. и др. (2000). «NPS 1506, неконкурентный антагонист рецепторов NMDA с умеренным сродством: доклиническое резюме и клинический опыт». Аминокислоты . 19 (1): 177–179. дои : 10.1007/s007260070047 . ПМИД 11026487 . S2CID 2899648 .
- ^ Монге-Фуэнтес В., Гомес Ф.М., Кампос Г.А., Силва Дж., Биолчи А.М., Дос Аньос Л.К. и др. (2015). «Нейроактивные соединения, полученные из ядов членистоногих, как новые терапевтические платформы для лечения неврологических расстройств» . Журнал ядовитых животных и токсинов, включая тропические болезни . 21:31 . doi : 10.1186/s40409-015-0031-x . ПМЦ 4529710 . ПМИД 26257776 .
- ^ Pop E (сентябрь 2000 г.). «Непсихотропные синтетические каннабиноиды». Текущий фармацевтический дизайн . 6 (13): 1347–1360. дои : 10.2174/1381612003399446 . ПМИД 10903397 .
- ^ Фейгенбаум Дж. Дж., Бергманн Ф., Ричмонд С.А., Мечулам Р., Надлер В., Клоог Ю., Соколовский М. (декабрь 1989 г.). «Непсихотропный каннабиноид действует как функциональный блокатор рецепторов N-метил-D-аспартата» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (23): 9584–9587. Бибкод : 1989PNAS...86.9584F . дои : 10.1073/pnas.86.23.9584 . ПМК 298542 . ПМИД 2556719 .
- ^ Надлер В., Мечулам Р., Соколовский М. (сентябрь 1993 г.). «Блокада притока 45Ca2+ через ионный канал рецептора N-метил-D-аспартата непсихоактивным каннабиноидом HU-211». Исследования мозга . 622 (1–2): 79–85. дои : 10.1016/0006-8993(93)90804-в . ПМИД 8242387 . S2CID 36689761 .
- ^ Каракас Э., Симоровски Н., Фурукава Х. (июнь 2011 г.). «Расположение субъединиц и связывание фенилэтаноламина в NMDA-рецепторах GluN1/GluN2B» . Природа . 475 (7355): 249–253. дои : 10.1038/nature10180 . ПМК 3171209 . ПМИД 21677647 .
- ^ Глушаков А.В., Деннис Д.М., Мори Т.Е., Самнерс С., Куккьяра Р.Ф., Зойберт К.Н., Мартынюк А.Е. (2002). «Специфическое ингибирование функции рецептора N-метил-D-аспартата в нейронах гиппокампа крысы L-фенилаланином в концентрациях, наблюдаемых при фенилкетонурии» . Молекулярная психиатрия . 7 (4): 359–367. дои : 10.1038/sj.mp.4000976 . ПМИД 11986979 .
- ^ Глушаков А.В., Глушакова О., Варшни М., Байпай Л.К., Самнерс С., Лайпис П.Дж. и др. (февраль 2005 г.). «Длительные изменения глутаматергической синаптической передачи при фенилкетонурии» . Мозг . 128 (Часть 2): 300–307. дои : 10.1093/brain/awh354 . ПМИД 15634735 .
- ^ Номер клинического исследования NCT00188383 «Влияние антагонизма рецепторов N -метил-D-аспартата (NMDA) на гипералгезию, употребление опиоидов и боль после радикальной простатэктомии» на сайте ClinicalTrials.gov.
- ^ Людольф А.Г., Удварди П.Т., Шаз У., Хенес С., Адольф О., Вейгт Х.У. и др. (май 2010 г.). «Атомоксетин действует как блокатор рецепторов NMDA в клинически значимых концентрациях» . Британский журнал фармакологии . 160 (2): 283–291. дои : 10.1111/j.1476-5381.2010.00707.x . ПМЦ 2874851 . ПМИД 20423340 .
- ^ Шульц Р.Б., Чжун Ю (май 2017 г.). «Миноциклин воздействует на множественные механизмы вторичного повреждения при травматическом повреждении спинного мозга» . Исследование регенерации нейронов . 12 (5): 702–713. дои : 10.4103/1673-5374.206633 . ПМЦ 5461601 . ПМИД 28616020 .
- ^ Перейти обратно: а б с д Lipton SA (октябрь 2007 г.). «Патологически активированные препараты для нейропротекции». Обзоры природы. Нейронаука . 8 (10): 803–808. дои : 10.1038/nrn2229 . ПМИД 17882256 . S2CID 34931289 .
- ^ Сколник П., Бойе К., Миллер Р., Пеннингтон М., Макчеккини М.Л. (октябрь 1992 г.). «Неконкурентное ингибирование N-метил-D-аспартата конантокином-G: доказательства аллостерического взаимодействия в полиаминных сайтах». Журнал нейрохимии . 59 (4): 1516–1521. дои : 10.1111/j.1471-4159.1992.tb08468.x . ПМИД 1328523 . S2CID 25871948 .
- ^ Диджей Хаггинса, Грант Г.Х. (январь 2005 г.). «Функция аминоконцевого домена в модуляции рецептора NMDA». Журнал молекулярной графики и моделирования . 23 (4): 381–388. дои : 10.1016/j.jmgm.2004.11.006 . ПМИД 15670959 .
- ^ Хавасли А.Х., Бенавидес Д.Р., Нгуен Дж., Канси Дж.В., Хаяши К., Чамбон П. и др. (июль 2007 г.). «Циклин-зависимая киназа 5 управляет обучением и синаптической пластичностью посредством контроля деградации NMDAR» . Природная неврология . 10 (7): 880–886. дои : 10.1038/nn1914 . ПМЦ 3910113 . ПМИД 17529984 .
- ^ Чжан С., Эдельманн Л., Лю Дж., Крэндалл Дж.Э., Морабито М.А. (январь 2008 г.). «Cdk5 регулирует фосфорилирование тирозина 1472 NR2B и поверхностную экспрессию рецепторов NMDA» . Журнал неврологии . 28 (2): 415–424. doi : 10.1523/JNEUROSCI.1900-07.2008 . ПМК 6670547 . ПМИД 18184784 .
- ^ Чен Ю, Бефферт У, Эртунц М, Тан Т.С., Кавалали Э.Т., Безпрозванный И., Герц Дж. (сентябрь 2005 г.). «Рилин модулирует активность рецепторов NMDA в корковых нейронах» . Журнал неврологии . 25 (36): 8209–8216. doi : 10.1523/JNEUROSCI.1951-05.2005 . ПМК 6725528 . ПМИД 16148228 .
- ^ Ю XM, Аскалан Р., Кейл Г.Дж., Солтер М.В. (январь 1997 г.). «Регуляция каналов NMDA с помощью ассоциированной с каналом протеинтирозинкиназы Src». Наука . 275 (5300): 674–678. дои : 10.1126/science.275.5300.674 . ПМИД 9005855 . S2CID 39275755 .
- ^ Петроцциелло Т., Боша Ф., Германс В., Панначчоне А., де Роза В., Корвино А. и др. (январь 2022 г.). "Нет + /Что 2+ изоформа обменника 1 участвует в Ca 2+ SOD1 в первичных мотонейронах, подвергшихся воздействию бета-метиламино-L-аланина» . Cell Communication and Signaling . 20 (1): 8. doi : 10.1186/s12964-021-00813-z . PMC 8756626. Связанный с этим путь выживания PMID 35022040 .
- ^ Хорнинг М.С., Тромбли PQ (октябрь 2001 г.). «Цинк и медь влияют на возбудимость нейронов обонятельной луковицы крысы посредством нескольких механизмов». Журнал нейрофизиологии . 86 (4): 1652–1660. дои : 10.1152/jn.2001.86.4.1652 . ПМИД 11600628 . S2CID 6141092 .
- ^ Нил А.П., Стэнсфилд К.Х., Уорли П.Ф., Томпсон Р.Э., Гиларте Т.Р. (июль 2010 г.). «Воздействие свинца во время синаптогенеза изменяет везикулярные белки и ухудшает высвобождение везикул: потенциальная роль зависимой от рецептора NMDA передачи сигналов BDNF» . Токсикологические науки . 116 (1): 249–263. дои : 10.1093/toxsci/kfq111 . ПМЦ 2886862 . ПМИД 20375082 .
- ^ Перейти обратно: а б Фуржо Л., Давенпорт СМ, Тайлер СМ, Ченг Т.Т., Спенсер М.Б., Буланже Л.М. (декабрь 2010 г.). «Класс I MHC модулирует функцию рецептора NMDA и трафик рецептора AMPA» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (51): 22278–22283. Бибкод : 2010PNAS..10722278F . дои : 10.1073/pnas.0914064107 . ПМК 3009822 . ПМИД 21135233 .
- ^ Ха Г.С., Буланже Л.М., Ду Х., Рикельме П.А., Бротц Т.М., Шац С.Дж. (декабрь 2000 г.). «Функциональные требования к MHC класса I в развитии и пластичности ЦНС» . Наука . 290 (5499): 2155–2159. Бибкод : 2000Sci...290.2155H . дои : 10.1126/science.290.5499.2155 . ПМК 2175035 . ПМИД 11118151 .
- ^ Нельсон П.А., Сейдж-младший, Вуд С.К., Давенпорт СМ, Анагностарас С.Г., Буланже Л.М. (сентябрь 2013 г.). «Иммунные белки MHC класса I имеют решающее значение для гиппокамп-зависимой памяти и ворот NMDAR-зависимой долгосрочной депрессии гиппокампа» . Обучение и память . 20 (9): 505–517. дои : 10.1101/lm.031351.113 . ПМК 3744042 . ПМИД 23959708 .
- ^ Трайнелис С.Ф., Калл-Кэнди С.Г. (май 1990 г.). «Протонное ингибирование рецепторов N-метил-D-аспартата в нейронах мозжечка». Природа . 345 (6273): 347–350. Бибкод : 1990Natur.345..347T . дои : 10.1038/345347a0 . ПМИД 1692970 . S2CID 4351139 .
- ^ Айзенман Э., Липтон С.А., Лоринг Р.Х. (март 1989 г.). «Селективная модуляция ответов NMDA путем восстановления и окисления». Нейрон . 2 (3): 1257–1263. дои : 10.1016/0896-6273(89)90310-3 . ПМИД 2696504 . S2CID 10324716 .
- ^ Монаган Д.Т., Джейн Д.Э. (2009). «Фармакология NMDA-рецепторов» . В Ван Донгене AM (ред.). Биология рецептора NMDA . Границы в неврологии. Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-4414-0 . ПМИД 21204415 .
- ^ Перейти обратно: а б с д Сонкусаре С.К., Каул С.Л., Рамарао П. (январь 2005 г.). «Слабоумие при болезни Альцгеймера и других нейродегенеративных расстройствах — мемантин, новая надежда». Фармакологические исследования . 51 (1): 1–17. дои : 10.1016/j.phrs.2004.05.005 . ПМИД 15519530 .
- ^ Такахаши Х., Ся П., Цуй Дж., Талантова М., Бодхинатан К., Ли В. и др. (октябрь 2015 г.). «Фармакологически целевой антагонизм нитромемантина к рецепторам NMDA при цереброваскулярных заболеваниях» . Научные отчеты . 5 : 14781. Бибкод : 2015NatSR...514781T . дои : 10.1038/srep14781 . ПМК 4609936 . ПМИД 26477507 .
- ^ Первс Д., Августин Г.Дж., Фитцпатрик Д., Холл У.К., ЛаМантия А.С., Макнамара Дж.Д., Уайт Л.Е. (2008). Нейронаука (4-е изд.). Синауэр Ассошиэйтс. стр. 129–131. ISBN 978-0-87893-697-7 . Архивировано из оригинала 27 сентября 2011 г.
- ^ Варгас-Кабальеро М., Робинсон Х.П. (июль 2004 г.). «Быстрая и медленная зависимая от напряжения динамика блока магния в рецепторе NMDA: модель асимметричного блока захвата» . Журнал неврологии . 24 (27): 6171–6180. doi : 10.1523/jneurosci.1380-04.2004 . ПМК 6729657 . ПМИД 15240809 .
- ^ Первс Д., Августин Г.Дж., Фитцпатрик Д., Холл У.К., ЛаМантия А.С., Макнамара Дж.Д., Уайт Л.Е. (2008). Нейронаука (4-е изд.). Синауэр Ассошиэйтс. стр. 191–195. ISBN 978-0-87893-697-7 . Архивировано из оригинала 27 сентября 2011 г.
- ^ Новак Л., Брегестовский П., Ашер П., Хербет А., Прочианц А. (февраль 1984 г.). «Каналы, активируемые глутаматом магниевых ворот, в центральных нейронах мыши». Природа . 307 (5950): 462–465. Бибкод : 1984Natur.307..462N . дои : 10.1038/307462a0 . ПМИД 6320006 . S2CID 4344173 .
- ^ Виджесингхе Р. (2014). «Новые методы лечения резистентной депрессии» . Клиника психического здоровья . 4 (5): 56. дои : 10.9740/mhc.n207179 . ISSN 2168-9709 .
- ^ Пун Л. (2014). «Все больше доказательств того, что наркотик для вечеринок может помочь при тяжелой депрессии» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР.
- ^ Стикс Джи (2014). «От клуба к клинике: врачи продвигают нестандартный кетамин как средство быстрого лечения депрессии» . Научный американец.
- ^ Перейти обратно: а б МакИвен Б.С., Чаттарджи С., Даймонд Д.М., Джей Т.М., Рейган Л.П., Свенингссон П., Фукс Э. (март 2010 г.). «Нейробиологические свойства тианептина (Стаблона): от моноаминной гипотезы к глутаматергической модуляции» . Молекулярная психиатрия . 15 (3): 237–249. дои : 10.1038/mp.2009.80 . ПМК 2902200 . ПМИД 19704408 .
- ^ МакИвен Б.С., Чаттарджи С. (декабрь 2004 г.). «Молекулярные механизмы нейропластичности и фармакологические последствия: на примере тианептина». Европейская нейропсихофармакология . 14 (Приложение 5): S497–S502. doi : 10.1016/j.euroneuro.2004.09.008 . ПМИД 15550348 . S2CID 21953270 .
- ^ МакИвен Б.С., Оли Дж.П. (июнь 2005 г.). «Нейробиология настроения, тревоги и эмоций, выявленная исследованиями уникального антидепрессанта: тианептина» . Молекулярная психиатрия . 10 (6): 525–537. дои : 10.1038/sj.mp.4001648 . ПМИД 15753957 .
- ^ Бринк CB, Харви Б.Х., Брэнд L (январь 2006 г.). «Тианептин: новый атипичный антидепрессант, который может дать новое понимание биомолекулярной основы депрессии» . Недавние патенты на открытие лекарств для ЦНС . 1 (1): 29–41. дои : 10.2174/157488906775245327 . ПМИД 18221189 . Архивировано из оригинала 14 апреля 2013 г. Проверено 12 апреля 2020 г.
- ^ Перейти обратно: а б Каспер С., МакИвен Б.С. (2008). «Нейробиологические и клинические эффекты антидепрессанта тианептина». Препараты ЦНС . 22 (1): 15–26. дои : 10.2165/00023210-200822010-00002 . ПМИД 18072812 . S2CID 30330824 .
- ^ Гора C, Даунтон C (июль 2006 г.). «Болезнь Альцгеймера: прогресс или прибыль?» . Природная медицина . 12 (7): 780–784. дои : 10.1038/nm0706-780 . ПМИД 16829947 .
- ^ Оценка технологии NICE, 18 января 2011 г. Болезнь Ацгеймера - донепезил, галантамин, ривастигмин и мемантин (обзор): окончательное определение оценки
- ^ Тодд А. Харди, Реддел, Барнетт, Палас, Луккинетти, Вайншенкер, Атипичные воспалительные демиелинизирующие синдромы ЦНС, Ланцетная неврология, том 15, выпуск 9, август 2016 г., страницы 967-981, doi: https://doi.org /10.1016/S1474-4422(16)30043-6 , доступно по адресу: [1]
- ^ Лисман Дж. Э., Койл Дж. Т., Грин Р. В., Джавитт Д. С., Бенес Ф. М., Хекерс С., Грейс А. А. (май 2008 г.). «Схемная основа для понимания взаимодействия нейромедиаторов и генов риска при шизофрении» . Тенденции в нейронауках . 31 (5): 234–242. дои : 10.1016/j.tins.2008.02.005 . ПМК 2680493 . ПМИД 18395805 .
- ^ Сантос Э., Оливарес-Ривера А., Майор С., Санчес-Поррас Р., Ульманн Л., Кунцманн К. и др. (декабрь 2019 г.). «Длительная s-кетаминовая блокада распространения деполяризации при субарахноидальном кровоизлиянии: ретроспективное когортное исследование» . Критическая помощь . 23 (1): 427. doi : 10.1186/s13054-019-2711-3 . ПМЦ 6937792 . ПМИД 31888772 .
Внешние ссылки
[ редактировать ] СМИ, связанные с рецептором NMDA, на Викискладе?
СМИ, связанные с рецептором NMDA, на Викискладе? - Фармакология рецептора NMDA
- Двигательная дискоординация возникает в результате комбинированного нарушения генов субъединиц NR2A и NR2C рецептора NMDA, но не в результате одиночного нарушения субъединицы NR2A или NR2C.
- дрозофилы Рецептор 1 NMDA - Интерактивная муха