Лиганд-управляемый ионный канал
| Трансмембранная область ионного канала, управляемая нейротрансмиттером | |||
|---|---|---|---|
 Лиганд-управляемый ионный канал | |||
| Идентификаторы | |||
| Символ | Neur_chan_memb | ||
| Пфам | PF02932 | ||
| ИнтерПро | ИПР006029 | ||
| PROSITE | PDOC00209 | ||
| СКОП2 | 1чек / СКОПе / СУПФАМ | ||
| TCDB | 1.А.9 | ||
| Суперсемейство OPM | 14 | ||
| белок OPM | 2bg9 | ||
| |||

- Рецептор, связанный с ионными каналами
- Ионы
- Лиганд (например, ацетилхолин )
Лиганд-управляемые ионные каналы ( LIC , LGIC ), также часто называемые ионотропными рецепторами , представляют собой группу трансмембранных белков ионных каналов , которые открываются для пропуска ионов, таких как Na. + , К + , Как 2+ и/или Cl − проходить через мембрану в ответ на связывание химического посланника (т.е. лиганда ) , такого как нейромедиатор . [1] [2] [3]
Когда пресинаптический нейрон возбуждается, он высвобождает нейромедиатор из везикул в синаптическую щель . Затем нейромедиатор связывается с рецепторами, расположенными на постсинаптическом нейроне . Если эти рецепторы представляют собой ионные каналы, управляемые лигандами, в результате конформационного изменения открываются ионные каналы, что приводит к потоку ионов через клеточную мембрану. Это, в свою очередь, приводит либо к деполяризации для реакции возбуждающего рецептора, либо к гиперполяризации для тормозной реакции.
Эти рецепторные белки обычно состоят по меньшей мере из двух разных доменов: трансмембранного домена, который включает ионную пору, и внеклеточного домена, который включает место связывания лиганда ( аллостерический сайт связывания). Эта модульность позволила применить подход «разделяй и властвуй» к поиску структуры белков (кристаллизация каждого домена отдельно). Функция таких рецепторов, расположенных в синапсах, преобразовании химического сигнала пресинаптически заключается в прямом и очень быстром высвобождаемого нейромедиатора в постсинаптический электрический сигнал. Многие LIC дополнительно модулируются аллостерическими лигандами , блокаторами каналов , ионами или мембранным потенциалом . LIC подразделяются на три суперсемейства, которые не имеют эволюционного родства: рецепторы цис-петли , ионотропные рецепторы глутамата и АТФ-управляемые каналы .
Цис-петлевые рецепторы
[ редактировать ]
Рецепторы цис-петли названы в честь характерной петли, образованной дисульфидной связью между двумя цистеиновыми остатками в N-концевом внеклеточном домене. Они являются частью более крупного семейства пентамерных лиганд-управляемых ионных каналов, в которых обычно отсутствует эта дисульфидная связь, отсюда и предварительное название «рецепторы пропетли». [4] [5] Сайт связывания во внеклеточном N-концевом лиганд-связывающем домене придает им специфичность к рецепторам (1) ацетилхолина (AcCh), (2) серотонина, (3) глицина, (4) глутамата и (5) γ-аминомасляной кислоты (ГАМК). ) у позвоночных. Рецепторы подразделяются по типу проводимого ими иона (анионные или катионные) и далее на семейства, определяемые эндогенным лигандом. Обычно они являются пентамерными, каждая субъединица содержит 4 трансмембранные спирали, составляющие трансмембранный домен, и внеклеточный, N-концевой, лигандсвязывающий домен типа сэндвича с бета-листом. [6] Некоторые также содержат внутриклеточный домен, как показано на изображении.
Прототипом лиганд-управляемого ионного канала является никотиновый ацетилхолиновый рецептор . Он состоит из пентамера белковых субъединиц (обычно ααβγδ) с двумя сайтами связывания ацетилхолина (по одному на границе каждой альфа-субъединицы). Когда ацетилхолин связывается, он изменяет конфигурацию рецептора (скручивает спирали Т2, что выводит остатки лейцина, блокирующие пору, из пути канала) и вызывает расширение поры примерно на 3 ангстрема до примерно 8 ангстрем, так что ионы могут пройти. Эта пора позволяет Na + ионы стекают по электрохимическому градиенту в клетку. При одновременном открытии достаточного количества каналов внутрь поступает положительный заряд, переносимый Na. + Ионы деполяризуют постсинаптическую мембрану в достаточной степени, чтобы инициировать потенциал действия .
Был идентифицирован бактериальный гомолог LIC, который, тем не менее, предположительно действует как хеморецептор. [4] Этот прокариотический вариант нАХР известен как рецептор GLIC по названию вида, у которого он был идентифицирован; Gloeobacter L канале igand- I на C. gate
Структура
[ редактировать ]Рецепторы Cys-петли имеют хорошо консервативные структурные элементы с большим внеклеточным доменом (ECD), содержащим альфа-спираль и 10 бета-цепей. После ECD четыре трансмембранных сегмента (TMS) соединены внутриклеточными и внеклеточными петлевыми структурами. [7] За исключением петли ТМС 3–4, их длина составляет всего 7–14 остатков. Петля TMS 3-4 образует большую часть внутриклеточного домена (ICD) и представляет собой наиболее вариабельную область между всеми этими гомологичными рецепторами. ICD определяется петлей TMS 3-4 вместе с петлей TMS 1-2, предшествующей поре ионного канала. [7] Кристаллизация выявила структуры некоторых членов семейства, но для обеспечения кристаллизации внутриклеточная петля обычно заменялась коротким линкером, присутствующим в прокариотических рецепторах цис-петли, поэтому их структура неизвестна. Тем не менее, эта внутриклеточная петля, по-видимому, участвует в десенсибилизации, модуляции физиологии каналов фармакологическими веществами и посттрансляционных модификациях . Там находятся мотивы, важные для транспорта, и ICD взаимодействует с каркасными белками, обеспечивая образование ингибирующих синапсов . [7]
Катионные рецепторы цис-петли
[ редактировать ]| Тип | Сорт | рекомендовано IUPHAR название белка [8] | Ген | Предыдущие имена |
|---|---|---|---|---|
| Серотонин (5-НТ) | 5- HT3 | 5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E | HTR3A HTR3B HTR3C HTR3D HTR3E | 5-НТ 3А 5-НТ 3Б 5- HT3C 5-HT 3D 5-НТ 3Е |
| Никотиновый ацетилхолин (нАХР) | альфа | а1 а2 а3 а4 а5 а6 а7 а9 а10 | CHRNA1 CHRNA2 CHRNA3 CHRNA4 CHRNA5 CHRNA6 CHRNA7 CHRNA9 CHRNA10 | ACHRA, ACHRD, CHRNA, CMS2A, FCCMS, SCCMS |
| бета | б1 б2 б3 б4 | ЧРНБ1 ЧРНБ2 ЧРНБ3 ЧРНБ4 | CMS2A, SCCMS, ACHRB, CHRNB, CMS1D EFNL3, нАХРБ2 | |
| гамма | с | ЧРНГ | АХРГ | |
| дельта | д | ЧРНД | ACHRD, CMS2A, FCCMS, SCCMS | |
| эпсилон | е | ЧЕРНЫЙ | ACHRE, CMS1D, CMS1E, CMS2A, FCCMS, SCCMS | |
| Ионный канал, активируемый цинком (ЗАК) | ЗАК | ЗАКН | ZAC1, L2m COUNT, COUNT1 |
Анионные рецепторы цис-петли
[ редактировать ]| Тип | Сорт | рекомендовано IUPHAR название белка [8] | Ген | Предыдущие имена |
|---|---|---|---|---|
| GABAРЫНОК | альфа | а1 а2 а3 а4 а5 а6 | ГАБРА1 ГАБРА2 ГАБРА3 ГАБРА4 ГАБРА5 ГАБРА6 | ЭЖМ, ECA4 |
| бета | б1 б2 б3 | ГАББР1 ГАББР2 ГАББР3 | ЭКА5 | |
| гамма | с1 с2 с3 | ГАБРГ1 ГАБРГ2 ГАБРГ3 | CAE2, ECA2, GEFSP3 | |
| дельта | д | ГАББРД | ||
| эпсилон | е | ГАБРИ | ||
| пи | п | ГАБРП | ||
| тэта | я | ГАБРК | ||
| ро | п1 п2 п3 | ГАБРР1 ГАБРР2 ГАБРР3 | ГАМК С [9] | |
| Глицин (ГлиР) | альфа | а1 а2 а3 а4 | ГЛРА1 ГЛРА2 GLRA3 ГЛРА4 | СТЭ |
| бета | б | ГЛРБ |
Ионотропные глутаматные рецепторы
[ редактировать ]Ионотропные рецепторы глутамата связывают нейромедиатор глутамат . Они образуют тетрамеры, каждая субъединица которых состоит из внеклеточного аминоконцевого домена (ATD, который участвует в сборке тетрамера), внеклеточного лигандсвязывающего домена (LBD, который связывает глутамат) и трансмембранного домена (TMD, который образует ионный канал). . Трансмембранный домен каждой субъединицы содержит три трансмембранные спирали, а также полумембранную спираль с возвратной петлей. Структура белка начинается с ATD на N-конце, за которой следует первая половина LBD, которая прерывается спиралями 1, 2 и 3 TMD, а затем продолжается последней половиной LBD и затем заканчивается спиралью 4 ВНЧС на С-конце. Это означает, что существует три связи между ВНЧС и внеклеточными доменами. Каждая субъединица тетрамера имеет сайт связывания глутамата, образованный двумя участками LBD, образующими форму раскладушки. Только два из этих сайтов в тетрамере должны быть заняты, чтобы открыть ионный канал. Пора в основном образована полуспиралью 2, напоминающей перевернутую калиевый канал .

| Тип | Сорт | рекомендовано IUPHAR название белка [8] | Ген | Предыдущие имена |
|---|---|---|---|---|
| АМПА | ГлуА | ГлуА1 ГлуА2 ГлуА3 ГлуА4 | ГРИА1 ГРИЯ2 ГРИА3 ГРИА4 | GLU A1 , GluR1, GluRA, GluR-A, GluR-K1, HBGR1 GLU A2 , GluR2, GluRB, GluR-B, GluR-K2, HBGR2 ГЛЮ А3 , ГлюР3, ГлюРК, ГлюР-С, ГлюР-К3 ГЛУ А4 , ГлюР4, ГлуРД, ГлюР-Д |
| Каинатэ | ГлюК | ГлюК1 ГлюК2 ГлюК3 ГлюК4 ГлюК5 | ГРИК1 ГРЕЧЕСКИЙ2 ГРЕЧЕСКИЙ3 ГРИК4 ГРИК5 | ГЛУ К5 , ГлуР5, ГлуР-5, ЕАА3 ГЛУ К6 , ГлуР6, ГлюР-6, ЕАА4 ГЛУ К7 , ГлуР7, ГлюР-7, ЕАА5 ГЛУ К1 , КА1, КА-1, ЕАА1 ГЛУ К2 , КА2, КА-2, ЕАА2 |
| НМДА | ГлюН | ГлюН1 НРЛ1А НРЛ1Б | ГРИН1 ГРИНЛ1А ГРИНЛ1Б | ГЛЮ N1 , NMDA-R1, NR1, GluRξ1 |
| ГлюН2А ГлюН2Б ГлюН2К ГлюН2Д | ГРИН2А ГРИН2Б GRIN2C ГРИН2Д | GLU N2A , NMDA-R2A, NR2A, GluRε1 GLU N2B , NMDA-R2B, NR2B, hNR3, GluRε2 ГЛУ N2C , NMDA-R2C, NR2C, GluRε3 GLU N2D , NMDA-R2D, NR2D, GluRε4 | ||
| ГлюН3А ГлюН3Б | ГРИН3А ГРИН3Б | ГЛУ Н3А , НМДА-Р3А, НМДАР-Л, чи-1 ГЛУ 3Б , НМДА-Р3Б | ||
| 'Сирота' | (ГлуД) | ГлуД1 ГлуД2 | СЕТКА1 ГРИД2 | GluRδ1 GluRδ2 |
АМРА-рецептор
[ редактировать ]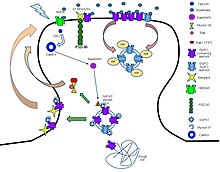
Рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (также известный как рецептор AMPA или кисквалатный рецептор ) представляет собой не- NMDA -типа ионотропный трансмембранный рецептор для глутамата , который обеспечивает быструю синаптическую передачу в центральной нервной системе. система (ЦНС).Его название происходит от его способности активироваться искусственным аналогом глутамата AMPA . Рецептор был впервые назван «рецептором кисквалата» Уоткинсом и его коллегами в честь встречающегося в природе агониста кисквалата , и только позже ему было присвоено название «рецептор АМРА» в честь селективного агониста, разработанного Таге Оноре и его коллегами в Датской королевской фармацевтической школе в Копенгагене. . [10] AMPAR обнаружены во многих частях мозга и являются наиболее часто встречающимся рецептором в нервной системе . Тетрамер АМРА-рецептора GluA2 (GluR2) был первым кристаллизованным ионным каналом глутаматного рецептора . Лиганды включают:
- Агонисты : глутамат , АМРА , 5-фторвиллардиин , домоевая кислота , кискваловая кислота и т. д.
- Антагонисты : CNQX , Кинуреновая кислота , NBQX , Перампанел , Пирацетам и др.
- Положительные аллостерические модуляторы : Анирацетам , Циклотиазид , CX-516 , CX-614 и др.
- Отрицательные аллостерические модуляторы : Этанол , Перампанель , Талампанель , GYKI-52,466 и др.
NMDA-рецепторы
[ редактировать ]
Рецептор N-метил-D-аспартата ( рецептор NMDA ) – тип ионотропного рецептора глутамата – представляет собой лиганд-управляемый ионный канал, который открывается за счет одновременного связывания глутамата и коагониста (т.е. либо D-серина , либо глицин ). [11] Исследования показывают, что рецептор NMDA участвует в регуляции синаптической пластичности и памяти. [12] [13]
Название «рецептор NMDA» происходит от лиганда N-метил-D-аспартата (NMDA), который действует как селективный агонист этих рецепторов. Когда рецептор NMDA активируется связыванием двух коагонистов, катионный канал открывается, позволяя Na + и Ca 2+ поступать в клетку, в свою очередь повышая электрический потенциал клетки . Таким образом, рецептор NMDA является возбуждающим рецептором. При потенциалах покоя связывание Mg 2+ или Zn 2+ в своих внеклеточных сайтах связывания на рецепторе блокирует поток ионов через канал рецептора NMDA. «Однако, когда нейроны деполяризуются, например, в результате интенсивной активации колокализованных постсинаптических АМРА-рецепторов , потенциал-зависимая блокада Mg 2+ частично облегчается, обеспечивая приток ионов через активированные рецепторы NMDA. Полученный Ca 2+ приток может запускать различные внутриклеточные сигнальные каскады, которые в конечном итоге могут изменить функцию нейронов посредством активации различных киназ и фосфатаз». [14] Лиганды включают:
- Первичные эндогенные коагонисты : глутамат и D-серин или глицин.
- Другие агонисты : аминоциклопропанкарбоновая кислота ; D-циклосерин ; L-аспартат; хинолинат и др.
- Частичные агонисты: N-метил-D-аспарагиновая кислота ( NMDA ); НРХ-1074 ; 3,5-дибром-L-фенилаланин, [15] и т. д.
- Антагонисты : кетамин , PCP , декстропропоксифен , кетобемидон , трамадол , кинуреновая кислота ( эндогенная ) и др.
АТФ-зависимые каналы
[ редактировать ]
АТФ-зависимые каналы открываются в ответ на связывание нуклеотида АТФ . Они образуют тримеры с двумя трансмембранными спиралями на субъединицу и C- и N-концами на внутриклеточной стороне.
| Тип | Сорт | рекомендовано IUPHAR название белка [8] | Ген | Предыдущие имена |
|---|---|---|---|---|
| P2X | Н/Д | P2X1 P2X2 P2X3 P2X4 P2X5 P2X6 P2X7 | P2RX1 P2RX2 P2RX3 P2RX4 P2RX5 P2RX6 P2RX7 | П2Х 1 П2Х 2 П2Х 3 П2Х 4 П2Х 5 П2Х 6 П2Х 7 |
Клиническая значимость
[ редактировать ]Лиганд-управляемые ионные каналы, вероятно, являются основным местом анестетиков и этанола , хотя однозначные доказательства этого еще не установлены. действия [16] [17] В частности, на рецепторы ГАМК и NMDA действуют анестетики в концентрациях, аналогичных тем, которые используются в клинической анестезии. [18]
Благодаря пониманию механизма и изучению химического/биологического/физического компонента, который может действовать на эти рецепторы, все больше и больше клинических применений подтверждается предварительными экспериментами или FDA . Мемантин одобрен USFDA и Европейским агентством лекарственных средств для лечения болезни Альцгеймера от умеренной до тяжелой степени . [19] Великобритании и теперь получил ограниченную рекомендацию Национального института здравоохранения и передового опыта для пациентов, которым другие варианты лечения не помогли. [20] Агомелатин – это тип препарата, который действует по двойному мелатонинергическому - серотонинергическому пути, который показал свою эффективность при лечении тревожной депрессии в ходе клинических исследований. [21] [22] Исследование также предполагает эффективность при лечении атипичной и меланхолической депрессии . [23]
См. также
[ редактировать ]- Потенциал действия
- Ионный канал, чувствительный к кислоте
- Кальций-активируемый калиевый канал
- Циклический нуклеотид-управляемый ионный канал
- Потенциал-зависимый кальциевый канал
- Рецептор (биохимия)
- Инозитолтрифосфатный рецептор
- Метаботропный рецептор
- Рианодиновый рецептор
Ссылки
[ редактировать ]- ^ «Семейство генов: лиганд-управляемые ионные каналы» . Комитет по генной номенклатуре Хьюго.
- ^ «лиганд-зависимый канал» в Медицинском словаре Дорланда
- ^ Первс, Дейл, Джордж Дж. Августин, Дэвид Фицпатрик, Уильям К. Холл, Энтони-Сэмюэл ЛаМантиа, Джеймс О. Макнамара и Леонард Э. Уайт (2008). Нейронаука. 4-е изд . Синауэр Ассошиэйтс. стр. 156–7. ISBN 978-0-87893-697-7 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Тасним А., Айер Л.М., Якобссон Э., Аравинд Л. (2004). «Идентификация прокариотических ионных каналов, управляемых лигандами, и их значение для механизмов и происхождения ионных каналов Cys-петли животных» . Геномная биология . 6 (1): Р4. дои : 10.1186/gb-2004-6-1-r4 . ПМК 549065 . ПМИД 15642096 .
- ^ Жайте М., Тали А., Энен Дж. (2016). «Эволюция пентамерных лиганд-управляемых ионных каналов: пропетлевые рецепторы» . ПЛОС ОДИН . 11 (3): e0151934. Бибкод : 2016PLoSO..1151934J . дои : 10.1371/journal.pone.0151934 . ПМЦ 4795631 . ПМИД 26986966 .
- ^ Касио М. (май 2004 г.). «Структура и функция глицинового рецептора и родственных ему никотиноидных рецепторов» . Журнал биологической химии . 279 (19): 19383–6. дои : 10.1074/jbc.R300035200 . ПМИД 15023997 .
- ^ Перейти обратно: а б с Ланглхофер Г., Вильманн К. (1 января 2016 г.). «Внутриклеточная петля глицинового рецептора: дело не только в размере» . Границы молекулярной нейронауки . 9 : 41. doi : 10.3389/fnmol.2016.00041 . ПМЦ 4891346 . ПМИД 27330534 .
- ^ Перейти обратно: а б с д Коллингридж Г.Л., Олсен Р.В., Питерс Дж., Спеддинг М. (январь 2009 г.). «Номенклатура лиганд-управляемых ионных каналов» . Нейрофармакология . 56 (1): 2–5. doi : 10.1016/j.neuropharm.2008.06.063 . ПМЦ 2847504 . ПМИД 18655795 .
- ^ Олсен Р.В., Зигхарт В. (сентябрь 2008 г.). «Международный союз фармакологии. LXX. Подтипы рецепторов гамма-аминомасляной кислоты (А): классификация на основе субъединичного состава, фармакологии и функции. Обновление» . Фармакологические обзоры . 60 (3): 243–60. дои : 10.1124/пр.108.00505 . ПМЦ 2847512 . ПМИД 18790874 .
- ^ Оноре Т., Лауридсен Дж., Крогсгаард-Ларсен П. (январь 1982 г.). «Связывание [3H] AMPA, структурного аналога глутаминовой кислоты, с мембранами головного мозга крысы». Журнал нейрохимии . 38 (1): 173–8. дои : 10.1111/j.1471-4159.1982.tb10868.x . ПМИД 6125564 . S2CID 42753770 .
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 5: Возбуждающие и ингибирующие аминокислоты». В Сидоре А., Брауне Р.Ю. (ред.). Молекулярная нейрофармакология: фонд клинической неврологии (2-е изд.). Нью-Йорк, США: McGraw-Hill Medical. стр. 124–125. ISBN 9780071481274 .
При мембранных потенциалах более отрицательных, чем примерно -50 мВ, Mg 2+ во внеклеточной жидкости мозга практически устраняет поток ионов через каналы NMDA-рецепторов даже в присутствии глутамата. ... Рецептор NMDA уникален среди всех рецепторов нейромедиаторов тем, что его активация требует одновременного связывания двух разных агонистов. Помимо связывания глутамата в обычном сайте связывания агониста, для активации рецептора, по-видимому, необходимо связывание глицина. Поскольку ни один из этих агонистов по отдельности не может открыть этот ионный канал, глутамат и глицин называются коагонистами рецептора NMDA. Физиологическое значение сайта связывания глицина неясно, поскольку считается, что нормальная внеклеточная концентрация глицина является насыщающей. Однако недавние данные свидетельствуют о том, что D-серин может быть эндогенным агонистом этого сайта.
- ^ Ли Ф, Цянь Дж.З. (июль 2009 г.). «Память и NMDA-рецепторы» . Медицинский журнал Новой Англии . 361 (3): 302–3. doi : 10.1056/NEJMcibr0902052 . ПМЦ 3703758 . ПМИД 19605837 .
- ^ Цао X, Цуй Z, Фэн Р, Тан ЮП, Цинь Z, Мэй Б, Цянь JZ (март 2007 г.). «Поддержание превосходных функций обучения и памяти у трансгенных мышей NR2B во время старения». Европейский журнал неврологии . 25 (6): 1815–22. дои : 10.1111/j.1460-9568.2007.05431.x . ПМИД 17432968 . S2CID 15442694 .
- ^ Дингледин Р., Борхес К., Боуи Д., Трайнелис С.Ф. (март 1999 г.). «Ионные каналы глутаматных рецепторов». Фармакологические обзоры . 51 (1): 7–61. ПМИД 10049997 .
- ^ Яроцкий В., Глушаков А.В., Самнерс С., Гравенштейн Н., Деннис Д.М., Зойберт К.Н., Мартынюк А.Е. (май 2005 г.). «Дифференциальная модуляция глутаматергической передачи 3,5-дибром-L-фенилаланином». Молекулярная фармакология . 67 (5): 1648–54. дои : 10.1124/моль.104.005983 . ПМИД 15687225 . S2CID 11672391 .
- ^ Красовский, доктор медицинских наук, Харрисон Н.Л. (август 1999 г.). «Общее анестезирующее действие на лиганд-управляемые ионные каналы» . Клеточные и молекулярные науки о жизни . 55 (10): 1278–303. дои : 10.1007/s000180050371 . ПМК 2854026 . ПМИД 10487207 .
- ^ Дилгер Дж. П. (июль 2002 г.). «Влияние общих анестетиков на лиганд-управляемые ионные каналы» . Британский журнал анестезии . 89 (1): 41–51. дои : 10.1093/bja/aef161 . ПМИД 12173240 .
- ^ Харрис Р.А., Михик С.Дж., Дилди-Мэйфилд Дж.Э., Мачу Т.К. (ноябрь 1995 г.). «Действие анестетиков на лиганд-управляемые ионные каналы: роль субъединичного состава рецептора» (аннотация) . Журнал ФАСЭБ . 9 (14): 1454–62. дои : 10.1096/fasebj.9.14.7589987 . ПМИД 7589987 . S2CID 17913232 .
- ^ Гора C, Даунтон C (июль 2006 г.). «Болезнь Альцгеймера: прогресс или прибыль?». Природная медицина . 12 (7): 780–4. дои : 10.1038/nm0706-780 . ПМИД 16829947 . S2CID 31877708 .
- ^ Оценка технологии NICE, 18 января 2011 г. Болезнь Ацгеймера - донепезил, галантамин, ривастигмин и мемантин (обзор): окончательное определение оценки
- ^ Хын, Р; Корал, РМ; Ахокас, А; Николини, Х; Тейшейра, Ж.М.; Дехелин, П. (2013). «1643 - Эффективность агомелатина у более тревожных пожилых пациентов с депрессией. Рандомизированное двойное слепое исследование по сравнению с плацебо». Европейская психиатрия . 28 (Приложение 1): 1. doi : 10.1016/S0924-9338(13)76634-3 . S2CID 144761669 .
- ^ Брантон, Л; Чабнер, Б; Ноллман, Б. (2010). «Фармакологические основы терапии» Гудмана и Гилмана (12-е изд.). Нью-Йорк: McGraw-Hill Professional. ISBN 978-0-07-162442-8 .
- ^ Аведисова, А; Марачев, М (2013). «2639 – Эффективность агомелатина (вальдоксана) при лечении атипичной депрессии». Европейская психиатрия . 28 (Приложение 1): 1. doi : 10.1016/S0924-9338(13)77272-9 . S2CID 145014277 .
Внешние ссылки
[ редактировать ]- База данных лиганд-зависимых ионных каналов Европейского института биоинформатики . Наличие подтверждено 11 апреля 2007 г.
- «Пересмотренные рекомендации по номенклатуре лиганд-управляемых ионных каналов» . База данных IUPHAR по рецепторам и ионным каналам . Международный союз фундаментальной и клинической фармакологии.
- www.esf.edu
- www.genenames.org
- www.guidetopharmacology.org
На момент редактирования в этой статье используется контент из «1.A.9 The Neurotransmitter Receptor, Cys Loop, Ligand-Gated Ion Channel (LIC) Family» , который лицензируется таким образом, что разрешается повторное использование в соответствии с Creative Commons Attribution-ShareAlike. 3.0 Непортированная лицензия , но не под GFDL . Все соответствующие условия должны быть соблюдены.