СК канал
| Кальций-активируемый калиевый канал SK | |||
|---|---|---|---|
 СК Канал | |||
| Идентификаторы | |||
| Символ | SK_канал | ||
| Пфам | PF03530 | ||
| ИнтерПро | ИПР015449 | ||
| |||
SK-каналы ( кальций-активируемые калиевые каналы с малой проводимостью ) представляют собой подсемейство кальций-активируемых калиевых каналов . [1] Они названы так из-за их небольшой одноканальной проводимости, порядка 10 пС . [2] SK-каналы представляют собой тип ионных каналов, позволяющих катионам калия пересекать клеточную мембрану и активироваться (открываться) при увеличении концентрации внутриклеточного кальция через кальциевые каналы N-типа . Их активация ограничивает частоту срабатывания потенциалов действия и важна для регуляции постгиперполяризации в нейронах центральной нервной системы , а также во многих других типах электрически возбудимых клеток . Это достигается за счет гиперполяризующей утечки положительно заряженных ионов калия по градиенту их концентрации во внеклеточное пространство. Эта гиперполяризация приводит к тому, что мембранный потенциал становится более отрицательным. [3] Считается, что SK-каналы участвуют в синаптической пластичности и, следовательно, играют важную роль в обучении и памяти. [4]
Функция
[ редактировать ]SK-каналы экспрессируются по всей центральной нервной системе . Они высоко консервативны у млекопитающих, а также у других организмов, таких как Drosophila melanogaster и Caenorhabditis elegans . [5] SK-каналы конкретно участвуют в постгиперполяризующем потенциале среды (мАГП). Они влияют как на внутреннюю возбудимость нейронов, так и на синаптическую передачу. Они также участвуют в передаче сигналов кальция. [6] Активация SK-канала может опосредовать нейропротекцию в различных моделях гибели клеток. [6] [7] [8] SK-каналы контролируют частоту разряда потенциала действия в нейронах гиппокампа, дофаминергических нейронах среднего мозга, дорсальных нейронах блуждающего нерва, симпатических нейронах, нейронах ретикулярного ядра таламуса, нейронах нижней оливы, спинальных и подъязычных мотонейронах, митральных клетках обонятельной луковицы и кортикальных нейронах. [3]
Структура
[ редактировать ]Калиевые каналы SK имеют ту же базовую архитектуру, что и шейкер-подобные потенциалзависимые калиевые каналы . [9] Четыре субъединицы объединяются, образуя тетрамер . Каждая из субъединиц имеет шесть трансмембранных гидрофобных альфа-спиральных доменов (S1-S6). Петля между S5 и S6, называемая P-петлей , обеспечивает область порообразования, которая всегда обращена к центру канала. [10] Каждая из субъединиц имеет шесть гидрофобных альфа-спиральных доменов, которые встраиваются в клеточную мембрану. Петля между пятым и шестым трансмембранными доменами образует фильтр селективности ионов калия . SK-каналы могут собираться как гомотетрамерные каналы или как гетеротетрамерные каналы, состоящие из более чем одного подтипа SK-канала. Кроме того, калиевые каналы SK тесно связаны с белком кальмодулином , что определяет чувствительность этих каналов к кальцию. [9] [11] Кальмодулин участвует в качестве субъединицы самого канала, связанного с цитоплазматической С-концевой областью пептида, называемого доменом связывания кальмодулина (CaMBD). [12]
Дополнительная ассоциация фосфорилирующей киназы CK2 и дефосфорилирующей фосфатазы PP2A на цитоплазматической поверхности белка обеспечивает обогащение Ca 2+ -чувствительность и, следовательно, модуляция кинетики. [13] CK2 служит для фосфорилирования связанного с SKCa CaM по остатку T80, а не по самим спиралям каналов, чтобы снизить чувствительность к кальцию. Это может быть достигнуто только тогда, когда пора канала закрыта. PP2A дефосфорилирует этот остаток при ингибировании CK2. [12] Селективный фильтр всех подтипов SK-каналов — будь то SK1, SK2, SK3 или SK4 — высококонсервативен и отражает селективность, наблюдаемую в любом калиевом канале , последовательности аминокислотных остатков GYGD в порообразующей петле. [14] Эти каналы считаются потенциал-независимыми, поскольку они содержат только два из семи положительно заряженных аминокислотных остатков, которые обычно наблюдаются в прототипе потенциал-управляемого калиевого канала . [10]
Классификация
[ редактировать ]Семейство каналов SK состоит из 4 членов — SK1 , SK2 , SK3 и SK4 . SK4 часто называют IK (промежуточная проводимость) из-за его более высокой проводимости (20–80 пС). [15]
| Канал | Ген | Псевдонимы | Связанные субъединицы |
| СК1 | КСНН1 | К около 2,1 | кальмодулин , PP2A , CK2 |
| СК2 | КСНН2 | К около 2,2 | кальмодулин , PP2A , CK2 |
| СК3 | КСНН3 | К около 2,3 | кальмодулин , PP2A , CK2 |
| СК4 | KCNN4 | К около 3,1 | кальмодулин , PP2A , CK2 |
Механизм ворот
[ редактировать ]Механизм открытия SK-каналов контролируется внутриклеточными уровнями кальция. [5] Кальций поступает в клетку через активируемые напряжением кальциевые каналы, а также через NMDA-рецепторы. [3] Кальций не связывается напрямую с SK-каналом. Даже в отсутствие кальция SK-канал связывается с C-долей белка кальмодулина (CaM). Когда N-доля связывает кальций, она захватывает линкер S4-S5 на внутриклеточной субъединице SK-канала. Когда каждый из четырех линкеров S4-S5 связывается с N-долей кальмодулина, SK-канал меняет конформацию. Кальмодулин подталкивает линкер S4-S5, позволяя расширить место пересечения пучка S6, что приводит к открытию поры. Идея о том, что это переводит канал из тетрамера мономеров димеров, что приводит к вращению CaM-связывающих доменов, в настоящее время отвергнута, а самые последние наблюдения в свернутый димер несовместимы с предположением о том, что это вращение вызывает механическое открытие ворот канала. [5] Постоянная времени активации канала SK составляет примерно 5 мс. Когда уровень кальция истощается, постоянная времени дезактивации каналов колеблется в пределах 15–60 мс. [16]
Блокаторы
[ редактировать ]Все SK-каналы могут быть фармакологически заблокированы четвертичными аммониевыми солями нейротоксина растительного происхождения бикукуллина . [17] Кроме того, SK-каналы (SK1-SK3), но не SK4 (IK), чувствительны к блокаде пчелиным токсином апамином . [18] и скорпиона (ChTx) яда тамапин и харибдотоксин , все через конкурентный антагонизм за доступ к устью порового образования. [19] Все известные блокаторы во всех подтипах конкурируют примерно за один и тот же сайт связывания — поры. Это обеспечивает физическую закупорку пор канала. [20] Поскольку все блокаторы универсальны для всех трех типов SK-каналов, существует невероятно узкое терапевтическое окно , не позволяющее блокировать определенный подтип SK-канала. [13] Соли четвертичного аммония, такие как бикукуллин и тетраэтиламмоний (ТЭА), попадают в поры через селективный фильтр, действуя как имитатор калия на стадии обезвоживания при проникновении в поры. [20]
Следующие молекулы представляют собой другие токсины и органические соединения , которые также ингибируют все три малых подтипа SK-каналов в любой (даже минимальной) степени: [13]
- Деквалиниум
- d-тубокурарин
- UCL-1684
- UCL-1848
- Ципрогептадин
- Флуоксетин , активный ингредиент Прозака.
- НС8593
- Сциллатоксин (лейуротоксин-I)
- Лей-Даб7
- N-метиллауданозин
- N-Ме-бикукуллин
- Панкуроний
- Атракурий
- 1-этил-1H-бензо[d]имидазол-2(3H)-он
- 6,7-дихлор-3-(гидроксиимино)индолин-2-он
- N-циклогексил-2-(3,5-диметил-1Н-пиразол-1-ил)-6-метилпиримидин-4-амин
- (R)-N-(1,2,3,4-тетрагидронафталин-1-ил)-1H-бензо[d]имидазол-2-амин
Модуляторы
[ редактировать ]Аллостерические модуляторы малых SK-каналов работают путем изменения кажущейся чувствительности каналов к кальцию. Примеры включают в себя:
- Рилузол
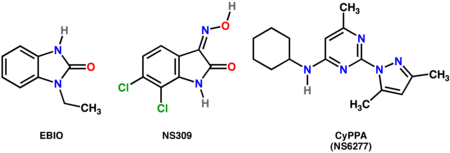
- Неселективные положительные модуляторы SK-каналов: EBIO (1 - Ethyl-2 - Benzim I dazolin One ), [21] NS309 (6,7-дихлор-1H-индол-2,3-дион-3-оксим) [22]
- Селективные положительные модуляторы SK-2 и SK-3: CyPPA (NS6277; циклогексил- (2-(3,5-диметил - пиразол-1-ил)-6-метил - пиримидин-4-ил) -амин . ) [23]
Синаптическая пластичность и долговременная потенциация
[ редактировать ]В дендритных шипиках SK-каналы напрямую связаны с NMDA- рецепторами. Помимо активации потоком кальция через потенциалзависимые кальциевые каналы, SK-каналы могут активироваться потоком кальция через NMDA-рецепторы, что происходит после деполяризации постсинаптической мембраны. [12] Эксперименты с использованием апамина показали, что специфическая блокировка SK-каналов может улучшить обучение и долгосрочную потенциацию . Кроме того, нейротрофический фактор головного мозга (BDNF) вызывает подавление SK-каналов, что способствует долгосрочному потенцированию. Увеличение активности каналов SK имеет противоположный эффект и ухудшает обучение . [5] Увеличение активности SK-каналов, происходящее с течением времени, может быть связано со снижением пластичности и памяти, наблюдаемым с возрастом. [24]
Роль в болезни Паркинсона
[ редактировать ]Считается, что дисфункция калиевых каналов, включая SK-каналы, играет роль в патогенезе болезни Паркинсона (БП), прогрессирующего нейродегенеративного заболевания .
Блокаторы SK-каналов контролируют скорость срабатывания (количество потенциалов действия, вырабатываемых нейроном за данный момент времени) и характер срабатывания (способ распределения потенциалов действия во времени) посредством производства m-AHP. Активаторы SK-каналов снижают скорость импульсации, чувствительность нейронов к возбуждающим стимулам, обеспечивая нейропротекцию, тогда как блокаторы SK-каналов увеличивают частоту импульсации и чувствительность к возбуждающим стимулам. [25] Это имеет важные последствия для функции дофаминергических нейронов. [25] Например, количество дофамина, выделяемого дофаминергическими нейронами среднего мозга, намного выше, когда частота импульсов увеличивается, чем когда они работают с постоянной скоростью.
SK-каналы широко экспрессируются в дофаминергических нейронах среднего мозга. Для регулирования сродства SK к ионам кальция использовались многочисленные фармакологические методы, тем самым модулируя возбудимость дофаминергических нейронов черной субстанции . Блокировка SK-каналов in vivo увеличивает скорость срабатывания клеток черной субстанции, что увеличивает количество дофамина, высвобождаемого из синаптических терминалей. [25] Когда большое количество дофамина накапливается в цитозоле, происходит повреждение клеток из-за накопления свободных радикалов и повреждения митохондрий. Кроме того, использовались методы модуляции SK-каналов с целью изменения дофаминового фенотипа нейронов. После потери TH+ ( тирозингидроксилазоположительных ) нейронов компактной черной субстанции (SNc) из-за нейродегенерации, вызванной болезнью Паркинсона, количество этих нейронов может частично восстановиться за счет «сдвига» клеточного фенотипа с TH- (тирозингидроксилазонегативного) на ТХ+. Количество TH+-нейронов можно изменить путем модуляции канала SK; конкретнее, инфузия SK-агонистов в черную субстанцию увеличивает количество TH+-нейронов, тогда как инфузия SK-антагониста уменьшает количество TH+-нейронов. Причина такой связи между SK-каналами и экспрессией TH может быть связана с нейропротекцией против токсичности дофамина . [25]
В качестве терапевтических вариантов улучшения симптомов БП были предложены два противоречивых метода:
Торможение SK-каналов
- Ингибирование SK-каналов, а точнее блокировка SK3-каналов, увеличивает частоту возбуждения дофаминергических нейронов, тем самым увеличивая высвобождение дофамина . Поэтому считается, что применение блокаторов SK3-каналов у пациентов с БП может облегчить кратковременные двигательные симптомы.
- Однако ингибирование также приводит к уменьшению количества TH+ нейронов компактной черной субстанции (SNc) в клетке, что приводит к снижению синтеза дофамина в долгосрочной перспективе.
Сопровождение каналов SK
- Усиление функции SK-каналов увеличивает количество TH+ нейронов компактной черной субстанции (SNc) в клетке, тем самым поддерживая синтез дофамина в течение длительного времени.
- Однако облегчение работы SK-каналов снижает частоту импульсов в дофаминергических нейронах в краткосрочной перспективе.
Ссылки
[ редактировать ]- ^ Бонд CT, Мэйли Дж., Адельман Дж. П. (апрель 1999 г.). «Калиевые каналы с малой проводимостью, активируемые кальцием». Анналы Нью-Йоркской академии наук . 868 (1): 370–8. Бибкод : 1999NYASA.868..370B . дои : 10.1111/j.1749-6632.1999.tb11298.x . ПМИД 10414306 . S2CID 22930702 .
- ^ Кёлер М., Хиршберг Б., Бонд К.Т., Кинзи Дж.М., Маррион Н.В., Мэйли Дж., Адельман Дж.П. (сентябрь 1996 г.). «Калиевые каналы с малой проводимостью, активируемые кальцием, из мозга млекопитающих». Наука . 273 (5282): 1709–14. Бибкод : 1996Sci...273.1709K . дои : 10.1126/science.273.5282.1709 . ПМИД 8781233 . S2CID 11603552 .
- ^ Jump up to: а б с Фабер Э.С., Сах П. (октябрь 2007 г.). «Функции SK-каналов центральных нейронов». Клиническая и экспериментальная фармакология и физиология . 34 (10): 1077–83. дои : 10.1111/j.1440-1681.2007.04725.x . ПМИД 17714097 . S2CID 5553791 .
- ^ Стэкман Р.В., Хаммонд Р.С., Линардатос Э., Герлах А., Мэйли Дж., Адельман Дж.П., Цунопулос Т. (декабрь 2002 г.). «Малая проводимость Ca 2+ -активирован К + каналы модулируют синаптическую пластичность и кодирование памяти» . Журнал Neuroscience . 22 (23): 10163–71. doi : 10.1523/ . PMC 6758766. . PMID 12451117 JNEUROSCI.22-23-10163.2002
- ^ Jump up to: а б с д Адельман Дж. П., Мэйли Дж., Сах П. (2012). «Малая проводимость Ca 2+ -активирован К + Каналы: форма и функция». Annual Review of Physiology . 74 : 245–69. doi : 10.1146/annurev-psyol-020911-153336 . PMID 21942705 .
- ^ Jump up to: а б Долга А.М., Терполилли Н., Кепура Ф., Нейхолт И.М., Кнаус Х.Г., Д'Орси Б. и др. (апрель 2011 г.). «Активация каналов KCa2 предотвращает [Ca 2+ ]i дерегуляция и уменьшает гибель нейронов после токсичности глутамата и церебральной ишемии» Cell Death & заболевания . 2 (e147): e147. doi : 10.1038/cddis.2011.30 . PMC 3122061. . PMID 21509037 .
- ^ Хонрат Б., Матшке Л., Мейер Т., Магерханс Л., Перокки Ф., Ганджам Г.К. и др. (май 2017 г.). «Каналы SK2 регулируют митохондриальное дыхание и митохондриальный Ca 2+ поглощение» . Клеточная гибель и дифференциация . 24 (5): 761–773. doi : /cdd.2017.2 . PMC 5423111. . PMID 28282037 10.1038
- ^ Аллен Д., Накаяма С., Куроива М., Накано Т., Палматир Дж., Косака Ю. и др. (декабрь 2011 г.). «Каналы SK2 являются нейропротекторами в отношении гибели нейронов, вызванной ишемией» . Журнал церебрального кровотока и метаболизма . 31 (12): 2302–12. дои : 10.1038/jcbfm.2011.90 . ПМЦ 3323193 . ПМИД 21712833 .
- ^ Jump up to: а б Мэйли Дж., Бонд К.Т., Херсон П.С., Ли В.С., Адельман Дж.П. (январь 2004 г.). «Малая проводимость Ca 2+ -активирован К + каналы и кальмодулин» . Журнал физиологии . 554 (Pt 2): 255–61. : 10.1113 /jphysyol.2003.049072 . PMC 1664776. . PMID 14500775 doi
- ^ Jump up to: а б Стокер М. (октябрь 2004 г.). «Ca(2+)-активированный K + каналы: молекулярные детерминанты и функции семейства SK». Nature Reviews. Neuroscience . 5 (10): 758–70. : 10.1038 /nrn1516 . PMID 15378036. . S2CID 22211829 doi
- ^ Шумахер М.А., Ривард А.Ф., Бэхингер Х.П., Адельман Дж.П. (апрель 2001 г.). «Структура воротного домена Ca 2+ -активирован К + канал в комплексе с Ca 2+ / кальмодулин». Nature . 410 (6832): 1120–4. : 2001Natur.410.1120S . doi : 10.1038 /35074145 . PMID 11323678. . S2CID 205016620 Bibcode
- ^ Jump up to: а б с Лухан Р., Мэйли Дж., Адельман Дж. П. (июль 2009 г.). «Новые площадки действий для каналов ГИРК и СК». Обзоры природы. Нейронаука . 10 (7): 475–80. дои : 10.1038/nrn2668 . ПМИД 19543219 . S2CID 5137151 .
- ^ Jump up to: а б с Weatherall KL, Goodchild SJ, Джейн Д.Е., Marrion NV (июль 2010 г.). «Калиевые каналы с малой проводимостью, активируемые кальцием: от структуры к функции». Прогресс нейробиологии . 91 (3): 242–55. doi : 10.1016/j.pneurobio.2010.03.002 . ПМИД 20359520 . S2CID 32565287 .
- ^ Бернеш С., Ру Б. (апрель 2005 г.). «Ворота в фильтре селективности калиевых каналов» . Структура . 13 (4): 591–600. дои : 10.1016/j.str.2004.12.019 . ПМИД 15837197 .
- ^ Вергара С., Латорре Р., Маррион Н.В., Адельман Дж.П. (июнь 1998 г.). «Кальций-активируемые калиевые каналы». Современное мнение в нейробиологии . 8 (3): 321–9. дои : 10.1016/S0959-4388(98)80056-1 . ПМИД 9687354 . S2CID 40840564 .
- ^ Беркефельд Х., Факлер Б., Шульте У. (октябрь 2010 г.). "Ка 2+ -активирован К + каналы: от белковых комплексов к функции». Physiological Reviews . 90 (4): 1437–59. doi : 10.1152/physrev.00049.2009 . PMID 20959620 .
- ^ Хавалед Р., Брюнинг-Райт А., Адельман Дж. П., Мэйли Дж. (август 1999 г.). «Бикукуллиновая блокада кальций-активируемых калиевых каналов малой проводимости». Архив Пфлюгерса . 438 (3): 314–21. дои : 10.1007/s004240050915 . ПМИД 10398861 . S2CID 7033568 .
- ^ Блатц А.Л., Маглеби К.Л. (1986). «Один блокируемый апамином Са-активированный K + каналы малой проводимости в культивируемых скелетных мышцах крыс». Nature . 323 (6090): 718–20. : 1986Natur.323..718B . doi : 10.1038 /323718a0 . PMID 2430185. . S2CID 4270667 Bibcode
- ^ Педарзани П., Д'Хэдт Д., Дорти К.Б., Уодсворт Дж.Д., Джозеф Дж.С., Джеясилан К. и др. (ноябрь 2002 г.). «Тамапин, ядовитый пептид индийского красного скорпиона (Mesobuthus tamulus), нацеленный на малую проводимость Ca 2+ -активирован К + каналы и токи послегиперполяризации в центральных нейронах» . Журнал биологической химии . 277 (48): 46101–9. doi : 10.1074/jbc.M206465200 . PMID 12239213 .
- ^ Jump up to: а б Дилли С., Лами С., Маррион Н.В., Льежуа Ж.Ф., Сеутин В. (август 2011 г.). «Модуляторы ионных каналов: больше разнообразия, чем считалось ранее». ХимБиоХим . 12 (12): 1808–12. дои : 10.1002/cbic.201100236 . ПМИД 21726033 . S2CID 3303526 .
- ^ Педарзани П., Мосбахер Дж., Ривард А., Чинголани Л.А., Оливер Д., Стокер М. и др. (март 2001 г.). «Контроль электрической активности центральных нейронов путем модуляции ворот малой проводимости Ca 2+ -активирован К + каналы» . Журнал биологической химии . 276 (13): 9762–9. doi : 10.1074/jbc.M010001200 . PMID 11134030 .
- ^ Стробек Д., Тойбер Л., Йоргенсен Т.Д., Аринг П.К., Кьяер К., Хансен Р.С. и др. (октябрь 2004 г.). «Активация ИК и СК человека 2+ -активирован К + каналы с помощью NS309 (6,7-дихлор-1H-индол-2,3-дион-3-оксим)» . Biochimica et Biophysica Acta (BBA) - Biomembranes . 1665 (1–2): 1–5. doi : 10.1016/ j.bbamem.2004.07.006 .PMID 15471565 .
- ^ Хугаард С., Эриксен Б.Л., Йоргенсен С., Йохансен Т.Х., Дюринг Т., Мэдсен Л.С. и др. (июль 2007 г.). «Селективная положительная модуляция подтипов SK3 и SK2 малой проводимости Ca. 2+ -активирован К + каналы» . Британский журнал фармакологии . 151 (5): 655–65. : 10.1038 /sj.bjp.0707281 . PMC 2014002. PMID doi 17486140 .
- ^ Цунопулос Т., Стэкман Р. (декабрь 2003 г.). «Усиление синаптической пластичности и памяти: роль кальция с малой проводимостью». 2+ -активирован К + каналы». Нейробиолог . 9 (6): 434–9. doi : /1073858403259282 . PMID 14678575. . S2CID 32595023 10.1177
- ^ Jump up to: а б с д Лю С.К., Ван Г, Чен С.Д. (июнь 2010 г.). «Модуляция активности дофаминергических нейронов по SK-каналам: потенциальная мишень для лечения болезни Паркинсона?» . Неврологический бюллетень . 26 (3): 265–71. дои : 10.1007/s12264-010-1217-4 . ПМК 5560298 . ПМИД 20502506 .
Внешние ссылки
[ редактировать ]- SK Калийные каналы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- «Кальций-активируемые калиевые каналы» . База данных IUPHAR по рецепторам и ионным каналам . Международный союз фундаментальной и клинической фармакологии.
- Джон Адельман. «Научные интересы: Кальций-активируемые калиевые каналы малой проводимости (SK-каналы)» . Орегонский университет здравоохранения и науки. Архивировано из оригинала 30 сентября 2007 г. Проверено 22 января 2008 г.