SCN8A
| SCN8A | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SCN8A , CERIII, CIAT, EIEE13, MED, NaCh6, Nav1.6, PN4, альфа-субъединица 8 натриевого потенциалзависимого канала, BFIS5, MYOCL2, DEE13 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 600702 ; МГИ : 103169 ; Гомологен : 7927 ; Генные карты : SCN8A ; OMA : SCN8A — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Субъединица альфа типа 8 белка натриевых каналов, также известная как Na v 1.6, представляет собой мембранный белок, кодируемый SCN8A геном . [5] [6] Na v 1.6 представляет собой одну изоформу натриевого канала и является первичным потенциалзависимым натриевым каналом в каждом перехвате Ранвье . Каналы сконцентрированы в сенсорных и моторных аксонах периферической нервной системы и группируются в узлах центральной нервной системы. [7] [8] [9]
Структура
[ редактировать ]Na v 1.6 кодируется геном SCN8A, который содержит 27 экзонов и имеет размер 170 т.п.н. Потенциал-управляемый натриевый канал состоит из 1980 остатков. Как и другие натриевые каналы, Na v 1.6 представляет собой мономер, состоящий из четырех гомологичных доменов (I-IV) и 25 трансмембранных сегментов. SCN8A кодирует трансмембранные сегменты S3-S4, образующие внутриклеточную петлю. [10]
Функция
[ редактировать ]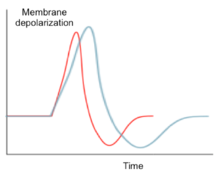
Как и другие каналы ионов натрия , Na v 1.6 способствует распространению потенциала действия, когда потенциал деполяризуется мембранный притоком Na. + ионы. Однако Na v 1.6 способен выдерживать повторяющееся возбуждение и срабатывание. Высокочастотная характеристика Na v 1.6 вызвана постоянным и возобновляющимся натриевым током. Эта характеристика вызвана медленной активацией натриевого канала после реполяризации. [11] что обеспечивает установившийся натриевый ток после начального распространения потенциала действия. Установившийся натриевый ток способствует деполяризации следующего потенциала действия. Кроме того, порог активации Na v 1,6 ниже по сравнению с другими распространенными натриевыми каналами, такими как Na v 1,2. Эта функция позволяет каналам Na v 1.6 быстро восстанавливаться после инактивации и поддерживать высокий уровень активности. [12]
Na v 1.6 экспрессируется преимущественно в перехватах Ранвье в миелинизированных аксонах, но также высоко концентрируется на дистальном конце аксонного бугорка, в гранулярных клетках мозжечка и нейронах Пуркинье и в меньшей степени в немиелинизированных аксонах и дендритах. [12] Учитывая расположение Na v 1,6, канал вносит вклад в порог срабатывания данного нейрона, поскольку электрические импульсы от различных входов суммируются на бугорке аксона , чтобы достичь порога срабатывания перед распространением по аксону. Другие изоформы натриевых каналов экспрессируются на дистальном конце аксонного холмика, включая Na v 1.1 и Na v 1.2. [8]

Каналы Na V 1.6 демонстрируют устойчивость к регуляции фосфорилирования белков. Натриевые каналы модулируются фосфорилированием протеинкиназы А и протеинкиназы С (PKC), что снижает пиковые токи натрия. Дофамин и ацетилхолин уменьшают токи натрия в пирамидных нейронах гиппокампа посредством фосфорилирования. Точно так же рецепторы серотонина в префронтальной коре регулируются ПКС, чтобы уменьшить токи натрия. [11] Регуляция фосфорилирования натриевых каналов помогает замедлить инактивацию. Однако каналы Na V 1.6 не имеют адекватных сайтов протеинкиназы. Сайты фосфорилирования аминокислотных остатков Ser573 и Ser687 обнаружены и в других натриевых каналах, но недостаточно консервативны в Na V 1.6. Отсутствие остатков серина приводит к способности канала последовательно и быстро активироваться после инактивации. [14]
Na V 1.6, наоборот, регулируется кальмодулином (CaM). CaM взаимодействует с изолейцин-глутаминовым (IQ) мотивом Na V 1.6, чтобы инактивировать канал. Мотив IQ сворачивается в спираль при взаимодействии с CaM, и CaM инактивирует Na V 1,6 в зависимости от концентрации кальция. Na V 1,6 IQ демонстрирует умеренное сродство к CaM по сравнению с другими изоформами натриевых каналов, такими как Na V 1,6. Разница в сродстве к CaM способствует устойчивости Na V 1.6 к инактивации. [15]
Клиническое значение
[ редактировать ]Первую известную мутацию у людей обнаружили Кришна Вирама и Майкл Хаммер в 2012 году. [16] Геном ребенка с эпилептической энцефалопатией был секвенирован и выявил миссенс-мутацию de novo , p.Asn1768Asp. Миссенс-мутации Na v 1.6 усиливали функцию канала за счет увеличения продолжительности постоянного натриевого тока и предотвращали полную инактивацию после гиперполяризации. 20% начального тока сохранялось в течение 100 мс после гиперполяризации, что приводило к гипервозбудимости нейрона и увеличивало вероятность преждевременного или непреднамеренного срабатывания. Помимо эпилептической энцефалопатии, у пациента наблюдались задержка развития, аутистические черты, умственная отсталость и атаксия.
Преобразование натриевых каналов участвует в демиелинизации аксонов, связанной с рассеянным склерозом (РС). На ранних стадиях миелинизации количество незрелых Na v каналов 1,2 превышает количество Na v 1,6 в аксонах. Однако зрелые каналы Na v 1,6 постепенно заменяют другие каналы по мере продолжения миелинизации, что позволяет увеличить скорость проводимости с учетом нижнего порога Na v 1,6. [8] Однако в моделях MS преобразование натриевых каналов из зрелого Na v 1,6 в Na v 1,2. наблюдается [17]
См. также
[ редактировать ]- Натриевый канал
- паралитический - ортолог SCN8A у дрозофилы
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Ensembl, выпуск 89: ENSG00000196876 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000023033 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «ЮниПрот» . www.uniprot.org . Проверено 25 июля 2022 г.
- ^ «Ген Энтрез: натриевый канал SCN8A, потенциалзависимый, тип VIII, альфа-субъединица» .
- ^ Колдуэлл Дж. Х., Шаллер К. Л., Лэшер Р. С., Пелес Э., Левинсон С. Р. (май 2000 г.). «Натриевый канал Na(v)1,6 локализован в узлах Ранвье, дендритах и синапсах» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (10): 5616–20. Бибкод : 2000PNAS...97.5616C . дои : 10.1073/pnas.090034797 . ПМК 25877 . ПМИД 10779552 .
- ^ Перейти обратно: а б с Бойко Т., Расбанд М.Н., Левинсон С.Р., Колдуэлл Дж.Х., Мандель Г., Триммер Дж.С., Мэтьюз Дж. (апрель 2001 г.). «Компактный миелин диктует различное нацеливание двух изоформ натриевых каналов в один и тот же аксон» . Нейрон . 30 (1): 91–104. дои : 10.1016/s0896-6273(01)00265-3 . ПМИД 11343647 . S2CID 7168889 .
- ^ Цумака Э., Тишлер А.С., Сангамешваран Л., Эглен Р.М., Хантер Дж.К., Новакович С.Д. (апрель 2000 г.). «Дифференциальное распределение чувствительных к тетродотоксину натриевых каналов rPN4/NaCh6/Scn8a в нервной системе». Журнал нейробиологических исследований . 60 (1): 37–44. doi : 10.1002/(SICI)1097-4547(20000401)60:1<37::AID-JNR4>3.0.CO;2-W . ПМИД 10723066 . S2CID 46539625 .
- ^ О'Брайен Дж. Э., Мейслер М. Х. (октябрь 2013 г.). «Натриевый канал SCN8A (Nav1.6): свойства и мутации de novo при эпилептической энцефалопатии и умственной отсталости» . Границы генетики . 4 : 213. дои : 10.3389/fgene.2013.00213 . ПМК 3809569 . ПМИД 24194747 .
- ^ Перейти обратно: а б Чен Ю, Ю Ф.Х., Шарп Э.М., Бичем Д., Шойер Т., Каттералл В.А. (август 2008 г.). «Функциональные свойства и дифференциальная нейромодуляция каналов Na(v)1,6» . Молекулярная и клеточная нейронауки . 38 (4): 607–15. дои : 10.1016/j.mcn.2008.05.009 . ПМЦ 3433175 . ПМИД 18599309 .
- ^ Перейти обратно: а б Фриман С.А., Демазьер А., Фрикер Д., Любецки С., Соль-Фулон Н. (февраль 2016 г.). «Механизмы кластеризации натриевых каналов и ее влияние на аксональную проводимость импульса» . Клеточные и молекулярные науки о жизни . 73 (4): 723–35. дои : 10.1007/s00018-015-2081-1 . ПМЦ 4735253 . ПМИД 26514731 .
- ^ Редди Чичили, вице-президент, Сяо Ю, Ситхараман Дж, Камминс Т.Р., Сивараман Дж (2013). «Структурные основы модуляции нейронального потенциалзависимого натриевого канала NaV1.6 кальмодулином» . Научные отчеты . 3 : 2435. Бибкод : 2013NatSR...3E2435C . дои : 10.1038/srep02435 . ПМК 3743062 . ПМИД 23942337 .
- ^ Чен Ю, Ю Ф.Х., Шарп Э.М., Бичем Д., Шойер Т., Каттералл В.А. (август 2008 г.). «Функциональные свойства и дифференциальная нейромодуляция каналов Na(v)1,6» . Молекулярная и клеточная нейронауки . 38 (4): 607–15. дои : 10.1016/j.mcn.2008.05.009 . ПМЦ 3433175 . ПМИД 18599309 .
- ^ Редди Чичили, вице-президент, Сяо Ю, Ситхараман Дж, Камминс Т.Р., Сивараман Дж (14 августа 2013 г.). «Структурная основа модуляции нейронального потенциалзависимого натриевого канала NaV1.6 кальмодулином» . Научные отчеты . 3 : 2435. Бибкод : 2013NatSR...3E2435C . дои : 10.1038/srep02435 . ПМК 3743062 . ПМИД 23942337 .
- ^ Вирама К.Р., О'Брайен Дж.Э., Мейслер М.Х., Ченг X, Диб-Хадж С.Д., Ваксман С.Г., Талвар Д., Гирираджан С., Эйхлер Э.Э., Рестифо Л.Л., Эриксон Р.П., Хаммер М.Ф. (март 2012 г.). «Погенная мутация SCN8A de novo, выявленная с помощью полногеномного секвенирования семейного квартета, страдающего детской эпилептической энцефалопатией и SUDEP» . Американский журнал генетики человека . 90 (3): 502–10. дои : 10.1016/j.ajhg.2012.01.006 . ПМК 3309181 . ПМИД 22365152 .
- ^ Крэнер М.Дж., Ньюкомб Дж., Блэк Дж.А., Хартл С., Кузнер М.Л., Ваксман С.Г. (май 2004 г.). «Молекулярные изменения в нейронах при рассеянном склерозе: измененная аксональная экспрессия натриевых каналов Nav1.2 и Nav1.6 и обменника Na+/Ca2+» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (21): 8168–73. Бибкод : 2004PNAS..101.8168C . дои : 10.1073/pnas.0402765101 . ПМК 419575 . ПМИД 15148385 .
Дальнейшее чтение
[ редактировать ]- Каттералл В.А., Голдин А.Л., Ваксман С.Г. (декабрь 2005 г.). «Международный союз фармакологии. XLVII. Номенклатура и структурно-функциональные связи потенциалзависимых натриевых каналов». Фармакологические обзоры . 57 (4): 397–409. дои : 10.1124/пр.57.4.4 . ПМИД 16382098 . S2CID 7332624 .
- Берджесс Д.Л., Корман Д.К., Галт Дж., Пламмер Н.В., Джонс Дж.М., Спир Б., Мейслер М.Х. (август 1995 г.). «Мутация нового гена натриевого канала, Scn8a, у мышиной мутантной болезни двигательной концевой пластинки» . Природная генетика . 10 (4): 461–5. дои : 10.1038/ng0895-461 . ПМИД 7670495 . S2CID 28941670 .
- Пламмер Н.В., Макберни М.В., Мейслер М.Х. (сентябрь 1997 г.). «Альтернативный сплайсинг натриевого канала SCN8A предсказывает появление усеченного двухдоменного белка в мозге плода и ненейрональных клетках» . Журнал биологической химии . 272 (38): 24008–15. дои : 10.1074/jbc.272.38.24008 . ПМИД 9295353 .
- Пламмер Н.В., Галт Дж., Джонс Дж.М., Берджесс Д.Л., Спрунгер Л.К., Корман Д.К., Мейслер М.Х. (декабрь 1998 г.). «Организация экзонов, кодирующая последовательность, физическое картирование и полиморфные внутригенные маркеры гена натриевых каналов нейронов человека SCN8A». Геномика . 54 (2): 287–96. дои : 10.1006/geno.1998.5550 . ПМИД 9828131 .
- Анис Ю, Нюрнберг Б, Височек Л, Рейсс Н, Наор З, Коэн-Армон М (март 1999 г.). «Активация Go-белков путем деполяризации мембраны, прослеживаемая с помощью фотоаффинного мечения галфао-белков in situ [альфа32P]GTP-азидоанилидом» . Журнал биологической химии . 274 (11): 7431–40. дои : 10.1074/jbc.274.11.7431 . ПМИД 10066808 .
- Колдуэлл Дж. Х., Шаллер К. Л., Лэшер Р. С., Пелес Э., Левинсон С. Р. (май 2000 г.). «Натриевый канал Na(v)1,6 локализован в узлах Ранвье, дендритах и синапсах» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (10): 5616–20. Бибкод : 2000PNAS...97.5616C . дои : 10.1073/pnas.090034797 . ПМК 25877 . ПМИД 10779552 .
- Виттмак Э.К., Раш А.М., Крэнер М.Дж., Гольдфарб М., Ваксман С.Г., Диб-Хадж С.Д. (июль 2004 г.). «Гомологический фактор 2B фактора роста фибробластов: ассоциация с Nav1.6 и селективная колокализация в узлах Ранвье аксонов дорсальных корешков» . Журнал неврологии . 24 (30): 6765–75. doi : 10.1523/JNEUROSCI.1628-04.2004 . ПМК 6729706 . ПМИД 15282281 .
- Раймонд К.К., Касл Дж., Гарретт-Энгеле П., Armor CD, Кан З., Циноремас Н., Джонсон Дж.М. (октябрь 2004 г.). «Экспрессия генов альфа-субъединицы альтернативно сплайсированных натриевых каналов. Уникальные паттерны сплайсинга наблюдаются в ганглиях дорсальных корешков» . Журнал биологической химии . 279 (44): 46234–41. дои : 10.1074/jbc.M406387200 . ПМИД 15302875 .
- Дрюс В.Л., Либерман А.П., Мейслер М.Х. (февраль 2005 г.). «Множественные транскрипты натриевого канала SCN8A (Na (V)1.6) с альтернативными 5'- и 3'-нетранслируемыми областями и первоначальная характеристика промотора SCN8A». Геномика . 85 (2): 245–57. дои : 10.1016/j.ygeno.2004.09.002 . ПМИД 15676283 .
- Витмак Э.К., Раш А.М., Хадмон А., Ваксман С.Г., Диб-Хадж С.Д. (июль 2005 г.). «Потенциал-управляемый натриевый канал Nav1.6 модулируется митоген-активируемой протеинкиназой p38» . Журнал неврологии . 25 (28): 6621–30. doi : 10.1523/JNEUROSCI.0541-05.2005 . ПМК 6725417 . ПМИД 16014723 .
- Скьявон Э., Сакко Т., Кассулини Р.Р., Гуррола Дж., Темпия Ф., Поссани Л.Д., Ванке Э. (июль 2006 г.). «Регенерирующий захват датчика тока и напряжения усиливает активацию токсином бета-скорпиона исключительно в канале Nav1.6. Значение для нейронов Пуркинье мышей» . Журнал биологической химии . 281 (29): 20326–37. дои : 10.1074/jbc.M600565200 . ПМИД 16702217 .
- Сирахата Э., Ивасаки Х., Такаги М., Лин С., Беннетт В., Окамура Ю., Хаясака К. (сентябрь 2006 г.). «Анкирин-G регулирует ворота инактивации нейронального натриевого канала, Nav1.6». Журнал нейрофизиологии . 96 (3): 1347–57. дои : 10.1152/Jn.01264.2005 . ПМИД 16775201 .
- Блэк Дж.А., Ньюкомб Дж., Трапп Б.Д., Ваксман С.Г. (сентябрь 2007 г.). «Экспрессия натриевых каналов в бляшках хронического рассеянного склероза» . Журнал невропатологии и экспериментальной неврологии . 66 (9): 828–37. дои : 10.1097/nen.0b013e3181462841 . ПМИД 17805013 .
Внешние ссылки
[ редактировать ]- «Веб-сайт и реестр SCN8A» . Университет Аризоны.
- «Поддержка семьи SCN8A» . Фонд «Милый синдром».
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .