На версии 1.8
| SCN10A | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SCN10A , FEPS2, Nav1.8, PN3, SNS, hPN3, альфа-субъединица 10 натриевого потенциалзависимого канала | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 604427 ; МГИ : 108029 ; Гомологен : 21300 ; Генные карты : SCN10A ; ОМА : SCN10A – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Na v 1.8 представляет собой подтип натриевых ионных каналов , который у человека кодируется геном SCN10A . [5] [6] [7] [8]
Каналы, содержащие Na v 1.8, представляют собой к тетродотоксину потенциалзависимые каналы, устойчивые (ТТХ). Na v 1.8 экспрессируется конкретно в ганглии дорсальных корешков малого диаметра, (DRG), в безмиелиновых сенсорных нейронах называемых C-волокнами , и участвует в ноцицепции . [9] [10] С-волокна могут активироваться вредными термическими или механическими раздражителями и, таким образом, передавать болевые сообщения.
Специфическое расположение Na v 1.8 в сенсорных нейронах ДРГ может сделать его ключевой терапевтической мишенью для разработки новых анальгетиков. [11] и лечение хронической боли . [12]
Функция
[ редактировать ]Потенциал-управляемые натриевые ионные каналы (VGSC) необходимы для создания и распространения потенциалов действия . Тетродотоксин, токсин, обнаруженный в рыбе-фугу , способен блокировать некоторые VGSC и поэтому используется для различения различных подтипов. Существует три ТТХ-резистентных VGSC: Na v 1,5 , Na v 1,8 и Na v 1,9 . Na v 1,8 и Na v 1,9 экспрессируются в ноцицепторах (нейронах, чувствительных к повреждению). Na v 1,7 , Na v 1,8 и Na v 1,9 обнаружены в DRG и помогают опосредовать хроническую воспалительную боль. [13] Na v 1.8 представляет собой субъединицу канала α-типа, состоящую из четырех гомологичных доменов, каждый из которых имеет шесть трансмембранных областей, из которых один является датчиком напряжения.
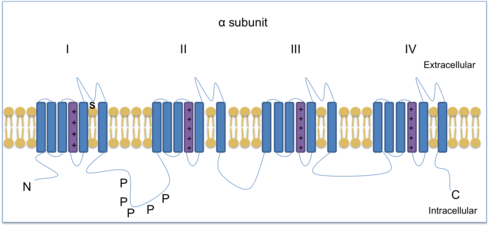
Методы фиксации напряжения показали, что Na V 1,8 является уникальным среди натриевых каналов, демонстрируя относительно деполяризованную инактивацию в устойчивом состоянии. Таким образом, Na V 1.8 остается доступным для работы, когда нейроны деполяризуются до уровней, инактивирующих другие натриевые каналы. Зажим напряжения использовался, чтобы показать, как потенциалы действия в клетках DRG формируются устойчивыми к ТТХ натриевыми каналами. Na v 1.8 в наибольшей степени способствует поддержанию деполяризующей стадии действия повторяющихся высокочастотных потенциалов в ноцицептивных сенсорных нейронах, поскольку он активируется быстро и остается активированным после обнаружения вредного стимула . [14] [15] Следовательно, Na v 1,8 способствует гипералгезии (повышенной чувствительности к боли) и аллодинии (боль от раздражителей, которые обычно ее не вызывают), которые являются элементами хронической боли. [16] Na v 1.8 Исследования на мышах с нокаутом показали, что этот канал связан с воспалительной и нейропатической болью. [9] [17] [18] Более того, Na v 1.8 играет решающую роль в боли при холоде. [19] Снижение температуры с 30 °C до 10 °C замедляет активацию VGSC и, следовательно, уменьшает ток. Однако Na v 1.8 холодоустойчив и способен генерировать на холоде потенциалы действия для переноса информации от ноцицепторов к центральной нервной системе (ЦНС). Кроме того, мыши с нулевым значением Na v 1,8 не смогли создать потенциалы действия, что указывает на то, что Na v 1,8 важен для восприятия боли при низких температурах. [19]
Хотя ранние исследования биофизики каналов Na V 1.8 проводились на каналах грызунов, в более поздних исследованиях изучались свойства каналов Na V 1.8 человека. Примечательно, что каналы Na V 1,8 человека демонстрируют зависимость от напряжения инактивации, которая даже более деполяризована, чем у грызунов, а также имеет больший постоянный ток. [20] Таким образом, влияние каналов Na V 1.8 человека на активацию сенсорных нейронов может быть даже больше, чем влияние каналов Na V 1.8 грызунов.
1.8, связанные с усилением функции Было обнаружено, что мутации Na V , выявленные у пациентов с болезненными периферическими невропатиями, делают нейроны DRG гипервозбудимыми и, таким образом, являются причиной боли. [21] [22] Хотя Na V 1.8 обычно не экспрессируется в мозжечке, его экспрессия повышается в мозжечковых клетках Пуркинье на животных моделях рассеянного склероза (рассеянный склероз) и при рассеянном склерозе у человека. [23] Присутствие каналов Na V 1.8 внутри этих нейронов мозжечка, где он обычно не присутствует, увеличивает их возбудимость и изменяет характер их импульсов in vitro. [24] и у грызунов с экспериментальным аутоиммунным энцефаломиелитом - модель рассеянного склероза. [25] На поведенческом уровне было показано, что эктопическая экспрессия Na V 1.8 в нейронах Пуркинье мозжечка ухудшает двигательные функции в трансгенной модели. [26]
Клиническое значение
[ редактировать ]Сигнальные пути боли
[ редактировать ]Ноцицепторы отличаются от других сенсорных нейронов тем, что они имеют низкий порог активации и, следовательно, повышают свою реакцию на постоянные раздражители. Следовательно, ноцицепторы легко сенсибилизируются такими агентами, как брадикинин и фактор роста нервов , которые высвобождаются в месте повреждения ткани, что в конечном итоге вызывает изменения проводимости ионных каналов. Было показано, что плотность VGSC увеличивается после повреждения нерва. [27] Следовательно, VGSC можно модулировать множеством различных гипералгезирующих агентов, которые высвобождаются после повреждения нерва. Дополнительные примеры включают простагландин E 2 (PGE 2 ), серотонин и аденозин , которые усиливают ток через Na v 1,8. [28]
Простагландины, такие как PGE 2, могут повышать чувствительность ноцицепторов к термическим, химическим и механическим раздражителям и повышать возбудимость сенсорных нейронов DRG. Это происходит потому, что PGE 2 модулирует транспорт Na v 1.8 путем связывания с G-белком-связанным рецептором EP2 , который, в свою очередь, активирует протеинкиназу A. [29] [30] Протеинкиназа А фосфорилирует Na v 1.8 во внутриклеточных участках, что приводит к увеличению токов ионов натрия. Доказательства связи между PGE 2 и гипералгезией получены в результате нокдауна антисмыслового дезоксинуклеотида Na v 1,8 в DRG крыс. [31] Другим модулятором Na v 1.8 является ε-изоформа PKC . Эта изоформа активируется медиатором воспаления брадикинином и фосфорилирует Na v 1.8, вызывая увеличение тока натрия в сенсорных нейронах, что способствует механической гипералгезии. [32]
синдром Бругада
[ редактировать ]Мутации в SCN10A связаны с синдромом Бругада . [33] [34] [35]
Мембранный трафик
[ редактировать ]Уровни фактора роста нервов в воспаленных или поврежденных тканях повышаются, что приводит к повышенной чувствительности к боли (гипералгезия). [36] Повышенные уровни фактора роста нервов и фактора некроза опухоли-α (TNF-α) вызывают активацию Na v 1,8 в сенсорных нейронах посредством вспомогательного белка p11 (легкая цепь аннексина II). было показано С помощью метода скрининга дрожжевых двух гибридов , что p11 связывается с фрагментом из 28 аминокислот на N-конце Na v 1.8 и способствует его транслокации к плазматической мембране . Это способствует повышенной возбудимости сенсорных нейронов во время боли. [37] p11-нулевые ноцицептивные сенсорные нейроны мышей, созданные с использованием системы CreloxP 1.8 рекомбиназной , демонстрируют снижение экспрессии Na v на плазматической мембране. [38] Следовательно, нарушение взаимодействия между p11 и Na v 1.8 может быть хорошей терапевтической целью для снижения боли.
В миелиновых волокнах VGSC расположены в перехватах Ранвье ; однако в немиелинизированных волокнах точное расположение VGSC не установлено. Na v 1,8 в немиелинизированных волокнах был обнаружен в кластерах, связанных с липидными рафтами вдоль волокон DRG, как in vitro , так и in vivo . [39] Липидные рафты организуют клеточную мембрану, которая включает в себя каналы транспортировки и локализации ионов. Удаление липидных рафтов в мембране с помощью MβCD , который истощает холестерин из плазматической мембраны, приводит к сдвигу Na v 1,8 в не-плотную часть мембраны, вызывая снижение возбуждения и распространения потенциала действия. [39]
Болезненные периферические невропатии
[ редактировать ]Болезненные периферические невропатии или невропатии мелких волокон представляют собой нарушения безмиелинизированных ноцицептивных С-волокон, вызывающие нейропатическую боль; в некоторых случаях причина неизвестна. [40] Генетический скрининг пациентов с этими идиопатическими нейропатиями выявил мутации в гене SCN9A , кодирующем родственный канал Na v 1.7. В одном исследовании мутация усиления функции Na v 1.7, расположенная в сенсорных нейронах DRG, была обнаружена почти у 30% пациентов с идиопатической нейропатией мелких волокон. [41] Эта мутация усиления функции вызывает повышение возбудимости (гипервозбудимости) сенсорных нейронов DRG и, следовательно, усиление боли. Таким образом, было показано, что Na v 1.7 связан с человеческой болью; Na v 1.8, напротив, до недавнего времени ассоциировался с болью только в исследованиях на животных. Мутация усиления функции была обнаружена в , кодирующем Na v 1.8, гене SCN10A у пациентов с болезненной периферической нейропатией. [21] В исследовании 104 пациентов с идиопатическими периферическими невропатиями, у которых не было мутации в SCN9A, использовались методы фиксации напряжения и тока , а также алгоритмы прогнозирования , и выявили две мутации усиления функции в SCN10A у трех пациентов. Обе мутации вызывают повышенную возбудимость сенсорных нейронов DRG и, следовательно, способствуют возникновению боли, но механизм, посредством которого они это делают, не ясен.
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000185313 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000034533 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Энтрез Ген: натриевый канал» .
- ^ Раберт Д.К., Кох Б.Д., Ильница М., Обернолте Р.А., Нейлор С.Л., Герман Р.К., Эглен Р.М., Хантер Дж.К., Сангамесваран Л. (ноябрь 1998 г.). «Устойчивый к тетродотоксину потенциалзависимый натриевый канал из ганглиев дорсальных корешков человека, hPN3 / SCN10A». Боль . 78 (2): 107–14. дои : 10.1016/S0304-3959(98)00120-1 . ПМИД 9839820 . S2CID 45480324 .
- ^ Пламмер Н.В., Мейслер М.Х. (апрель 1999 г.). «Эволюция и разнообразие генов натриевых каналов млекопитающих». Геномика . 57 (2): 323–31. дои : 10.1006/geno.1998.5735 . ПМИД 10198179 .
- ^ Каттералл В.А., Голдин А.Л., Ваксман С.Г. (декабрь 2005 г.). «Международный союз фармакологии. XLVII. Номенклатура и структурно-функциональные связи потенциалзависимых натриевых каналов». Фармакологические обзоры . 57 (4): 397–409. дои : 10.1124/пр.57.4.4 . ПМИД 16382098 . S2CID 7332624 .
- ^ Jump up to: а б Акопян А.Н., Сослова В., Англия С., Окусе К., Огата Н., Юре Дж., Смит А., Керр Б.Дж., МакМахон С.Б., Бойс С., Хилл Р., Станфа Л.К., Дикенсон А.Х., Вуд Дж.Н. (июнь 1999 г.). «Устойчивый к тетродотоксину натриевый канал СНС выполняет специализированную функцию в путях боли». Природная неврология . 2 (6): 541–8. дои : 10.1038/9195 . ПМИД 10448219 . S2CID 17487906 .
- ^ Акопян А.Н., Сивилотти Л., Вуд Дж.Н. (январь 1996 г.). «Устойчивый к тетродотоксину потенциалзависимый натриевый канал, экспрессируемый сенсорными нейронами». Природа . 379 (6562): 257–62. Бибкод : 1996Natur.379..257A . дои : 10.1038/379257a0 . ПМИД 8538791 . S2CID 4360775 .
- ^ Cummins TR, Sheets PL, Waxman SG (октябрь 2007 г.). «Роль натриевых каналов в ноцицепции: значение для механизмов боли» . Боль . 131 (3): 243–57. дои : 10.1016/j.pain.2007.07.026 . ПМК 2055547 . ПМИД 17766042 .
- ^ Jump up to: а б Суонвик Р.С., Пристера А., Окусе К. (декабрь 2010 г.). «Незаконный оборот Na(V)1,8» . Письма по неврологии . 486 (2): 78–83. дои : 10.1016/j.neulet.2010.08.074 . ПМЦ 2977848 . ПМИД 20816723 .
- ^ Стрикленд И.Т., Мартиндейл Дж.К., Вудхэмс П.Л., Рив А.Дж., Чесселл И.П., МакКуин Д.С. (июль 2008 г.). «Изменения в экспрессии NaV1.7, NaV1.8 и NaV1.9 в отдельной популяции ганглиев дорсальных корешков, иннервирующих коленный сустав крысы, на модели хронической воспалительной боли в суставах». Европейский журнал боли . 12 (5): 564–72. дои : 10.1016/j.ejpain.2007.09.001 . ПМИД 17950013 . S2CID 24952010 .
- ^ Блэр Н.Т., Бин Б.П. (2002). «Роль тетродотоксина (ТТХ)-чувствительного тока Na+, ТТХ-резистентного тока Na+ и тока Ca2+ в потенциалах действия ноцицептивных сенсорных нейронов» . Журнал неврологии . 22 (23): 10277–10290. doi : 10.1523/JNEUROSCI.22-23-10277.2002 . ПМК 6758735 . ПМИД 12451128 .
- ^ Ренганатан М., Cummins TR и Waxman SG (2001). «Вклад натриевых каналов Nav1.8 в электрогенез потенциала действия в нейронах DRG». Журнал нейрофизиологии . 86 (2): 629–640. дои : 10.1152/jn.2001.86.2.629 . ПМИД 11495938 . S2CID 11579149 .
- ^ Миллан М.Дж. (1999). «Индукция боли: интегративный обзор». Прогресс нейробиологии . 57 (1): 1–164. дои : 10.1016/S0301-0082(98)00048-3 . ПМИД 9987804 . S2CID 206054345 .
- ^ Мэтьюз Э.А., Вуд Дж.Н., Дикенсон А.Х. (февраль 2006 г.). «Na(v) 1,8-нулевые мыши демонстрируют стимул-зависимый дефицит активности спинных нейронов» . Молекулярная боль . 2 : 1744-8069–2-5. дои : 10.1186/1744-8069-2-5 . ПМЦ 1403745 . ПМИД 16478543 .
- ^ Джарвис М.Ф., Оноре П., Ши К.С., Чепмен М., Джоши С., Чжан К.Ф., Корт М., Кэрролл В., Маррон Б., Аткинсон Р., Томас Дж., Лю Д., Крамбис М., Лю Ю., МакГороти С., Чу К., Рулоффс Р. , Чжун С, Микуса Дж.П., Эрнандес Г., Говен Д., Уэйд С., Чжу С., Пай М., Сканио М., Ши Л., Дризин И., Грегг Р., Матуленко М., Хаким А., Гросс М., Джонсон М., Марш К., Вагонер ПК, Салливан Дж. П., Фалтынек Ч. Р., Крафте Д. С. (май 2007 г.). «А-803467, мощный и селективный блокатор натриевых каналов Nav1.8, ослабляет нейропатическую и воспалительную боль у крыс» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (20): 8520–5. дои : 10.1073/pnas.0611364104 . ПМК 1895982 . ПМИД 17483457 .
- ^ Jump up to: а б Циммерманн К., Леффлер А., Бэйбс А., Сендан СМ, Карр Р.В., Кобаяши Дж., Нау С., Вуд Дж.Н., Ри П.В. (июнь 2007 г.). «Натриевый канал сенсорного нейрона Nav1.8 необходим для боли при низких температурах». Природа . 447 (7146): 855–8. Бибкод : 2007Natur.447..856Z . дои : 10.1038/nature05880 . ПМИД 17568746 . S2CID 4391511 .
- ^ Хан С., Эстасьон М., Хуан Дж., Васильев Д., Чжао П., Диб-Хадж С.Д., Ваксман С.Г. (май 2015 г.). «Человеческий Na(v)1.8: усиленные постоянные и нарастающие токи способствуют отчетливым активирующим свойствам нейронов DRG человека» . Журнал нейрофизиологии . 113 (9): 3172–85. дои : 10.1152/jn.00113.2015 . ПМЦ 4432682 . ПМИД 25787950 .
- ^ Хуан Дж., Ян Й., Чжао П., Герритс М.М., Хойджмейкерс Дж.Г., Бекелаар К., Меркис И.С., Фабер К.Г., Диб-Хадж С.Д., Ваксман С.Г. (август 2013 г.). «Мутация Nav1.8 при нейропатии мелких волокон смещает активацию к гиперполяризованным потенциалам и увеличивает возбудимость нейронов дорсальных корешков ганглиев» . Журнал неврологии . 33 (35): 14087–97. doi : 10.1523/JNEUROSCI.2710-13.2013 . ПМК 6618513 . ПМИД 23986244 .
- ^ Блэк Дж.А., Диб-Хадж С., Бейкер Д., Ньюкомб Дж., Кузнер М.Л., Ваксман С.Г. (октябрь 2000 г.). «Сенсорно-специфичные для нейронов натриевые каналы SNS аномально экспрессируются в мозге мышей с экспериментальным аллергическим энцефаломиелитом и людей с рассеянным склерозом» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (21): 11598–602. Бибкод : 2000PNAS...9711598B . дои : 10.1073/pnas.97.21.11598 . ПМК 17246 . ПМИД 11027357 .
- ^ Ренганатан М., Гелдерблом М., Блэк Дж.А., Ваксман С.Г. (январь 2003 г.). «Экспрессия натриевых каналов Nav1.8 нарушает структуру импульсов клеток Пуркинье мозжечка». Исследования мозга . 959 (2): 235–42. дои : 10.1016/s0006-8993(02)03750-2 . ПМИД 12493611 . S2CID 34784900 .
- ^ Сааб С.И., Крэнер М.Дж., Катаока Ю., Ваксман С.Г. (сентябрь 2004 г.). «Аномальная активность клеток Пуркинье in vivo при экспериментальном аллергическом энцефаломиелите». Экспериментальное исследование мозга . 158 (1): 1–8. дои : 10.1007/s00221-004-1867-4 . ПМИД 15118796 . S2CID 34656521 .
- ^ Шилдс С.Д., Ченг X, Гассер А., Сааб С.И., Тиррелл Л., Истман Э.М., Ивата М., Цвингер П.Дж., Блэк Дж.А., Диб-Хадж С.Д., Ваксман С.Г. (февраль 2012 г.). «Каналопатия способствует дисфункции мозжечка в модели рассеянного склероза». Анналы неврологии . 71 (2): 186–94. дои : 10.1002/ana.22665 . ПМИД 22367990 . S2CID 25128887 .
- ^ Девор М; Говрин-Липпманн Р. и Ангелидес (1993). «Иммунолокализация Na+-каналов в периферических аксонах млекопитающих и изменения после повреждения нервов и формирования невромы» . Журнал неврологии . 13 (5): 1976–1992. doi : 10.1523/JNEUROSCI.13-05-01976.1993 . ПМК 6576562 . ПМИД 7683047 .
- ^ Голд М.С., Райхлинг Д.Б., Шустер М.Дж., Левин Дж.Д. (февраль 1996 г.). «Гипералгетики увеличивают ток Na+, устойчивый к тетродотоксину, в ноцицепторах» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (3): 1108–12. Бибкод : 1996PNAS...93.1108G . дои : 10.1073/pnas.93.3.1108 . ПМК 40039 . ПМИД 8577723 .
- ^ Гектор Т.Х. (январь 1975 г.). «Простой метод изготовления хроматографических записей с использованием прозрачного ацетатного листа» . Журнал физиологии . 32 (1): 31–2. дои : 10.1113/jphysicalol.1996.sp021604 . ПМЦ 1160802 . ПМИД 8887754 .
- ^ Лю С, Ли Ц, Су Ю, Бао Л (март 2010 г.). «Простагландин Е2 способствует транспортировке Na1.8 через его внутриклеточный мотив RRR через путь протеинкиназы А» . Трафик . 11 (3): 405–17. дои : 10.1111/j.1600-0854.2009.01027.x . ПМИД 20028484 . S2CID 997800 .
- ^ Хасар С.Г., Голд М.С. и Левин Дж.Д. (1998). «Устойчивый к тетродотоксину натриевый ток вызывает воспалительную боль у крыс» . Письма по неврологии . 256 (1): 17–20. дои : 10.1016/s0304-3940(98)00738-1 . ПМИД 9832206 . S2CID 5614913 .
- ^ Ву Д.Ф., Чандра Д., МакМахон Т., Ван Д., Дадгар Дж., Харазия В.Н., Лян Ю.Дж., Ваксман С.Г., Диб-Хадж С.Д., Мессинг РО (апрель 2012 г.). «Фосфорилирование PKCε натриевого канала NaV1.8 увеличивает функцию канала и вызывает механическую гипералгезию у мышей» . Журнал клинических исследований . 122 (4): 1306–15. дои : 10.1172/JCI61934 . ПМЦ 3315445 . ПМИД 22426212 .
- ^ Ху Д., Барахас-Мартинес Х., Пфайффер Р., Дези Ф., Пфайффер Дж., Бух Т., Бетценхаузер М.Дж., Белардинелли Л., Калиг К.М., Раджамани С., ДеАнтонио Х.Дж., Майербург Р.Дж., Ито Х., Дешмух П., Мариб М., Нам ГБ, Бхатия А, Хасдемир С, Хайссагер М, Вельтманн С, Шимпф Р, Боргрефе М, Вискин С, Анцелевич С (июль 2014 г.). «Мутации в SCN10A ответственны за большую часть случаев синдрома Бругада» . Журнал Американского колледжа кардиологов . 64 (1): 66–79. дои : 10.1016/j.jacc.2014.04.032 . ПМК 4116276 . ПМИД 24998131 .
- ^ Монаски М.М., Микальо Е., Вицедомини Дж., Локати Э.Т., Чиконте Г., Джаннелли Л., Джордано Ф., Криса С., Векки М., Боррелли В., Джирольди А., Д'Империо С., Ди Реста К., Бенедетти С., Феррари М., Сантинелли В. , Анастасия Л., Паппоне С. (2019). «Сопоставимые клинические характеристики у пациентов с синдромом Бругада, несущих SCN5A или новые варианты SCN10A» . Европа . 21 (10): 1550–1558. doi : 10.1093/europace/euz186 . ПМИД 31292628 . Проверено 27 апреля 2021 г.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Монаски М.М., Микаглио Э., Чиконте Дж., Паппоне С. (2020). «Синдром Бругада: олигогенная или менделевская болезнь?» . Int J Mol Sci . 21 (5): 1687. doi : 10.3390/ijms21051687 . ПМЦ 7084676 . ПМИД 32121523 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ МакМахон С.Б. (март 1996 г.). «NGF как медиатор воспалительной боли». Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 351 (1338): 431–40. Бибкод : 1996РСТБ.351..431М . дои : 10.1098/rstb.1996.0039 . ПМИД 8730782 .
- ^ Окусе К., Малик-Холл М., Бейкер М.Д., Пун Вайоминг, Конг Х., Чао М.В., Вуд Дж.Н. (июнь 2002 г.). «Легкая цепь аннексина II регулирует экспрессию натриевых каналов, специфичных для сенсорных нейронов». Природа . 417 (6889): 653–6. Бибкод : 2002Natur.417..653O . дои : 10.1038/nature00781 . ПМИД 12050667 . S2CID 4423351 .
- ^ Фоулкс Т., Нассар М.А., Лейн Т., Мэтьюз Э.А., Бейкер М.Д., Герке В., Окусе К., Дикенсон А.Х., Вуд Дж.Н. (октябрь 2006 г.). «Удаление легкой цепи аннексина 2 p11 в ноцицепторах вызывает нарушения соматосенсорного кодирования и болевого поведения» (PDF) . Журнал неврологии . 26 (41): 10499–507. doi : 10.1523/JNEUROSCI.1997-06.2006 . ПМК 6674704 . ПМИД 17035534 .
- ^ Jump up to: а б Пристера А., Бейкер, доктор медицинских наук, Окусе К. (2012). «Ассоциация между каналами, устойчивыми к тетродотоксину, и липидными рафтами регулирует возбудимость сенсорных нейронов» . ПЛОС ОДИН . 7 (8): е40079. Бибкод : 2012PLoSO...740079P . дои : 10.1371/journal.pone.0040079 . ПМЦ 3411591 . ПМИД 22870192 .
- ^ Хоймейкерс Дж.Г., Фабер К.Г., Лаурия Г., Меркис И.С., Ваксман С.Г. (май 2012 г.). «Мелковолоконные невропатии - достижения в диагностике, патофизиологии и лечении». Обзоры природы. Неврология . 8 (7): 369–79. дои : 10.1038/nrneurol.2012.97 . ПМИД 22641108 . S2CID 8804151 .
- ^ Фабер К.Г., Хоймейкерс Дж.Г., Ан Х.С., Ченг Х., Хан С., Чой Дж.С., Эстасьон М., Лаурия Г., Ванхаутт Е.К., Герритс М.М., Диб-Хадж С., Дрент Дж.П., Ваксман С.Г., Меркис И.С. (январь 2012 г.). «Усиление функции мутаций Naν1.7 при идиопатической невропатии мелких волокон». Анналы неврологии . 71 (1): 26–39. дои : 10.1002/ana.22485 . ПМИД 21698661 . S2CID 11711575 .
Дальнейшее чтение
[ редактировать ]- Окусе К (2007). «Пути передачи сигналов боли: от цитокинов к ионным каналам». Международный журнал биохимии и клеточной биологии . 39 (3): 490–6. дои : 10.1016/j.biocel.2006.11.016 . ПМИД 17194618 .
- Ваксман С.Г. (июль 2013 г.). «Болезненные Na-каналопатии: расширяющаяся вселенная». Тенденции молекулярной медицины . 19 (7): 406–9. doi : 10.1016/j.molmed.2013.04.003 . ПМИД 23664154 .
- Лай Дж., Поррека Ф., Хантер Дж.К., Голд М.С. (2004). «Потенциал-управляемые натриевые каналы и гипералгезия». Ежегодный обзор фармакологии и токсикологии . 44 : 371–97. doi : 10.1146/annurev.pharmtox.44.101802.121627 . ПМИД 14744251 .
- Вуд Дж.Н., Бурман Дж.П., Окусе К., Бейкер, доктор медицинских наук (октябрь 2004 г.). «Натриевые каналы и болевые пути, управляемые напряжением». Журнал нейробиологии . 61 (1): 55–71. дои : 10.1002/neu.20094 . ПМИД 15362153 .
- Малик-Холл М., Пун Вайоминг, Бейкер М.Д., Вуд Дж.Н., Окусе К. (февраль 2003 г.). «Белки сенсорных нейронов взаимодействуют с внутриклеточными доменами натриевого канала NaV1.8». Исследования мозга. Молекулярные исследования мозга . 110 (2): 298–304. дои : 10.1016/S0169-328X(02)00661-7 . ПМИД 12591166 .
- Ямаока К., Иноуэ М., Миядзаки К., Хирама М., Кондо С., Киносита Е., Миёси Х., Сейама I (март 2009 г.). «Синтетические цигуатоксины избирательно активируют химерные натриевые каналы, производные Nav1.8, экспрессируемые в клетках HEK293» . Журнал биологической химии . 284 (12): 7597–605. дои : 10.1074/jbc.M806481200 . ПМК 2658054 . ПМИД 19164297 .
- Чой Дж.С., Хадмон А., Ваксман С.Г., Диб-Хадж С.Д. (июль 2006 г.). «Кальмодулин регулирует плотность тока и частотно-зависимое ингибирование натриевого канала Nav1.8 в нейронах DRG». Журнал нейрофизиологии . 96 (1): 97–108. дои : 10.1152/jn.00854.2005 . ПМИД 16598065 .
- Лю С.Дж., Прист Б.Т., Бугианеси Р.М., Дульски П.М., Феликс Дж.П., Дик И.Э., Брочу Р.М., Кнаус Х.Г., Миддлтон Р.Э., Качоровски Г.Дж., Слотер Р.С., Гарсия М.Л., Кёлер М.Г. (февраль 2006 г.). «Анализ мембранного потенциала высокой емкости на основе FRET для каналов NaV1.8». Технологии анализа и разработки лекарств . 4 (1): 37–48. дои : 10.1089/adt.2006.4.37 . ПМИД 16506887 .
- Браун Л.Е., Блейни Ф.Е., Юсаф С.П., Клэр Дж.Дж., Рэй Д. (апрель 2009 г.). «Структурные детерминанты препаратов, действующих на канале Nav1.8» . Журнал биологической химии . 284 (16): 10523–36. дои : 10.1074/jbc.M807569200 . ПМЦ 2667739 . ПМИД 19233853 .
- Раберт Д.К., Кох Б.Д., Ильница М., Обернолте Р.А., Нейлор С.Л., Герман Р.К., Эглен Р.М., Хантер Дж.К., Сангамесваран Л. (ноябрь 1998 г.). «Устойчивый к тетродотоксину потенциалзависимый натриевый канал из ганглиев дорсальных корешков человека, hPN3 / SCN10A». Боль . 78 (2): 107–14. дои : 10.1016/S0304-3959(98)00120-1 . ПМИД 9839820 . S2CID 45480324 .
- Пламмер Н.В., Мейслер М.Х. (апрель 1999 г.). «Эволюция и разнообразие генов натриевых каналов млекопитающих». Геномика . 57 (2): 323–31. дои : 10.1006/geno.1998.5735 . ПМИД 10198179 .
- Каттералл В.А., Голдин А.Л., Ваксман С.Г. (декабрь 2005 г.). «Международный союз фармакологии. XLVII. Номенклатура и структурно-функциональные связи потенциалзависимых натриевых каналов». Фармакологические обзоры . 57 (4): 397–409. дои : 10.1124/пр.57.4.4 . ПМИД 16382098 . S2CID 7332624 .



