Рецептор, связанный с G-белком
| ГПКР | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | 7tm_1 | ||
| Пфам | PF00001 | ||
| ИнтерПро | IPR000276 | ||
| PROSITE | PDOC00210 | ||
| TCDB | 9.А.14 | ||
| Суперсемейство OPM | 6 | ||
| белок OPM | 1гзм | ||
| CDD | cd14964 | ||
| |||
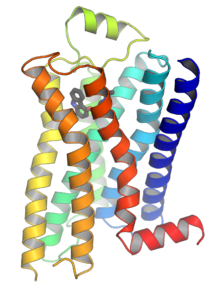
Рецепторы, связанные с G-белком ( GPCR ), также известные как рецепторы семи-(проходного)-трансмембранного домена , рецепторы 7TM , гептаспиральные рецепторы , серпентиновые рецепторы и рецепторы, связанные с G-белком ( GPLR ), образуют большую группу эволюционно родственных белков , которые представляют собой рецепторы клеточной поверхности , которые обнаруживают молекулы вне клетки и активируют клеточные реакции. Они связаны с G-белками . Они проходят через клеточную мембрану семь раз в виде шести петель. [ 2 ] (три внеклеточные петли, взаимодействующие с молекулами лиганда , три внутриклеточные петли, взаимодействующие с G-белками, N-концевая внеклеточная область и С-концевая внутриклеточная область [ 2 ] ) аминокислотных остатков , поэтому их иногда называют семитрансмембранными рецепторами. [ 3 ] Лиганды могут связываться либо с внеклеточными N-концами и петлями (например, глутаматные рецепторы), либо с сайтом связывания внутри трансмембранных спиралей ( родопсин -подобное семейство). Все они активируются агонистами , хотя также наблюдалась спонтанная автоактивация пустого рецептора. [ 3 ]
Рецепторы, связанные с G-белком, обнаружены только у эукариот , включая дрожжи , и хоанофлагеллят . [ 4 ] Лиганды , которые связывают и активируют эти рецепторы , включают светочувствительные соединения, запахи , феромоны , гормоны и нейротрансмиттеры и различаются по размеру: от небольших молекул до пептидов и крупных белков . Рецепторы, связанные с G-белком, участвуют во многих заболеваниях.
Существует два основных пути передачи сигнала с участием рецепторов, связанных с G-белком:
- путь цАМФ сигнальный и
- путь фосфатидилинозитола сигнальный . [ 5 ]
Когда лиганд связывается с GPCR, он вызывает конформационные изменения в GPCR, что позволяет ему действовать как фактор обмена гуаниновых нуклеотидов (GEF). Затем GPCR может активировать связанный G-белок путем обмена GDP, связанного с G-белком, на GTP . Субъединица α белка G вместе со связанным GTP может затем диссоциировать от субъединиц β и γ, чтобы далее воздействовать на внутриклеточные сигнальные белки или целевые функциональные белки, непосредственно в зависимости от типа субъединицы α ( G αs , G αi/o , G αq/ 11 , Gα12 /13 ). [ 6 ] : 1160
GPCR являются важной мишенью для лекарств, и около 34% [ 7 ] всех лекарств, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), предназначены для 108 членов этой семьи. Мировой объем продаж этих препаратов оценивается в 180 миллиардов долларов США по состоянию на 2018 год. [update]. [ 7 ] Подсчитано, что GPCRs являются мишенью для около 50% лекарств, имеющихся в настоящее время на рынке, в основном из-за их участия в сигнальных путях, связанных со многими заболеваниями, т.е. психическими, метаболическими, включая эндокринологические расстройства, иммунологические, включая вирусные инфекции, сердечно-сосудистые, воспалительные, расстройства чувств и т.д. и рак. Еще одной динамично развивающейся областью фармацевтических исследований является давно обнаруженная связь между GPCR и многими эндогенными и экзогенными веществами, приводящая, например, к анальгезии. [ 3 ]
История и значение
[ редактировать ]С определением первой структуры комплекса между рецептором, связанным с G-белком (GPCR) и тримером G-белка (Gαβγ), в 2011 году была открыта новая глава исследований GPCR для структурных исследований глобальных переключателей с более чем одним белком. расследуется. Предыдущие открытия включали определение кристаллической структуры первого GPCR, родопсина, в 2000 году и кристаллической структуры первого GPCR с диффундирующим лигандом (β 2 AR) в 2007 году. Способ, которым семь трансмембранных спиралей GPCR соединяются Собрание в пучок было заподозрено на основе модели родопсина лягушки с низким разрешением, полученной в результате криогенной электронной микроскопии исследований двумерных кристаллов с помощью . Кристаллическая структура родопсина, обнаруженная три года спустя, не стала неожиданностью, если не считать наличия дополнительной цитоплазматической спирали H8 и точного расположения петли, охватывающей место связывания с сетчаткой. Однако он предоставил основу, которая, как надеялись, станет универсальной матрицей для моделирования гомологии и разработки лекарств для других GPCR – идея, которая оказалась слишком оптимистичной.
Семь лет спустя кристаллизация β 2 -адренергического рецептора (β 2 АР) с диффундирующим лигандом принесла неожиданные результаты, поскольку выявила совершенно иную форму внеклеточной стороны рецептора, чем у родопсина. Эта область важна, поскольку она отвечает за связывание лигандов и на нее воздействуют многие лекарства. При этом место связывания лиганда было значительно более просторным, чем в структуре родопсина, и было открыто наружу. В других рецепторах, кристаллизованных вскоре после этого, связывающая сторона была еще более доступна для лиганда. Новые структуры, дополненные биохимическими исследованиями, открыли механизмы действия молекулярных переключателей, которые модулируют структуру рецептора, приводя к состояниям активации для агонистов или к состояниям полной или частичной инактивации для обратных агонистов. [ 3 ]
2012 года Нобелевская премия по химии была присуждена Брайану Кобилке и Роберту Лефковицу за работу, которая «имела решающее значение для понимания того, как функционируют рецепторы, связанные с G-белком». [ 8 ] были По меньшей мере семь других Нобелевских премий присуждены за некоторые аспекты передачи сигналов, опосредованной G-белком. По состоянию на 2012 год два из десяти самых продаваемых в мире лекарств ( Advair Diskus и Abilify ) действуют путем воздействия на рецепторы, связанные с G-белком. [ 9 ]
Классификация
[ редактировать ]
Точный размер суперсемейства GPCR неизвестен, но человека генома было предсказано, что по крайней мере 831 различный ген (или около 4% всего , кодирующего белок генома ) кодирует их на основе анализа последовательности . [ 10 ] [ 11 ] Хотя были предложены многочисленные схемы классификации, суперсемейство было классически разделено на три основных класса (A, B и C) без обнаруживаемой гомологии общих последовательностей между классами.
Самым крупным классом на сегодняшний день является класс А, на который приходится почти 85% генов GPCR. Предполагается, что из GPCR класса А более половины из них кодируют обонятельные рецепторы , в то время как остальные рецепторы связаны известными эндогенными соединениями или классифицируются как орфанные рецепторы . Несмотря на отсутствие гомологии последовательностей между классами, все GPCR имеют общую структуру и механизм передачи сигнала . Очень большая группа родопсина А была подразделена на 19 подгрупп ( А1-А19 ). [ 12 ]
Согласно классической системе AF, GPCR можно сгруппировать в шесть классов на основе гомологии последовательностей и функционального сходства: [ 13 ] [ 14 ] [ 15 ] [ 16 ]
- Класс А (или 1) ( родопсинподобные )
- Класс B (или 2) ( семейство рецепторов секретина )
- Класс C (или 3) ( метаботропный глутамат /феромон)
- Класс D (или 4) ( рецепторы спаривания феромонов грибов )
- Класс E (или 5) ( циклические AMP-рецепторы )
- Класс F (или 6) ( кудрявый / гладкий )
Совсем недавно альтернативная система классификации под названием GRAFS ( глутамат , родопсин , адгезия , вьющиеся / вкус2 , секретин ). для GPCR позвоночных была предложена [ 10 ] Они соответствуют классическим классам C, A, B2, F и B. [ 17 ]
Раннее исследование, основанное на доступных последовательностях ДНК, показало, что геном человека кодирует примерно 750 рецепторов, связанных с G-белками. [ 18 ] около 350 из которых обнаруживают гормоны, факторы роста и другие эндогенные лиганды. Примерно 150 GPCR, обнаруженных в геноме человека, имеют неизвестные функции.
Некоторые веб-серверы [ 19 ] и методы прогнозирования биоинформатики [ 20 ] [ 21 ] были использованы для прогнозирования классификации GPCR только по их аминокислотной последовательности с помощью подхода псевдоаминокислотного состава .
Физиологические роли
[ редактировать ]GPCRs участвуют в широком спектре физиологических процессов. Некоторые примеры их физиологической роли включают в себя:
- Визуальный смысл: опсины используют реакцию фотоизомеризации для перевода электромагнитного излучения в клеточные сигналы. Родопсин , например, использует для этой цели преобразование 11-цис -ретиналя в полностью транс -ретиналь .
- Вкусовое ощущение (вкус): GPCR во вкусовых клетках опосредуют высвобождение густдуцина в ответ на вещества с горьким, умами и сладким вкусом.
- Обоняние: рецепторы обонятельного эпителия связывают одоранты (обонятельные рецепторы) и феромоны (вомероназальные рецепторы).
- Регуляция поведения и настроения: рецепторы в млекопитающих мозге связывают несколько различных нейротрансмиттеров , включая серотонин , дофамин , гистамин , ГАМК и глутамат.
- Регуляция активности иммунной системы и воспаления : хемокиновые рецепторы связывают лиганды, которые опосредуют межклеточную связь между клетками иммунной системы; рецепторы, такие как рецепторы гистамина, связывают медиаторы воспаления и вовлекают типы клеток-мишеней в воспалительную реакцию . GPCR также участвуют в иммуномодуляции, например, регулируют индукцию интерлейкинов. [ 22 ] или подавление TLR -индуцированных иммунных ответов Т-клеток. [ 23 ]
- Передача вегетативной нервной системы: как симпатическая , так и парасимпатическая нервные системы регулируются путями GPCR, ответственными за контроль многих автоматических функций организма, таких как кровяное давление, частота сердечных сокращений и процессы пищеварения.
- Определение плотности клеток: новая роль GPCR в регулировании определения плотности клеток.
- Модуляция гомеостаза (например, водного баланса). [ 24 ]
- Участвует в росте и метастазировании некоторых типов опухолей . [ 25 ]
- Используется в эндокринной системе для гормонов, производных пептидов и аминокислот, которые связываются с GCPR на клеточной мембране клетки-мишени. Это активирует цАМФ, который, в свою очередь, активирует несколько киназ, обеспечивая клеточный ответ, такой как транскрипция.
Структура рецептора
[ редактировать ]GPCRs представляют собой интегральные мембранные белки , которые обладают семью трансмембранными доменами или трансмембранными спиралями . [ 26 ] [ 27 ] Внеклеточные части рецептора могут быть гликозилированы . Эти внеклеточные петли также содержат два высококонсервативных остатка цистеина , которые образуют дисульфидные связи для стабилизации структуры рецептора. Некоторые семитрансмембранные белки-спирали ( канальный родопсин ), напоминающие GPCR, могут содержать ионные каналы внутри своего белка.
В 2000 году была раскрыта первая кристаллическая структура GPCR млекопитающих — бычьего родопсина ( 1F88 ). [ 28 ] В 2007 году была раскрыта первая структура GPCR человека. [ 29 ] [ 1 ] [ 30 ] Эта структура человеческого β 2 -адренергического рецептора GPCR оказалась очень похожей на бычий родопсин. Также были определены структуры активированных или связанных с агонистами GPCR. [ 31 ] [ 32 ] [ 33 ] [ 34 ] Эти структуры показывают, как связывание лиганда на внеклеточной стороне рецептора приводит к конформационным изменениям на цитоплазматической стороне рецептора. Самым большим изменением является перемещение наружу цитоплазматической части 5-й и 6-й трансмембранных спиралей (TM5 и TM6). Структура активированного бета-2-адренергического рецептора в комплексе с G подтверждает , что Gα связывается с полостью, созданной этим движением. [ 35 ]
GPCR имеют структуру, аналогичную некоторым другим белкам с семью трансмембранными доменами , таким как микробные родопсины и рецепторы адипонектина 1 и 2 ( ADIPOR1 и ADIPOR2 ). Однако эти рецепторы и каналы 7TMH (7-трансмембранные спирали) не связываются с G-белками . Кроме того, ADIPOR1 и ADIPOR2 ориентированы противоположно GPCR в мембране (т.е. GPCR обычно имеют внеклеточный N-конец , цитоплазматический C-конец , тогда как ADIPOR инвертированы). [ 36 ]
Отношения структура-функция
[ редактировать ]
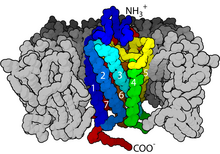
С точки зрения структуры GPCR характеризуются внеклеточным N-концом , за которым следуют семь трансмембранных (7-TM) α-спиралей (TM-1–TM-7), соединенных тремя внутриклеточными (IL-1–IL-3) и три внеклеточные петли (от EL-1 до EL-3) и, наконец, внутриклеточный С-конец . GPCR образует третичную структуру, напоминающую бочонок, с семью трансмембранными спиралями, образующими полость внутри плазматической мембраны, которая обслуживает лиганд -связывающий домен, который часто покрыт EL-2. Однако лиганды могут связываться и в других местах, как в случае с более объемными лигандами (например, белками или большими пептидами ), которые вместо этого взаимодействуют с внеклеточными петлями или, как показано на примере метаботропных глутаматных рецепторов класса C (mGluR), N- конечный хвост. GPCR класса C отличаются большим N-концевым хвостом, который также содержит лиганд-связывающий домен. При связывании глутамата с mGluR N-концевой хвост претерпевает конформационное изменение, которое приводит к его взаимодействию с остатками внеклеточных петель и ТМ-доменами. Конечный эффект всех трех типов Активация, индуцированная агонистом, представляет собой изменение относительной ориентации спиралей ТМ (по аналогии с скручивающим движением), приводящее к более широкой внутриклеточной поверхности и «обнаружению» остатков внутриклеточных спиралей и доменов ТМ, имеющих решающее значение для функции передачи сигнала (т.е. G -белковая связь). Обратные агонисты и антагонисты также могут связываться с рядом различных сайтов, но конечным эффектом должно быть предотвращение этой переориентации спирали ТМ. [ 3 ]
Структура N- и C-концевых хвостов GPCR может также выполнять важные функции, помимо связывания лигандов. Например, С-конца мускариновых рецепторов М 3 достаточно, а многоосновный домен из шести аминокислот (KKKRRK) на С-конце необходим для его предварительной сборки с белками Gq . [ 37 ] В частности, С-конец часто содержит серина (Ser) или треонина остатки (Thr), которые при фосфорилировании увеличивают сродство внутриклеточной поверхности к связыванию каркасных белков, называемых β- аррестинами (β-arr). [ 38 ] После связывания β-аррестины как стерически предотвращают связывание G-белков, так и могут рекрутировать другие белки, что приводит к созданию сигнальных комплексов, участвующих в киназы, регулируемой внеклеточными сигналами ( ERK активации пути ), или эндоцитозе (интернализации) рецепторов. Поскольку фосфорилирование этих остатков Ser и Thr часто происходит в результате активации GPCR, β-arr-опосредованное развязывание G-белка и интернализация GPCRs являются важными механизмами десенсибилизации . [ 39 ] Кроме того, интернализованные «мегакомплексы», состоящие из одного GPCR, β-arr (в конформации хвоста), [ 40 ] [ 41 ] и гетеротримерный G-белок существуют и могут отвечать за передачу сигналов белка из эндосом. [ 42 ] [ 43 ]
Последней общей структурной темой среди GPCRs является пальмитоилирование одного или нескольких участков C-концевого хвоста или внутриклеточных петель. Пальмитоилирование представляет собой ковалентную модификацию остатков цистеина (Cys) посредством добавления гидрофобных ацильных групп и оказывает эффект нацеливания рецептора на богатые холестерином и сфинголипидами микродомены плазматической мембраны, называемые липидными рафтами . Поскольку многие из нижестоящих молекул-преобразователей и эффекторов GPCR (включая те, которые участвуют в путях отрицательной обратной связи ) также нацелены на липидные рафты, это способствует быстрой передаче сигналов рецептором.
GPCR реагируют на внеклеточные сигналы, опосредованные огромным разнообразием агонистов, от белков до биогенных аминов и протонов , но все они передают этот сигнал посредством механизма сцепления G-белка. Это становится возможным благодаря домену фактора обмена гуанин -нуклеотидов ( GEF ), в первую очередь образованному комбинацией IL-2 и IL-3 вместе с соседними остатками связанных спиралей TM.
Механизм
[ редактировать ]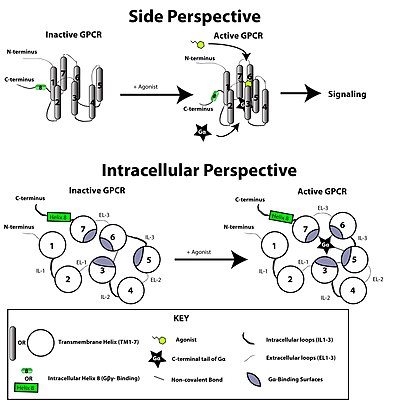
Рецептор, связанный с G-белком, активируется внешним сигналом в виде лиганда или другого сигнального медиатора. Это создает конформационные изменения в рецепторе, вызывая активацию G-белка . Дальнейший эффект зависит от типа G-белка. Белки G впоследствии инактивируются белками, активирующими ГТФазу, известными как белки RGS .
Связывание лиганда
[ редактировать ]GPCR включают один или несколько рецепторов для следующих лигандов: медиаторы сенсорных сигналов (например, световые и обонятельные стимулирующие молекулы); аденозин , бомбезин , брадикинин , эндотелин , γ-аминомасляная кислота ( ГАМК ), фактор роста гепатоцитов ( HGF ), меланокортины , нейропептид Y , опиоидные пептиды, опсины , соматостатин , GH , тахикинины , члены семейства вазоактивных кишечных пептидов и вазопрессин ; биогенные амины (например, дофамин , адреналин , норадреналин , гистамин , серотонин и мелатонин ); глутамат ( метаботропный эффект); глюкагон ; ацетилхолин ( мускариновый эффект); хемокины ; липидные медиаторы воспаления (например, простагландины , простаноиды , фактор активации тромбоцитов и лейкотриены ); пептидные гормоны (например, кальцитонин , анафилатоксин C5a , фолликулостимулирующий гормон [FSH], гонадотропин-высвобождающий гормон [GnRH], нейрокинин , тиреотропин-высвобождающий гормон [TRH] и окситоцин ); и эндоканнабиноиды .
GPCR, которые действуют как рецепторы для стимулов, которые еще не идентифицированы, известны как сиротские рецепторы .
Однако в отличие от других типов рецепторов, которые были изучены, лиганды которых связываются с мембраной снаружи, лиганды GPCR обычно связываются внутри трансмембранного домена. Однако рецепторы, активируемые протеазой, активируются путем отщепления части их внеклеточного домена. [ 45 ]
Конформационные изменения
[ редактировать ]
Трансдукция сигнала рецептором через мембрану до конца не изучена. Известно, что в неактивном состоянии GPCR связан с гетеротримерным комплексом G-белка . Связывание агониста с GPCR приводит к конформационному изменению рецептора, которое передается связанной субъединице Gα гетеротримерного G-белка посредством динамики белкового домена . Активированная субъединица Gα обменивает GTP вместо GDP , что, в свою очередь, запускает диссоциацию субъединицы Gα от димера Gβγ и от рецептора. Диссоциированные субъединицы Gα и Gβγ взаимодействуют с другими внутриклеточными белками, продолжая каскад передачи сигнала, в то время как освобожденный GPCR способен повторно связываться с другим гетеротримерным G-белком с образованием нового комплекса, который готов инициировать новый раунд передачи сигнала. [ 46 ]
Считается, что молекула рецептора существует в конформационном равновесии между активным и неактивным биофизическими состояниями. [ 47 ] Связывание лигандов с рецептором может сместить равновесие в сторону активных состояний рецептора. Существуют три типа лигандов: агонисты — это лиганды, смещающие равновесие в пользу активных состояний; обратные агонисты — лиганды, смещающие равновесие в пользу неактивных состояний; а нейтральные антагонисты представляют собой лиганды, не влияющие на равновесие. Пока неизвестно, чем именно отличаются активное и неактивное состояния друг от друга.
Цикл активации/деактивации G-белка
[ редактировать ]
Когда рецептор неактивен, домен GEF может быть связан с также неактивной α-субъединицей гетеротримерного G-белка . Эти «G-белки» представляют собой тример субъединиц α, β и γ (известных как Gα, Gβ и Gγ соответственно), который становится неактивным при обратимом связывании с гуанозиндифосфатом (GDP) (или, альтернативно, без гуанинового нуклеотида). ), но активен при связывании с гуанозинтрифосфатом (ГТФ). При активации рецептора домен GEF, в свою очередь, аллостерически активирует G-белок, способствуя обмену молекулы GDP на GTP в α-субъединице G-белка. В клетке поддерживается соотношение цитозольного ГТФ:ГДП 10:1, поэтому обеспечивается обмен на ГТФ. В этот момент субъединицы G-белка диссоциируют от рецептора, а также друг от друга, образуя мономер Gα-GTP и тесно взаимодействующий димер Gβγ , которые теперь могут модулировать активность других внутриклеточных белков. Однако степень их диффузии ограничена из-за пальмитоилирования Gα и присутствия изопреноидный фрагмент, ковалентно добавленный к С-концу Gγ.
Поскольку Gα также обладает способностью к медленному гидролизу GTP→GDP , неактивная форма α-субъединицы (Gα-GDP) в конечном итоге регенерируется, что позволяет реассоциироваться с димером Gβγ с образованием «покоящегося» G-белка, который может снова связываться с GPCR и дождитесь активации. Скорость гидролиза GTP часто ускоряется из-за действия другого семейства аллостерических модулирующих белков, называемых регуляторами передачи сигналов G-белка , или белков RGS, которые представляют собой тип белка, активирующего GTPase , или GAP. Фактически, многие из первичных эффекторных белков (например, аденилатциклазы ), которые активируются/инактивируются при взаимодействии с Gα-GTP, также обладают активностью GAP. Таким образом, даже на этой ранней стадии процесса передача сигналов, инициируемая GPCR, обладает способностью к самозавершению.
Перекрестные помехи
[ редактировать ]
Было показано, что нижестоящие сигналы GPCRs, возможно, взаимодействуют с сигналами интегрина , такими как FAK . [ 48 ] Передача сигналов интегрина будет фосфорилировать FAK, что затем может снизить активность GPCR Gαs .
Сигнализация
[ редактировать ]
Если рецептор в активном состоянии встречает G-белок , он может активировать его. Некоторые данные свидетельствуют о том, что рецепторы и G-белки на самом деле предварительно связаны. [ 37 ] Например, связывание G-белков с рецепторами влияет на сродство рецептора к лигандам. Активированные G-белки связаны с GTP .
Дальнейшая передача сигнала зависит от типа G-белка. Фермент аденилатциклаза является примером клеточного белка, который может регулироваться G-белком, в данном случае G-белком G s . Активность аденилатциклазы активируется, когда она связывается с субъединицей активированного G-белка. Активация аденилатциклазы заканчивается, когда G-белок возвращается в GDP -связанное состояние.
Аденилатциклазы (из которых у человека известны 9 мембраносвязанных и одна цитозольная формы) также могут быть активированы или ингибированы другими способами (например, связыванием Ca2+/ кальмодулина ), что может модифицировать активность этих ферментов аддитивным или синергическим образом. вместе с G-белками.
Сигнальные пути, активируемые посредством GPCR, ограничены первичной последовательностью и третичной структурой самого GPCR, но в конечном итоге определяются конкретной конформацией, стабилизированной конкретным лигандом , а также доступностью молекул- преобразователей . В настоящее время считается, что GPCR используют два основных типа преобразователей: G-белки и β-аррестины . Поскольку β-arr имеют высокое сродство только к фосфорилированной форме большинства GPCR (см. выше или ниже), большая часть передачи сигналов в конечном итоге зависит от активации G-белка. Однако возможность взаимодействия действительно позволяет осуществлять независимую от G-белка передачу сигналов.
G-белковозависимая передача сигналов
[ редактировать ]Существует три основных сигнальных пути, опосредованных G-белками, опосредованных четырьмя подклассами G-белков, отличающихся друг от друга гомологией последовательностей ( Gαs , , Gαi /o Gαq / 11 и Gα12 /13 ). Каждый подкласс G-белка состоит из множества белков, каждый из которых является продуктом множества генов или вариаций сплайсинга , которые могут придавать им различия в диапазоне от едва заметных до различных в отношении сигнальных свойств, но в целом они кажутся разумно сгруппированными в четыре класса. Поскольку свойства передачи сигнала различных возможных комбинаций βγ, по-видимому, радикально не отличаются друг от друга, эти классы определяются в соответствии с изоформой их α-субъединицы. [ 6 ] : 1163
Хотя большинство GPCR способны активировать более одного Gα-подтипа, они также отдают предпочтение одному подтипу над другим. Когда активированный подтип зависит от лиганда, который связан с GPCR, это называется функциональной селективностью (также известной как агонист-направленный транспорт или конформационно-специфический агонизм). Однако связывание любого отдельного агониста может также инициировать активацию множества различных G-белков, поскольку он может быть способен стабилизировать более чем одну конформацию домена GEF GPCR даже в ходе одного взаимодействия. Кроме того, конформация, которая предпочтительно активирует одну изоформу Gα, может активировать другую, если предпочтительная менее доступна. Более того, пути обратной связи могут приводить к модификациям рецепторов (например, фосфорилированию), которые изменяют предпочтение G-белка. Независимо от этих различных нюансов, предпочтительный партнер для связывания GPCR обычно определяется в соответствии с G-белком, который наиболее явно активируется эндогенным лигандом в большинстве случаев. физиологические или экспериментальные условия.
Передача сигналов Gα
[ редактировать ]- Эффектором путей Gαs и Gαi /o является генерирующий циклический аденозинмонофосфат (цАМФ) фермент аденилатциклаза, , или AC. Хотя у млекопитающих существует десять различных продуктов генов AC, каждый из которых имеет небольшие различия в тканей распределении или функциях , все они катализируют превращение цитозольного аденозинтрифосфата (АТФ) в цАМФ, и все они непосредственно стимулируются G-белками класса Gαs . Однако, напротив, взаимодействие с субъединицами Gα типа Gαi /o ингибирует AC генерирование цАМФ. Таким образом, GPCR, связанный с Gαs , противодействует действию GPCR, связанного с Gαi /o , и наоборот. Уровень цитозольного цАМФ может затем определять активность различных ионных каналов , а также членов семейства ser/thr-специфичных протеинкиназ А (PKA). Таким образом, цАМФ считается вторичным мессенджером , а ПКА – вторичным эффектором .
- Эффектором пути G αq/11 является фосфолипаза C-β (PLCβ), которая катализирует расщепление мембраносвязанного фосфатидилинозитол-4,5-бисфосфата (PIP2) на вторичные мессенджеры инозитол (1,4,5) трифосфат (IP3). ) и диацилглицерин (ДАГ). IP3 действует на рецепторы IP3, обнаруженные в мембране эндоплазматического ретикулума (ER), вызывая Ca. 2+ высвобождается из ЭР, в то время как ДАГ диффундирует вдоль плазматической мембраны , где он может активировать любые локализованные в мембране формы второй ser/thr киназы, называемой протеинкиназой C (PKC). Поскольку многие изоформы ПКС также активируются увеличением внутриклеточного кальция 2+ Оба эти пути также могут сходиться друг с другом, чтобы передать сигнал через один и тот же вторичный эффектор. Повышенный внутриклеточный Ca 2+ также связывает и аллостерически активирует белки, называемые кальмодулинами , которые, в свою очередь, тозолируют малую ГТФазу Rho . После связывания с GTP Rho может затем активировать различные белки, ответственные за регуляцию цитоскелета, такие как Rho-киназа (ROCK). Большинство GPCR, которые соединяются с Gα12 /13, также связываются с другими подклассами, часто с Gαq /11 .
Передача сигналов Gβγ
[ редактировать ]Приведенные выше описания игнорируют эффекты передачи сигналов Gβγ , которые также могут быть важны, в частности, в случае активированных Gαi /o -связанных GPCR. Первичными эффекторами Gβγ являются различные ионные каналы, такие как регулируемые G-белком внутренние выпрямляющие K + каналы (ГИРК), P / Q- и N-типа потенциал-управляемые Ca 2+ каналы , а также некоторые изоформы AC и PLC, а также некоторые изоформы фосфоинозитид-3-киназы (PI3K).
Независимая от G-белка передача сигналов
[ редактировать ]Хотя традиционно считается, что они работают только вместе, GPCRs могут передавать сигналы посредством независимых от G-белков механизмов, а гетеротримерные G-белки могут играть функциональные роли, независимые от GPCR. GPCRs могут передавать сигналы независимо через многие белки, уже упомянутые в связи с их ролью в G-белкозависимой передаче сигналов, такие как β-arrs , GRKs и Srcs . Было показано, что такая передача сигналов физиологически значима, например, передача сигналов β-аррестина , опосредованная хемокиновым рецептором CXCR3, была необходима для полной эффективности хемотаксиса активированных Т-клеток. [ 49 ] Кроме того, дополнительные каркасные белки, участвующие в субклеточной локализации GPCR (например, белки, содержащие PDZ-домен ), также могут действовать как преобразователи сигнала. Чаще всего эффектор является членом семейства МАПК .
Примеры
[ редактировать ]В конце 1990-х годов начали накапливаться данные, позволяющие предположить, что некоторые GPCR способны передавать сигналы без G-белков. Было показано, что митоген -активируемая протеинкиназа ERK2 , ключевой медиатор передачи сигнала после активации рецептора во многих путях, активируется в ответ на опосредованную цАМФ активацию рецептора у слизевика D. discoideum, несмотря на отсутствие связанного с ним G-белка. α- и β-субъединицы. [ 50 ]
В клетках млекопитающих было продемонстрировано, что хорошо изученный β 2 -адренорецептор активирует путь ERK2 после опосредованного арестином разобщения передачи сигналов, опосредованной G-белком. Таким образом, вполне вероятно, что некоторые механизмы, которые ранее считались связанными исключительно с десенсибилизацией рецепторов, на самом деле являются примерами переключения рецепторов на свои сигнальные пути, а не просто их выключения.
Было показано , что в клетках почек рецептор брадикинина B2 напрямую взаимодействует с протеинтирозинфосфатазой. Присутствие тирозин-фосфорилированной последовательности ITIM (иммунорецепторный тирозин-ингибирующий мотив) в рецепторе B2 необходимо для обеспечения этого взаимодействия и, как следствие, антипролиферативного эффекта брадикинина. [ 51 ]
GPCR-независимая передача сигналов гетеротримерными G-белками
[ редактировать ]Хотя это относительно незрелая область исследований, похоже, что гетеротримерные G-белки также могут принимать участие в передаче сигналов, не связанных с GPCR. Имеются доказательства роли преобразователей сигналов почти во всех других типах рецептор-опосредованной передачи сигналов, включая интегрины , рецепторные тирозинкиназы (RTK), рецепторы цитокинов ( JAK/STAT ), а также модуляцию различных других «вспомогательных» белков, таких как GEF , ингибиторы диссоциации гуанин-нуклеотидов (GDI) и протеинфосфатазы . Могут даже существовать специфические белки этих классов, основная функция которых является частью GPCR-независимых путей, называемых активаторами передачи сигналов G-белка (AGS). Как повсеместное распространение этих взаимодействий, так и важность субъединиц Gα и Gβγ для этих процессов до сих пор неясны.
Подробности о путях цАМФ и PIP2
[ редактировать ]


Существует два основных пути передачи сигнала с участием рецепторов, связанных с G-белком : сигнальный путь цАМФ и сигнальный путь фосфатидилинозитола . [ 5 ]
сигнальный путь цАМФ
[ редактировать ]Передача сигнала цАМФ содержит пять основных символов: рецептор стимулирующего гормона (Rs) или рецептор тормозного гормона (Ri); стимулирующий регулятивный G-белок (Gs) или ингибирующий регулятивный G-белок (Gi); аденилатциклаза ; протеинкиназа А (PKA); и цАМФ- фосфодиэстераза .
Рецептор стимулирующего гормона (Rs) представляет собой рецептор, который может связываться со стимулирующими сигнальными молекулами, тогда как рецептор ингибирующего гормона (Ri) представляет собой рецептор, который может связываться с ингибирующими сигнальными молекулами.
Стимулирующий регулятивный G-белок представляет собой G-белок, связанный с рецептором стимулирующего гормона (Rs), и его α-субъединица при активации может стимулировать активность фермента или другой внутриклеточный метаболизм. Напротив, ингибирующий регулятивный G-белок связан с рецептором ингибирующего гормона, и его α-субъединица при активации может ингибировать активность фермента или другой внутриклеточный метаболизм.
Аденилатциклаза — 12-трансмембранный гликопротеин, катализирующий превращение АТФ в цАМФ с помощью кофактора Mg. 2+ или Мн 2+ . Продуцируемый цАМФ является вторичным мессенджером клеточного метаболизма и аллостерическим активатором протеинкиназы А.
Протеинкиназа А является важным ферментом клеточного метаболизма благодаря своей способности регулировать клеточный метаболизм путем фосфорилирования специфических детерминированных ферментов метаболического пути. Он также может регулировать экспрессию специфических генов, клеточную секрецию и проницаемость мембран. Белок-фермент содержит две каталитические субъединицы и две регуляторные субъединицы. При отсутствии цАМФ комплекс неактивен. Когда цАМФ связывается с регуляторными субъединицами, их конформация изменяется, вызывая диссоциацию регуляторных субъединиц, что активирует протеинкиназу А и обеспечивает дальнейшие биологические эффекты.
Эти сигналы затем могут быть прекращены фосфодиэстеразой цАМФ, которая представляет собой фермент, который расщепляет цАМФ до 5'-АМФ и инактивирует протеинкиназу А.
Сигнальный путь фосфатидилинозитола
[ редактировать ]В сигнальном пути фосфатидилинозита внеклеточная сигнальная молекула связывается с рецептором G-белка (Gq ) на поверхности клетки и активирует фосфолипазу C , которая расположена на плазматической мембране . Липаза ( гидролизует фосфатидилинозитол-4,5-бисфосфат (PIP2) до двух вторичных мессенджеров: инозитол-1,4,5-трифосфат (IP3) и диацилглицерин DAG). IP3 связывается с рецептором IP3 в мембране гладкой эндоплазматической сети и митохондриях, открывая Ca. 2+ каналы. DAG помогает активировать протеинкиназу C (PKC), которая фосфорилирует многие другие белки, изменяя их каталитическую активность, что приводит к клеточным реакциям.
Эффекты Ca 2+ также примечательны: он сотрудничает с DAG при активации PKC и может активировать путь киназы CaM , в котором модулированный кальцием белок кальмодулин (CaM) связывает Ca 2+ , претерпевает изменение конформации и активирует киназу CaM II, которая обладает уникальной способностью увеличивать свое сродство связывания с CaM путем аутофосфорилирования, что делает CaM недоступным для активации других ферментов. Затем киназа фосфорилирует целевые ферменты, регулируя их активность. Два сигнальных пути соединены вместе Ca 2+ -CaM, который также является регуляторной субъединицей аденилатциклазы и фосфодиэстеразы в сигнальном пути цАМФ.
Регуляция рецепторов
[ редактировать ]GPCR теряют чувствительность при воздействии их лиганда в течение длительного периода времени. Существуют две признанные формы десенсибилизации: 1) гомологичная десенсибилизация , при которой активированный GPCR подавляется; и 2) гетерологичная десенсибилизация , при которой активированный GPCR вызывает подавление другого GPCR. Ключевой реакцией этого подавления является фосфорилирование внутриклеточного (или цитоплазматического ) рецепторного домена протеинкиназами .
Фосфорилирование цАМФ-зависимыми протеинкиназами
[ редактировать ]Циклические АМФ-зависимые протеинкиназы ( протеинкиназа А ) активируются сигнальной цепью, исходящей от белка G (который был активирован рецептором) через аденилатциклазу и циклический АМФ (цАМФ). По механизму обратной связи эти активированные киназы фосфорилируют рецептор. Чем дольше рецептор остается активным, тем больше киназ активируется и тем больше рецепторов фосфорилируется. В β 2 -адренорецепторах это фосфорилирование приводит к переключению связи с класса G s G-белка на Gi класс . [ 52 ] цАМФ-зависимое фосфорилирование, опосредованное ПКА, может вызывать гетерологичную десенсибилизацию рецепторов, отличных от активированных. [ 53 ]
Фосфорилирование GRK
[ редактировать ]Киназы рецепторов, связанных с G-белком (GRK), представляют собой протеинкиназы, которые фосфорилируют только активные GPCR. [ 54 ] Киназы рецепторов, связанных с G-белками (GRK), являются ключевыми модуляторами передачи сигналов рецепторов, связанных с G-белками (GPCR). Они составляют семейство из семи серин-треониновых протеинкиназ млекопитающих, которые фосфорилируют рецептор, связанный с агонистом. GRK-опосредованное фосфорилирование рецепторов быстро инициирует глубокое нарушение передачи сигналов рецептора и десенсибилизацию. Активность GRK и субклеточное нацеливание жестко регулируется взаимодействием с рецепторными доменами, субъединицами G-белка, липидами, якорными белками и чувствительными к кальцию белками. [ 55 ]
Фосфорилирование рецептора может иметь два последствия:
- Транслокация : рецептор вместе с частью мембраны, в которую он встроен, попадает внутрь клетки, где дефосфорилируется в кислой везикулярной среде. [ 56 ] а потом вернули. Этот механизм используется для регулирования длительного воздействия, например, гормона, позволяя повторной сенсибилизации следовать за десенсибилизацией. Альтернативно, рецептор может подвергаться лизосомальной деградации или оставаться интернализованным, при этом считается, что он участвует в инициации сигнальных событий, природа которых зависит от субклеточной локализации интернализованной везикулы. [ 53 ]
- аррестина Связывание : фосфорилированный рецептор может быть связан с молекулами аррестина , которые не позволяют ему связываться (и активировать) G-белки, фактически отключая его на короткий период времени. Этот механизм используется, например, с родопсином в клетках сетчатки для компенсации воздействия яркого света. Во многих случаях связывание аррестина с рецептором является предпосылкой транслокации. Например, бета-аррестин, связанный с β 2 -адренорецепторами, действует как адаптер для связывания как с клатрином, так и с бета-субъединицей AP2 (молекулами-адаптерами клатрина); таким образом, аррестин здесь действует как каркас, собирающий компоненты, необходимые для клатрин-опосредованного эндоцитоза β 2 -адренорецепторов. [ 57 ] [ 58 ]
Механизмы терминации сигнала GPCR
[ редактировать ]Как упоминалось выше, G-белки могут прекращать собственную активацию из-за присущей им способности гидролиза GTP → GDP . Однако эта реакция протекает с медленной скоростью (≈0,02 раза в секунду), и, таким образом, деактивация любого отдельного G-белка заняла бы около 50 секунд, если бы в игру не вступили другие факторы. Действительно, существует около 30 изоформ белков RGS , которые при связывании с Gα через свой домен GAP ускоряют скорость гидролиза до ≈30 раз/сек. Это 1500-кратное увеличение скорости позволяет клетке реагировать на внешние сигналы с высокой скоростью, а также с пространственным разрешением из-за ограниченного количества вторичного мессенджера , который может быть сгенерирован, и ограниченного расстояния, на которое G-белок может диффундировать за 0,03 секунды. По большей части белки RGS различаются по своей способности деактивировать G-белки, тогда как участие RGS в конкретном сигнальном пути, по-видимому, в большей степени определяется тканью и вовлеченными GPCR, чем чем-либо еще. Кроме того, белки RGS обладают дополнительной функцией увеличения скорости обмена GTP-GDP в GPCR (т.е. в качестве своего рода co-GEF), что дополнительно способствует временному разрешению передачи сигналов GPCR.
Кроме того, GPCR сам может быть десенсибилизирован . Это может произойти как:
- прямой результат оккупации лиганда , при котором изменение конформации позволяет рекрутировать GPCR-регулирующие киназы (GRK), которые продолжают фосфорилировать различные сериновые / треониновые остатки IL-3 и C-концевого хвоста. При фосфорилировании GRK сродство GPCR к β-аррестину (β-аррестин-1/2 в большинстве тканей) увеличивается, после чего β-аррестин может связываться и действовать как стерически препятствуя связыванию G-белка, а также инициируя этот процесс. интернализации рецепторов посредством клатрин-опосредованного эндоцитоза . Поскольку по этому механизму десенсибилизируется только лигандированный рецептор, это называется гомологичной десенсибилизацией.
- сродство к β-аррестину может быть увеличено за счет лиганда и независимо от GRK посредством фосфорилирования различных сайтов ser/thr (а также IL-3 и C-концевого хвоста) с помощью PKC и PKA. Этих фосфорилирований часто бывает достаточно, чтобы сами по себе нарушить связывание G-белка. [ 59 ]
- Вместо этого PKC/PKA может фосфорилировать GRK, что также может приводить к фосфорилированию GPCR и связыванию β-аррестина независимым от профессии способом. Эти два последних механизма допускают десенсибилизацию одного GPCR за счет активности других или гетерологичную десенсибилизацию . GRK также могут иметь домены GAP и поэтому могут способствовать инактивации . также посредством некиназных механизмов Также может иметь место сочетание этих механизмов.
Как только β-аррестин связывается с GPCR, он претерпевает конформационные изменения, позволяющие ему служить каркасным белком для адаптерного комплекса, называемого AP-2 , который, в свою очередь, рекрутирует другой белок, называемый клатрином . Если достаточное количество рецепторов в локальной области рекрутируют клатрин таким образом, они агрегируются, и мембрана отпочковывается внутрь в результате взаимодействия между молекулами клатрина, в процессе, называемом опсонизацией . После того, как ямка оторвалась от плазматической мембраны под действием двух других белков, называемых амфифизином и динамином , она теперь представляет собой эндоцитарную везикулу . В этот момент молекулы-адаптеры и клатрин диссоциируются , и рецептор либо возвращается к плазматической мембране, либо направляется в лизосомы для деградации .
В любой момент этого процесса β-аррестины могут также рекрутировать другие белки, такие как нерецепторная тирозинкиназа (nRTK), c-SRC , которые могут активировать ERK1/2 или другую митоген-активируемую протеинкиназу (MAPK). передача сигнала, например, посредством фосфорилирования малой ГТФазы Ras , ERK-1/2) , или прямого рекрутирования белков каскада ERK (т. е. Raf-1 , MEK в этот момент инициируется передача сигнала из-за их непосредственной близости к друг друга. Другой мишенью c-SRC являются молекулы динамина, участвующие в эндоцитозе. Динамины полимеризуются на шейке входящей везикулы, и их фосфорилирование с помощью c-SRC обеспечивает энергию, необходимую для конформационного изменения, позволяющего окончательно «отщепиться» от мембраны.
Клеточная регуляция GPCR
[ редактировать ]Десенсибилизация рецептора опосредуется посредством комбинированного фосфорилирования, связывания β-arr и эндоцитоза, как описано выше. Понижение регуляции происходит, когда эндоцитированный рецептор внедряется в эндосому, которая перемещается для слияния с органеллой, называемой лизосомой. Поскольку лизосомальные мембраны богаты протонными насосами, их внутренняя часть имеет низкий pH (≈4,8 по сравнению с pH≈7,2 цитозоля), что денатурирует GPCR. Кроме того, лизосомы содержат множество деградирующих ферментов , включая протеазы, которые могут функционировать только при таком низком pH, поэтому пептидные связи, соединяющие остатки GPCR, могут расщепляться. Доставляется ли данный рецептор в лизосому, задерживается в эндосомах или возвращается обратно на плазматическую мембрану, зависит от множества факторов, включая тип рецептора и величину сигнала. Регуляция GPCR дополнительно опосредуется факторами транскрипции генов. Эти факторы могут увеличивать или уменьшать транскрипцию генов и, таким образом, увеличивать или уменьшать выработку новых рецепторов (повышающая или понижающая регуляция), которые перемещаются к клеточной мембране.
Олигомеризация рецепторов
[ редактировать ]Олигомеризация рецепторов, связанных с G-белком, является широко распространенным явлением. Одним из наиболее изученных примеров является ГАМК В. рецептор метаботропный так называемый конститутивный рецептор образуется путем гетеродимеризации GABA BR1 BR2 и GABA Этот субъединиц . Экспрессия GABA BR1 без GABA BR2 в гетерологичных системах приводит к сохранению субъединицы в эндоплазматическом ретикулуме . Экспрессия только субъединицы GABA B R2, тем временем, приводит к поверхностной экспрессии субъединицы, хотя и без функциональной активности (т.е. рецептор не связывает агонист и не может инициировать ответ после воздействия агониста). Совместная экспрессия двух субъединиц приводит к экспрессии функционального рецептора на плазматической мембране. Было показано, что GABA B связывание R2 с GABA B R1 вызывает маскирование сигнала удерживания. [ 60 ] функциональных рецепторов. [ 61 ]
Происхождение и разнообразие надсемейства
[ редактировать ]Передача сигнала , опосредованная суперсемейством GPCRs, восходит к зарождению многоклеточности . GPCR, подобные млекопитающим, обнаружены в грибах и классифицированы в соответствии с системой классификации GRAFS, основанной на отпечатках пальцев GPCR. [ 17 ] Идентификация членов суперсемейства в эукариотическом домене и сравнение специфичных для семейства мотивов показали, что суперсемейство GPCRs имеет общее происхождение. [ 62 ] Характерные мотивы указывают на то, что три из пяти семейств GRAFS, Rhodopsin , Adhesion и Frizzled , произошли от цАМФ-рецепторов Dictyostelium discoideum до разделения опистоконтов . Позже семейство секретинов эволюционировало из семейства рецепторов адгезии GPCR еще до разделения нематод . [ 17 ] GPCR насекомых, по-видимому, принадлежат к отдельной группе, а Taste2 идентифицируется как происходящий от Rhodopsin . [ 62 ] Обратите внимание, что разделение секретин / адгезия основано на предполагаемой функции, а не на сигнатуре, поскольку классический класс B (7tm_2, Pfam PF00002 в исследованиях для идентификации обоих используется ).
См. также
[ редактировать ]- База данных рецепторов, связанных с G-белком
- Список кодов MeSH (D12.776)
- Метаботропный рецептор
- Сиротский рецептор
- Пепдуцины , класс кандидатов в лекарства, нацеленные на GPCR.
- Рецептор, активируемый исключительно синтетическим лигандом , метод контроля клеточной передачи сигналов посредством синтетических GPCR.
- Суперсемейство TOG
Ссылки
[ редактировать ]- ^ Jump up to: а б Черезов В., Розенбаум Д.М., Хансон М.А., Расмуссен С.Г., Тиан Ф.С., Кобылка Т.С. и др. (ноябрь 2007 г.). «Кристаллическая структура высокого разрешения сконструированного человеческого рецептора, связанного с бета2-адренергическим G-белком» . Наука . 318 (5854): 1258–65. Бибкод : 2007Sci...318.1258C . дои : 10.1126/science.1150577 . ПМК 2583103 . ПМИД 17962520 .
- ^ Jump up to: а б Чжан, Цзянь В.; Ли, Лей; Хуан, Циншэн; Рен, Пей-Ген (1 января 2013 г.). «Глава третья - Рецептор обестатина в энергетическом гомеостазе и патогенезе ожирения» . В Тао, Я-Сюн (ред.). Прогресс молекулярной биологии и трансляционной науки . Рецепторы, связанные с G-белком, в энергетическом гомеостазе и патогенезе ожирения. Том. 114. Академическая пресса. стр. 89–107. дои : 10.1016/B978-0-12-386933-3.00003-0 . ISBN 9780123869333 . ПМИД 23317783 . Архивировано из оригинала 17 января 2023 года . Проверено 24 октября 2023 г.
- ^ Jump up to: а б с д и Тшасковский Б., Латек Д., Юань С., Гошдастидер У., Дебински А., Филипек С. (2012). «Действие молекулярных переключателей в GPCR - теоретические и экспериментальные исследования» . Современная медицинская химия . 19 (8): 1090–109. дои : 10.2174/092986712799320556 . ПМЦ 3343417 . ПМИД 22300046 .
 Текст был скопирован из этого источника, который доступен по лицензии Attribution 2.5 Generic (CC BY 2.5).
Текст был скопирован из этого источника, который доступен по лицензии Attribution 2.5 Generic (CC BY 2.5).
- ^ Кинг Н., Хиттингер Коннектикут, Кэрролл С.Б. (июль 2003 г.). «Эволюция семейств ключевых клеточных сигнальных белков и белков адгезии предшествует животному происхождению». Наука . 301 (5631): 361–3. Бибкод : 2003Sci...301..361K . дои : 10.1126/science.1083853 . ПМИД 12869759 . S2CID 9708224 .
- ^ Jump up to: а б Гилман А.Г. (1987). «G-белки: преобразователи сигналов, генерируемых рецепторами». Ежегодный обзор биохимии . 56 (1): 615–49. дои : 10.1146/annurev.bi.56.070187.003151 . ПМИД 3113327 .
- ^ Jump up to: а б Веттшурек Н., Офферманнс С. (октябрь 2005 г.). «G-белки млекопитающих и их функции, специфичные для типов клеток». Физиологические обзоры . 85 (4): 1159–204. doi : 10.1152/physrev.00003.2005 . ПМИД 16183910 .
- ^ Jump up to: а б Хаузер А.С., Чавали С., Масухо И., Ян Л.Дж., Мартемьянов К.А., Глориам Д.Э., Бабу М.М. (январь 2018 г.). «Фармакогеномика лекарственных средств-мишеней GPCR» . Клетка . 172 (1–2): 41–54.e19. дои : 10.1016/j.cell.2017.11.033 . ПМЦ 5766829 . ПМИД 29249361 .
- ^ Шведская королевская академия наук (10 октября 2012 г.). «Нобелевская премия по химии 2012 года Роберт Дж. Лефковиц, Брайан К. Кобилка» . Проверено 10 октября 2012 г.
- ^ Линдсли CW (июнь 2013 г.). «Лучшие рецептурные лекарства 2012 года в мире: преобладают биологические препараты, но низкомолекулярные препараты для ЦНС удерживают первые места» . ACS Химическая нейронаука . 4 (6): 905–7. дои : 10.1021/cn400107y . ПМК 3689196 . ПМИД 24024784 .
- ^ Jump up to: а б с Бьярнадоттир Т.К., Глориам Д.Э., Хеллстранд С.Х., Кристианссон Х., Фредрикссон Р., Шиот Х.Б. (сентябрь 2006 г.). «Комплексный репертуар и филогенетический анализ рецепторов, связанных с G-белком, у человека и мыши». Геномика . 88 (3): 263–73. дои : 10.1016/j.ygeno.2006.04.001 . ПМИД 16753280 .
- ^ «ключевое слово: «рецептор, связанный с G-белком [KW-0297]» И организм: «Homo sapiens (человек) [9606]» в UniProtKB» . www.uniprot.org . Архивировано из оригинала 15 сентября 2020 года . Проверено 24 июня 2019 г.
- ^ Йост П., Метнер А. (октябрь 2002 г.). «Филогенетический анализ 277 человеческих рецепторов, связанных с G-белком, как инструмент прогнозирования лигандов орфанных рецепторов» . Геномная биология . 3 (11): ИССЛЕДОВАНИЕ0063. doi : 10.1186/gb-2002-3-11-research0063 . ПМЦ 133447 . ПМИД 12429062 .
- ^ Эттвуд Т.К., Финдли Дж.Б. (февраль 1994 г.). «Отпечатки пальцев, связанные с G-белком рецепторы». Белковая инженерия . 7 (2): 195–203. дои : 10.1093/белок/7.2.195 . ПМИД 8170923 .
- ^ Колаковский Л. Ф. (1994). «GCRDb: база данных рецепторов, связанных с G-белком». Рецепторы и каналы . 2 (1): 1–7. ПМИД 8081729 .
- ^ Фурд С.М., Боннер Т.И., Нойбиг Р.Р., Россер Э.М., Пин Дж.П., Давенпорт А.П. и др. (июнь 2005 г.). «Международный союз фармакологии. XLVI. Список рецепторов, связанных с G-белком». Фармакологические обзоры . 57 (2): 279–88. дои : 10.1124/пр.57.2.5 . ПМИД 15914470 . S2CID 34541683 .
- ^ «ИнтерПро» . Архивировано из оригинала 21 февраля 2008 года . Проверено 10 декабря 2007 г.
- ^ Jump up to: а б с Кришнан А., Альмен М.С., Фредрикссон Р., Шиот Х.Б. (2012). Сюэ С (ред.). «Происхождение GPCR: идентификация GPCR млекопитающих, таких как родопсин, адгезия, глутамат и вьющиеся GPCR, в грибах» . ПЛОС ОДИН . 7 (1): e29817. Бибкод : 2012PLoSO...729817K . дои : 10.1371/journal.pone.0029817 . ПМК 3251606 . ПМИД 22238661 .
- ^ Вассилатис Д.К., Хохманн Дж.Г., Цзэн Х., Ли Ф., Ранчалис Дж.Э., Мортруд М.Т. и др. (апрель 2003 г.). «Репертуар рецепторов, связанных с G-белком, человека и мыши» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (8): 4903–8. Бибкод : 2003PNAS..100.4903V . дои : 10.1073/pnas.0230374100 . ПМК 153653 . ПМИД 12679517 .
- ^ Сяо X, Ван П., Чжоу К.С. (июль 2009 г.). «GPCR-CA: подход к изображению клеточного автомата для прогнозирования функциональных классов рецепторов, связанных с G-белком» . Журнал вычислительной химии . 30 (9): 1414–23. дои : 10.1002/jcc.21163 . ПМИД 19037861 . S2CID 813484 . Архивировано из оригинала 9 апреля 2017 года.
- ^ Цю Дж.Д., Хуан Дж.Х., Лян Р.П., Лу XQ (июль 2009 г.). «Прогнозирование классов рецепторов, связанных с G-белком, на основе концепции псевдоаминокислотного состава Чоу: подход на основе дискретного вейвлет-преобразования». Аналитическая биохимия . 390 (1): 68–73. дои : 10.1016/j.ab.2009.04.009 . ПМИД 19364489 .
- ^ Гу Ц, Дин Ю.С., Чжан Т.Л. (май 2010 г.). «Прогнозирование классов рецепторов, связанных с G-белком, с низкой гомологией с использованием псевдоаминокислотного состава Чоу с приблизительными моделями энтропии и гидрофобности». Буквы о белках и пептидах . 17 (5): 559–67. дои : 10.2174/092986610791112693 . ПМИД 19594431 .
- ^ Сароз Ю., Хо Д.Т., Гласс М., Грэм Э.С., Гримси Н.Л. (декабрь 2019 г.). «Каннабиноидный рецептор 2 (CB 2 ) передает сигналы через G-альфа-ы и индуцирует секрецию цитокинов IL-6 и IL-10 в первичных лейкоцитах человека» . ACS Фармакология и трансляционная наука . 2 (6): 414–428. дои : 10.1021/acptsci.9b00049 . ПМЦ 7088898 . ПМИД 32259074 .
- ^ Шарма Н., Ахаде А.С., Кадри А. (апрель 2013 г.). «Сфингозин-1-фосфат подавляет TLR-индуцированную секрецию CXCL8 из Т-клеток человека». Журнал биологии лейкоцитов . 93 (4): 521–8. дои : 10.1189/jlb.0712328 . ПМИД 23345392 . S2CID 21897008 .
- ^ Хейзелл Г.Г., Хиндмарч CC, Поуп Г.Р., Ропер Дж.А., Лайтман С.Л., Мерфи Д. и др. (январь 2012 г.). «Связанные с G-белком рецепторы в паравентрикулярном и супраоптическом ядрах гипоталамуса — змеевидные ворота нейроэндокринного гомеостаза» . Границы нейроэндокринологии . 33 (1): 45–66. doi : 10.1016/j.yfrne.2011.07.002 . ПМК 3336209 . ПМИД 21802439 .
- ^ Дорсам Р.Т., Гуткинд Дж.С. (февраль 2007 г.). «Рецепторы, связанные с G-белком, и рак». Обзоры природы. Рак . 7 (2): 79–94. дои : 10.1038/nrc2069 . ПМИД 17251915 . S2CID 10996598 .
- ^ Венкатакришнан А.Дж., Деупи Икс, Лебон Дж., Тейт К.Г., Шертлер Г.Ф., Бабу М.М. (февраль 2013 г.). «Молекулярные подписи рецепторов, связанных с G-белком». Природа . 494 (7436): 185–94. Бибкод : 2013Природа.494..185В . дои : 10.1038/nature11896 . ПМИД 23407534 . S2CID 4423750 .
- ^ Холленштейн К., де Грааф К., Бортолато А., Ван М.В., Маршалл Ф.Х., Стивенс Р.К. (январь 2014 г.). «Взгляд на структуру GPCR класса B» . Тенденции в фармакологических науках . 35 (1): 12–22. дои : 10.1016/j.tips.2013.11.001 . ПМЦ 3931419 . ПМИД 24359917 .
- ^ Пальчевски К., Кумасака Т., Хори Т., Бенке К.А., Мотошима Х., Фокс Б.А. и др. (август 2000 г.). «Кристаллическая структура родопсина: рецептор, связанный с белком AG». Наука . 289 (5480): 739–45. Бибкод : 2000Sci...289..739P . CiteSeerX 10.1.1.1012.2275 . дои : 10.1126/science.289.5480.739 . ПМИД 10926528 .
- ^ Расмуссен С.Г., Чой Х.Дж., Розенбаум Д.М., Кобилка Т.С., Тиан Ф.С., Эдвардс ПК и др. (ноябрь 2007 г.). «Кристаллическая структура человеческого бета2-адренергического рецептора, связанного с G-белком». Природа . 450 (7168): 383–7. Бибкод : 2007Natur.450..383R . дои : 10.1038/nature06325 . ПМИД 17952055 . S2CID 4407117 .
- ^ Розенбаум Д.М., Черезов В., Хансон М.А., Расмуссен С.Г., Тиан Ф.С., Кобылка Т.С. и др. (ноябрь 2007 г.). «Инженерия GPCR дает структурную информацию с высоким разрешением о функции бета2-адренергических рецепторов» . Наука . 318 (5854): 1266–73. Бибкод : 2007Sci...318.1266R . дои : 10.1126/science.1150609 . ПМИД 17962519 . S2CID 1559802 .
- ^ Расмуссен С.Г., Чой Х.Дж., Фунг Дж.Дж., Пардон Э., Касароса П., Чае П.С. и др. (январь 2011 г.). «Структура стабилизированного нанотелами активного состояния β(2)-адренорецептора» . Природа . 469 (7329): 175–80. Бибкод : 2011Natur.469..175R . дои : 10.1038/nature09648 . ПМК 3058308 . ПМИД 21228869 .
- ^ Розенбаум Д.М., Чжан С., Лайонс Дж.А., Холл Р., Арагао Д., Арлоу Д.Х. и др. (январь 2011 г.). «Структура и функция необратимого комплекса агонист-β (2) адренорецептор» . Природа . 469 (7329): 236–40. Бибкод : 2011Natur.469..236R . дои : 10.1038/nature09665 . ПМК 3074335 . ПМИД 21228876 .
- ^ Уорн Т., Мухаметзянов Р., Бейкер Дж.Г., Неме Р., Эдвардс П.К., Лесли А.Г. и др. (январь 2011 г.). «Структурная основа агонистического и частичного агонистического действия на β (1)-адренергический рецептор» . Природа . 469 (7329): 241–4. Бибкод : 2011Natur.469..241W . дои : 10.1038/nature09746 . ПМК 3023143 . ПМИД 21228877 .
- ^ Сюй Ф, Ву Х, Катритч В., Хан Г.В., Джейкобсон К.А., Гао З.Г. и др. (апрель 2011 г.). «Структура связанного с агонистом человеческого аденозинового рецептора A2A» . Наука . 332 (6027): 322–7. Бибкод : 2011Sci...332..322X . дои : 10.1126/science.1202793 . ПМК 3086811 . ПМИД 21393508 .
- ^ Расмуссен С.Г., ДеВри Б.Т., Зоу Й., Крузе А.К., Чунг К.Ю., Кобилка Т.С. и др. (июль 2011 г.). «Кристаллическая структура комплекса β2-адренергический рецептор-Gs-белок» . Природа . 477 (7366): 549–55. Бибкод : 2011Natur.477..549R . дои : 10.1038/nature10361 . ПМК 3184188 . ПМИД 21772288 .
- ^ Ямаути Т., Камон Дж., Ито Ю., Цучида А., Ёкомизо Т., Кита С. и др. (июнь 2003 г.). «Клонирование рецепторов адипонектина, которые опосредуют противодиабетические метаболические эффекты». Природа 423 (6941): 762–9. Бибкод : 2003Nature.423..762Y . дои : 10.1038/nature01705 . ПМИД 12802337 . S2CID 52860797 .
- ^ Jump up to: а б Цинь К., Донг С., Ву Г, Ламберт Н.А. (август 2011 г.). «Предварительная сборка G(q)-сопряженных рецепторов и G(q)-гетеротримеров» в неактивном состоянии» . Химическая биология природы . 7 (10): 740–7. дои : 10.1038/nchembio.642 . ПМК 3177959 . ПМИД 21873996 .
- ^ Лозе М.Дж., Бенович Дж.Л., Кодина Дж., Кэрон М.Г., Лефковиц Р.Дж. (июнь 1990 г.). «Бета-аррестин: белок, который регулирует функцию бета-адренергических рецепторов». Наука . 248 (4962): 1547–50. Бибкод : 1990Sci...248.1547L . дои : 10.1126/science.2163110 . ПМИД 2163110 .
- ^ Латтрелл Л.М., Лефковиц Р.Дж. (февраль 2002 г.). «Роль бета-аррестинов в терминации и передаче сигналов рецепторов, связанных с G-белком». Журнал клеточной науки . 115 (Часть 3): 455–65. дои : 10.1242/jcs.115.3.455 . hdl : 10161/7805 . ПМИД 11861753 .
- ^ Кэхилл Т.Дж., Томсен А.Р., Тарраш Дж.Т., Плуфф Б., Нгуен А.Х., Ян Ф. и др. (март 2017 г.). «Различные конформации комплексов GPCR-β-аррестин опосредуют десенсибилизацию, передачу сигналов и эндоцитоз» . Труды Национальной академии наук Соединенных Штатов Америки . 114 (10): 2562–2567. Бибкод : 2017PNAS..114.2562C . дои : 10.1073/pnas.1701529114 . ПМЦ 5347553 . ПМИД 28223524 .
- ^ Кумари П., Шривастава А., Банерджи Р., Гош Э., Гупта П., Ранджан Р. и др. (ноябрь 2016 г.). «Функциональная компетентность частично задействованного комплекса GPCR-β-аррестин» . Природные коммуникации . 7 : 13416. Бибкод : 2016NatCo...713416K . дои : 10.1038/ncomms13416 . ПМК 5105198 . ПМИД 27827372 .
- ^ Томсен А.Р., Плауфф Б., Кэхилл Т.Дж., Шукла А.К., Тарраш Дж.Т., Дози А.М. и др. (август 2016 г.). «Суперкомплекс белка GPCR-G-β-аррестина опосредует устойчивую передачу сигналов G-белка» . Клетка . 166 (4): 907–919. дои : 10.1016/j.cell.2016.07.004 . ПМЦ 5418658 . ПМИД 27499021 .
- ^ Нгуен А.Х., Томсен А.Р., Кэхилл Т.Дж., Хуанг Р., Хуанг Л.И., Марцинк Т. и др. (декабрь 2019 г.). «Структура эндосомального сигнального мегакомплекса белок GPCR-G-β-аррестин» . Структурная и молекулярная биология природы . 26 (12): 1123–1131. дои : 10.1038/s41594-019-0330-y . ПМЦ 7108872 . ПМИД 31740855 .
- ^ Миллар Р.П., Ньютон К.Л. (январь 2010 г.). «Год исследования рецепторов, связанных с G-белком» . Молекулярная эндокринология . 24 (1): 261–74. дои : 10.1210/me.2009-0473 . ПМЦ 5428143 . ПМИД 20019124 .
- ^ Brass LF (сентябрь 2003 г.). «Активация тромбина и тромбоцитов». Грудь . 124 (3 доп): 18С–25С. doi : 10.1378/chest.124.3_suppl.18S . ПМИД 12970120 . S2CID 22279536 .
- ^ Дигби Г.Дж., Лобер Р.М., Сетхи П.Р., Ламберт Н.А. (ноябрь 2006 г.). «Некоторые гетеротримеры G-белка физически диссоциируют в живых клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (47): 17789–94. Бибкод : 2006PNAS..10317789D . дои : 10.1073/pnas.0607116103 . ПМК 1693825 . ПМИД 17095603 .
- ^ Рубинштейн Л.А., Ланзара Р.Г. (1998). «Активация рецепторов, связанных с G-белком, влечет за собой модуляцию цистеином связывания агониста» . Журнал молекулярной структуры: Theochem . 430 : 57–71. дои : 10.1016/S0166-1280(98)90217-2 . Архивировано из оригинала 16 мая 2011 года . Проверено 14 января 2006 г.
- ^ Теох СМ, Тэм Дж.К., Тран Т (2012). «Перекрестные помехи Интегрина и GPCR в регуляции передачи сигналов сокращения ASM при астме» . Журнал аллергии . 2012 : 341282. doi : 10.1155/2012/341282 . ПМЦ 3465959 . ПМИД 23056062 .
- ^ Смит Дж.С., Николсон Л.Т., Суванпрадид Дж., Гленн Р.А., Кнапе Н.М., Алагесан П. и др. (ноябрь 2018 г.). «Смещенные агонисты хемокинового рецептора CXCR3 дифференциально контролируют хемотаксис и воспаление» . Научная сигнализация . 11 (555): eaaq1075. дои : 10.1126/scisignal.aaq1075 . ПМК 6329291 . ПМИД 30401786 .
- ^ Ким Дж.Ю., Хаастерт П.В., Девреотес П.Н. (апрель 1996 г.). «Социальные чувства: сигнальные пути рецепторов, связанных с G-белком, у Dictyostelium discoideum» . Химия и биология . 3 (4): 239–43. дои : 10.1016/S1074-5521(96)90103-9 . ПМИД 8807851 .
- ^ Дюшен Дж., Шанстра Дж.П., Печер С., Пизард А., Сузини С., Эстев Дж.П. и др. (октябрь 2002 г.). «Новое белок-белковое взаимодействие между рецептором, связанным с G-белком, и фосфатазой SHP-2 участвует в индуцированном брадикинином ингибировании пролиферации клеток» . Журнал биологической химии . 277 (43): 40375–83. дои : 10.1074/jbc.M202744200 . ПМИД 12177051 .
- ^ Чен-Идзу Ю., Сяо Р.П., Идзу Л.Т., Ченг Х., Кушель М., Сперджен Х., Лакатта Э.Г. (ноябрь 2000 г.). «G(i)-зависимая локализация передачи сигналов бета(2)-адренергических рецепторов на Ca(2+)-каналы L-типа» . Биофизический журнал . 79 (5): 2547–56. Бибкод : 2000BpJ....79.2547C . дои : 10.1016/S0006-3495(00)76495-2 . ПМК 1301137 . ПМИД 11053129 .
- ^ Jump up to: а б Тан СМ, Брейди А.Е., Николс Х.Х., Ван К., Лимберд Л.Е. (2004). «Мембранный транспорт рецепторов, связанных с G-белком». Ежегодный обзор фармакологии и токсикологии . 44 (1): 559–609. doi : 10.1146/annurev.pharmtox.44.101802.121558 . ПМИД 14744258 .
- ^ Сантулли Дж., Тримарко Б., Яккарино Дж. (март 2013 г.). «Киназа рецептора, связанная с G-белком, и гипертония: молекулярные данные и патофизиологические механизмы». Высокое кровяное давление и профилактика сердечно-сосудистых заболеваний . 20 (1): 5–12. дои : 10.1007/s40292-013-0001-8 . ПМИД 23532739 . S2CID 45674941 .
- ^ Пенела П., Рибас С., мэр Ф. (ноябрь 2003 г.). «Механизмы регуляции экспрессии и функции киназ рецепторов, связанных с G-белком». Сотовая сигнализация . 15 (11): 973–81. дои : 10.1016/S0898-6568(03)00099-8 . ПМИД 14499340 .
- ^ Крюгер К.М., Даака Ю., Питчер Дж.А., Лефковиц Р.Дж. (январь 1997 г.). «Роль секвестрации в ресенсибилизации рецепторов, связанных с G-белком. Регуляция дефосфорилирования бета2-адренергических рецепторов путем везикулярного подкисления» . Журнал биологической химии . 272 (1): 5–8. дои : 10.1074/jbc.272.1.5 . ПМИД 8995214 .
- ^ Лапорт С.А., Окли Р.Х., Холт Дж.А., Барак Л.С., Кэрон М.Г. (июль 2000 г.). «Взаимодействие бета-аррестина с адаптером AP-2 необходимо для кластеризации бета-2-адренергических рецепторов в ямки, покрытые клатрином» . Журнал биологической химии . 275 (30): 23120–6. дои : 10.1074/jbc.M002581200 . ПМИД 10770944 .
- ^ Лапорт С.А., Окли Р.Х., Чжан Дж., Холт Дж.А., Фергюсон С.С., Кэрон М.Г., Барак Л.С. (март 1999 г.). «Комплекс бета2-адренергический рецептор/бетааррестин рекрутирует клатриновый адаптер AP-2 во время эндоцитоза» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (7): 3712–7. Бибкод : 1999PNAS...96.3712L . дои : 10.1073/pnas.96.7.3712 . ПМК 22359 . ПМИД 10097102 .
- ^ Тобин А.Б. (март 2008 г.). «Фосфорилирование рецепторов, связанных с G-белком: где, когда и кем» . Британский журнал фармакологии . 153 (Приложение 1): С167–76. дои : 10.1038/sj.bjp.0707662 . ПМК 2268057 . ПМИД 18193069 .
- ^ Маргета-Митрович М., Ян Ю.Н., Ян Л.Ю. (июль 2000 г.). «Контрольный пункт незаконного оборота контролирует гетеродимеризацию рецептора ГАМК (В)» . Нейрон . 27 (1): 97–106. дои : 10.1016/S0896-6273(00)00012-X . ПМИД 10939334 . S2CID 15430860 .
- ^ Уайт Дж.Х., Уайз А., Мейн М.Дж., Грин А., Фрейзер Нью-Джерси, Дисней Г.Х. и др. (декабрь 1998 г.). «Гетеродимеризация необходима для образования функционального рецептора ГАМК (В)». Природа . 396 (6712): 679–82. Бибкод : 1998Natur.396..679W . дои : 10.1038/25354 . ПМИД 9872316 . S2CID 4406311 .
- ^ Jump up to: а б Нордстрем К.Дж., Саллман Альмин М., Эдстам М.М., Фредрикссон Р., Шит Х.Б. (сентябрь 2011 г.). «Независимый анализ HH, анализ Нидлмана-Вунша и мотивов выявляет общую иерархию для большинства семейств рецепторов, связанных с G-белком». Молекулярная биология и эволюция . 28 (9): 2471–80. дои : 10.1093/molbev/msr061 . ПМИД 21402729 .
Дальнейшее чтение
[ редактировать ]- Вассилатис Д.К., Хохманн Дж.Г., Цзэн Х., Ли Ф., Ранчалис Дж.Э., Мортруд М.Т. и др. (апрель 2003 г.). «Репертуар рецепторов, связанных с G-белком, человека и мыши» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (8): 4903–8. Бибкод : 2003PNAS..100.4903V . дои : 10.1073/pnas.0230374100 . ПМК 153653 . ПМИД 12679517 .
- «Справочная библиотека GPCR» . Проверено 11 августа 2008 г.
Справочник молекулярных и математических моделей первоначального ответа рецептора.
- «Нобелевская премия по химии 2012 г.» (PDF) . Архивировано (PDF) из оригинала 18 октября 2012 года . Проверено 10 октября 2012 г.
Внешние ссылки
[ редактировать ]- Рецепторы, связанные с G-белком, Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Клеточная линия GPCR. Архивировано 3 апреля 2015 г. в Wayback Machine.
- «Руководство IUPHAR/BPS по базе данных ФАРМАКОЛОГИИ (GPCR)» . База данных ИЮФАР . Эдинбургский университет/Международный союз фундаментальной и клинической фармакологии . Проверено 6 февраля 2019 г.
- "GPCRdb" .
Данные, диаграммы и веб-инструменты для рецепторов, связанных с G-белком (GPCR).
; Мунк Дж., Исберг В., Мордальски С., Харпсё К., Ратаж К., Хаузер А.С. и др. (июль 2016 г.). «GPCRdb: база данных рецепторов, связанных с G-белком, - введение» . Британский журнал фармакологии . 173 (14): 2195–207. дои : 10.1111/bph.13509 . ПМЦ 4919580 . ПМИД 27155948 . - «Рецепторы, связанные с G-белком, в СЕТИ» . Архивировано из оригинала 23 июля 2011 года . Проверено 10 ноября 2010 г.
классификация GPCR
- «Сетевой центр PSI GPCR» . Архивировано из оригинала 25 июля 2013 года . Проверено 11 июля 2013 г.
Инициатива по структуре белка: Сетевой центр биологии, направленный на определение трехмерных структур репрезентативных белков семейства GPCR.
- GPCR-HGmod. Архивировано 1 февраля 2016 г. в Wayback Machine , базе данных трехмерных структурных моделей всех рецепторов, связанных с G-белком человека, созданных конвейером GPCR- -TASSER. I Чжан Дж., Ян Дж., Чан Р., Чжан Ю. (август 2015 г.). «GPCR-I-TASSER: гибридный подход к моделированию структуры рецептора, связанного с G-белком, и его применению к геному человека» . Структура . 23 (8): 1538–1549. дои : 10.1016/j.str.2015.06.007 . ПМЦ 4526412 . ПМИД 26190572 .