Аденилосукцинатлиаза
| АДСЛ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ADSL , AMPS, ASASE, ASL, аденилосукцинатлиаза, аденилосукцинатлиаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 608222 ; МГИ : 103202 ; Гомологен : 12 ; GeneCards : ADSL ; ОМА : ADSL — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Аденилосукцинатлиаза | |||
|---|---|---|---|
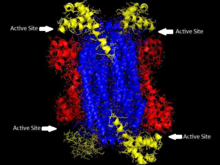 «Гомотетрамерная структура ASL у Thermotoga maritima. Домен 1 выделен красным , Домен 2 — синим , Домен 3 — желтым . Эта структура была вдохновлена статьей Тота и Йейтса. [ 5 ] | |||
| Идентификаторы | |||
| Номер ЕС. | 4.3.2.2 | ||
| Номер CAS. | 9027-81-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Аденилосукцинатлиаза (или аденилосукциназа ) — фермент , который у человека кодируется геном ADSL . [ 6 ]
Аденилосукцинатлиаза превращает аденилосукцинат в АМФ и фумарат в рамках пуринового нуклеотидного цикла . АСЛ катализирует две реакции пути биосинтеза пуринов, в результате которых образуется АМФ; ASL расщепляет аденилсукцинат на AMP и фумарат и расщепляет SAICAR на AICAR и фумарат.
Аденилосукцинатлиаза является частью суперсемейства ферментов β-элиминирования и действует по механизму реакции E1cb . Фермент представляет собой гомотетрамер с тремя доменами в каждом мономере и четырьмя активными центрами на гомотетрамер.
Точечные мутации аденилосукцината, вызывающие снижение ферментативной активности , вызывают клинические симптомы, указывающие на дефицит аденилсукцинатлиазы .
Этот белок может использовать морфеиновую модель аллостерической регуляции . [ 7 ]
Функция
[ редактировать ]
Аденилосукцинатлиаза (ASL) представляет собой фермент, который катализирует две реакции de novo пути биосинтеза пуринов . В обеих реакциях он использует механизм реакции элиминирования E1cb для отщепления фумарата от субстрата. В первой реакции ASL превращает 5-аминоимидазол-(N-сукцинилокарбоксамид) риботид (SAICAR) в 5-аминоимидазол-4-карбоксамид риботид (AICAR) и фумарат. AICAR проходит еще три реакции, прежде чем он превращается в аденилосукцинат (также называемый сукциниладенозинмонофосфатом или SAMP), который ASL затем расщепляет на аденозинмонофосфат (AMP) и фумарат. [ 8 ] АСЛ важен для клеток не только из-за его участия в создании пуринов, необходимых для клеточной репликации , но и потому, что он помогает регулировать метаболические процессы, контролируя уровни АМФ и фумарата в клетке. [ 9 ]

Структура
[ редактировать ]Субъединицы
[ редактировать ]Аденилосукцинатлиаза принадлежит к суперсемейству β-элиминирующих, и поэтому ее структура представляет собой гомотетрамер. Мономер аденилосукцинатлиазы имеет три домена. У Thermotoga maritima домен 1 содержит 7 α-спиралей в остатках 1–93, включая His68, который является высококонсервативным и ранее считался каталитической кислотой в активном сайте . [ 5 ] Более поздние исследования показали, что His171 в домене 2, который ранее считался каталитическим основанием , на самом деле может действовать как каталитическая кислота, по крайней мере, в Escherichia coli . [ 9 ] мономера Домен 2 состоит из остатков 94–341 и содержит 5 α-спиралей и единственный β-лист . Домен 3 состоит из 7 α-спиралей. Ядро тетрамера состоит из четырех копий домена 2, и на каждом конце тетрамера имеется по две копии доменов 1 и 3, что придает тетрамеру D2 диэдрическую симметрию . Тетрамер имеет четыре активных центра, в каждом из которых встречаются три домена. [ 5 ]
Аденилосукцинатлиазу у людей и Bacillus subtilis можно конкурентно ингибировать с помощью аналога субстрата аденозинфосфономасляной кислоты 2'(3'),5'-дифосфата (APBADP). APBADP является конкурентным ингибитором обеих реакций, катализируемых аденилосукцинатлиазой, а кинетические исследования с APBADP показывают, что субстраты для обеих реакций используют один и тот же активный центр. [ 10 ] В катализируемой ASL реакции расщепления аденилосукцината на аденозинмонофосфат (АМФ) и фумарат АМФ должен слегка вращаться после завершения реакции и до высвобождения фумарата, чтобы оба продукта поместились в активном центре. [ 11 ]
Мутации
[ редактировать ]аденилосукцинатлиазы Мутанты могут иметь значительно сниженную активность независимо от того, находится ли мутация в активном сайте или за его пределами. Вызывающие заболевание мутанты ASL R396C и R396H находятся у входа в активный сайт и имеют более низкий Vmax , чем ASL дикого типа, но мутанты K246E и L311V, находящиеся вдали от активного сайта, также вызывают снижение Vmax . Мутант ASL R194C находится вдали от активного сайта, и хотя он поддерживает V max, аналогичный ASL дикого типа, было показано, что он наименее конформационно стабильен из пяти мутантов in vitro и все еще вызывает заболевание. [ 12 ]
Механизм
[ редактировать ]Ранее считалось, что механизм действия аденилосукцинатлиазы представляет собой согласованный катализ, при котором водород на β-углероде (по отношению к уходящему азоту) отрывается каталитическим основанием, в то время как уходящий азот протонируется каталитическая кислота для элиминации Е2. [ 5 ] Более поздние данные противоречат этой идее и подтвердили, что механизм на самом деле не согласован, но что абстракция происходит сначала и существует промежуточная разновидность карбаниона , которая стабилизируется резонансом. Для обеих реакций, катализируемых ASL, сначала происходит депротонирование углерода β до уходящего азота, затем происходит образование и резонансная стабилизация карбаниона и, наконец, протонирование уходящего азота, которое вызывает разрыв связи CN. [ 9 ] Экспериментальное подтверждение депротонирования, образования карбанионов и лимитирующей стадии протонирования, вызывающей расщепление, означает, что это механизм E1cb. Самые последние данные позволяют предположить, что каталитической кислотой является His171, который ранее считался каталитическим основанием, и что несколько необычно то, что серин в положении 295 действует как каталитическое основание. Расщепление аденилосукцината до АМФ и фумарата представляет собой упорядоченный механизм уни-би, что означает, что после расщепления фумарат покидает активный центр раньше, чем это сделает АМФ. [ 13 ]

Роль в болезни
[ редактировать ]Мутированная аденилсукцинатлиаза (ASL) вызывает у пациентов клиническое заболевание, которое называется дефицитом аденилсукцинатлиазы . Это состояние встречается редко и проявляется различной степенью психомоторной отсталости , аутизмом , мышечной атрофией и эпилепсией . [ 14 ] [ 15 ] Точная причина заболевания неизвестна, но возможные причины включают недостаточный пуриновых нуклеотидов синтез для репликации клеток , нарушение цикла пуриновых нуклеотидов и накопление субстратов до токсических уровней. Было выявлено несколько точковых мутаций, связанных с заболеванием, и те, кто гетерозиготен по точковой мутации, здоровы, но у гомозиготных развивается клиническое заболевание. [ 16 ] Число генотипов, вызывающих заболевания, продолжает увеличиваться по мере обнаружения новых мутаций, и в настоящее время идентифицировано тридцать различных точечных мутаций и одна делеция, которые вызывают дефицит аденилсукцинатлиазы. [ 17 ]
Когда субстраты ASL (аденилосукцинат и SAICAR) накапливаются из-за дефицита фермента, они дефосфорилируются и превращаются в сукциниладенозин (S-Ado) и рибозид сукциниламиноимидазолкарбоксимида (рибозид SAICA). [ 18 ] Обычно эти соединения не присутствуют в спинномозговой жидкости или моче, поскольку ASL действует на большинство молекул субстрата до того, как они смогут накопиться и фосфорилироваться. [ 15 ] В прошлом не существовало хорошего теста на дефицит аденилсукцинатлиазы, что затрудняло диагностику редкого заболевания, но недавно был разработан тест для обнаружения SAICA и S-Ado в моче. Тест стоит недорого и в небольшой выборке исследователей не дал ни ложноположительных, ни ложноотрицательных результатов. [ 19 ]
Считается, что рибозид SAICA может быть более токсичным соединением, поскольку его более высокие уровни обнаруживаются у пациентов с тяжелыми клиническими симптомами, а некоторые исследователи полагают, что S-Ado может даже оказывать защитное действие. Необходимо провести дополнительные исследования того, что определяет тяжесть заболевания, но нестабильность человеческого ASL в лабораторных условиях стала препятствием для этих исследований. [ 17 ]
Терапевтическое применение
[ редактировать ]Поскольку устойчивость к противомалярийным препаратам возрастает, исследователи ищут новые стратегии борьбы с паразитами Plasmodium , вызывающими малярию , особенно с более смертоносным P. falciparum . Некоторые исследователи предложили рассматривать ASL как потенциальную мишень для лекарств, поскольку, хотя прерывание пути биосинтеза пуринов de novo токсично для хозяина, ASL Plasmodium имеет низкий уровень гомологии последовательностей с ASL человека, что может привести к созданию любых антиплазмодийных ASL -препаратов. достаточно специфичен, чтобы не причинить вреда человеку-хозяину. [ 20 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000239900 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000022407 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д и Тот Э.А., Йейтс Т.О. (февраль 2000 г.). «Структура аденилосукцинатлиазы, фермента с двойной активностью в пути биосинтеза пуринов de novo» . Структура . 8 (2): 163–74. дои : 10.1016/S0969-2126(00)00092-7 . ПМИД 10673438 .
- ^ «Ген Энтрез: Аденилосукцинатлиаза» . Проверено 1 марта 2012 г.
- ^ Селвуд Т., Яффе Е.К. (март 2012 г.). «Динамическая диссоциация гомоолигомеров и контроль функции белка» . Архив биохимии и биофизики . 519 (2): 131–43. дои : 10.1016/j.abb.2011.11.020 . ПМЦ 3298769 . ПМИД 22182754 .
- ^ Шпигель Е.К., Колман Р.Ф., Паттерсон Д. (2006). «Дефицит аденилосукцинатлиазы». Молекулярная генетика и обмен веществ . 89 (1–2): 19–31. дои : 10.1016/j.ymgme.2006.04.018 . ПМИД 16839792 .
- ^ Jump up to: а б с д Цай М., Ку Дж., Ип П., Колман Р.Ф., Сигалл М.Л., Хауэлл П.Л. (июль 2007 г.). «Комплексы субстратов и продуктов аденилосукцинатлиазы Escherichia coli открывают новое понимание ферментативного механизма» . Журнал молекулярной биологии . 370 (3): 541–54. дои : 10.1016/j.jmb.2007.04.052 . ПМК 4113493 . ПМИД 17531264 .
- ^ Сивендран С., Колман Р.Ф. (июль 2008 г.). «Влияние нового нерасщепляемого аналога субстрата на дикого типа и сериновые мутанты в характерной последовательности аденилосукцинатлиазы Bacillus subtilis и Homo sapiens» . Белковая наука . 17 (7): 1162–74. дои : 10.1110/ps.034777.108 . ПМК 2442012 . ПМИД 18469177 .
- ^ Козлов Г., Нгуен Л., Пирсолл Дж., Геринг К. (сентябрь 2009 г.). «Структура фосфатсвязанной аденилосукцинатлиазы Escherichia coli идентифицирует His171 как каталитическую кислоту» . Acta Crystallographica Раздел F. 65 (Часть 9): 857–61. дои : 10.1107/S1744309109029674 . ПМЦ 2795585 . ПМИД 19724117 .
- ^ Арьянанда Лде З., Ли П., Антонопулос С., Колман Р.Ф. (июнь 2009 г.). «Биохимический и биофизический анализ пяти мутантов аденилосукцинатлиазы человека, связанных с заболеваниями» . Биохимия . 48 (23): 5291–302. дои : 10.1021/bi802321m . ПМЦ 2745324 . ПМИД 19405474 .
- ^ Булусу В., Шринивасан Б., Бопанна М.П., Баларам Х. (апрель 2009 г.). «Выяснение субстратной специфичности, кинетического и каталитического механизма аденилосукцинатлиазы Plasmodium falciparum». Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1794 (4): 642–54. дои : 10.1016/j.bbapap.2008.11.021 . ПМИД 19111634 .
- ^ Маасвинкель-Муйдж П.Д., Лаан Л.А., Онкенхаут В., Брауэр О.Ф., Джекен Дж., Поортуис Б.Дж. (август 1997 г.). «Дефицит аденилосукциназы, проявляющийся эпилепсией в раннем детстве». Журнал наследственных метаболических заболеваний . 20 (4): 606–7. дои : 10.1023/А:1005323512982 . ПМИД 9266401 . S2CID 52833816 .
- ^ Jump up to: а б Ли П., Колман Р.Ф. (февраль 2007 г.). «Экспрессия, очистка и характеристика стабильной рекомбинантной аденилосукцинатлиазы человека». Экспрессия и очистка белков . 51 (2): 227–34. дои : 10.1016/j.pep.2006.07.023 . ПМИД 16973378 .
- ^ Стоун Р.Л., Эйми Дж., Баршоп Б.А., Джейкен Дж., Ван ден Берге Г., Залкин Х., Диксон Дж.Э. (апрель 1992 г.). «Мутация аденилсукцинатлиазы, связанная с умственной отсталостью и аутистическими особенностями». Природная генетика . 1 (1): 59–63. дои : 10.1038/ng0492-59 . ПМИД 1302001 . S2CID 21577926 .
- ^ Jump up to: а б Паленчар Дж. Б., Крокко Дж. М., Колман Р. Ф. (август 2003 г.). «Характеристика мутантных аденилосукцинатлиаз Bacillus subtilis, соответствующих серьезному дефициту аденилосукцинатлиазы человека» . Белковая наука . 12 (8): 1694–705. дои : 10.1110/ps.0303903 . ПМК 2323956 . ПМИД 12876319 .
- ^ Джаекен Дж., Ван ден Берге Дж. (ноябрь 1984 г.). «Детский аутистический синдром, характеризующийся наличием сукцинилпуринов в жидкостях организма». Ланцет . 2 (8411): 1058–61. дои : 10.1016/s0140-6736(84)91505-8 . ПМИД 6150139 . S2CID 54275991 .
- ^ Мэддокс Дж., Рид Т. (январь 1989 г.). «Анализ мочи на дефицит аденилосукциназы у детей с аутизмом». Ланцет . 1 (8630): 158–9. дои : 10.1016/S0140-6736(89)91172-0 . ПМИД 2563072 . S2CID 1534130 .
- ^ Маршалл В.М., Коппель Р.Л. (сентябрь 1997 г.). «Характеристика гена, кодирующего аденилосукцинатлиазу Plasmodium falciparum». Молекулярная и биохимическая паразитология . 88 (1–2): 237–41. дои : 10.1016/S0166-6851(97)00054-6 . ПМИД 9274883 .
Дальнейшее чтение
[ редактировать ]- Мари С., Куппенс Х., Хеутерспрёут М., Ясперс М., Тола Э.З., Гу XX, Легиус Э., Винсент М.Ф., Джейкен Дж., Кассиман Дж.Дж., Ван ден Берге Дж. (1999). «Анализ мутаций при дефиците аденилсукцинатлиазы: восемь новых мутаций в повторно оцененной полной кодирующей последовательности ADSL» . Человеческая мутация . 13 (3): 197–202. doi : 10.1002/(SICI)1098-1004(1999)13:3<197::AID-HUMU3>3.0.CO;2-D . ПМИД 10090474 . S2CID 37296574 .
- Кмоч С., Хартманнова Х., Стибуркова Б., Крайт Дж., Зиканова М., Себеста I (июнь 2000 г.). «Человеческая аденилосукцинатлиаза (ADSL), клонирование и характеристика полноразмерной кДНК и ее изоформы, структура гена и молекулярная основа дефицита ADSL у шести пациентов» . Молекулярная генетика человека . 9 (10): 1501–13. дои : 10.1093/hmg/9.10.1501 . ПМИД 10888601 .
- Гонка V, Мари С., Винсент М.Ф., Ван ден Берге Дж. (сентябрь 2000 г.). «Клинические, биохимические и молекулярно-генетические корреляции при дефиците аденилсукцинатлиазы» . Молекулярная генетика человека . 9 (14): 2159–65. дои : 10.1093/hmg/9.14.2159 . ПМИД 10958654 .
- Табукки А., Карлуччи Ф., Рози Ф., Герранти Р., Маринелло Э. (июнь 2001 г.). «Определение, активность и биологическая роль аденилосукцинатлиазы в клетках крови». Биомедицина и фармакотерапия . 55 (5): 277–83. дои : 10.1016/s0753-3322(01)00061-0 . ПМИД 11428554 .
- Мари С., Race V, Нассонь MC, Винсент М.Ф., Ван ден Берге Дж. (июль 2002 г.). «Мутация сайта связывания ядерного респираторного фактора 2 в 5'-нетранслируемой области гена ADSL у трех пациентов с дефицитом аденилосукцинатлиазы» . Американский журнал генетики человека . 71 (1): 14–21. дои : 10.1086/341036 . ПМК 384970 . ПМИД 12016589 .
- Кастро М., Перес-Серда К., Меринеро Б., Гарсиа М.Дж., Бернар Х., Хиль Нагель А., Торрес Х., Бермудес М., Гаравито П., Мари С., Винсент Ф., Ван ден Берге Г., Угарте М. (август 2002 г.). «Скрининг дефицита аденилосукцинатлиазы: клинические, биохимические и молекулярные данные у четырех пациентов». Нейропедиатрия . 33 (4): 186–9. дои : 10.1055/s-2002-34493 . ПМИД 12368987 . S2CID 20537145 .
- Паленчар Дж. Б., Колман Р. Ф. (февраль 2003 г.). «Характеристика мутантной аденилосукцинатлиазы Bacillus subtilis, эквивалентной мутантному ферменту, обнаруженному при дефиците аденилосукцинатлиазы человека: аспарагин 276 играет важную структурную роль». Биохимия . 42 (7): 1831–41. дои : 10.1021/bi020640+ . ПМИД 12590570 .
- Эдери П., Шабрие С., Себальос-Пико I, Мари С., Винсент М.Ф., Тардье М. (июль 2003 г.). «Внутрисемейная изменчивость фенотипического выражения дефицита аденилосукцинатлиазы: отчет о трех пациентах» . Американский журнал медицинской генетики, часть A. 120А (2): 185–90. дои : 10.1002/ajmg.a.20176 . ПМИД 12833398 . S2CID 21114377 .
- Стоун Р.Л., Эйми Дж., Баршоп Б.А., Джейкен Дж., Ван ден Берге Г., Залкин Х., Диксон Дж.Э. (апрель 1992 г.). «Мутация аденилсукцинатлиазы, связанная с умственной отсталостью и аутистическими особенностями». Природная генетика . 1 (1): 59–63. дои : 10.1038/ng0492-59 . ПМИД 1302001 . S2CID 21577926 .
- Сивендран С., Паттерсон Д., Шпигель Э., Макгоун И., Коули Д., Колман Р.Ф. (декабрь 2004 г.). «Две новые мутантные аденилосукцинатлиазы человека (ASL), связанные с аутизмом, и характеристика эквивалентного мутанта Bacillus subtilis ASL» . Журнал биологической химии . 279 (51): 53789–97. дои : 10.1074/jbc.M409974200 . ПМИД 15471876 .
Внешние ссылки
[ редактировать ]- Аденилосукцинат + лиаза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- человека Расположение генома ADSL и ADSL страница сведений о гене в браузере генома UCSC .
- человека ASL Расположение генома и страница сведений о гене ASL в браузере генома UCSC .



