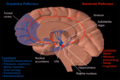
Черное вещество
| Черное вещество | |
|---|---|
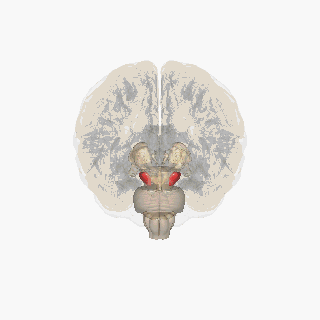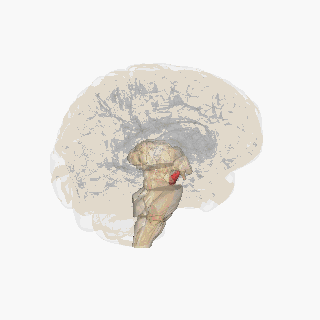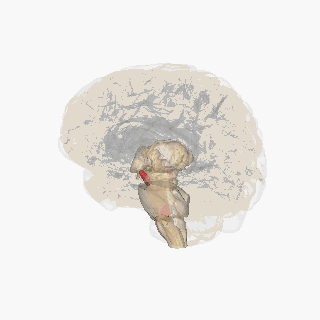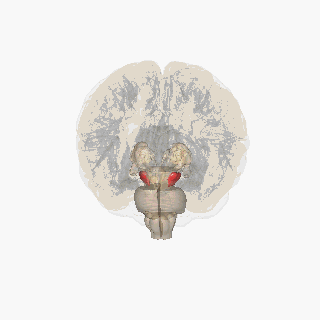 Черная субстанция выделена красным. | |
 На разрезе верхних холмиков видна черная субстанция. | |
| Подробности | |
| Часть | Средний мозг , базальные ганглии |
| Идентификаторы | |
| латинский | черное вещество |
| Акроним(ы) | СН |
| МеШ | Д013378 |
| Нейроимена | 536 |
| НейроЛекс ID | бирнлекс_789 |
| ТА98 | А14.1.06.111 |
| ТА2 | 5881 |
| ФМА | 67947 |
| Анатомические термины нейроанатомии | |
( Черная субстанция СН ) представляет собой структуру базальных ганглиев, расположенную в среднем мозге и играющую важную роль в вознаграждении и движении . Substantia nigra в переводе с латыни означает «черное вещество», что отражает тот факт, что части черной субстанции кажутся более темными, чем соседние области, из-за высокого уровня нейромеланина в дофаминергических нейронах . [1] Болезнь Паркинсона характеризуется потерей дофаминергических нейронов в компактной части черной субстанции . [2]
Хотя черная субстанция выглядит как непрерывная полоса в отделах мозга, анатомические исследования показали, что на самом деле она состоит из двух частей с очень разными соединениями и функциями: компактной части (SNpc) и сетчатой части (SNpr). Компактная часть служит главным образом проекцией контура базальных ганглиев, снабжая полосатое тело дофамином. Сетчатая часть передает сигналы от базальных ганглиев к многочисленным другим структурам мозга. [3]
Структура
[ редактировать ]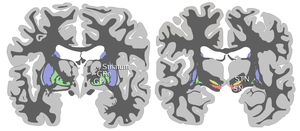

Черная субстанция вместе с четырьмя другими ядрами входит в состав базальных ганглиев . Это самое большое ядро среднего мозга, лежащее дорсально от ножки мозга . У человека есть две черные субстанции, по одной с каждой стороны от средней линии.
ЧС делится на две части: сетчатую часть (SNpr) и компактную часть (SNpc), лежащую медиальнее сетчатой части. Иногда упоминается третья область, латеральная часть, хотя обычно ее классифицируют как часть сетчатой части. (SNpr) и внутренний бледный шар (GPi) разделены внутренней капсулой . [4]
Парс сетчатый
[ редактировать ]Сетчатая часть имеет сильное структурное и функциональное сходство с внутренней частью бледного шара. Иногда их считают частями одной структуры, разделенными белым веществом внутренней капсулы. Как и нейроны бледного шара, нейроны сетчатой части в основном являются ГАМКергическими . [ нужна ссылка ]
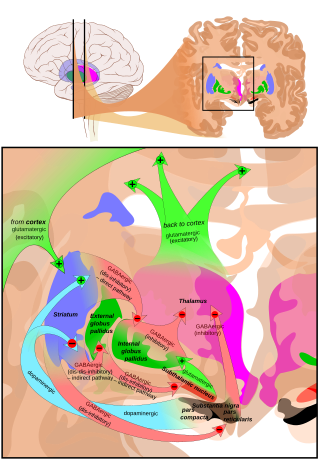
Афферентные связи
[ редактировать ]Основной вклад в SNpr поступает из полосатого тела . Он поступает двумя путями, известными как прямой и косвенный пути . Прямой путь состоит из аксонов средних шиповатых клеток полосатого тела, которые проецируются непосредственно в сетчатую часть. Непрямой путь состоит из трех звеньев: проекции от шиповатых клеток полосатого тела к наружной части бледного шара ; ГАМКергическая проекция от субталамического ядра к проекция от бледного шара к субталамическому ядру и глутаматергическая сетчатой части. [5] [ нужен лучший источник ] Таким образом, активность полосатого тела по прямому пути оказывает тормозящее действие на нейроны (SNpr), но возбуждающее действие по непрямому пути. Прямой и непрямой пути происходят от разных подмножеств шиповатых клеток полосатого тела: они тесно переплетены, но экспрессируют разные типы дофаминовых рецепторов, а также демонстрируют другие нейрохимические различия.
Эфферентные связи
[ редактировать ]Значительные проекции происходят в таламусе (вентрально-латеральном и вентральном переднем ядрах), верхних холмиках и других каудальных ядрах из сетчатой части (нигроталамического пути). [6] которые используют ГАМК в качестве нейромедиатора. Кроме того, эти нейроны образуют до пяти коллатералей, которые разветвляются как в пределах компактной, так и в сетчатой части, вероятно, модулируя дофаминергическую активность в компактной части. [7]
Функция
[ редактировать ]Черная субстанция играет важную роль в функционировании мозга, в частности, в движении глаз , планировании движений , поиске вознаграждения , обучении и зависимости . Многие эффекты черной субстанции опосредуются через полосатое тело . вклад ниграла Дофаминергический в полосатое тело через нигростриарный путь тесно связан с функцией полосатого тела. [8] Взаимосвязь между полосатым телом и черной субстанцией можно увидеть следующим образом: когда черная субстанция электрически стимулируется, движения не происходит; однако симптомы дегенерации черной субстанции, вызванной болезнью Паркинсона, являются ярким примером влияния черной субстанции на движение. Помимо функций, опосредованных полосатым телом, черная субстанция также служит основным источником ГАМКергического ингибирования различных целей мозга.
Парс сетчатый
[ редактировать ]Сетчатая часть черной субстанции является важным обрабатывающим центром в базальных ганглиях. ГАМКергические нейроны сетчатой части передают окончательные обработанные сигналы базальных таламусу и верхним ганглиев холмикам . Кроме того, сетчатая часть также ингибирует дофаминергическую активность в компактной части через коллатерали аксонов, хотя функциональная организация этих связей остается неясной.
ГАМКергические нейроны сетчатой части спонтанно запускают потенциалы действия . У крыс частота потенциалов действия составляет примерно 25 Гц. [9] Целью этих спонтанных потенциалов действия является торможение мишеней базальных ганглиев, а снижение торможения связано с движением. [10] Субталамическое ядро дает возбуждающий импульс, который модулирует скорость возникновения этих спонтанных потенциалов действия. Однако поражение субталамического ядра приводит лишь к 20%-ному снижению частоты срабатывания сетчатой части, что позволяет предположить, что генерация потенциалов действия в сетчатой части в значительной степени автономна. [11] на примере роли сетчатой части в саккадических движениях глаз . Группа ГАМКергических нейронов из сетчатой части проецируется в верхний холмик, демонстрируя высокий уровень устойчивой тормозной активности. [12] Проекции хвостатого ядра на верхний холмик также модулируют саккадические движения глаз.Измененные паттерны стрельбы сетчатой части, такие как одиночные или импульсные стрельбы, обнаруживаются при болезни Паркинсона. [13] и эпилепсия . [14]
Компактный парс
[ редактировать ]Наиболее важной функцией pars Compacta является двигательный контроль . [15] хотя роль черной субстанции в регуляции моторики является косвенной; электрическая стимуляция черной субстанции не приводит к движению из-за опосредования полосатого тела в черном влиянии движения. Компактная часть посылает возбуждающий импульс в полосатое тело через путь D1, который возбуждает и активирует полосатое тело, что приводит к высвобождению ГАМК на бледный шар, чтобы ингибировать ее ингибирующее воздействие на ядро таламуса. Это приводит к возбуждению таламокортикальных путей и передаче сигналов двигательных нейронов в кору головного мозга, что позволяет начать движение, которое отсутствует при болезни Паркинсона. Однако отсутствие нейронов компактной части оказывает большое влияние на движение, о чем свидетельствуют симптомы болезни Паркинсона. Двигательная роль компактной части может включать контроль мелкой моторики, что было подтверждено на животных моделях с поражениями этой области. [16]
Компактная часть активно участвует в выученных реакциях на раздражители. У приматов активность дофаминергических нейронов нигростриарного пути увеличивается при предъявлении нового стимула. [17] Дофаминергическая активность снижается при повторном предъявлении стимула. [17] Однако предъявление поведенчески значимых стимулов (т.е. вознаграждений) продолжает активировать дофаминергические нейроны в компактной части черной субстанции. Дофаминергические проекции из вентральной покрышки (нижняя часть «среднего мозга» или среднего мозга) в префронтальную кору (мезокортикальный путь) и к прилежащему ядру (мезолимбический путь – «мезо» означает «из среднего мозга»… особенно вентральная покрышка ) участвуют в вознаграждении, удовольствии и аддиктивном поведении. Компактная часть также важна для пространственного обучения, наблюдения за окружающей средой и местоположением в пространстве. Поражения компактной части приводят к нарушениям обучения повторению одинаковых движений. [18] и некоторые исследования указывают на его участие в дорсальной зависимой от полосатого тела системе памяти, основанной на реакциях, которая функционирует относительно независимо от гиппокампа , который, как традиционно считается, выполняет функции пространственной или эпизодической памяти . [19]
Компактная часть также играет роль во временной обработке и активируется во время воспроизведения времени. Поражения компактной части приводят к временному дефициту. [20] В последнее время подозревают, что компактная часть регулирует цикл сна-бодрствования. [21] что соответствует таким симптомам, как бессонница и нарушения быстрого сна , о которых сообщают пациенты с болезнью Паркинсона . Тем не менее, частичный дефицит дофамина, который не влияет на двигательный контроль, может привести к нарушениям цикла сон-бодрствование, особенно к паттернам нейронной активности, подобным фазе быстрого сна, во время бодрствования, особенно в гиппокампе . [22]
Клиническое значение
[ редактировать ]Черная субстанция имеет решающее значение в развитии многих заболеваний и синдромов, включая паркинсонизм и болезнь Паркинсона . Существует исследование, показывающее, что высокочастотная стимуляция левой черной субстанции может вызывать транзиторные симптомы острой депрессии. [23]
болезнь Паркинсона
[ редактировать ]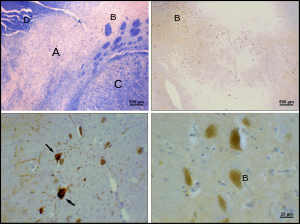
Болезнь Паркинсона представляет собой нейродегенеративное заболевание , характеризующееся, в частности, гибелью дофаминергических нейронов в SNpc. К основным симптомам болезни Паркинсона относятся тремор , акинезия , брадикинезия и ригидность. [24] Другие симптомы включают нарушения осанки, усталость , нарушения сна и депрессивное настроение . [25]
Причина гибели дофаминергических нейронов SNpc неизвестна. Однако был выявлен некоторый вклад в уникальную восприимчивость дофаминергических нейронов компактной части. Во-первых, дофаминергические нейроны обнаруживают аномалии в митохондриальном комплексе 1 , вызывающие агрегацию альфа-синуклеина ; это может привести к аномальному обращению с белком и гибели нейронов. [26] Во-вторых, дофаминергические нейроны компактной части содержат меньше кальбиндина , чем другие дофаминергические нейроны. [27] Кальбиндин — это белок, участвующий в транспорте ионов кальция внутри клеток, а избыток кальция в клетках токсичен. Теория кальбиндина могла бы объяснить высокую цитотоксичность болезни Паркинсона в черной субстанции по сравнению с вентральной областью покрышки. Независимо от причины гибели нейронов, пластичность компактной части очень устойчива; Симптомы паркинсонизма обычно не проявляются до тех пор, пока не погибнут по крайней мере 30% дофаминергических нейронов pars Compacta. [28] Большая часть этой пластичности происходит на нейрохимическом уровне; Транспортные системы дофамина замедляются, что позволяет дофамину задерживаться на более длительные периоды времени в химических синапсах полосатого тела. [29]
Менке, Джбабди, Миллер, Мэтьюз и Зари (2010) использовали диффузионно-тензорную визуализацию, а также картирование T1 для оценки объемных различий в SNpc и SNpr у участников с болезнью Паркинсона по сравнению со здоровыми людьми. Эти исследователи обнаружили, что у участников с болезнью Паркинсона всегда было меньше черной субстанции, особенно в SNpr. Поскольку SNpr связан с задним таламусом, вентральным таламусом и, в частности, с моторной корой, а также поскольку участники с болезнью Паркинсона сообщают о наличии меньших SNprs (Menke, Jbabdi, Miller, Matthews and Zari, 2010), небольшой объем этой области может быть ответственным за двигательные нарушения, обнаруженные у пациентов с болезнью Паркинсона. Этот небольшой объем может быть причиной более слабых и/или менее контролируемых двигательных движений, что может привести к тремору, который часто испытывают люди с болезнью Паркинсона. [30]
Окислительный стресс и окислительное повреждение SNpc, вероятно, являются ключевыми факторами в этиологии болезни Паркинсона по мере старения человека. [31] Повреждения ДНК, вызванные окислительным стрессом, могут быть устранены с помощью процессов, модулируемых альфа-синуклеином . [32] Альфа-синуклеин экспрессируется в черной субстанции, но его функция восстановления ДНК , по-видимому, нарушена в с тельцами Леви , несущих включения нейронах . [32] Эта потеря может вызвать гибель клеток.
Шизофрения
[ редактировать ]Повышенный уровень дофамина уже давно вовлечен в развитие шизофрении . [33] Однако по сей день продолжаются многочисленные дебаты вокруг дофаминовой гипотезы шизофрении . Несмотря на разногласия, антагонисты дофамина остаются стандартным и успешным методом лечения шизофрении. К этим антагонистам относятся (типичные) антипсихотики первого поколения, такие как бутирофеноны , фенотиазины и тиоксантены . Эти препараты в значительной степени были заменены (атипичными) антипсихотиками второго поколения, такими как клозапин и палиперидон . В целом эти препараты действуют не на сами нейроны, продуцирующие дофамин, а на рецепторы постсинаптического нейрона.
Другие нефармакологические доказательства в поддержку дофаминовой гипотезы, касающейся черной субстанции, включают структурные изменения в компактной части, такие как уменьшение размера синаптических окончаний. [34] Другие изменения в черной субстанции включают повышенную экспрессию рецепторов NMDA в черной субстанции и снижение дисбиндина экспрессии . Увеличение количества NMDA-рецепторов может указывать на участие глутамат - дофаминовых взаимодействий при шизофрении. Дисбиндин, который (спорно) связан с шизофренией, может регулировать высвобождение дофамина, а низкая экспрессия дисбиндина в черной субстанции может иметь важное значение в этиологии шизофрении. [35] Из-за изменений в черной субстанции в головном мозге больных шизофренией в конечном итоге можно будет использовать специальные методы визуализации (например, нейромеланин-специфическую визуализацию) для обнаружения физиологических признаков шизофрении в черной субстанции. [36]
Синдром деревянной груди
[ редактировать ]Деревянный сундук , также называемый фентаниловым синдромом ригидности грудной клетки, является редким побочным эффектом синтетических опиоидов , таких как фентанил , сульфентанил, альфентанил , ремифентанил . Это приводит к общему повышению тонуса скелетных мышц . Предполагается, что этот механизм заключается в повышенном высвобождении дофамина и снижении высвобождения ГАМК в нервах черной субстанции/полосатого тела. Эффект наиболее выражен на мышцах грудной стенки и может привести к нарушению вентиляции. Это состояние чаще всего наблюдается при анестезии, когда внутривенно вводятся быстрые и высокие дозы этих препаратов. [ нужна ссылка ]
Множественная системная атрофия
[ редактировать ]Множественная системная атрофия, характеризующаяся дегенерацией нейронов в полосатом теле и черной субстанции, ранее называлась стриатонигральной дегенерацией .
Химическая модификация черной субстанции
[ редактировать ]Химические манипуляции и модификации черной субстанции важны в области нейрофармакологии и токсикологии . Различные соединения, такие как леводопа и МФТП, используются при лечении и изучении болезни Паркинсона, а многие другие препараты оказывают воздействие на черную субстанцию.
Амфетамин и следовые амины
[ редактировать ]Исследования показали, что в определенных областях мозга амфетамин и следовые амины увеличивают концентрацию дофамина в синаптической щели , тем самым усиливая реакцию постсинаптического нейрона. [37] Различные механизмы, с помощью которых амфетамин и следовые амины влияют на концентрацию дофамина, тщательно изучены, и известно, что они включают как DAT , так и VMAT2 . [37] [38] [39] Амфетамин по структуре похож на дофамин и следовые амины; как следствие, он может проникать в пресинаптический нейрон через DAT , а также напрямую диффундировать через нервную мембрану. [37] Попадая в пресинаптический нейрон, амфетамин и следовые амины активируют TAAR1 , который посредством передачи сигналов протеинкиназы вызывает отток дофамина, зависимую от фосфорилирования DAT интернализацию и неконкурентное ингибирование обратного захвата. [37] [40] Из-за сходства амфетамина и следовых аминов он также является субстратом для переносчиков моноаминов; как следствие, он (конкурентно) ингибирует обратный захват дофамина и других моноаминов, конкурируя с ними за поглощение. [37]
Кроме того, амфетамин и следовые амины являются субстратами для нейронального везикулярного переносчика моноаминов, везикулярного переносчика моноаминов 2 (VMAT2). [39] Когда амфетамин поглощается VMAT2 , везикула взамен высвобождает (выводит) молекулы дофамина в цитозоль. [39]
Кокаин
[ редактировать ]Механизм действия кокаина на мозг человека включает ингибирование обратного захвата дофамина. [41] что объясняет вызывающие привыкание свойства кокаина, поскольку дофамин является важнейшим нейромедиатором вознаграждения. Однако кокаин более активен в дофаминергических нейронах вентральной покрышки, чем в черной субстанции. Прием кокаина увеличивает метаболизм в черной субстанции, что может объяснить изменение двигательной функции, наблюдаемое у субъектов, употребляющих кокаин. [42] Подавление обратного захвата дофамина кокаином также подавляет возникновение спонтанных потенциалов действия в компактной части. [43] Механизм, с помощью которого кокаин ингибирует обратный захват дофамина, включает его связывание с белком- переносчиком дофамина . Однако исследования показывают, что кокаин также может вызывать снижение уровня мРНК DAT . [44] скорее всего, это связано с блокированием кокаином рецепторов дофамина, а не с прямым вмешательством в пути транскрипции или трансляции. [44]
Инактивация черной субстанции может оказаться возможным методом лечения кокаиновой зависимости. В исследовании на кокаинзависимых крысах инактивация черной субстанции с помощью имплантированных канюль значительно снижала рецидивы кокаиновой зависимости. [45]
Леводопа
[ редактировать ]Черная субстанция является мишенью химической терапии при лечении болезни Паркинсона. Леводопа (обычно называемая L-ДОФА), предшественник дофамина, является наиболее часто назначаемым лекарством при болезни Паркинсона, несмотря на разногласия относительно нейротоксичности дофамина и L-ДОФА. [46] Препарат особенно эффективен при лечении пациентов на ранних стадиях болезни Паркинсона, хотя со временем он теряет свою эффективность. [47] Леводопа может преодолевать гематоэнцефалический барьер и повышать уровень дофамина в черной субстанции, облегчая тем самым симптомы болезни Паркинсона. Недостаток лечения леводопой заключается в том, что оно лечит симптомы болезни Паркинсона (низкий уровень дофамина), а не ее причину (гибель дофаминергических нейронов черной субстанции).
МПТП
[ редактировать ]МФТП представляет собой нейротоксин, специфичный для дофаминергических клеток головного мозга, особенно черной субстанции. MPTP оказался в центре внимания в 1982 году, когда у потребителей героина в Калифорнии появились симптомы, подобные болезни Паркинсона, после употребления MPPP , загрязненного MPTP. Пациенты, которые были ригидными и почти полностью неподвижными, ответили на лечение леводопой. О ремиссии симптомов, подобных болезни Паркинсона, не сообщалось, что указывает на необратимую гибель дофаминергических нейронов. [48] Предполагаемый механизм МФТП включает нарушение функции митохондрий , включая нарушение метаболизма и образование свободных радикалов . [49]
Вскоре после этого MPTP был протестирован на животных моделях на предмет его эффективности в индукции болезни Паркинсона (с успехом). МФТП вызывал акинезию, ригидность и тремор у приматов, и было обнаружено, что его нейротоксичность очень специфична для компактной части черной субстанции. [50] У других животных, таких как грызуны, индукция болезни Паркинсона с помощью МФТП является неполной или требует гораздо более высоких и частых доз, чем у приматов. Сегодня MPTP остается наиболее предпочтительным методом индуцирования болезни Паркинсона на животных моделях . [49] [51]
История
[ редактировать ]Черная субстанция была открыта в 1784 году Феликсом Вик-д'Азиром . [52] и Самуэль Томас фон Зёммерринг упомянул об этой структуре в 1791 году. [53] Различие между сетчатой и компактной частью черной субстанции было впервые предложено Сано в 1910 году. [54] В 1963 году Олег Горникевич на основании своего наблюдения пришел к выводу, что «потеря клеток черной субстанции (у пациентов с болезнью Паркинсона) вполне может быть причиной дефицита дофамина в полосатом теле». [55]
Дополнительные изображения
[ редактировать ]- Дофамин и серотонин
- Деградация черной субстанции, связанная с болезнью Паркинсона.
- Горизонтальный срез МРТ (взвешенный по Т1) с выделением, указывающим расположение черной субстанции.
- МРТ с улучшенным нейромеланином и цветными изображениями (RGB), показывающими компактную часть черной субстанции.
- Микрофильмирование
Ссылки
[ редактировать ]- ^ Рабей Дж. М., Хефти Ф (1990). «Синтез нейромеланина в черной субстанции крысы и человека». Журнал нейронной передачи. Секция болезни Паркинсона и деменции . 2 (1): 1–14. дои : 10.1007/BF02251241 . ПМИД 2357268 . S2CID 6769760 .
- ^ Ким С.Дж., Сунг Дж.И., Ум Дж.В., Хаттори Н., Мизуно Ю., Танака К., Пайк С.Р., Ким Дж., Чунг К.С. (октябрь 2003 г.). «Паркин расщепляет внутриклеточные включения альфа-синуклеина посредством активации кальпаина» . Журнал биологической химии . 278 (43): 41890–9. дои : 10.1074/jbc.M306017200 . ПМИД 12917442 .
- ^ Болам, JP; Браун, MTC; Мосс, Дж.; Мэгилл, П.Дж. (1 января 2009 г.), «Базальные ганглии: внутренняя организация» , в Сквайре, Ларри Р. (редактор), Энциклопедия нейронаук , Оксфорд: Academic Press, стр. 97–104, doi : 10.1016/b978-008045046 -9.01294-8 , ISBN 978-0-08-045046-9 , получено 7 сентября 2020 г.
- ^ Кита Х, Джагер Д (2016). «Организация Globus Pallidus». Справочник по структуре и функциям базальных ганглиев, второе издание . Справочник по поведенческой нейронауке. Том. 24. С. 259–276. дои : 10.1016/B978-0-12-802206-1.00013-1 . ISBN 9780128022061 .
- ^ Наута Х.Дж., Коул М. (июль 1978 г.). «Эфферентные проекции субталамического ядра: авторадиографическое исследование на обезьянах и кошках». Журнал сравнительной неврологии . 180 (1): 1–16. дои : 10.1002/cne.901800102 . ПМИД 418083 . S2CID 43046462 .
- ^ Карпентер М.Б., Накано К., Ким Р. (февраль 1976 г.). «Нигроталамические проекции у обезьян, продемонстрированные с помощью авторадиографической техники». Журнал сравнительной неврологии . 165 (4): 401–15. дои : 10.1002/cne.901650402 . ПМИД 57125 . S2CID 11790266 .
- ^ Дениау Дж.М., Китай С.Т., Донохью Дж.П., Грофова И. (1982). «Нейрональные взаимодействия в сетчатой части черной субстанции через коллатерали аксонов проекционных нейронов. Электрофизиологическое и морфологическое исследование». Экспериментальное исследование мозга . 47 (1): 105–13. дои : 10.1007/BF00235891 . ПМИД 6288427 . S2CID 20289802 .
- ^ Никола С.М., Сюрмейер Дж ., Маленка Р.К. (2000). «Дофаминергическая модуляция возбудимости нейронов в полосатом теле и прилежащем ядре». Ежегодный обзор неврологии . 23 : 185–215. дои : 10.1146/annurev.neuro.23.1.185 . ПМИД 10845063 .
- ^ Гернерт М., Федровиц М., Влаз П., Лёшер В. (ноябрь 2004 г.). «Субрегиональные изменения в частоте разрядов, характере и чувствительности к лекарствам предполагаемых ГАМКергических черных нейронов в модели киндлинга эпилепсии» . Европейский журнал неврологии . 20 (9): 2377–86. дои : 10.1111/j.1460-9568.2004.03699.x . ПМИД 15525279 . S2CID 24485657 .
- ^ Сато М., Хикосака О. (март 2002 г.). «Роль приматов substantia nigra pars reticulata в саккадических движениях глаз, ориентированных на вознаграждение» . Журнал неврологии . 22 (6): 2363–73. doi : 10.1523/JNEUROSCI.22-06-02363.2002 . ПМК 6758246 . ПМИД 11896175 .
- ^ Зар Н.М., Мартин Л.П., Ващак Б.Л. (ноябрь 2004 г.). «Поражения субталамического ядра изменяют базальный и агонист дофамина, стимулирующий электрофизиологический выход базальных ганглиев крысы». Синапс . 54 (2): 119–28. дои : 10.1002/syn.20064 . ПМИД 15352137 . S2CID 10239473 .
- ^ Хикосака О., Вурц Р.Х. (май 1983 г.). «Зрительные и глазодвигательные функции обезьяны substantia nigra pars reticulata. III. Зрительные и саккадные реакции, зависящие от памяти». Журнал нейрофизиологии . 49 (5): 1268–84. дои : 10.1152/jn.1983.49.5.1268 . ПМИД 6864250 .
- ^ Ценг К.Ю., Рикельме Л.А., Белфорте Дж.Э., Пасо Дж.Х., Мурер М.Г. (январь 2000 г.). «Единицы substantia nigra pars reticulata у крыс, пораженных 6-гидроксидофамином: ответы на стимуляцию стриарных дофаминовых рецепторов D2 и субталамические поражения». Европейский журнал неврологии . 12 (1): 247–56. дои : 10.1046/j.1460-9568.2000.00910.x . hdl : 11336/39220 . ПМИД 10651879 . S2CID 22886675 .
- ^ Дерансарт С., Хеллвиг Б., Хойпель-Рейтер М., Леже Дж.Ф., Хек Д., Люкинг CH (декабрь 2003 г.). «Одноединичный анализ нейронов ретикулатной части черной субстанции у свободно ведущих себя крыс с генетической абсансной эпилепсией». Эпилепсия . 44 (12): 1513–20. дои : 10.1111/j.0013-9580.2003.26603.x . ПМИД 14636321 . S2CID 6661257 .
- ^ Ходж Г.К., Батчер Л.Л. (август 1980 г.). «Компактная часть черной субстанции модулирует двигательную активность, но не участвует в регулировании потребления пищи и воды». Архив фармакологии Наунина-Шмидеберга . 313 (1): 51–67. дои : 10.1007/BF00505805 . ПМИД 7207636 . S2CID 24642979 .
- ^ Пиоли Э.Ю., Мейснер В., Сор Р., Гросс CE, Безард Э., Биулак Б.Х. (июнь 2008 г.). «Дифференциальные поведенческие эффекты частичных двусторонних поражений вентральной покрышки или компактной части черной субстанции у крыс». Нейронаука . 153 (4): 1213–24. doi : 10.1016/j.neuroscience.2008.01.084 . ПМИД 18455318 . S2CID 11239586 .
- ^ Перейти обратно: а б Юнгберг Т., Апицелла П., Шульц В. (январь 1992 г.). «Ответы дофаминовых нейронов обезьян при обучении поведенческим реакциям». Журнал нейрофизиологии . 67 (1): 145–63. дои : 10.1152/jn.1992.67.1.145 . ПМИД 1552316 . S2CID 18024404 .
- ^ Да Кунья К., Силва М.Х., Ветзикоски С., Витзикоски Э.К., Ферро М.М., Кузмине И., Карьерс Н.С. (декабрь 2006 г.). «Стратегия изучения места у крыс с поражением компактной части черной субстанции». Поведенческая нейронаука . 120 (6): 1279–84. дои : 10.1037/0735-7044.120.6.1279 . ПМИД 17201473 .
- ^ Да Кунья С., Ветзикоски С., Витзикоски Э.К., Миёши Э., Ферро М.М., Ансельмо-Франси Х.А., Кантерас Н.С. (май 2003 г.). «Доказательства того, что черная субстанция компактная часть является важным компонентом системы памяти, независимой от системы памяти гиппокампа». Нейробиология обучения и памяти . 79 (3): 236–42. дои : 10.1016/S1074-7427(03)00008-X . ПМИД 12676522 . S2CID 12045200 .
- ^ Мэтелл М.С., Мек WH (январь 2000 г.). «Нейропсихологические механизмы интервального временного поведения». Биоэссе . 22 (1): 94–103. doi : 10.1002/(SICI)1521-1878(200001)22:1<94::AID-BIES14>3.0.CO;2-E . ПМИД 10649295 .
- ^ Лима М.М., Андерсен М.Л., Рексидлер А.Б., Виталь М.А., Туфик С. (июнь 2007 г.). Броснан С. (ред.). «Роль компактной части черной субстанции в регуляции режима сна у крыс» . ПЛОС ОДИН . 2 (6): е513. Бибкод : 2007PLoSO...2..513L . дои : 10.1371/journal.pone.0000513 . ПМЦ 1876809 . ПМИД 17551593 .

- ^ Дзираса К., Рибейро С., Коста Р., Сантос Л.М., Лин С.К., Гросмарк А., Сотникова Т.Д., Гайнетдинов Р.Р., Карон М.Г., Николелис М.А. (октябрь 2006 г.). «Дофаминергический контроль состояний сна-бодрствования» . Журнал неврологии . 26 (41): 10577–89. doi : 10.1523/JNEUROSCI.1767-06.2006 . ПМК 6674686 . ПМИД 17035544 .
- ^ Беджани, Булос-Поль; Дамье, Филипп; Арнульф, Изабель; Тивард, Лайонел; Бонне, Анн-Мари; Дормон, Дидье; Корню, Филипп; Пиду, Бернар; Самсон, Ив; Агид, Ив (13 мая 1999 г.). «Транзиторная острая депрессия, вызванная высокочастотной стимуляцией глубокого мозга» . Медицинский журнал Новой Англии . 340 (19): 1476–1480. дои : 10.1056/NEJM199905133401905 . ISSN 0028-4793 . ПМИД 10320386 .
- ^ Янкович Дж. (апрель 2008 г.). «Болезнь Паркинсона: клиника и диагностика» . Журнал неврологии, нейрохирургии и психиатрии . 79 (4): 368–76. дои : 10.1136/jnnp.2007.131045 . ПМИД 18344392 .
- ^ Адлер Ч. (2005). «Немоторные осложнения при болезни Паркинсона». Двигательные расстройства . 20 (Приложение 11): S23-9. дои : 10.1002/mds.20460 . ПМИД 15822106 . S2CID 19045599 .
- ^ Доусон Т.М. , Доусон В.Л. (октябрь 2003 г.). «Молекулярные пути нейродегенерации при болезни Паркинсона». Наука . 302 (5646): 819–22. Бибкод : 2003Sci...302..819D . дои : 10.1126/science.1087753 . ПМИД 14593166 . S2CID 35486083 .
- ^ Лян CL, Синтон CM, Sonsalla PK, немецкий округ Колумбия (декабрь 1996 г.). «Дофаминергические нейроны среднего мозга у мышей, содержащие кальбиндин-D28k, демонстрируют пониженную уязвимость к нейродегенерации, индуцированной MPTP». Нейродегенерация . 5 (4): 313–8. дои : 10.1006/neur.1996.0042 . ПМИД 9117542 .
- ^ Грош Дж., Винклер Дж., Коль З. (2016). «Ранняя дегенерация как дофаминергических, так и серотонинергических аксонов – общий механизм болезни Паркинсона» . Передний. Клетка. Нейроски . 10 : 293. дои : 10.3389/fncel.2016.00293 . ПМК 5177648 . ПМИД 28066188 .
- ^ Интервью. Йоланд Смит, доктор философии [ нужна проверка ]
- ^ Менке Р.А., Джбабди С., Миллер К.Л., Мэтьюз П.М., Зарей М. (октябрь 2010 г.). «Сегментация черной субстанции на основе связности у человека и ее последствия при болезни Паркинсона». НейроИмидж . 52 (4): 1175–80. doi : 10.1016/j.neuroimage.2010.05.086 . ПМИД 20677376 . S2CID 19871414 .
- ^ Трист Б.Г., Заяц DJ, Double KL. Окислительный стресс при старении черной субстанции и этиология болезни Паркинсона. Стареющая клетка. 2019 декабрь;18(6):e13031. дои: 10.1111/acel.13031. Epub, 20 августа 2019 г. Обзор. ПМИД 31432604
- ^ Перейти обратно: а б Шазер А.Дж., Остерберг В.Р., Дент С.Э., Стэкхаус Т.Л., Уэйкхэм СМ, Бутрос С.В., Уэстон Л.Дж., Оуэн Н., Вайсман Т.А., Луна Е, Рабер Дж., Люк К.С., Маккалоу А.К., Вольтьер Р.Л., Унни В.К. Альфа-синуклеин представляет собой ДНК-связывающий белок, который модулирует восстановление ДНК, что приводит к нарушениям с тельцами Леви. Sci Rep. 29 июля 2019 г.; 9 (1): 10919. doi: 10.1038/s41598-019-47227-z. PMID 31358782
- ^ ван Россум Дж (1967). «Значение блокады дофаминовых рецепторов для действия нейролептиков». В Брилл Х., Коул Дж., Деникер П., Хиппиус Х., Брэдли П.Б. (ред.). Нейропсихофармакология, Труды Пятой международной коллегии Neuropsychopharmacologicum . стр. 321–9. OCLC 458719 .
- ^ Коломеец Н.С., Уранова Н.А. (1999). «Синаптические контакты при шизофрении: исследования с использованием иммуноцитохимической идентификации дофаминергических нейронов». Неврология и поведенческая физиология . 29 (2): 217–21. дои : 10.1007/BF02465329 . ПМИД 10432512 . S2CID 2233617 .
- ^ Кумамото Н., Мацудзаки С., Иноуэ К., Хаттори Т., Симидзу С., Хасимото Р., Яматодани А., Катаяма Т., Тохьяма М. (июнь 2006 г.). «Гиперактивация дофаминергической системы среднего мозга при шизофрении может быть связана со снижением регуляции дисбиндина». Связь с биохимическими и биофизическими исследованиями . 345 (2): 904–9. дои : 10.1016/j.bbrc.2006.04.163 . ПМИД 16701550 .
- ^ Сибата Э., Сасаки М., Тохьяма К., Оцука К., Эндо Дж., Тераяма Ю., Сакаи А. (сентябрь 2008 г.). «Использование нейромеланин-чувствительной МРТ для различения пациентов с шизофренией и депрессией и здоровых людей на основе изменений сигналов в черной субстанции и голубом пятне». Биологическая психиатрия . 64 (5): 401–6. doi : 10.1016/j.biopsych.2008.03.021 . ПМИД 18452894 . S2CID 25752976 .
- ^ Перейти обратно: а б с д и Миллер GM (январь 2011 г.). «Новая роль рецептора 1, связанного с следами аминов, в функциональной регуляции переносчиков моноаминов и дофаминергической активности» . Журнал нейрохимии . 116 (2): 164–76. дои : 10.1111/j.1471-4159.2010.07109.x . ПМК 3005101 . ПМИД 21073468 .
- ^ «Амфетамин» . Наркобанк . Университет Альберты. 8 февраля 2013 года . Проверено 13 октября 2013 г.
- ^ Перейти обратно: а б с Эйден Л.Е., Вэйхэ Э. (январь 2011 г.). «VMAT2: динамический регулятор функции моноаминергических нейронов мозга, взаимодействующий с наркотиками» . Анналы Нью-Йоркской академии наук . 1216 (1): 86–98. Бибкод : 2011NYASA1216...86E . дои : 10.1111/j.1749-6632.2010.05906.x . ПМЦ 4183197 . ПМИД 21272013 .
- ^ Магуайр Дж.Дж., Паркер В.А., Фурд С.М., Боннер Т.И., Нойбиг Р.Р., Давенпорт А.П. (март 2009 г.). «Международный союз фармакологии. LXXII. Рекомендации по номенклатуре следовых аминных рецепторов» . Фармакологические обзоры . 61 (1): 1–8. дои : 10.1124/пр.109.001107 . ПМК 2830119 . ПМИД 19325074 .
- ^ Хейккила Р.Э., Каббат Ф.С., Дювуазен Р.К. (1979). «Двигательная активность и вращательное поведение после аналогов кокаина: корреляция с блокадой захвата дофамина». Коммуникации в психофармакологии . 3 (5): 285–90. ПМИД 575770 .
- ^ Лакоски Дж. М., член парламента Галлоуэя, Уайт FJ (1991). Кокаин . Телфорд Пресс. ISBN 978-0-8493-8813-2 .
- ^ Лейси М.Г., Mercuri NB, Северная Армения (апрель 1990 г.). «Действие кокаина на дофаминергические нейроны крысы in vitro» . Британский журнал фармакологии . 99 (4): 731–5. дои : 10.1111/j.1476-5381.1990.tb12998.x . ЧВК 1917549 . ПМИД 2361170 .
- ^ Перейти обратно: а б Ся Ю, Goebel DJ, Капатос Дж, Бэннон MJ (сентябрь 1992 г.). «Количественное определение мРНК крысиного переносчика дофамина: эффекты лечения кокаином и абстиненции». Журнал нейрохимии . 59 (3): 1179–82. дои : 10.1111/j.1471-4159.1992.tb08365.x . ПМИД 1494906 . S2CID 34068876 .
- ^ См. RE, Эллиот Дж.К., Фельтенштейн М.В. (октябрь 2007 г.). «Роль дорсальных и вентральных путей полосатого тела в поведении, связанном с поиском кокаина, после длительного воздержания у крыс». Психофармакология . 194 (3): 321–31. дои : 10.1007/s00213-007-0850-8 . ПМИД 17589830 . S2CID 12652533 .
- ^ Ченг Н., Маэда Т., Куме Т., Канеко С., Кочияма Х., Акаике А., Гошима Ю., Мису Ю. (декабрь 1996 г.). «Дифференциальная нейротоксичность, индуцированная L-ДОФА и дофамином в культивируемых нейронах полосатого тела». Исследования мозга . 743 (1–2): 278–83. дои : 10.1016/S0006-8993(96)01056-6 . ПМИД 9017256 . S2CID 22529926 .
- ^ Раскол О., Пайу П., Ори Ф., Феррейра Дж.Дж., Брефель-Курбон С., Монтаструк Дж.Л. (2003). «Ограничения современной терапии болезни Паркинсона». Анналы неврологии . 53 (Приложение 3): С3–12, обсуждение С12–5. дои : 10.1002/ана.10513 . ПМИД 12666094 . S2CID 45078589 .
- ^ Лэнгстон Дж.В., Баллард П., Тетруд Дж.В., Ирвин I (февраль 1983 г.). «Хронический паркинсонизм у человека, вызванный продуктом синтеза аналога меперидина». Наука . 219 (4587): 979–80. Бибкод : 1983Sci...219..979L . дои : 10.1126/science.6823561 . ПМИД 6823561 . S2CID 31966839 .
- ^ Перейти обратно: а б Шмидт Н., Фергер Б. (2001). «Нейрохимические данные в модели MPTP болезни Паркинсона». Журнал нейронной передачи . 108 (11): 1263–82. дои : 10.1007/s007020100004 . ПМИД 11768626 . S2CID 2834254 .
- ^ Лэнгстон Дж.В., Форно Л.С., Реберт К.С., Ирвин I (февраль 1984 г.). «Селективная ниграловая токсичность после системного введения 1-метил-4-фенил-1,2,5,6-тетрагидропирина (МФТП) беличьим обезьянам». Исследования мозга . 292 (2): 390–4. дои : 10.1016/0006-8993(84)90777-7 . ПМИД 6607092 . S2CID 34183578 .
- ^ Бланше П.Дж., Калон Ф., Мориссетт М., Хадж Тахар А., Беланжер Н., Самади П., Гронден Р., Грегори Л., Мельцер Л., Ди Паоло Т., Бедард П.Дж. (июль 2004 г.). «Значение модели приматов MPTP для изучения механизмов прайминга дискинезии». Паркинсонизм и связанные с ним расстройства . 10 (5): 297–304. дои : 10.1016/j.parkredis.2004.02.011 . ПМИД 15196509 .
- ^ Таббс Р.С., Лукас М., Шоя М.М., Мортазави М.М., Коэн-Гадол А.А. (июль 2011 г.). «Феликс Вик д'Азир (1746-1794): один из основателей нейроанатомии и королевский французский врач» . Нервная система ребенка . 27 (7): 1031–4. дои : 10.1007/s00381-011-1424-y . ПМИД 21445631 .
- ^ Суонсон Л.В. (2014). Нейроанатомическая терминология: лексикон классического происхождения и исторических основ . Англия: Издательство Оксфордского университета. ISBN 9780195340624 .
- ^ Сано Т (1910). «Вклад в сравнительную анатомию черной субстанции, тела Луисии и неясной зоны» . МСЧР Психиат Нейрол . 28 (1): 26–34. doi : 10.1159/000209678 (неактивен 22 июня 2024 г.).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на июнь 2024 г. ( ссылка ) - ^ Горникевич, О. (2006). «Открытие дефицита дофамина в мозге, страдающем паркинсонизмом». В Ридерере, П.; Райхманн, Х.; Юдим, МБХ; Герлах, М. (ред.). Болезнь Паркинсона и связанные с ней расстройства . Спрингер Вена. стр. 9–15. дои : 10.1007/978-3-211-45295-0_3 . ISBN 978-3-211-28927-3 . ПМИД 17017502 .
{{cite book}}:|journal=игнорируется ( помогите )