Нитрат меди(II)

| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
Нитрат меди(II)
| |||
| Другие имена
Нитрат меди
| |||
| Идентификаторы | |||
| |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.019.853 | ||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ |
| ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| Cu(NO 3 ) 2 | |||
| Молярная масса | 187,5558 г/моль (безводный) 241,60 г/моль (тригидрат) 232,591 г/моль (гемипентагидрат) | ||
| Появление | синие кристаллы гигроскопичен | ||
| Плотность | 3,05 г/см 3 (безводный) 2,32 г/см 3 (тригидрат) 2,07 г/см 3 (гексагидрат) | ||
| Температура плавления | 114 ° C (237 ° F, 387 К) (безводный, разлагается) 114,5 ° C (тригидрат) 26,4 °C (гексагидрат, разлагается) | ||
| Точка кипения | 170 ° C (338 ° F, 443 К) (тригидрат, разлагается) | ||
| тригидрат: [3] 381 г/100 мл (40 °С) 666 г/100 мл (80 °С) гексагидрат: [3] 243,7 г/100 мл (80 °С) | |||
| Растворимость | гидраты, хорошо растворимые в этаноле , аммиаке , воде ; нерастворим в этилацетате | ||
| +1570.0·10 −6 см 3 /mol (~3H 2 O) | |||
| Структура | |||
| орторомбический (безводный) ромбоэдрические (гидраты) | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
Раздражающее вещество, Окислитель | ||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
ПЭЛ (допустимо)
|
СВВ 1 мг/м 3 (туз С) [4] | ||
РЕЛ (рекомендуется)
|
СВВ 1 мг/м 3 (туз С) [4] | ||
IDLH (Непосредственная опасность)
|
СВВ 100 мг/м 3 (туз С) [4] | ||
| Паспорт безопасности (SDS) | Cu(NO 3 ) 2 3H 2 O | ||
| Родственные соединения | |||
Другие анионы
|
Сульфат меди(II) Хлорид меди(II) | ||
Другие катионы
|
Нитрат серебра Нитрат золота(III) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Нитрат меди(II) описывает любого члена семейства неорганических соединений с формулой Cu ( NO 3 ) 2 (H 2 O) x . Гидраты представляют собой твердые вещества синего цвета . Безводный нитрат меди образует сине-зеленые кристаллы и сублимируется в вакууме при температуре 150-200°С. [5] [6] Обычными гидратами являются гемипентагидрат и тригидрат.
Синтез и реакции
[ редактировать ]Гидратированный нитрат меди(II)
[ редактировать ]Гидратированный нитрат меди получают обработкой металлической меди или ее оксида азотной кислотой : [7]
- Cu + 4 HNO 3 → Cu(NO 3 ) 2 + 2 H 2 O + 2 NO 2
Те же соли можно получить обработкой металлической меди водным раствором нитрата серебра . Эта реакция иллюстрирует способность металлической меди восстанавливать ионы серебра.
В водном растворе гидраты существуют в виде аквакомплекса. [Си(Н 2 О) 6 ] 2+ . Такие комплексы весьма лабильны и подвержены быстрому лигандному обмену за счет d 9 электронная конфигурация меди(II).
Попытка дегидратации любого из гидратированных нитратов меди(II) при нагревании приводит к образованию оксидов, а не оксидов. Cu(NO 3 ) 2 . [6] При 80 ° C гидраты превращаются в «основной нитрат меди». Cu 2 (NO 3 )(OH) 3 , который превращается в CuO при 180 °C. [7] Используя эту реакционную способность, нитрат меди можно использовать для получения азотной кислоты , нагревая ее до разложения и пропуская пары непосредственно в воду. Этот метод аналогичен последнему этапу процесса Оствальда . Уравнения следующие:
- 2 Cu(NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2
- 3 NO 2 + H 2 O → 2 HNO 3 + NO
Обработка растворов нитрата меди(II) трифенилфосфином , трифениларсином и трифенилстибином приводит к образованию соответствующих комплексов меди(I). [Cu(EPh 3 ) 3 ]NO 3 (E = P, As, Sb; Ph = С 6 Н 5 ). Лиганд группы V окисляется до оксида. [8]
Безводный нитрат меди(II)
[ редактировать ]Безводный Cu(NO 3 ) 2 — один из немногих безводных нитратов переходных металлов. [9] Его нельзя получить реакциями, содержащими или производящими воду. Вместо этого безводный Cu(NO 3 ) 2 образуется при обработке металлической меди четырехокисью азота : [6]
- Cu + 2 N 2 O 4 → Cu(NO 3 ) 2 + 2 NO
Структура
[ редактировать ]Безводный нитрат меди(II)
[ редактировать ]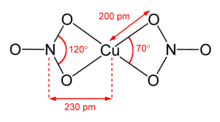
две полиморфные модификации безводного нитрата меди(II) — α и β. Известны [6] Оба полиморфа представляют собой трехмерные координационные полимерные сетки с бесконечными цепочками центров меди(II) и нитратных групп. Альфа-форма имеет только одно медное окружение с координацией [4+1], [1] но β-форма имеет два разных медных центра: один с [4+1] и другой плоский квадрат. [2]
Сольват нитрометана также имеет «координацию [4+1]» с четырьмя короткими связями Cu-O примерно в 200 часов и одной более длинной связью в 240 часов. [10]
Нагревание твердого безводного нитрата меди(II) в вакууме до 150-200 °С приводит к сублимации и « крекингу » с образованием паров мономерных молекул нитрата меди(II). [6] [11] В паровой фазе молекула содержит два бидентатных нитратных лиганда. [12]
Гидратированный нитрат меди(II)
[ редактировать ]пяти гидратах : моногидрат ( Сообщалось о Cu(NO 3 ) 2 2H 2 O ), [2] полуторный гидрат ( Cu(NO 3 ) 2 1,5H 2 O ), [13] гемипентагидрат ( Cu(NO 3 ) 2 2,5H 2 O ), [14] тригидрат ( Cu(NO 3 ) 2 3H 2 O ), [15] и гексагидрат ( [Cu(OH 2 ) 6 ](NO 3 ) 2 . [16] Кристаллическая структура гексагидрата, по-видимому, демонстрирует шесть почти равных расстояний Cu–O, не обнаруживая обычного эффекта ян-теллеровского искажения , который в остальном характерен для октаэдрических комплексов Cu(II). Это отсутствие эффекта было объяснено сильной водородной связью , которая ограничивает эластичность связей Cu-O, но, вероятно, это связано с тем, что никель был ошибочно идентифицирован как медь при очистке.
Приложения
[ редактировать ]Нитрат меди(II) находит множество применений, главным из которых является его преобразование в оксид меди(II) , который используется в качестве катализатора для различных процессов в органической химии . Его растворы используются в текстиле и в средствах для полировки других металлов. Нитраты меди встречаются в некоторой пиротехнике . [7] Его часто используют в школьных лабораториях для демонстрации химических реакций с гальваническими элементами . Это компонент некоторых керамических глазурей и металлических патин.
Органический синтез
[ редактировать ]Нитрат меди в сочетании с уксусным ангидридом является эффективным реагентом для нитрования ароматических соединений, известного как нитрование Менке . [17] Гидратированный нитрат меди, адсорбированный на глине, дает реагент под названием «Claycop». Полученную глину синего цвета используют в виде суспензии, например, для окисления тиолов до дисульфидов . Claycop также используется для преобразования дитиоацеталей в карбонилы. [18] Родственный реагент на основе монтмориллонита оказался полезным для нитрования ароматических соединений. [19]
Электродобыча
[ редактировать ]Нитрат меди(II) также можно использовать для электровыделения меди в небольших масштабах с аммиаком (NH 3 ) в качестве побочного продукта. [20]
Нитраты меди природного происхождения
[ редактировать ]Нет минерала идеального Формула Cu(NO 3 ) или гидраты известны. Ликасите, Cu 3 (NO 3 )(OH) 5 ·2H 2 O и бутгенбахит, Cu 19 (NO 3 ) 2 (OH) 32 Cl 4 ·2H 2 O – родственные минералы. [21] [22]
Природные основные нитраты меди включают редкие минералы герхардтит и руаит, которые являются полиморфными модификациями Cu 2 (NO 3 )(OH) 3 . [23] [24] [25] Гораздо более сложная, основная, гидратированная и хлоридсодержащая природная соль — это бутгенбахит. [22] [25]
Ссылки
[ редактировать ]- ^ Jump up to: а б Уоллворк, СК; Аддисон, МЫ (1965). «526. Кристаллические структуры безводных нитратов и их комплексов. Часть I. α-форма нитрата меди(II)». Дж. Хим. Соц . 1965 : 2925–2933. дои : 10.1039/JR9650002925 .
- ^ Jump up to: а б с Троянов С.И.; Морозов, ИВ; Знаменков, КО; Ю; Коренев, М. (1995). «Синтез и рентгенологическая структура новых нитратов меди(II): Cu(NO 3 ) 2 ·H 2 O и β-модификация Cu(NO 3 ) 2 ». З. Анорг. Аллг. Хим . 621 (7): 1261–1265. дои : 10.1002/zaac.19956210727 .
- ^ Jump up to: а б Справочник Перриса по химии, 7-е изд.
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0150» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Пасс и Сатклифф (1968). Практическая неорганическая химия . Лондон: Чепмен и Холл.
- ^ Jump up to: а б с д и ж Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 1190. ИСБН 978-0-08-037941-8 .
- ^ Jump up to: а б с Х. Уэйн Ричардсон «Соединения меди» Энциклопедия промышленной химии Ульмана, 2005, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a07_567 .
- ^ Гайслинг, Генри Дж. (1979). «Координационные комплексы нитрата меди(I)». Неорганические синтезы . Неорганические синтезы. Том. 19. С. 92–97. дои : 10.1002/9780470132500.ch19 . ISBN 9780470132500 .
- ^ Аддисон, CC; Логан, Н.; Уоллворк, СК; Гарнер, компакт-диск (1971). «Структурные аспекты координированных нитратных групп». Ежеквартальные обзоры, Химическое общество . 25 (2): 289. doi : 10.1039/qr9712500289 .
- ^ Даффин, Б.; Уоллворк, Южная Каролина (1966). «Кристаллическая структура безводных нитратов и их комплексов. II. Комплекс нитрат-нитрометан меди (II) 1: 1». Акта Кристаллографика . 20 (2): 210–213. дои : 10.1107/S0365110X66000434 .
- ^ Аддисон, CC; Хэтэуэй, Би Джей (1958). «628. Давление пара безводной нитрата меди и его молекулярная масса в парообразном состоянии». Дж. Хим. Соц. : 3099–3106. дои : 10.1039/JR9580003099 .
- ^ ЛаВилла, RE; Бауэр, С.Х. (1963). «Структура газообразного нитрата меди (II), определенная методом дифракции электронов». Дж. Ам. хим. Соц . 85 (22): 3597–3600. дои : 10.1021/ja00905a015 .
- ^ Дорнбергер-Шифф, К.; Лециевич, Дж. (1958). «О строении нитрата меди Cu(NO 3 ) 2 . 1,5H 2 O". Acta Crystallogr . 11 (11): 825–826. doi : 10.1107/S0365110X58002322 .
- ^ Моросин, Б. (1970). «Кристаллическая структура Cu(NO 3 ) 2 .2,5H 2 O». Акта Кристаллогр . Б26 (9): 1203–1208. дои : 10.1107/S0567740870003898 .
- ^ J. Garaj, Sbornik Prac. Chem.-Technol. Fak. Svst., Cskosl. 1966, pp. 35–39.
- ^ Зибасерешт, Р.; Хартшорн, РМ (2006). «Динитрат гексааквамеди (II): отсутствие ян-теллеровских искажений». Акта Кристаллогр. Э. 62 : i19–i22. дои : 10.1107/S1600536805041851 .
- ^ Менке Дж.Б. (1925). «Нитрование нитратами». Коллекция химических предприятий Нидерландов . 44 :141 дои : 10.1002/recl.19250440209 .
- ^ Балог, М. «Нитрат меди (II) – бентонитовая глина K10» в Энциклопедии реагентов для органического синтеза (под ред.: Л. Пакетт), 2004 г., J. Wiley & Sons, Нью-Йорк. дои : 10.1002/047084289X .
- ^ Колле, Кристина (1990). «Глины прямого ароматического нитрования». Angewandte Chemie International Edition на английском языке . 29 (5): 535–536. дои : 10.1002/anie.199005351 .
- ^ Оиси, Тецуо; Кояма, Казуя; Кониси, Хирокадзу; Танака, Мика; Ли, Джэ-Чун (ноябрь 2007 г.). «Влияние соли аммония на электровыделение меди из аммиачно-щелочных растворов» . Электрохимический акт . 53 (1): 127–132. дои : 10.1016/j.electacta.2007.06.024 .
- ^ «Ликасите» . www.mindat.org .
- ^ Jump up to: а б «Бутгенбахит» . www.mindat.org .
- ^ «Герхардтит» . www.mindat.org .
- ^ «Руайте» . www.mindat.org .
- ^ Jump up to: а б Международная минералогическая ассоциация (21 марта 2011 г.). «Список минералов» . www.ima-mineralogy.org .


