Жировая ткань
| Жировая ткань | |
|---|---|
 Свиной брюшной жир (белый) | |
 Жировая ткань — один из основных видов соединительной ткани . | |
| Произношение | / ˈ æ d ɪ ˌ p oʊ s / |
| Идентификаторы | |
| МеШ | D000273 |
| ФМА | 20110 |
| Анатомическая терминология | |
Жировая ткань (также известная как жировые отложения или просто жир ) представляет собой рыхлую соединительную ткань, состоящую в основном из адипоцитов . [1] [2] Он также содержит стромально-сосудистую фракцию ( СВФ ) клеток, включая преадипоциты , фибробласты , сосудистые эндотелиальные клетки и различные иммунные клетки, такие как макрофаги жировой ткани . Его основная роль — хранить энергию в виде липидов , хотя он также смягчает и изолирует тело.
Жировая ткань, которую раньше считали гормонально инертной, в последние годы признана важным эндокринным органом. [3] поскольку он вырабатывает такие гормоны, как лептин , эстроген , резистин и цитокины (особенно TNFα ). [2] При ожирении жировая ткань участвует в хроническом высвобождении провоспалительных маркеров, известных как адипокины , которые ответственны за развитие метаболического синдрома — совокупности заболеваний, включая диабет 2 типа , сердечно-сосудистые заболевания и атеросклероз . [2] [4]
Жировая ткань происходит из преадипоцитов, и ее образование, по-видимому, частично контролируется жировым геном . Два типа жировой ткани — это белая жировая ткань (БЖТ), которая сохраняет энергию, и бурая жировая ткань (БЖТ), которая генерирует тепло тела. Жировая ткань, точнее бурая жировая ткань, была впервые обнаружена швейцарским натуралистом Конрадом Гесснером в 1551 году. [5]
Анатомические особенности
[ редактировать ]
У человека жировая ткань расположена: под кожей ( подкожный жир ), вокруг внутренних органов ( висцеральный жир ), в костном мозге ( желтый костный мозг ), межмышечной ( мышечная система ) и в молочной железе ( ткань молочной железы ). Жировая ткань находится в определенных местах, которые называются жировыми депо . Помимо адипоцитов, которые составляют самый высокий процент клеток в жировой ткани, присутствуют и другие типы клеток, которые в совокупности называются стромально-васкулярной фракцией (СВФ) клеток. СВФ включает преадипоциты , фибробласты жировой ткани , макрофаги и эндотелиальные клетки .
Жировая ткань содержит множество мелких кровеносных сосудов . В покровной системе , к которой относится и кожа, он накапливается на самом глубоком уровне, в подкожном слое, обеспечивая изоляцию от жары и холода. Вокруг органов он обеспечивает защитную прокладку. Однако его основная функция — быть резервом липидов, которые могут окисляться для удовлетворения энергетических потребностей организма и защиты его от избытка глюкозы путем хранения триглицеридов, вырабатываемых печенью из сахаров, хотя некоторые данные свидетельствуют о том, что большая часть синтеза липидов из углеводов происходит в самой жировой ткани. [6] Жировые депо в разных частях тела имеют разные биохимические профили. В нормальных условиях он обеспечивает обратную связь с мозгом о голоде и диете.
Мыши
[ редактировать ]
У мышей есть восемь основных жировых депо, четыре из которых находятся в брюшной полости . [1] Парные депо гонад прикрепляются к матке и яичникам у женщин и к придаткам яичек и семенникам у мужчин; парные забрюшинные депо располагаются вдоль дорсальной стенки живота , окружая почку, и в случае массивности распространяются в таз. Брыжеечное депо образует клееподобную паутину, которая поддерживает кишечник и сальниковое депо (начинающееся возле желудка и селезенки ) и - когда оно массивное - распространяется на вентральную часть живота. И брыжеечные, и сальниковые депо включают большое количество лимфоидной ткани в виде лимфатических узлов и молочных пятен соответственно.
Двумя поверхностными депо являются парные паховые депо, которые находятся впереди верхнего сегмента задних конечностей (под кожей), и подлопаточные депо, парные медиальные смеси бурой жировой ткани, прилегающие к областям белой жировой ткани, которые обнаруживаются под кожей между тыльными гребнями лопаток. Слой бурой жировой ткани в этом депо часто покрыт «глазурью» белой жировой ткани; иногда эти два типа жира (бурый и белый) трудно различить. Паховые депо окружают паховую группу лимфатических узлов. Второстепенные депо включают перикард , который окружает сердце, и парные подколенные депо, между основными мышцами позади коленей, каждый из которых содержит один большой лимфатический узел . [7] Из всех депо у мышей гонадные депо являются самыми большими и наиболее легко рассекаемыми. [8] Содержит около 30% расслаиваемого жира. [9]
Ожирение
[ редактировать ]У человека с ожирением избыток жировой ткани, свисающий вниз от живота, называется панникулюсом . Панникулюс осложняет хирургическое вмешательство у людей с морбидным ожирением. Он может оставаться буквально «кожным фартуком», если человек с тяжелым ожирением теряет большое количество жира (частый результат операции по шунтированию желудка ). Ожирение лечится с помощью физических упражнений, диеты и поведенческой терапии. Реконструктивная хирургия является одним из аспектов лечения. [10]
Висцеральный жир
[ редактировать ]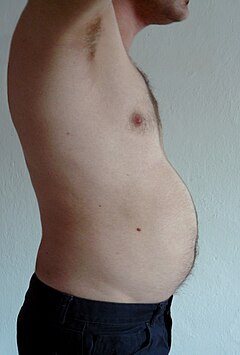
Висцеральный жир или брюшной жир [11] (также известный как органный жир или внутрибрюшной жир) расположен внутри брюшной полости , упакован между органами (желудком, печенью, кишечником, почками и т. д.). Висцеральный жир отличается от подкожного жира под кожей и внутримышечного жира, рассеянного в скелетных мышцах . Жир в нижней части тела, как на бедрах и ягодицах, находится подкожно и не представляет собой равномерно распределенную ткань, тогда как жир в области живота в основном висцеральный и полужидкий. [12] Висцеральный жир состоит из нескольких жировых отложений, в том числе мезентериальных , придаточных отложений белой жировой ткани (EWAT) и околопочечных отложений. Висцеральный жир часто выражают по его площади в см. 2 (VFA, область висцерального жира). [13]
Избыток висцерального жира известен как абдоминальное ожирение , или «животный жир», при котором живот чрезмерно выпячивается. Новые разработки, такие как индекс объема тела (BVI), специально разработаны для измерения объема брюшной полости и количества брюшного жира. Избыток висцерального жира также связан с диабетом 2 типа . [14] инсулинорезистентность , [15] воспалительные заболевания , [16] и другие заболевания, связанные с ожирением. [17] Аналогичным образом было показано, что накопление жира на шее (или шейной жировой ткани) связано со смертностью. [18] Несколько исследований показали, что количество висцерального жира можно предсказать на основе простых антропометрических показателей. [19] и предсказывает смертность более точно, чем индекс массы тела или окружность талии. [20]
У мужчин чаще жир накапливается в области живота из-за различий в половых гормонах . Эстроген (женский половой гормон) вызывает отложение жира в ягодицах, бедрах и бедрах у женщин. [21] [22] Когда женщины достигают менопаузы и уровень эстрогена, вырабатываемого яичниками, снижается, жир мигрирует с ягодиц, бедер и бедер на талию; [23] позже жир откладывается в области живота. [12]
Висцеральный жир может быть вызван избытком кортизола . [24] По крайней мере 10 МЕТ -часов в неделю аэробных упражнений приводят к уменьшению висцерального жира у людей без метаболических нарушений. [25] Тренировки с отягощениями и ограничение калорий также уменьшают количество висцерального жира, хотя их эффект может не быть кумулятивным. [26] И физические упражнения, и гипокалорийная диета вызывают потерю висцерального жира, но упражнения оказывают большее влияние на висцеральный жир, чем на общий жир. [27] Высокоинтенсивные упражнения — один из способов эффективного уменьшения общего количества жира в брюшной полости. [28] [29] Диета с ограничением энергии в сочетании с физическими упражнениями приведет к снижению общего количества жира в организме и соотношения висцеральной жировой ткани к подкожной жировой ткани, что предполагает предпочтительную мобилизацию висцерального жира по сравнению с подкожным жиром. [30]
Эпикардиальный жир
[ редактировать ]Эпикардиальная жировая ткань (ЭЖТ) представляет собой особую форму висцерального жира, отложившегося вокруг сердца и являющегося метаболически активным органом, генерирующим различные биоактивные молекулы, которые могут существенно влиять на сердечную функцию. [31] [32] [33] Заметные различия компонентов наблюдались при сравнении ЭЖТ с подкожным жиром , что позволяет предположить влияние локализованных жирных кислот на функцию и метаболизм адипоцитов. [34]
Подкожный жир
[ редактировать ]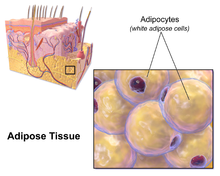
Большая часть оставшегося невисцерального жира находится чуть ниже кожи в области, называемой гиподермой . [35] Этот подкожный жир не связан со многими классическими патологиями, связанными с ожирением, такими как болезни сердца , рак и инсульт , и некоторые данные даже предполагают, что он может иметь защитную функцию. [36] Типично женский (или гинекоидный) тип распределения жира в организме вокруг бедер, бедер и ягодиц представляет собой подкожный жир и, следовательно, представляет меньший риск для здоровья по сравнению с висцеральным жиром. [37] [38]
Как и все другие жировые органы, подкожно-жировая клетчатка является активной частью эндокринной системы, секретирующей гормоны лептин и резистин . [35]
Взаимосвязь между подкожным жировым слоем и общим количеством жира в организме человека часто моделируется с помощью уравнений регрессии. Самое популярное из этих уравнений было составлено Дарнином и Уормерсли, которые тщательно протестировали многие типы кожных складок и в результате создали две формулы для расчета плотности тела как мужчин, так и женщин. Эти уравнения представляют обратную корреляцию между кожными складками и плотностью тела: по мере увеличения суммы кожных складок плотность тела уменьшается. [39]
Такие факторы, как пол, возраст, численность населения или другие переменные, могут сделать уравнения недействительными и непригодными для использования, и по состоянию на 2012 г. [update]Уравнения Дарнина и Уормерсли остаются лишь оценкой истинного уровня ожирения человека. Новые формулы все еще создаются. [39]
Костный жир
[ редактировать ]Костный жир, также известный как костномозговая жировая ткань (ЖТ), представляет собой плохо изученное жировое депо, которое находится в кости и перемежается кроветворными клетками, а также костными элементами. Адипоциты в этом депо происходят из мезенхимальных стволовых клеток (МСК), которые могут давать начало жировым клеткам, костным клеткам, а также другим типам клеток. Тот факт, что МАТ увеличивается в условиях ограничения калорий/анорексии, является особенностью, отличающей это депо от других жировых депо. [40] [41] [42] Физические упражнения регулируют МАТ, уменьшая количество МАТ и уменьшая размер адипоцитов костного мозга. [43] [44] [45] Регуляция содержания жира в костном мозге с помощью упражнений позволяет предположить, что он имеет некоторое физиологическое сходство с другими отложениями белой жировой ткани. Более того, увеличение MAT при ожирении также предполагает сходство с отложениями белого жира. [43]
Эктопический жир
[ редактировать ]Эктопический жир — это накопление триглицеридов в тканях, отличных от жировой ткани, которые, как предполагается, содержат лишь небольшое количество жира, таких как печень , скелетные мышцы , сердце и поджелудочная железа . [1] Это может влиять на клеточные функции и, следовательно, на функции органов и связано с резистентностью к инсулину при диабете 2 типа. [46] Он хранится в относительно больших количествах вокруг органов брюшной полости , но его не следует путать с висцеральным жиром.
Конкретная причина накопления внематочного жира неизвестна. Причиной, вероятно, является сочетание генетических, экологических и поведенческих факторов, которые связаны с избыточным потреблением энергии и снижением физической активности. Существенная потеря веса может уменьшить запасы эктопического жира во всех органах, что связано с улучшением функции этих органов. [46]
В последнем случае неинвазивные меры по снижению веса, такие как диета или физические упражнения, могут уменьшить количество эктопического жира (особенно в сердце и печени) у детей и взрослых с избыточным весом или ожирением. [47] [48]
Физиология
[ редактировать ]Свободные жирные кислоты (СЖК) высвобождаются из липопротеинов под действием липопротеинлипазы (ЛПЛ) и попадают в адипоциты, где снова собираются в триглицериды путем этерификации их на глицерине . [2] Жировая ткань человека содержит около 87% липидов . [49]
Существует постоянный поток СЖК, поступающих и покидающих жировую ткань. [2] Чистое направление этого потока контролируется инсулином и лептином: если уровень инсулина повышен, возникает чистый приток СЖК внутрь, и только при низком уровне инсулина СЖК могут покинуть жировую ткань. Секреция инсулина стимулируется высоким уровнем сахара в крови, возникающим в результате потребления углеводов. [50]
У людей липолиз (гидролиз триглицеридов до свободных жирных кислот) контролируется посредством сбалансированного контроля липолитических B-адренергических рецепторов и антилиполиза, опосредованного a2A-адренергическими рецепторами.
Жировые клетки играют важную физиологическую роль в поддержании уровня триглицеридов и свободных жирных кислот, а также в определении резистентности к инсулину . [2] Брюшной жир имеет другой метаболический профиль — он более склонен вызывать резистентность к инсулину. Это в значительной степени объясняет, почему центральное ожирение является маркером нарушения толерантности к глюкозе и независимым фактором риска сердечно-сосудистых заболеваний (даже при отсутствии сахарного диабета и гипертонии ). [51] Исследования самок обезьян в Университете Уэйк Форест (2009) обнаружили, что люди, испытывающие более высокий стресс, имеют более высокий уровень висцерального жира в организме. Это предполагает возможную причинно-следственную связь между ними: стресс способствует накоплению висцерального жира, что, в свою очередь, вызывает гормональные и метаболические изменения, которые способствуют болезням сердца и другим проблемам со здоровьем. [52]
Последние достижения в области биотехнологии позволили получать взрослые стволовые клетки из жировой ткани, что позволяет стимулировать возобновление роста тканей с использованием собственных клеток пациента. Кроме того, как сообщается, стволовые клетки, полученные из жировой ткани, как человека, так и животных, можно эффективно перепрограммировать в индуцированные плюрипотентные стволовые клетки без необходимости использования фидерных клеток . [53] Использование собственных клеток пациента снижает вероятность отторжения тканей и позволяет избежать этических проблем, связанных с использованием эмбриональных стволовых клеток человека . [54] Все больше данных также свидетельствует о том, что различные жировые отложения (т.е. абдоминальные, сальниковые, перикардиальные) дают стволовые клетки, полученные из жировой ткани, с разными характеристиками. [54] [55] Эти депо-зависимые особенности включают скорость пролиферации , иммунофенотип , потенциал дифференцировки , экспрессию генов , а также чувствительность к гипоксическим условиям культивирования. [56] Уровни кислорода, по-видимому, играют важную роль в метаболизме и в целом на функции стволовых клеток, полученных из жировой ткани. [57]
Жировая ткань является основным периферическим источником ароматазы как у мужчин, так и у женщин, способствуя выработке эстрадиола . [58]
Гормоны, полученные из жировой ткани, включают:
Жировые ткани также секретируют тип цитокинов (межклеточные сигнальные белки), называемые адипокинами (жировые цитокины), которые играют роль в осложнениях, связанных с ожирением. Периваскулярная жировая ткань высвобождает адипокины, такие как адипонектин, которые влияют на сократительную функцию сосудов, которые они окружают. [1] [59]
Бурый жир
[ редактировать ]
Бурый жир или бурая жировая ткань (БЖТ) представляет собой специализированную форму жировой ткани, важную для адаптивного термогенеза у людей и других млекопитающих. BAT может генерировать тепло, «разъединяя» дыхательную цепь окислительного фосфорилирования в митохондриях посредством тканеспецифической экспрессии разобщающего белка 1 (UCP1). [60] БЖТ преимущественно локализуется вокруг шеи и крупных кровеносных сосудов грудной клетки , где может эффективно осуществлять теплообмен. BAT активно активируется при воздействии холода за счет высвобождения катехоламинов из симпатических нервов , что приводит к активации UCP1.Почти половина нервов, присутствующих в жировой ткани, представляют собой сенсорные нейроны, связанные с ганглиями дорсальных корешков . [61]
Активация BAT также может произойти в ответ на перекармливание. [62] Активность UCP1 стимулируется длинноцепочечными жирными кислотами, которые образуются после активации β-адренергических рецепторов . [60] Предполагается, что UCP1 действует как симпортер протонов жирных кислот , хотя точный механизм еще не выяснен. [63] Напротив, UCP1 ингибируется АТФ , АДФ и ГТФ . [64]
Попытки смоделировать этот процесс фармакологически пока не увенчались успехом. Методы управления дифференциацией «бурого жира» могут стать для снижения веса в будущем механизмом терапии , стимулируя рост тканей с помощью этого специализированного метаболизма, не вызывая его в других органах. Обзор возможного терапевтического применения бурого жира для лечения ожирения у людей был опубликован Самуэльсоном и Видалем-Пучом в 2020 году. [65]
До недавнего времени считалось, что бурая жировая ткань у людей в основном встречается только у младенцев, но новые данные опровергли это мнение. Метаболически активная ткань с температурными реакциями, сходными с бурой жировой тканью, впервые была обнаружена в шее и туловище некоторых взрослых людей в 2007 году. [66] а наличие бурого жира у взрослых людей позже было подтверждено гистологически в тех же анатомических областях. [67] [68] [69]
Бежевый жир и WAT подрумянивание
[ редактировать ]Потемнение WAT, также называемое «beiging», происходит, когда адипоциты в депо WAT приобретают черты BAT. Бежевые адипоциты приобретают многокамерный вид (содержат несколько липидных капель) и повышают экспрессию разобщающего белка 1 (UCP1). [70] При этом эти адипоциты, обычно запасающие энергию, становятся адипоцитами, высвобождающими энергию.
Способность бурого и бежевого жира сжигать калории тщательно изучается, поскольку исследовательские усилия сосредоточены на методах лечения ожирения и диабета. Препарат 2,4-динитрофенол , который также действует как химический разобщитель , подобно UCP1, использовался для снижения веса в 1930-х годах. Однако его быстро прекратили, когда чрезмерная дозировка привела к неблагоприятным побочным эффектам, включая гипертермию и смерть. [70] β 3 -адренергические агонисты , такие как CL316,243, также были разработаны и протестированы на людях. Однако использование таких препаратов оказалось в значительной степени безуспешным из-за ряда проблем, включая различную видовую специфичность рецепторов и плохую биодоступность при пероральном приеме . [71]
Холод является основным регулятором процессов BAT и вызывает потемнение WAT. Потемнение в ответ на хроническое воздействие холода хорошо документировано и является обратимым процессом. Исследование на мышах показало, что потемнение, вызванное холодом, можно полностью обратить вспять за 21 день, при этом измеримое снижение UCP1 наблюдается в течение 24 часов. [72] Исследование Розенвальда и др. выявили, что когда животные повторно подвергаются воздействию холодной среды, те же самые адипоциты приобретают бежевый фенотип, что позволяет предположить, что бежевые адипоциты сохраняются. [73]
Регуляторы транскрипции, а также растущее число других факторов регулируют индукцию образования бежевого жира. Четыре регулятора транскрипции играют центральную роль в потемнении WAT и служат мишенями для многих молекул, которые, как известно, влияют на этот процесс. [74] К ним относятся гамма-рецептор, активирующий пролифератор пероксисом (PPARγ) , PRDM16 , [75] рецептор гамма-коактиватора 1 альфа, активируемый пролифератором пероксисомы (PGC-1α) , и ранний B-клеточный фактор-2 (EBF2). [76] [77] [78]
Список молекул, влияющих на потемнение, вырос прямо пропорционально популярности этой темы и постоянно расширяется по мере приобретения новых знаний. Среди этих молекул — иризин и фактор роста фибробластов 21 ( FGF21 ), которые хорошо изучены и считаются важными регуляторами потемнения. Иризин секретируется мышцами в ответ на физическую нагрузку и, как было показано, усиливает потемнение кожи, воздействуя на бежевые преадипоциты. [79] FGF21, гормон, секретируемый в основном печенью, вызвал большой интерес после того, как был идентифицирован как мощный стимулятор поглощения глюкозы и регулятор потемнения благодаря своему влиянию на PGC-1α. [70] Его уровень в BAT увеличивается во время воздействия холода и, как полагают, способствует устойчивости к ожирению, вызванному диетой. [80] FGF21 также может секретироваться в ответ на физические упражнения и диету с низким содержанием белка, хотя последняя не была тщательно исследована. [81] [82] Данные этих исследований показывают, что факторы окружающей среды, такие как диета и физические упражнения, могут быть важными факторами потемнения. У мышей было обнаружено, что бейджинг может происходить за счет продукции метионин-энкефалиновых пептидов врожденными лимфоидными клетками 2 типа в ответ на интерлейкин 33 . [83]
Инструменты геномики и биоинформатики для изучения потемнения
[ редактировать ]Из-за сложной природы жировой ткани и растущего списка молекул, регулирующих потемнение, существует большой потенциал для использования инструментов биоинформатики для улучшения исследований в этой области. Исследования подрумянивания WAT значительно выиграли от достижений в этих методах, поскольку бежевый жир быстро набирает популярность в качестве терапевтической мишени для лечения ожирения и диабета.
ДНК-микрочип — это биоинформатический инструмент, используемый для одновременной количественной оценки уровней экспрессии различных генов и широко используемый при изучении жировой ткани. В одном из таких исследований использовался микроматричный анализ в сочетании с программным обеспечением Ingenuity IPA для изучения изменений в экспрессии генов WAT и BAT, когда мыши подвергались воздействию температур 28 и 6 °C. [84] Затем были идентифицированы и использованы для анализа путей дифференциальной экспрессии наиболее значительно повышающие и понижающие экспрессию гены. Было обнаружено, что многие пути, активирующиеся в WAT после воздействия холода, также высоко выражены в BAT, такие как окислительное фосфорилирование , метаболизм жирных кислот и метаболизм пирувата. [84] Это говорит о том, что некоторые адипоциты перешли на бежевый фенотип при 6 °C. Мессенбёк и др. также использовали микроматричный анализ, чтобы продемонстрировать, что дефицит инсулина ингибирует дифференцировку бежевых адипоцитов, но не нарушает их способность к потемнению. [85] Эти два исследования демонстрируют потенциал использования микрочипов для изучения потемнения WAT.
Секвенирование РНК ( RNA-Seq ) — мощный вычислительный инструмент, позволяющий количественно оценить экспрессию РНК для всех генов в образце. Включение RNA-Seq в исследования потемнения имеет большую ценность, поскольку оно обеспечивает лучшую специфичность, чувствительность и более полный обзор экспрессии генов, чем другие методы. RNA-Seq использовался как в исследованиях на людях, так и на мышах в попытке охарактеризовать бежевые адипоциты в соответствии с профилями экспрессии их генов и идентифицировать потенциальные терапевтические молекулы, которые могут индуцировать бежевый фенотип. В одном из таких исследований использовалась RNA-Seq для сравнения профилей экспрессии генов WAT у мышей дикого типа (WT) и мышей со сверхэкспрессией раннего B-клеточного фактора-2 (EBF2). WAT от трансгенных животных демонстрировал программу генов бурого жира и снижал экспрессию специфичных для WAT генов по сравнению с мышами WT. [86] Таким образом, EBF2 был идентифицирован как потенциальная терапевтическая молекула, вызывающая старение.
Иммунопреципитация хроматина с секвенированием (ChIP-seq) — это метод, используемый для идентификации сайтов связывания белков на ДНК и оценки модификаций гистонов . Этот инструмент позволил изучить эпигенетическую регуляцию потемнения и помогает выяснить механизмы, с помощью которых взаимодействия белок-ДНК стимулируют дифференцировку бежевых адипоцитов. Исследования, наблюдающие за ландшафтами хроматина бежевых адипоцитов, показали, что адипогенез этих клеток возникает в результате формирования клеточно-специфичных ландшафтов хроматина, которые регулируют программу транскрипции и, в конечном итоге, контролируют дифференцировку. Используя ChIP-seq в сочетании с другими инструментами, недавние исследования выявили более 30 транскрипционных и эпигенетических факторов, которые влияют на развитие бежевых адипоцитов. [86]
Генетика
[ редактировать ]Гипотеза бережливого гена (также называемая гипотезой голода) утверждает, что в некоторых популяциях организм будет более эффективно удерживать жир во времена изобилия, тем самым обеспечивая большую устойчивость к голоданию во времена нехватки продовольствия. Эта гипотеза, первоначально выдвинутая в контексте метаболизма глюкозы и резистентности к инсулину, была дискредитирована физическими антропологами, физиологами и самим первоначальным сторонником идеи в этом контексте, хотя, по мнению ее разработчика, она остается «столь же жизнеспособной, как и тогда, когда [оно было] впервые выдвинуто» в других контекстах. [87] [88]
В 1995 году Джеффри Фридман в своей резиденции в Рокфеллеровском университете вместе с Рудольфом Лейбелем , Дугласом Коулманом и др. обнаружили белок лептин , которого не хватало мышам с генетическим ожирением. [89] [90] [91] Лептин вырабатывается в белой жировой ткани и передает сигналы гипоталамусу . Когда уровень лептина падает, организм интерпретирует это как потерю энергии, и голод усиливается. Мыши, которым не хватает этого белка, едят до тех пор, пока их размер не увеличится в четыре раза.
Однако лептин играет разную роль в ожирении, вызванном диетой, у грызунов и людей. Поскольку адипоциты вырабатывают лептин, уровень лептина повышается у людей с ожирением. Однако голод остается, а когда уровень лептина падает из-за потери веса, голод усиливается. Падение уровня лептина лучше рассматривать как сигнал голодания, чем повышение уровня лептина как сигнал насыщения . [92] Однако повышенный уровень лептина при ожирении известен как резистентность к лептину . Изменения, которые происходят в гипоталамусе и приводят к резистентности к лептину при ожирении, в настоящее время находятся в центре внимания исследований ожирения. [93]
Генные дефекты в гене лептина ( ob ) при ожирении у человека встречаются редко. [94] По состоянию на июль 2010 г. [update]Во всем мире было идентифицировано только 14 человек из пяти семей, несущих мутировавший ген ob (один из которых был первой когда-либо выявленной причиной генетического ожирения у людей) — две семьи пакистанского происхождения, живущие в Великобритании, одна семья, живущая в Турции, один в Египте и один в Австрии [95] [96] [97] [98] [99] - и были обнаружены еще два семейства, которые несут мутировавший ob -рецептор. [100] [101] У других был выявлен генетический частичный дефицит лептина, и у этих людей уровень лептина на нижней границе нормального диапазона может предсказать ожирение. [102]
Было также выявлено, что несколько мутаций генов, включающих меланокортины (используемые в передаче сигналов мозга, связанных с аппетитом) и их рецепторы, вызывают ожирение у большей части населения, чем мутации лептина. [103]
Физические свойства
[ редактировать ]Жировая ткань имеет плотность ~0,9 г/мл. [104] Таким образом, человеку с большим количеством жировой ткани будет легче плавать, чем человеку того же веса с большим количеством мышечной ткани , поскольку мышечная ткань имеет плотность 1,06 г/мл. [105]
Измеритель жира в организме
[ редактировать ]Измеритель жира в организме — это инструмент, используемый для измерения соотношения жира и веса в организме человека. В разных счетчиках используются разные методы определения соотношения. Они склонны недооценивать процентное содержание жира в организме.
В отличие от клинических инструментов, таких как DXA и подводное взвешивание , один относительно недорогой тип измерителя жира в организме использует принцип биоэлектрического импедансного анализа (BIA) для определения процентного содержания жира в организме человека. Для этого прибор пропускает небольшой, безвредный электрический ток через тело и измеряет сопротивление , а затем использует информацию о весе, росте, возрасте и поле человека для расчета приблизительного значения процентного содержания жира в организме человека. При расчете измеряется общий объем воды в организме (сухая ткань и мышцы содержат более высокий процент воды, чем жир) и на основе этой информации оценивается процент жира. Результат может колебаться на несколько процентных пунктов в зависимости от того, что было съедено и сколько воды было выпито перед анализом. Этот метод быстрый и доступный, но неточный. Альтернативные методы: методы кожных складок с использованием штангенциркуля , подводное взвешивание всего тела. , плетизмография с вытеснением воздуха (ADP) и DXA .
Исследования на животных
[ редактировать ]В жировой (жировой) ткани CCR2 с дефицитом мышей наблюдается повышенное количество эозинофилов , большая активация альтернативных макрофагов и склонность к экспрессии цитокинов 2 типа . Более того, этот эффект был преувеличен, когда мыши страдали ожирением из-за диеты с высоким содержанием жиров. [106]
Галерея
[ редактировать ]- Схематический разрез кожи (увеличенный)
- Белая жировая ткань в парафиновом срезе
- Электронный прибор для измерения жира в организме
См. также
[ редактировать ]- Белок, связанный с дифференцировкой жировой ткани
- Адипоциты
- Обращение
- Биоэлектрический импедансный анализ – метод измерения процентного содержания жира в организме.
- Жир – очень толстая форма жировой ткани, встречающаяся у некоторых морских млекопитающих.
- Процент жира в организме
- Целлюлит
- Липолиз
- Липодистрофия
- Человеческий жир используется в качестве фармацевтического средства в традиционной медицине
- Ожирение
- Голод
- Стеатоз (также называемый жировыми изменениями, жировой дегенерацией или жировой дегенерацией)
- Стволовые клетки
- Подкожный жир
- Бариатрия
- Классификация ожирения
- Классификация детского ожирения
- Международная сеть EPODE , крупнейшая в мире сеть по профилактике ожирения.
- Программа World Fit A Олимпийского комитета США (USOC) и Ассоциации олимпийцев и паралимпийцев США (USOP)
- Ожирение и ходьба
- Социальная стигма ожирения
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Бирбрайр А., Чжан Т., Ван З.М., Месси М.Л., Ениколопов Г.Н., Минц А., Дельбоно О. (август 2013 г.). «Роль перицитов в регенерации скелетных мышц и накоплении жира» . Стволовые клетки и развитие . 22 (16): 2298–2314. дои : 10.1089/scd.2012.0647 . ПМЦ 3730538 . ПМИД 23517218 .
- ^ Перейти обратно: а б с д и ж Йе Р.З., Ричард Г., Жеври Н., Черноф А., Карпентье А.С. (январь 2022 г.). «Размер жировых клеток: методы измерения, патофизиологическое происхождение и связь с метаболическими нарушениями» . Эндокринные обзоры . 43 (1): 35–60. дои : 10.1210/endrev/bnab018 . ПМЦ 8755996 . ПМИД 34100954 .
- ^ Кершоу Э.Э., Флиер Дж.С. (июнь 2004 г.). «Жировая ткань как эндокринный орган» . Журнал клинической эндокринологии и метаболизма . 89 (6): 2548–2556. дои : 10.1210/jc.2004-0395 . ПМИД 15181022 .
- ^ Манкузо П. (май 2016 г.). «Роль адипокинов в хроническом воспалении» . Иммуномишени и терапия . 5 (2016): 47–56. дои : 10.2147/ITT.S73223 . ПМЦ 4970637 . ПМИД 27529061 .
- ^ Кэннон Б, Недергаард Дж (август 2008 г.). «Биология развития: Ни жира, ни мяса» . Природа . 454 (7207): 947–948. Бибкод : 2008Natur.454..947C . дои : 10.1038/454947a . ПМИД 18719573 . S2CID 205040511 .
- ^ Аарсланд А., Чинкс Д., Вулф Р.Р. (июнь 1997 г.). «Синтез жира в печени и во всем организме у человека при перекармливании углеводами» . Американский журнал клинического питания . 65 (6): 1774–1782. дои : 10.1093/ajcn/65.6.1774 . ПМИД 9174472 .
- ^ Пруд СМ (1998). Жиры жизни . Издательство Кембриджского университета. ISBN 978-0-521-63577-6 .
- ^ Синти С. (июль 2005 г.). «Жировой орган». Простагландины, лейкотриены и незаменимые жирные кислоты . 73 (1): 9–15. дои : 10.1016/j.plefa.2005.04.010 . ПМИД 15936182 . S2CID 24434046 .
- ^ Бахманов А.А. , Рид Д.Р., Тордофф М.Г., Прайс Р.А., Бошан ГК (март 2001 г.). «Предпочтение питательных веществ и ожирение, вызванное диетой, у мышей C57BL/6ByJ и 129P3/J» . Физиология и поведение . 72 (4): 603–613. дои : 10.1016/S0031-9384(01)00412-7 . ПМК 3341942 . ПМИД 11282146 .
- ^ Вирт А., Вабич М., Хаунер Х. (октябрь 2014 г.). «Профилактика и лечение ожирения» . Deutsches Ärzteblatt International . 111 (42): 705–713. дои : 10.3238/arztebl.2014.0705 . ПМЦ 4233761 . ПМИД 25385482 .
- ^ Жир внутри: выглядеть худым недостаточно. Архивировано 17 ноября 2016 г. в Wayback Machine , Фиона Хейнс, About.com.
- ^ Перейти обратно: а б «Жир на животе и что с этим делать» . Президент и члены Гарвардского колледжа. Сентябрь 2005 г.
Висцеральный жир представляет большую угрозу для здоровья, чем подкожный жир.
- ^ Нагай М., Комия Х., Мори Ю., Ота Т., Касахара Ю., Икеда Ю. (май 2010 г.). «Оценка площади висцерального жира с помощью многочастотного биоэлектрического импеданса» . Уход при диабете . 33 (5): 1077–1079. дои : 10.2337/dc09-1099 . ПМЦ 2858179 . ПМИД 20150289 .
- ^ Монтегю, Коннектикут, О'Рахилли С. (июнь 2000 г.). «Опасности полноты: причины и последствия висцерального ожирения» . Диабет . 49 (6): 883–888. дои : 10.2337/диабет.49.6.883 . ПМИД 10866038 .
- ^ Керн П.А., Ранганатан С., Ли С., Вуд Л., Ранганатан Г. (май 2001 г.). «Фактор некроза опухоли жировой ткани и экспрессия интерлейкина-6 при ожирении и резистентности к инсулину у человека». Американский журнал физиологии. Эндокринология и обмен веществ . 280 (5): E745–E751. дои : 10.1152/ajpendo.2001.280.5.e745 . ПМИД 11287357 . S2CID 24306481 .
- ^ Маретт А. (декабрь 2003 г.). «Молекулярные механизмы воспаления при инсулинорезистентности, связанной с ожирением». Международный журнал ожирения и связанных с ним метаболических нарушений . 27 (Приложение 3): S46–S48. дои : 10.1038/sj.ijo.0802500 . ПМИД 14704744 . S2CID 30693649 .
- ^ Мокдад А.Х., Форд Э.С., Боуман Б.А., Дитц В.Х., Виникор Ф., Бэйлс В.С., Маркс Дж.С. (январь 2003 г.). «Распространенность ожирения, диабета и связанных с ожирением факторов риска для здоровья, 2001 г.» . ДЖАМА . 289 (1): 76–79. дои : 10.1001/jama.289.1.76 . ПМИД 12503980 .
- ^ Марески Х.С., Шарфман З., Зив-Баран Т., Гомори Дж.М., Копель Л., Тал С. (ноябрь 2015 г.). «Антропометрическая оценка жировой ткани шеи и объема дыхательных путей с использованием мультидетекторной компьютерной томографии: метод визуализации и связь с общей смертностью» . Лекарство . 94 (45): e1991. doi : 10.1097/MD.0000000000001991 . ПМЦ 4912280 . ПМИД 26559286 .
- ^ Браун Дж.К., Хархей М.О., Хархей М.Н. (февраль 2018 г.). «Антропометрически предсказанная висцеральная жировая ткань и биомаркеры крови: перекрестный анализ» . Европейский журнал питания . 57 (1): 191–198. дои : 10.1007/s00394-016-1308-8 . ПМК 5513780 . ПМИД 27614626 .
- ^ Браун Дж.К., Хархей М.О., Хархей М.Н. (январь 2017 г.). «Антропометрически предсказанные показатели висцеральной жировой ткани и смертности среди мужчин и женщин в ходе третьего национального исследования здоровья и питания (NHANES III)» . Американский журнал биологии человека . 29 (1): e22898. дои : 10.1002/ajhb.22898 . ПМК 5241265 . ПМИД 27427402 .
- ^ «Уменьшить брюшной жир» . Архивировано из оригинала 28 сентября 2011 г. Проверено 10 апреля 2009 г.
Эстроген вызывает накопление жира в области таза, бедер, ягодиц и бедер (область таза).
- ^ «Беспокойство о талии: превращаем яблоки обратно в груши» . сайт HealthWomen.org . Архивировано из оригинала 9 июня 2009 г.
- ^ Исследователи считают, что недостаток эстрогена в период менопаузы играет роль в перемещении нашего жира на север. Видеть: Эндрюс М (01 декабря 2006 г.). «Дело о жире» . Yahoo Здоровье . Женское здоровье. Архивировано из оригинала 15 марта 2007 г.
- ^ Сингх А.К., Лоскальсо Дж., ред. (2014). Интенсивный обзор внутренней медицины Бригама (2-е изд.). Нью-Йорк, штат Нью-Йорк: Издательство Оксфордского университета. п. 483. ИСБН 978-0-19-935827-4 . Проверено 3 августа 2021 г.
- ^ Окавара К., Танака С., Миячи М., Исикава-Таката К., Табата I (декабрь 2007 г.). «Взаимосвязь доза-реакция между аэробными упражнениями и уменьшением висцерального жира: систематический обзор клинических испытаний». Международный журнал ожирения . 31 (12): 1786–1797. дои : 10.1038/sj.ijo.0803683 . ПМИД 17637702 .
- ^ Халафи М., Маландиш А., Розенкранц С.К., Раваси А.А. (сентябрь 2021 г.). «Влияние тренировок с отягощениями с ограничением калорий и без него на висцеральный жир: системный обзор и метаанализ». Обзоры ожирения . 22 (9): e13275. дои : 10.1111/обр.13275 . ПМИД 33998135 . S2CID 234747534 .
- ^ Верхегген Р.Дж., Мессен М.Ф., Green DJ, Хермус А.Р., Хопман М.Т., Тийссен Д.Х. (август 2016 г.). «Систематический обзор и метаанализ влияния физических упражнений по сравнению с гипокалорийной диетой: различное влияние на массу тела и висцеральную жировую ткань» (PDF) . Обзоры ожирения . 17 (8): 664–690. дои : 10.1111/обр.12406 . ПМИД 27213481 . S2CID 206228752 .
- ^ Ирвинг Б.А., Дэвис С.К., Брок Д.В., Велтман Дж.Ю., Свифт Д., Барретт Э.Дж. и др. (ноябрь 2008 г.). «Влияние интенсивности тренировок на брюшной висцеральный жир и состав тела» . Медицина и наука в спорте и физических упражнениях . 40 (11): 1863–1872. дои : 10.1249/MSS.0b013e3181801d40 . ПМК 2730190 . ПМИД 18845966 .
- ^ Кокер Р.Х., Уильямс Р.Х., Кортебейн П.М., Салливан Д.Х., Эванс У.Дж. (август 2009 г.). «Влияние интенсивности упражнений на брюшной жир и адипонектин у пожилых людей» . Метаболический синдром и связанные с ним расстройства . 7 (4): 363–368. дои : 10.1089/met.2008.0060 . ПМК 3135883 . ПМИД 19196080 .
- ^ Росс Р., Риссанен Дж. (ноябрь 1994 г.). «Мобилизация висцеральной и подкожной жировой ткани в ответ на ограничение энергии и физические упражнения» . Американский журнал клинического питания . 60 (5): 695–703. дои : 10.1093/ajcn/60.5.695 . ПМИД 7942575 .
- ^ Мазурек Т., Чжан Л., Залевски А., Маннион Дж.Д., Диль Дж.Т., Арафат Х. и др. (ноябрь 2003 г.). «Эпикардиальная жировая ткань человека является источником медиаторов воспаления» . Тираж . 108 (20): 2460–2466. дои : 10.1161/01.CIR.0000099542.57313.C5 . ПМИД 14581396 .
- ^ Де Костер Т., Клаус П., Зееманн Г., Виллемс Р., Сипидо К.Р., Панфилов А.В. (октябрь 2018 г.). «Ремоделирование миоцитов за счет фиброзно-жировых инфильтраций влияет на аритмогенность» . Границы в физиологии . 9 : 1381. doi : 10.3389/fphys.2018.01381 . hdl : 1854/LU-8607023 . ПМК 6182296 . ПМИД 30344493 .
- ^ Де Костер Т., Клаус П., Казбанов И.В., Хамерс П., Виллемс Р., Сипидо КР и др. (февраль 2018 г.). «Аритмогенность фиброзно-жировых инфильтратов» . Научные отчеты . 8 (1): 2050. Бибкод : 2018НатСР...8.2050Д . doi : 10.1038/s41598-018-20450-w . hdl : 1854/LU-8548759 . ПМК 5795000 . ПМИД 29391548 .
- ^ Пезешкиан М., Нури М., Наджарпур-Джаббари Х., Аболфати А., Дараби М., Дараби М. и др. (апрель 2009 г.). «Жирнокислотный состав эпикардиальной и подкожной жировой ткани человека». Метаболический синдром и связанные с ним расстройства . 7 (2): 125–131. дои : 10.1089/met.2008.0056 . ПМИД 19422139 .
- ^ Перейти обратно: а б Хен К., Мариб Э.Н. (2008). Анатомия и физиология (3-е изд.). Сан-Франциско, Калифорния: Пирсон/Бенджамин Каммингс. ISBN 978-0-8053-0094-9 .
- ^ Портер С.А., Массаро Дж.М., Хоффманн Ю., Васан Р.С., О'Доннел С.Дж., Фокс CS (июнь 2009 г.). «Абдоминальная подкожная жировая клетчатка: защитное жировое депо?» . Уход при диабете . 32 (6): 1068–1075. дои : 10.2337/dc08-2280 . ПМК 2681034 . ПМИД 19244087 .
- ^ «Жир на животе у женщин: убрать и сохранить его» . MayoClinic.com. 08.06.2013 . Проверено 2 декабря 2013 г.
- ^ Манолопулос К.Н., Карпе Ф., Фрейн К.Н. (июнь 2010 г.). «Глютеофеморальный жир как фактор метаболического здоровья». Международный журнал ожирения . 34 (6): 949–959. дои : 10.1038/ijo.2009.286 . ПМИД 20065965 . S2CID 21052919 .
- ^ Перейти обратно: а б Броди Д., Москрип В., Хатчон Р. (март 1998 г.). «Измерение состава тела: обзор гидроденситометрии, антропометрии и методов импеданса». Питание . 14 (3): 296–310. дои : 10.1016/S0899-9007(97)00474-7 . ПМИД 9583375 .
- ^ Девлин М.Дж., Клотье А.М., Томас Н.А., Панус Д.А., Лотинун С., Пинц I и др. (сентябрь 2010 г.). «Ограничение калорий приводит к сильному ожирению костного мозга и снижению костной массы у растущих мышей» . Журнал исследований костей и минералов . 25 (9): 2078–2088. дои : 10.1002/jbmr.82 . ПМК 3127399 . ПМИД 20229598 .
- ^ Коуторн В.П., Шеллер Э.Л., Парли С.Д., Фам Х.А., Лирман Б.С., Редшоу К.М. и др. (февраль 2016 г.). «Расширение жировой ткани костного мозга при ограничении калорий связано с увеличением циркулирующих глюкокортикоидов, а не с гиполептинемией» . Эндокринология . 157 (2): 508–521. дои : 10.1210/en.2015-1477 . ПМЦ 4733126 . ПМИД 26696121 .
- ^ Бределла М.А., Фазели П.К., Миллер К.К., Мисра М., Торриани М., Томас Б.Дж. и др. (июнь 2009 г.). «Повышение содержания жира в костном мозге при нервной анорексии» . Журнал клинической эндокринологии и метаболизма . 94 (6): 2129–2136. дои : 10.1210/jc.2008-2532 . ПМК 2690416 . ПМИД 19318450 .
- ^ Перейти обратно: а б Стайнер М., Паньотти Г.М., МакГрат С., Ву X, Сен Б., Юзер Г. и др. (август 2017 г.). «Упражнения уменьшают количество жировой ткани костного мозга за счет β-окисления у бегающих мышей, страдающих ожирением» . Журнал исследований костей и минералов . 32 (8): 1692–1702. дои : 10.1002/jbmr.3159 . ПМК 5550355 . ПМИД 28436105 .
- ^ Стайнер М., Паньотти Г.М., Галиор К., Ву X, Томпсон В.Р., Юзер Г. и др. (август 2015 г.). «Регуляция костного жира в условиях лечения агонистами PPARγ у самок мышей C57BL/6» . Эндокринология . 156 (8): 2753–2761. дои : 10.1210/en.2015-1213 . ПМК 4511140 . ПМИД 26052898 .
- ^ Стайнер М., Томпсон В.Р., Галиор К., Узер Г., Ву Икс, Кадари С. и др. (июль 2014 г.). «Накопление жира в костном мозге, ускоренное диетой с высоким содержанием жиров, подавляется физическими упражнениями» . Кость . 64 : 39–46. дои : 10.1016/j.bone.2014.03.044 . ПМК 4041820 . ПМИД 24709686 .
- ^ Перейти обратно: а б Снел М., Джонкер Дж. Т., Шунс Дж., Лэмб Х., де Роос А., Пийл Х. и др. (2012). «Эктопический жир и резистентность к инсулину: патофизиология и влияние диеты и образа жизни» . Международный журнал эндокринологии . 2012 : 983814. doi : 10.1155/2012/983814 . ПМК 3366269 . ПМИД 22675355 .
- ^ Хенс В., Виссерс Д., Хансен Д., Петерс С., Гилен Дж., Ван Гал Л., Тайманс Дж. (ноябрь 2017 г.). «Влияние диеты или физических упражнений на эктопическое ожирение у детей и подростков с ожирением: систематический обзор и метаанализ». Обзоры ожирения . 18 (11): 1310–1322. дои : 10.1111/обр.12577 . hdl : 1942/24948 . ПМИД 28913977 . S2CID 10876113 .
- ^ Хенс В., Тейман Дж., Корнелис Дж., Гилен Дж., Ван Гал Л., Виссерс Д. (июнь 2016 г.). «Влияние изменений образа жизни на избыточное эктопическое отложение жира, измеренное с помощью неинвазивных методов у взрослых с избыточным весом и ожирением: систематический обзор и метаанализ». Журнал физической активности и здоровья . 13 (6): 671–694. дои : 10.1123/jpah.2015-0560 . hdl : 10067/1321600151162165141 . ПМИД 26694194 .
- ^ Томас Л.В. (апрель 1962 г.). «Химический состав жировой ткани человека и мыши» . Ежеквартальный журнал экспериментальной физиологии и родственных медицинских наук . 47 (2): 179–188. doi : 10.1113/expphysicalol.1962.sp001589 . ПМИД 13920823 .
- ^ Амитани М, Асакава А, Амитани Х, Инуи А (2013). «Роль лептина в контроле оси инсулин-глюкоза» . Границы в неврологии . 7:51 . дои : 10.3389/fnins.2013.00051 . ПМК 3619125 . ПМИД 23579596 .
- ^ Даливал С.С., Велборн Т.А. (май 2009 г.). «Центральное ожирение и многовариантный сердечно-сосудистый риск по шкале прогнозирования Фрамингема». Американский журнал кардиологии . 103 (10): 1403–1407. дои : 10.1016/j.amjcard.2008.12.048 . ПМИД 19427436 .
- ^ Парк А (08 августа 2009 г.). «Обезьяны с толстым животом объясняют, почему стресс — отстой» . Время . Архивировано из оригинала 20 декабря 2013 года . Проверено 19 декабря 2013 г.
- ^ Суги С., Кида Ю., Кавамура Т., Сузуки Дж., Вассена Р., Инь Ю.К. и др. (февраль 2010 г.). «Клетки, полученные из жировой ткани человека и мыши, поддерживают фидер-независимую индукцию плюрипотентных стволовых клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (8): 3558–3563. Бибкод : 2010PNAS..107.3558S . дои : 10.1073/pnas.0910172106 . ПМК 2840462 . ПМИД 20133714 .
- ^ Перейти обратно: а б Ацмон Дж., Ян Х.М., Музумдар Р., Ма Х.Х., Габриэли И., Барзилай Н. (ноябрь 2002 г.). «Дифференциальная экспрессия генов между висцеральными и подкожными жировыми отложениями». Гормональные и метаболические исследования . 34 (11–12): 622–628. дои : 10.1055/s-2002-38250 . ПМИД 12660871 . S2CID 33960130 .
- ^ Бальони С., Кантини Дж., Поли Дж., Франкаланчи М., Скекко Р., Ди Франко А. и др. (4 мая 2012 г.). «Функциональные различия висцеральных и подкожных жировых отложений возникают из-за различий в жировых стволовых клетках» . ПЛОС ОДИН . 7 (5): e36569. Бибкод : 2012PLoSO...736569B . дои : 10.1371/journal.pone.0036569 . ПМЦ 3344924 . ПМИД 22574183 .
- ^ Руссо В., Ю. С., Белливо П., Гамильтон А., Флинн Л. Е. (февраль 2014 г.). «Сравнение стволовых клеток, полученных из жировой ткани человека, выделенных из депо подкожной, сальниковой и внутригрудной жировой ткани, для регенеративного применения» . Трансляционная медицина стволовых клеток . 3 (2): 206–217. дои : 10.5966/sctm.2013-0125 . ПМК 3925056 . ПМИД 24361924 .
- ^ Лемпесис И.Г., ван Мейел Р.Л., Манолопулос К.Н., Гуссенс Г.Х. (январь 2020 г.). «Оксигенация жировой ткани: человеческий взгляд» . Акта Физиологика . 228 (1): e13298. дои : 10.1111/apha.13298 . ПМК 6916558 . ПМИД 31077538 .
- ^ Стокко C (январь 2012 г.). «Физиология тканей и патология ароматазы» . Стероиды . 77 (1–2): 27–35. doi : 10.1016/j.steroids.2011.10.013 . ПМЦ 3286233 . ПМИД 22108547 .
- ^ Лён М., Дубровска Г., Лаутербах Б., Люфт ФК, Голлаш М., Шарма А.М. (июль 2002 г.). «Периадвентициальный жир высвобождает фактор релаксации сосудов» . Журнал ФАСЭБ . 16 (9): 1057–1063. дои : 10.1096/fj.02-0024com . ПМИД 12087067 . S2CID 902537 .
- ^ Перейти обратно: а б Кэннон Б, Недергаард Дж (январь 2004 г.). «Бурая жировая ткань: функция и физиологическое значение». Физиологические обзоры . 84 (1): 277–359. doi : 10.1152/physrev.00015.2003 . ПМИД 14715917 . S2CID 14289041 .
- ^ «Подслушивание связи между жиром и мозгом» . 31 августа 2022 г.
- ^ Бузиелло Р.А., Саварезе С., Ломбарди А. (2015). «Митохондриальные разобщающие белки и энергетический обмен» . Границы в физиологии . 6 (36): 36. doi : 10.3389/fphys.2015.00036 . ПМЦ 4322621 . ПМИД 25713540 .
- ^ Федоренко А, Лишко П.В., Киричок Ю (октябрь 2012 г.). «Механизм зависимого от жирных кислот разобщения UCP1 в митохондриях бурого жира» . Клетка . 151 (2): 400–413. дои : 10.1016/j.cell.2012.09.010 . ПМК 3782081 . ПМИД 23063128 .
- ^ Аззу В., бренд, доктор медицинских наук (май 2010 г.). «Включатели митохондриальных разобщающих белков» . Тенденции биохимических наук . 35 (5): 298–307. дои : 10.1016/j.tibs.2009.11.001 . ПМК 3640847 . ПМИД 20006514 .
- ^ Самуэльсон I, Видаль-Пуч А (2020). «Изучение бурой жировой ткани у человека in vitro » . Границы эндокринологии . 11 : 629. дои : 10.3389/fendo.2020.00629 . ПМЦ 7523498 . ПМИД 33042008 .
- ^ Недергаард Дж., Бенгтссон Т., Кэннон Б. (август 2007 г.). «Неожиданные доказательства наличия активной бурой жировой ткани у взрослых людей». Американский журнал физиологии. Эндокринология и обмен веществ . 293 (2): E444–E452. дои : 10.1152/ajpendo.00691.2006 . ПМИД 17473055 . S2CID 230947 .
- ^ Виртанен К.А., Лиделл М.Е., Орава Дж., Хеглинд М., Вестергрен Р., Ниеми Т. и др. (апрель 2009 г.). «Функциональная бурая жировая ткань у здоровых взрослых» . Медицинский журнал Новой Англии . 360 (15): 1518–1525. doi : 10.1056/NEJMoa0808949 . ПМИД 19357407 .
- ^ ван Маркен Лихтенбелт В.Д., Ванхоммериг Дж.В., Смолдерс Н.М., Дроссартс Дж.М., Кемеринк Г.Дж., Буви Н.Д. и др. (апрель 2009 г.). «Активированная холодом бурая жировая ткань у здоровых мужчин» (PDF) . Медицинский журнал Новой Англии . 360 (15): 1500–1508. doi : 10.1056/NEJMoa0808718 . ПМИД 19357405 . S2CID 477352 .
- ^ Сайпесс А.М., Леман С., Уильямс Г., Тал И., Родман Д., Голдфайн А.Б. и др. (апрель 2009 г.). «Идентификация и значение бурой жировой ткани у взрослых людей» . Медицинский журнал Новой Англии . 360 (15): 1509–1517. doi : 10.1056/NEJMoa0810780 . ПМЦ 2859951 . ПМИД 19357406 .
- ^ Перейти обратно: а б с Хармс М., Сил П. (октябрь 2013 г.). «Бурый и бежевый жир: развитие, функции и терапевтический потенциал» . Природная медицина . 19 (10): 1252–1263. дои : 10.1038/нм.3361 . ПМИД 24100998 .
- ^ Сайпесс AM, Кан CR (апрель 2010 г.). «Бурый жир как терапия ожирения и диабета» . Современное мнение в эндокринологии, диабете и ожирении . 17 (2): 143–149. дои : 10.1097/MED.0b013e328337a81f . ПМК 3593105 . ПМИД 20160646 .
- ^ Господарская Е., Новиалис П., Козак Л.П. (март 2015 г.). «Обмен митохондрий: фенотип, отличающий бурые адипоциты от межлопаточной бурой жировой ткани и белой жировой ткани» . Журнал биологической химии . 290 (13): 8243–8255. дои : 10.1074/jbc.M115.637785 . ПМЦ 4375480 . ПМИД 25645913 .
- ^ Розенвальд М., Пердикари А., Рюлике Т., Вольфрум С. (июнь 2013 г.). «Двунаправленное взаимное преобразование бритов и белых адипоцитов». Природная клеточная биология . 15 (6): 659–667. дои : 10.1038/ncb2740 . ПМИД 23624403 . S2CID 2842953 .
- ^ Ло К.А., Сунь Л. (сентябрь 2013 г.). «Превращение WAT в BAT: обзор регуляторов, контролирующих потемнение белых адипоцитов» . Отчеты по биологическим наукам . 33 (5): 711–19. дои : 10.1042/BSR20130046 . ПМЦ 3764508 . ПМИД 23895241 .
- ^ Хармс М.Дж., Исибаши Дж., Ван В., Лим Х.В., Гояма С., Сато Т. и др. (апрель 2014 г.). «Prdm16 необходим для поддержания идентичности и функции бурых адипоцитов у взрослых мышей» . Клеточный метаболизм . 19 (4): 593–604. дои : 10.1016/j.cmet.2014.03.007 . ПМК 4012340 . ПМИД 24703692 .
- ^ Ван В., Киссиг М., Раджакумари С., Хуан Л., Лим Х.В., Вон К.Дж., Сил П. (октябрь 2014 г.). «Ebf2 является селективным маркером коричневых и бежевых адипогенных клеток-предшественников» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (40): 14466–14471. Бибкод : 2014PNAS..11114466W . дои : 10.1073/pnas.1412685111 . ПМК 4209986 . ПМИД 25197048 .
- ^ Киссиг М., Шапира С.Н., Сил П. (июнь 2016 г.). «SnapShot: термогенез коричневой и бежевой жировой ткани» . Клетка . 166 (1): 258–258.e1. дои : 10.1016/j.cell.2016.06.038 . ПМЦ 5478388 . ПМИД 27368105 .
- ^ Шапира С.Н., Лим Х.В., Раджакумари С., Сакерс А.П., Ишибаши Дж., Хармс М.Дж. и др. (апрель 2017 г.). «EBF2 транскрипционно регулирует коричневый адипогенез через считыватель гистонов DPF3 и комплекс ремоделирования хроматина BAF» . Гены и развитие . 31 (7): 660–673. дои : 10.1101/gad.294405.116 . ПМК 5411707 . ПМИД 28428261 .
- ^ Бострём П., Ву Дж., Едриховски М.П., Корде А., Йе Л., Ло Дж.К. и др. (январь 2012 г.). «PGC1-α-зависимый миокин, который стимулирует развитие белого жира и термогенез, подобный бурому жиру» . Природа . 481 (7382): 463–468. Бибкод : 2012Natur.481..463B . дои : 10.1038/nature10777 . ПМК 3522098 . ПМИД 22237023 .
- ^ Охта Х, Ито Н (2014). «Роль FGF как адипокинов в развитии, ремоделировании и метаболизме жировой ткани» . Границы эндокринологии . 5 (18): 18. дои : 10.3389/fendo.2014.00018 . ПМЦ 3932445 . ПМИД 24605108 .
- ^ Фензл А., Кифер Ф.В. (июль 2014 г.). «Бурая жировая ткань и термогенез» . Гормональная молекулярная биология и клинические исследования . 19 (1): 25–37. doi : 10.1515/hmbci-2014-0022 . ПМИД 25390014 . S2CID 35008082 .
- ^ Лагер Т., Хенаган Т.М., Альбарадо, округ Колумбия, Редман Л.М., Брей Г.А., Ноланд Р.К. и др. (сентябрь 2014 г.). «FGF21 представляет собой эндокринный сигнал ограничения белка» . Журнал клинических исследований . 124 (9): 3913–3922. дои : 10.1172/JCI74915 . ПМК 4153701 . ПМИД 25133427 .
- ^ Брестофф Дж.Р., Ким Б.С., Саенц С.А., Стайн Р.Р., Монтичелли Л.А., Зонненберг Г.Ф. и др. (март 2015 г.). «Врожденные лимфоидные клетки группы 2 способствуют образованию белой жировой ткани и ограничивают ожирение» . Природа . 519 (7542): 242–246. Бибкод : 2015Natur.519..242B . дои : 10.1038/nature14115 . ПМЦ 4447235 . ПМИД 25533952 .
- ^ Перейти обратно: а б Розелл М., Кафору М., Фронтини А., Около А., Чан Ю.В., Николопулу Е. и др. (апрель 2014 г.). «Бурая и белая жировая ткань: внутренние различия в экспрессии генов и реакции на воздействие холода у мышей» . Американский журнал физиологии. Эндокринология и обмен веществ . 306 (8): E945–E964. дои : 10.1152/ajpendo.00473.2013 . ПМЦ 3989735 . ПМИД 24549398 .
- ^ Инагаки Т., Сакаи Дж., Кадзимура С. (август 2016 г.). «Транкрипционный и эпигенетический контроль судьбы и функции бурых и бежевых жировых клеток» . Обзоры природы. Молекулярно-клеточная биология . 17 (8): 480–495. дои : 10.1038/номер.2016.62 . ПМЦ 4956538 . ПМИД 27251423 .
- ^ Перейти обратно: а б Стайн Р.Р., Шапира С.Н., Лим Х.В., Ишибаши Дж., Хармс М., Вон К.Дж., Сил П. (январь 2016 г.). «EBF2 способствует привлечению бежевых адипоцитов в белую жировую ткань» . Молекулярный метаболизм . 5 (1): 57–65. doi : 10.1016/j.molmet.2015.11.001 . ПМК 4703852 . ПМИД 26844207 .
- ^ Спикер-младший (2007). «Генетика ожирения: пять фундаментальных проблем гипотезы голода». В Fantuzzi G, Mazzone T (ред.). Жировая ткань и адипокины в здоровье и болезнях . Питание и здоровье. Хумана Пресс. стр. 221–236. дои : 10.1007/978-1-59745-370-7_17 . ISBN 978-1-58829-721-1 .
- ^ Нил СП (1989). «Изучение естественного отбора в примитивных и цивилизованных человеческих популяциях. 1958». Биология человека . 61 (5–6): 781–810, обсуждение 811–23. ПМИД 2699601 .
- ^ Шелл Э (1 января 2002 г.). «Глава 4: На переднем крае». Голодный ген: внутренняя история индустрии ожирения . Атлантик Ежемесячник Пресс. ISBN 978-1-4223-5243-4 .
- ^ Шелл Э (1 января 2002 г.). «Глава 5: Голод». Голодный ген: внутренняя история индустрии ожирения . Атлантик Ежемесячник Пресс. ISBN 978-1-4223-5243-4 .
- ^ Пеллимаунтер М.А., Каллен М.Дж., Бейкер М.Б., Хехт Р., Уинтерс Д., Бун Т., Коллинз Ф. (июль 1995 г.). «Влияние продукта гена ожирения на регуляцию массы тела у мышей ob/ob». Наука . 269 (5223): 540–543. Бибкод : 1995Sci...269..540P . дои : 10.1126/science.7624776 . ПМИД 7624776 .
- ^ Равуссин Э., Смит С.Р. (2013). «Глава 11: Роль адипоцитов в обмене веществ и эндокринной функции». В Weir GC, Jameson JL, De Groot LJ (ред.). Эндокринология взрослая и детская . Том. Сахарный диабет и ожирение (6-е изд.). Elsevier Науки о здоровье. ISBN 978-0-323-22154-2 . [ нужна страница ]
- ^ Моррис Д.Л., Руи Л. (декабрь 2009 г.). «Последние достижения в понимании передачи сигналов лептина и устойчивости к лептину» . Американский журнал физиологии. Эндокринология и обмен веществ . 297 (6): E1247–E1259. дои : 10.1152/ajpendo.00274.2009 . ПМК 2793049 . ПМИД 19724019 .
- ^ Карлссон Б., Линделл К., Габриэльссон Б., Карлссон С., Бьярнасон Р., Вестфаль О. и др. (январь 1997 г.). «Дефекты гена ожирения (ob) редко встречаются у людей с ожирением» . Исследования ожирения . 5 (1): 30–35. дои : 10.1002/j.1550-8528.1997.tb00280.x . ПМИД 9061713 .
- ^ Монтегю Коннектикут, Фаруки И.С., Уайтхед Дж.П., Сус М.А., Рау Х., Уэрхэм, Нью-Джерси, и др. (июнь 1997 г.). «Врожденный дефицит лептина связан с тяжелым ранним ожирением у людей» . Природа . 387 (6636): 903–908. Бибкод : 1997Natur.387..903M . дои : 10.1038/43185 . ПМИД 9202122 . S2CID 205032762 .
- ^ Стробель А., Иссад Т., Камоин Л., Озата М., Стросберг А.Д. (март 1998 г.). «Миссенс-мутация лептина, связанная с гипогонадизмом и патологическим ожирением». Природная генетика . 18 (3): 213–215. дои : 10.1038/ng0398-213 . ПМИД 9500540 . S2CID 36920931 .
- ^ Гибсон В.Т., Фаруки И.С., Моро М., ДеПаоли А.М., Лоуренс Э., О'Рахилли С., Трасселл Р.А. (октябрь 2004 г.). «Врожденный дефицит лептина из-за гомозиготности по мутации Delta133G: отчет о другом случае и оценка ответа на четыре года терапии лептином» . Журнал клинической эндокринологии и метаболизма . 89 (10): 4821–4826. дои : 10.1210/jc.2004-0376 . ПМИД 15472169 .
- ^ Мазен И., Эль-Гаммаль М., Абдель-Хамид М., Амр К. (август 2009 г.). «Новая гомозиготная миссенс-мутация гена лептина (N103K) у египетского пациента, страдающего ожирением». Молекулярная генетика и обмен веществ . 97 (4): 305–308. дои : 10.1016/j.ymgme.2009.04.002 . ПМИД 19427251 .
- ^ Фишер-Посовски П., фон Шнурбейн Дж., Моппс Б., Лар Г., Штраус Г., Барт Т.Ф. и др. (июнь 2010 г.). «Новая миссенс-мутация в гене лептина вызывает легкое ожирение и гипогонадизм, не влияя на чувствительность Т-клеток» . Журнал клинической эндокринологии и метаболизма . 95 (6): 2836–2840. дои : 10.1210/jc.2009-2466 . ПМИД 20382689 .
- ^ Клеман К., Вайс С., Лалу Н., Каброль С., Пеллу В., Кассуто Д. и др. (март 1998 г.). «Мутация в гене рецептора лептина человека вызывает ожирение и дисфункцию гипофиза». Природа . 392 (6674): 398–401. Бибкод : 1998Natur.392..398C . дои : 10.1038/32911 . ПМИД 9537324 . S2CID 4400661 .
- ^ Панков Ю.А. (июнь 1999 г.). «Жировая ткань как эндокринный орган, регулирующий рост, половое созревание и другие физиологические функции». Биохимия. Биохимия . 64 (6): 601–609. ПМИД 10395972 .
- ^ Фаруки И.С., Кио Дж.М., Камат С., Джонс С., Гибсон В.Т., Трасселл Р. и др. (ноябрь 2001 г.). «Частичный дефицит лептина и ожирение человека». Природа . 414 (6859): 34–35. Бибкод : 2001Natur.414...34F . дои : 10.1038/35102112 . ПМИД 11689931 . S2CID 4344492 .
- ^ Фаруки И.С., О'Рахилли С. (октябрь 2008 г.). «Мутации в лигандах и рецепторах пути лептин-меланокортин, приводящие к ожирению». Природная клиническая практика. Эндокринология и обмен веществ . 4 (10): 569–577. дои : 10.1038/ncpendmet0966 . ПМИД 18779842 . S2CID 13946212 .
- ^ Фарвид М.С., Нг Т.В., Чан, округ Колумбия, Барретт П.Х., Уоттс Г.Ф. (июль 2005 г.). «Связь адипонектина и резистина с жировыми тканями, резистентностью к инсулину и дислипидемией». Диабет, ожирение и обмен веществ . 7 (4): 406–413. дои : 10.1111/j.1463-1326.2004.00410.x . ПМИД 15955127 . S2CID 46736884 . ( требуется регистрация )
- ^ Урбанчек М.Г., Пикен Э.Б., Каллиайнен Л.К., Кузон В.М. (май 2001 г.). «Специфический дефицит силы в скелетных мышцах старых крыс частично объясняется наличием денервированных мышечных волокон» . Журналы геронтологии. Серия А, Биологические и медицинские науки . 56 (5): В191–В197. дои : 10.1093/gerona/56.5.B191 . ПМИД 11320099 .
- ^ Болюс В.Р., Гутьеррес Д.А., Кеннеди А.Дж., Андерсон-Баукум Е.К., Хэсти А.Х. (октябрь 2015 г.). «Дефицит CCR2 приводит к увеличению количества эозинофилов, альтернативной активации макрофагов и экспрессии цитокинов 2 типа в жировой ткани» . Журнал биологии лейкоцитов . 98 (4): 467–477. дои : 10.1189/jlb.3HI0115-018R . ПМК 4763864 . ПМИД 25934927 . Архивировано из оригинала 9 мая 2017 г. Проверено 8 сентября 2016 г.
Дальнейшее чтение
[ редактировать ]- Сток MJ, Синти С (2003). «Жировая ткань / Структура и функция бурой жировой ткани». Энциклопедия пищевых наук и питания . стр. 29–34. дои : 10.1016/B0-12-227055-X/00008-0 . ISBN 978-0-12-227055-0 .
- Вернон Р.Г., Флинт-ди-джей (2003). «Жировая ткань / Структура и функция белой жировой ткани». Энциклопедия пищевых наук и питания . стр. 23–29. дои : 10.1016/B0-12-227055-X/00007-9 . ISBN 978-0-12-227055-0 .
Внешние ссылки
[ редактировать ]- Жировая ткань Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Микрофотографии жировой ткани


