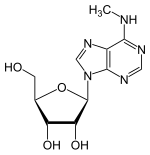
Н 6 -Метиладенозин
 | |
| Имена | |
|---|---|
| Название ИЮПАК Н 6 -Метиладенозин | |
| Систематическое название ИЮПАК ( 2R , 3S , 4R , 5R )-2-(Гидроксиметил)-5-[6-(метиламино)-9H -пурин -9-ил]оксолан-2,3-диол | |
| Другие имена м 6 А | |
| Идентификаторы | |
3D model ( JSmol ) | |
| КЭБ | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 11 Н 15 Н 5 О 4 | |
| Молярная масса | 281.272 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Н 6 -Метиладенозин ( м 6 А ) первоначально был идентифицирован и частично охарактеризован в 1970-х годах, [1] [2] [3] [4] и представляет собой многочисленную модификацию мРНК и ДНК. [5] Он содержится в некоторых вирусах, [4] [3] [6] [7] и большинство эукариот, включая млекопитающих, [2] [1] [8] [9] насекомые, [10] растения [11] [12] [13] и дрожжи. [14] [15] Он также обнаружен в тРНК , рРНК и малых ядерных РНК (мяРНК), а также в некоторых длинных некодирующих РНК , таких как Xist . [16] [17]
Метилирование m аденозина большим направляется 6 Комплекс метилтрансферазы , содержащий METTL3 , субъединицу, которая связывает S -аденозил- L -метионин (SAM). [18] In vitro этот комплекс метилтрансферазы преимущественно метилирует олигонуклеотиды РНК, содержащие GGACU. [19] и аналогичное предпочтение было выявлено in vivo у картированных m 6 Сайты А в вируса саркомы Рауса геномной РНК [20] и в мРНК бычьего пролактина . [21] Более поздние исследования охарактеризовали другие ключевые компоненты м. 6 Комплекс метилтрансферазы у млекопитающих, включая METTL14 , [22] [23] Белок, ассоциированный с опухолью Вильмса 1 ( WTAP ), [22] [24] ВИРМА [25] и МЕТТЛ5 . [26] После спекуляций 2010 года о м. 6 A в мРНК динамична и обратима, [27] открытие первого м 6 Деметилаза, жировая масса и белок, связанный с ожирением ( FTO ) в 2011 г. [28] подтвердил эту гипотезу и оживил интерес к изучению м. 6 А. Второй м 6 гомолог 5 деметилазы alkB (ALKBH5). Позже был также открыт [29]
Биологические функции м. 6 А опосредованы группой РНК-связывающих белков, которые специфически распознают метилированный аденозин на РНК. Эти связывающие белки называются m. 6 Читатели. Семейство домена гомологии YT521-B (YTH) белков ( YTHDF1 , YTHDF2 , YTHDF3 и YTHDC1 ) было охарактеризовано как прямой м 6 Читатели и имеют сохраненный м 6 Карман с переплетом. [17] [30] [31] [32] [33] мРНК-связывающие белки инсулиноподобного фактора роста-2 1 , 2 и 3 (IGF2BP1–3) представляют собой новый класс мРНК. Сообщается, что 6 Читатели. [34] IGF2BP используют домены K-гомологии (KH) для избирательного распознавания m6A-содержащих РНК и стимулирования их трансляции и стабильности. [34] Эти м 6 Читатели вместе с м. 6 Метилтрансферазы (писатели) и деметилазы (ластики) устанавливают сложный механизм м. 6 Постановление, согласно которому писатели и ластики определяют распределение m 6 A на РНК, тогда как читатели опосредуют m 6 А-зависимые функции. м 6 Также было показано, что A опосредует структурный переключатель, называемый m. 6 Переключатель. [35]
Специфика м. 6 Установка на мРНК контролируется архитектурой экзонов и комплексами соединений экзонов . Соединительные комплексы экзонов подавляют m 6 Метилирование вблизи соединений экзон-экзон путем упаковки близлежащей РНК и защиты ее от метилирования м 6 Метилтрансферазный комплекс. м 6 Области А в длинных внутренних и терминальных экзонах, вдали от соединений экзонов и комплексов соединений экзонов, избегают подавления и могут метилироваться комплексом метилтрансферазы. [36]
Распространение видов
[ редактировать ]Дрожжи
[ редактировать ]почкующихся дрожжей ( Saccharomyces cerevisiae ) экспрессия гомолога METTL3 , У IME4, индуцируется в диплоидных клетках в ответ на голодание по азоту и ферментируемому углероду и необходима для метилирования мРНК и инициации правильного мейоза и споруляции. [14] [15] Известно, что мРНК IME1 и IME2, ключевых ранних регуляторов мейоза , являются мишенями для метилирования , как и транскрипты самого IME4. [15]
Растения
[ редактировать ]У растений большая часть м. 6 А находится в пределах 150 нуклеотидов перед началом хвоста поли(А) . [37]
Мутации MTA, Arabidopsis thaliana гомолога METTL3 , приводят к остановке эмбриона на глобулярной стадии . Уменьшение m >90% 6 Уровни а в зрелых растениях приводят к резкому изменению моделей роста и цветочным гомеотическим отклонениям. [37]
Млекопитающие
[ редактировать ]Картирование м 6 В РНК человека и мыши обнаружено более 18 000 мкМ. 6 Сайты в транскриптах более 7000 генов человека с консенсусной последовательностью [G/A/U][G>A]m. 6 AC[U>A/C] [16] [17] [38] соответствует ранее выявленному мотиву. Локализация отдельных м 6 Сайты во многих мРНК человека и мыши очень схожи . [16] [17] и полнотранскриптомный анализ показывает, что m 6 А встречается в регионах с высокой эволюционной консервативностью . [16] м 6 А обнаруживается внутри длинных внутренних экзонов и преимущественно обогащен внутри 3'-UTR и вокруг стоп-кодонов . м 6 А внутри 3'-UTR также связано с наличием микроРНК сайтов связывания ; примерно 2/3 мРНК, которые содержат м 6 Сайт внутри их 3'-UTR также имеет по крайней мере один сайт связывания микроРНК. [16] Интегрируя все m 6 По данным секвенирования, новая база данных под названием RMBase идентифицировала и предоставила около 200 000 сайтов в геномах человека и мыши, соответствующих N6-метиладенозинам (м 6 А) в РНК. [38]
Точное сопоставление m6A с помощью m6A-CLIP/IP [39] (кратко m6A- CLIP ) выявило, что большая часть m6A локализуется в последнем экзоне мРНК во многих тканях/культивируемых клетках мыши и человека, [39] и обогащение m6A вокруг стоп-кодонов является совпадением: многие стоп-кодоны располагаются в начале последних экзонов, где m6A действительно обогащен. [39] Основное присутствие m6A в последнем экзоне (>=70%) обеспечивает возможность регуляции 3'UTR, включая альтернативное полиаденилирование. [39] Исследование, сочетающее m6A-CLIP со строгой биохимией фракционирования клеток, показывает, что модификации мРНК m6A депонируются в зарождающейся пре-мРНК и не требуются для сплайсинга, но определяют цитоплазматический оборот. [40] [41]
м 6 А подвержен динамической регуляции как на протяжении развития, так и в ответ на клеточные стимулы. Анализ м 6 А в РНК мозга мыши показывает, что m 6 Уровни А низки во время эмбрионального развития и резко возрастают к взрослому возрасту. [16] Было показано, что в мЭСК и во время развития мышей FTO опосредует РНК LINE1 m. 6 Деметилирование и, следовательно, влияет на локальное состояние хроматина и транскрипцию близлежащих генов. [42] Кроме того, отключение звука m 6 Метилтрансфераза TP53 существенно влияет на экспрессию генов и альтернативные модели сплайсинга РНК , что приводит к модуляции сигнального пути p53 (также известного как ) и апоптозу . [17]
м 6 А также обнаружен в компонентах РНК R-петлей в клетках человека, где он участвует в регуляции стабильности гибридов РНК:ДНК. [43]
Важность м 6 Недавно было продемонстрировано метилирование физиологических процессов. Ингибирование м 6 Метилирование посредством фармакологического ингибирования клеточного метилирования или, более конкретно, посредством siRNA -опосредованного подавления m 6 Метилаза Mettl3 приводила к удлинению циркадного периода. Напротив, сверхэкспрессия Mettl3 приводила к более короткому периоду. млекопитающих Циркадные часы , состоящие из петли обратной связи транскрипции, жестко регулируемой для колебаний с периодом около 24 часов, поэтому чрезвычайно чувствительны к возмущениям в организме. 6 А-зависимый процессинг РНК, вероятно, из-за присутствия м. 6 Сайты внутри транскриптов часового гена. [44] [45] Эффекты глобального ингибирования метилирования на циркадный период в клетках мышей можно предотвратить путем эктопической экспрессии фермента бактериального метаболизма метила. Мышиные клетки, экспрессирующие этот бактериальный белок, были устойчивы к фармакологическому ингибированию метаболизма метила, не обнаруживая снижения количества мРНК м. 6 Метилирование или метилирование белка . [46]
Клиническое значение
[ редактировать ]Учитывая универсальные функции m 6 Поэтому неудивительно, что в различных физиологических процессах обнаруживаются связи между м. 6 А и многочисленные болезни человека; многие из них возникли в результате мутаций или однонуклеотидных полиморфизмов (SNP) родственных факторов m. 6 А. Связи между м 6 В отчетах были указаны А и многочисленные типы рака, включая рак желудка , рак простаты , рак молочной железы , рак поджелудочной железы , рак почки , мезотелиому , саркому и лейкемию . [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] Воздействие м 6 С появлением большего количества данных вопрос о распространении раковых клеток может оказаться гораздо более глубоким. Известно, что истощение METTL3 вызывает апоптоз раковых клеток и снижает инвазивность раковых клеток. [59] [60] в то время как было показано, что активация ALKBH5 в результате гипоксии вызывает обогащение раковых стволовых клеток. [61] м 6 A также был показан в регуляции энергетического гомеостаза и ожирения, поскольку FTO является ключевым регуляторным геном энергетического метаболизма и ожирения. SNP FTO связаны с индексом массы тела в человеческих популяциях и возникновением ожирения и диабета. Было показано, что [62] [63] [64] [65] [66] о влиянии FTO на дифференцировку преадипоцитов . Высказано предположение [67] [68] [69] Связь между м. 6 Также изучались А и нейрональные расстройства. Например, на нейродегенеративные заболевания могут влиять м. 6 Было показано, что родственная передача сигналов дофамина зависит от FTO и корректирует m. 6 Метилирование ключевых сигнальных транскриптов. [70] Мутации в HNRNPA2B1 , потенциальном считывателе m 6 Известно, что A вызывает нейродегенерацию. [71] IGF2BP1–3, новый класс м. 6 Читатель, обладает онкогенными функциями. Нокаут или нокаут IGF2BP1–3 снижал экспрессию белка MYC, пролиферацию клеток и образование колоний в линиях раковых клеток человека. [34] ZC3H13 . , член комплекса метилтрансферазы m6A, заметно ингибирует рост клеток колоректального рака в нокдауне [72]
Кроме того, м 6 Сообщалось, что А влияет на вирусные инфекции. Известно, что многие РНК-вирусы, включая SV40, аденовирус, вирус герпеса, вирус саркомы Рауса и вирус гриппа, содержат внутренние м 6 Метилирование геномной РНК вируса. [73] Несколько более поздних исследований показали, что м. 6 Регуляторы A регулируют эффективность заражения, репликации, трансляции и транспорта РНК-вирусов, таких как вирус иммунодефицита человека (ВИЧ), вирус гепатита B (HBV), вирус гепатита C (HCV) и вирус Зика (ZIKV). [74] [75] [76] [77] [78] [79] Эти результаты позволяют предположить, что м. 6 А и родственные ему факторы играют решающую роль в регуляции жизненного цикла вируса и взаимодействия вируса с хозяином.
Помимо воздействия на сами вирусы, м 6 Модификации также могут нарушить врожденный иммунный ответ. Например, при ВГВ м 6 Было показано, что модификации нарушают распознавание вирусов RIG-1, рецептором распознавания образов в иммунной системе. Модификации также могут нарушать последующие сигнальные пути посредством механизмов, включая убиквитинирование и изменения уровней экспрессии белка. [79]
У бактерий
[ редактировать ]Метилирование M6A также широко распространено у бактерий , влияя на такие функции, как репликация ДНК , репарация и экспрессия генов , а также защита прокариот.
При репликации модификации M6A маркируют области ДНК, где происходит стадия инициации, а также регулируют точное время с помощью Dam метилтрансферазы в E. coli . [80] [81] Другой фермент, Dam ДНК-метилаза, регулирует восстановление несоответствий с помощью модификаций M6A, которые влияют на другие белки репарации, распознавая определенные несоответствия. [82]
В некоторых случаях защиты ДНК метилирование M6A (наряду с модификациями M4C) играет роль в защите бактериальной ДНК, воздействуя на определенные эндонуклеазы через систему рестрикции-модификации , уменьшая влияние бактериофагов . Одной из таких ролей является введение метилтрансферазы, которая распознает тот же сайт-мишень, который атакуют ферменты рестрикции (ферменты рестрикции типа 1), и модифицирует его, чтобы не дать таким ферментам атаковать ДНК бактерий. [83] [84]
В разработке
[ редактировать ]м 6 Было показано, что модификации, наряду с другими эпигенетическими изменениями, играют важную роль в развитии эукариот. гематопоэтические стволовые клетки (HSC), нейрональные стволовые клетки (NSC) и первичные зародышевые клетки (PCG) подвергаются м Было показано, что 6 Модификации во время роста и дифференцировки. В зависимости от стадии развития модификации ЗКП могут либо способствовать, либо ингибировать дифференцировку стволовых клеток, влияя на переход от эпителия к гемопоэтическому через ингибирование или истощение METTL3. м 6 Модификации НСК могут вызвать изменения размера мозга, формирования нейронов, долговременной памяти и способности к обучению. Эти изменения часто вызваны торможением чтения и записи METTL или YTHDF . В репродуктивной системе м 6 Было показано, что модификации нарушают переход мРНК от материнской к зиготической и отрицательно влияют как на образование гамет, так и на фертильность. Как и в случае с НСК, ингибирование белков семейств METTL и YTHDF часто является катализатором этих изменений. [85]
Ссылки
[ редактировать ]- ^ Jump up to: а б Адамс Дж. М., Кори С. (май 1975 г.). «Модифицированные нуклеозиды и причудливые 5'-концы мРНК миеломы мыши» . Природа . 255 (5503): 28–33. Бибкод : 1975Natur.255...28A . дои : 10.1038/255028a0 . ПМИД 1128665 . S2CID 4199864 .
- ^ Jump up to: а б Дерозье Р., Фридеричи К., Роттман Ф. (октябрь 1974 г.). «Идентификация метилированных нуклеозидов в информационной РНК клеток гепатомы Новикова» . Труды Национальной академии наук Соединенных Штатов Америки . 71 (10): 3971–3975. Бибкод : 1974PNAS...71.3971D . дои : 10.1073/pnas.71.10.3971 . ПМК 434308 . ПМИД 4372599 .
- ^ Jump up to: а б Алони Ю., Дхар Р., Хури Дж. (октябрь 1979 г.). «Метилирование 40 РНК ядерного вируса обезьян» . Журнал вирусологии . 32 (1): 52–60. doi : 10.1128/JVI.32.1.52-60.1979 . ПМК 353526 . ПМИД 232187 .
- ^ Jump up to: а б Бимон К., Кейт Дж (июнь 1977 г.). «Локализация N6-метиладенозина в геноме вируса саркомы Рауса». Журнал молекулярной биологии . 113 (1): 165–179. дои : 10.1016/0022-2836(77)90047-X . ПМИД 196091 .
- ^ Цзи П, Ван Х, Се Н, Ли Ю (2018). «N6-Метиладенозин в РНК и ДНК: эпитранскриптомный и эпигенетический игрок, участвующий в определении судьбы стволовых клеток» . Стволовые клетки Интернешнл . 2018 : 3256524. doi : 10.1155/2018/3256524 . ПМК 6199872 . ПМИД 30405719 .
- ^ Кортни Д.Г., Кеннеди Э.М., Дамм Р.Э., Богерд Х.П., Цай К., Хитон Н.С., Каллен Б.Р. (сентябрь 2017 г.). «Эпитранскриптомное усиление экспрессии и репликации генов вируса гриппа А» . Клетка-хозяин и микроб . 22 (3): 377–386.e5. дои : 10.1016/j.chom.2017.08.004 . ПМК 5615858 . ПМИД 28910636 .
- ^ Гохале Н.С., Макинтайр А.Б., Макфадден М.Дж., Родер А.Е., Кеннеди Э.М., Гандара Дж.А. и др. (ноябрь 2016 г.). «N6-Метиладенозин в геномах вирусной РНК Flaviviridae регулирует инфекцию» . Клетка-хозяин и микроб . 20 (5): 654–665. дои : 10.1016/j.chom.2016.09.015 . ПМК 5123813 . ПМИД 27773535 .
- ^ Вэй С.М., Гершовиц А., Мосс Б. (январь 1976 г.). «5'-концевые и внутренние метилированные нуклеотидные последовательности в мРНК клеток HeLa». Биохимия . 15 (2): 397–401. дои : 10.1021/bi00647a024 . ПМИД 174715 .
- ^ Перри Р.П., Келли Д.Е., Фридеричи К., Роттман Ф. (апрель 1975 г.). «Метилированные компоненты информационной РНК L-клеток: свидетельства необычного кластера на 5'-конце» . Клетка . 4 (4): 387–394. дои : 10.1016/0092-8674(75)90159-2 . ПМИД 1168101 .
- ^ Левис Р., Пенман С. (апрель 1978 г.). «5'-концевые структуры поли(А)+ цитоплазматической информационной РНК и поли(А)+ и поли(А)- гетерогенных ядерных РНК клеток двукрылых Drosophila melanogaster». Журнал молекулярной биологии . 120 (4): 487–515. дои : 10.1016/0022-2836(78)90350-9 . ПМИД 418182 .
- ^ Николс Дж.Л. (1979). «В кукурузе поли(А)-содержащая РНК». Письма о науке о растениях . 15 (4): 357–361. дои : 10.1016/0304-4211(79)90141-X .
- ^ Кеннеди Т.Д., Лейн Б.Г. (июнь 1979 г.). «Рибонуклеаты эмбрионов пшеницы. XIII. Метилзамещенные нуклеозидные компоненты и 5'-концевые динуклеотидные последовательности в объемной поли(AR)-богатой РНК из впитывающих зародышей пшеницы». Канадский журнал биохимии . 57 (6): 927–931. дои : 10.1139/o79-112 . ПМИД 476526 .
- ^ Чжун С., Ли Х., Боди З., Баттон Дж., Веспа Л., Херцог М., Фрай Р.Г. (май 2008 г.). «МТА представляет собой информационную РНК-аденозинметилазу Arabidopsis и взаимодействует с гомологом фактора сплайсинга, специфичного для пола» . Растительная клетка . 20 (5): 1278–1288. дои : 10.1105/tpc.108.058883 . ПМЦ 2438467 . ПМИД 18505803 .
- ^ Jump up to: а б Клэнси М.Дж., Шамбо М.Э., Тимпте К.С., Бокар Дж.А. (октябрь 2002 г.). «Индукция споруляции у Saccharomyces cerevisiae приводит к образованию N6-метиладенозина в мРНК: потенциальный механизм активности гена IME4» . Исследования нуклеиновых кислот . 30 (20): 4509–4518. дои : 10.1093/нар/gkf573 . ПМК 137137 . ПМИД 12384598 .
- ^ Jump up to: а б с Боди З., Баттон Дж.Д., Грирсон Д., Фрэй Р.Г. (сентябрь 2010 г.). «Дрожжевые мишени для метилирования мРНК» . Исследования нуклеиновых кислот . 38 (16): 5327–5335. дои : 10.1093/нар/gkq266 . ПМЦ 2938207 . ПМИД 20421205 .
- ^ Jump up to: а б с д и ж Мейер К.Д., Салеторе Ю., Зумбо П., Элементо О, Мейсон С.Э., Джеффри С.Р. (июнь 2012 г.). «Комплексный анализ метилирования мРНК показывает обогащение 3'-UTR и ближайшими стоп-кодонами» . Клетка . 149 (7): 1635–1646. дои : 10.1016/j.cell.2012.05.003 . ПМЦ 3383396 . ПМИД 22608085 .
- ^ Jump up to: а б с д и Доминисини Д., Мошич-Мошковитц С., Шварц С., Салмон-Дивон М., Унгар Л., Озенберг С. и др. (апрель 2012 г.). «Топология метиломов РНК m6A человека и мыши, выявленная с помощью m6A-seq». Природа . 485 (7397): 201–206. Бибкод : 2012Natur.485..201D . дои : 10.1038/nature11112 . ПМИД 22575960 . S2CID 3517716 .
- ^ Бокар Дж.А., Шамбо М.Э., Полайес Д., Матера А.Г., Роттман Ф.М. (ноябрь 1997 г.). «Очистка и клонирование кДНК AdoMet-связывающей субъединицы мРНК человека (N6-аденозин)-метилтрансферазы» . РНК . 3 (11): 1233–1247. ПМЦ 1369564 . ПМИД 9409616 .
- ^ Харпер Дж. Э., Мичели С. М., Робертс Р. Дж., Мэнли Дж. Л. (октябрь 1990 г.). «Специфичность последовательности человеческой мРНК N6-аденозинметилазы in vitro» . Исследования нуклеиновых кислот . 18 (19): 5735–5741. дои : 10.1093/нар/18.19.5735 . ПМК 332308 . ПМИД 2216767 .
- ^ Кейн С.Е., Бимон К. (сентябрь 1985 г.). «Точная локализация m6A в РНК вируса саркомы Рауса выявляет кластеризацию сайтов метилирования: последствия для процессинга РНК» . Молекулярная и клеточная биология . 5 (9): 2298–2306. дои : 10.1128/mcb.5.9.2298 . ПМК 366956 . ПМИД 3016525 .
- ^ Горовиц С., Горовиц А., Нильсен Т.В., Маннс Т.В., Роттман Ф.М. (сентябрь 1984 г.). «Картирование остатков N6-метиладенозина в мРНК бычьего пролактина» . Труды Национальной академии наук Соединенных Штатов Америки . 81 (18): 5667–5671. Бибкод : 1984PNAS...81.5667H . дои : 10.1073/pnas.81.18.5667 . ПМК 391771 . ПМИД 6592581 .
- ^ Jump up to: а б Лю Дж, Юэ Ю, Хань Д., Ван Х, Фу Ю, Чжан Л. и др. (февраль 2014 г.). «Комплекс METTL3-METTL14 опосредует метилирование N6-аденозина ядерной РНК млекопитающих» . Химическая биология природы . 10 (2): 93–95. дои : 10.1038/nchembio.1432 . ПМЦ 3911877 . ПМИД 24316715 .
- ^ Ван Ю, Ли Ю, Тот Цзи, Петроски, доктор медицинских наук, Чжан З, Чжао Дж. К. (февраль 2014 г.). «Модификация N6-метиладенозина дестабилизирует регуляторы развития эмбриональных стволовых клеток» . Природная клеточная биология . 16 (2): 191–198. дои : 10.1038/ncb2902 . ПМЦ 4640932 . ПМИД 24394384 .
- ^ Пинг XL, Сунь Б.Ф., Ван Л., Сяо В., Ян Х, Ван В.Дж. и др. (февраль 2014 г.). «WTAP млекопитающих является регуляторной субъединицей РНК N6-метиладенозинметилтрансферазы» . Клеточные исследования . 24 (2): 177–189. дои : 10.1038/cr.2014.3 . ПМЦ 3915904 . ПМИД 24407421 .
- ^ Шварц С., Мумбах М.Р., Йованович М., Ван Т., Мациаг К., Бушкин Г.Г. и др. (июль 2014 г.). «Возмущение авторов m6A выявляет два различных класса метилирования мРНК во внутренних и 5'-сайтах» . Отчеты по ячейкам . 8 (1): 284–296. дои : 10.1016/j.celrep.2014.05.048 . ПМЦ 4142486 . ПМИД 24981863 .
- ^ ван Тран Н., Эрнст Ф.Г., Хоули Б.Р., Зорбас С., Ульрик Н., Хакерт П. и др. (сентябрь 2019 г.). «Метилтрансфераза 18S рРНК m6A человека METTL5 стабилизируется TRMT112» . Исследования нуклеиновых кислот . 47 (15): 7719–7733. дои : 10.1093/nar/gkz619 . ПМК 6735865 . ПМИД 31328227 .
- ^ Он С (декабрь 2010 г.). «Комментарий к грандиозному вызову: эпигенетика РНК?». Химическая биология природы . 6 (12): 863–865. дои : 10.1038/nchembio.482 . ПМИД 21079590 .
- ^ Цзя Г, Фу Ю, Чжао Икс, Дай Ц, Чжэн Г, Ян Ю и др. (октябрь 2011 г.). «N6-метиладенозин в ядерной РНК является основным субстратом FTO, связанного с ожирением» . Химическая биология природы . 7 (12): 885–887. дои : 10.1038/nchembio.687 . ПМК 3218240 . ПМИД 22002720 .
- ^ Чжэн Г., Даль Дж.А., Ню Ю., Федорчак П., Хуанг С.М., Ли С.Дж. и др. (январь 2013 г.). «ALKBH5 — это РНК-деметилаза млекопитающих, которая влияет на метаболизм РНК и фертильность мышей» . Молекулярная клетка . 49 (1): 18–29. дои : 10.1016/j.molcel.2012.10.015 . ПМЦ 3646334 . ПМИД 23177736 .
- ^ Ван X, Лу З, Гомес А, Хон Г.К., Юэ Ю, Хан Д. и др. (январь 2014 г.). «N6-метиладенозин-зависимая регуляция стабильности информационной РНК» . Природа . 505 (7481): 117–120. Бибкод : 2014Natur.505..117W . дои : 10.1038/nature12730 . ПМЦ 3877715 . ПМИД 24284625 .
- ^ Ван X, Чжао Б.С., Раундтри И.А., Лу З., Хан Д., Ма Х. и др. (июнь 2015 г.). «N (6)-метиладенозин модулирует эффективность трансляции информационной РНК» . Клетка . 161 (6): 1388–1399. дои : 10.1016/j.cell.2015.05.014 . ПМЦ 4825696 . ПМИД 26046440 .
- ^ Сюй С, Ван X, Лю К, Раундтри И.А., Темпель В., Ли Ю и др. (ноябрь 2014 г.). «Структурная основа селективного связывания РНК m6A доменом YTHDC1 YTH». Химическая биология природы . 10 (11): 927–929. дои : 10.1038/nchembio.1654 . ПМИД 25242552 .
- ^ Сяо В., Адхикари С., Дахал У, Чен Ю.С., Хао Ю.Дж., Сунь Б.Ф. и др. (февраль 2016 г.). «Ядерный считыватель m(6)A YTHDC1 регулирует сплайсинг мРНК» . Молекулярная клетка . 61 (4): 507–519. doi : 10.1016/j.molcel.2016.01.012 . ПМИД 26876937 .
- ^ Jump up to: а б с Хуан Х., Вэн Х., Сунь В., Цинь Х., Ши Х., У Х. и др. (март 2018 г.). «Распознавание РНК N 6 -метиладенозин белками IGF2BP повышает стабильность и трансляцию мРНК» . Nature Cell Biology . 20 (3): 285–295. : 10.1038 /s41556-018-0045-z . PMC 5826585. . PMID 29476152 doi
- ^ Лю Н, Дай Ц, Чжэн Г, Хэ С, Парижьен М, Пан Т (февраль 2015 г.). «N (6)-метиладенозин-зависимые структурные переключатели РНК регулируют взаимодействия РНК-белок» . Природа . 518 (7540): 560–564. Бибкод : 2015Natur.518..560L . дои : 10.1038/nature14234 . ПМЦ 4355918 . ПМИД 25719671 .
- ^ He PC, Wei J, Dou X, Harada BT, Zhang Z, Ge R и др. (февраль 2023 г.). «Архитектура экзонов контролирует мРНК м 6 Подавление и экспрессия генов» . Science . 379 (6633): 677–682. Бибкод : 2023Sci...379..677H doi : 10.1126 /science.abj9090 . PMC 9990141. . PMID 36705538 .
- ^ Jump up to: а б Боди З., Чжун С., Мехра С., Сонг Дж., Грэм Н., Ли Х. и др. (2012). «Метилирование аденозина в мРНК Arabidopsis связано с 3'-концом, и пониженные уровни вызывают дефекты развития» . Границы в науке о растениях . 3 : 48. doi : 10.3389/fpls.2012.00048 . ПМЦ 3355605 . ПМИД 22639649 .
- ^ Jump up to: а б Сунь В.Дж., Ли Дж.Х., Лю С., Ву Дж., Чжоу Х., Цюй Л.Х., Ян Дж.Х. (январь 2016 г.). «RMBase: ресурс для расшифровки ландшафта модификаций РНК на основе данных высокопроизводительного секвенирования» . Исследования нуклеиновых кислот . 44 (Д1): Д259–Д265. дои : 10.1093/нар/gkv1036 . ПМК 4702777 . ПМИД 26464443 .
- ^ Jump up to: а б с д Ке С., Алему Э.А., Мертенс С., Гантман ЕС, Фак Дж.Дж., Меле А. и др. (октябрь 2015 г.). «Большинство остатков m6A находится в последних экзонах, что дает возможность регуляции 3'-UTR» . Гены и развитие . 29 (19): 2037–2053. дои : 10.1101/gad.269415.115 . ПМЦ 4604345 . ПМИД 26404942 .
- ^ Ке С., Пандья-Джонс А., Сайто Ю., Фак Дж.Дж., Вогбё С.Б., Геула С. и др. (май 2017 г.). "м 6 Модификации мРНК депонируются в формирующейся пре-мРНК и не требуются для сплайсинга, но определяют цитоплазматический оборот» Genes & Development . 31 (10): 990–1006. doi : 10.1101/gad.301036.117 . PMC 5495127. . PMID 28637692 .
- ^ Роза-Меркадо Н.А., Уизерс Дж.Б., Стейц Дж.А. (май 2017 г.). «Настройка м 6 Спор: метилирование зрелой мРНК не является динамичным, но ускоряет оборот» Genes & Development . 31 (10): 957–958. doi : 10.1101/gad.302695.117 . PMC 5495124. . PMID 28637691 .
- ^ Вэй Дж., Юй Х., Ян Л., Лю Х., Гао Б., Хуан Б. и др. (май 2022 г.). «FTO опосредует LINE1 м 6 Деметилирование и регуляция хроматина в мЭСК и развитие мышей» . Science . 376 (6596): 968–973. Bibcode : ...376..968W . doi : 10.1126/science.abe9582 . PMC 9746489. 2022Sci PMID 35511947 .
- ^ Абакир А., Джайлз Т.С., Кристини А., Фостер Дж.М., Дай Н., Старчак М. и др. (январь 2020 г.). "Н 6 -метиладенозин регулирует стабильность гибридов РНК:ДНК в клетках человека» . Nature Genetics . 52 (1): 48–55. : 10.1038 /s41588-019-0549-x . PMC 6974403. . PMID 31844323 doi
- ^ Фустин Дж.М., Дои М., Ямагути Ю., Хида Х., Нисимура С., Ёсида М. и др. (ноябрь 2013 г.). «Зависящая от метилирования РНК обработка РНК контролирует скорость циркадных часов» . Клетка . 155 (4): 793–806. дои : 10.1016/j.cell.2013.10.026 . ПМИД 24209618 .
- ^ Гастингс М.Х. (ноябрь 2013 г.). «Метилирование мРНК m (6)A: новый циркадный ритм» . Клетка . 155 (4): 740–741. дои : 10.1016/j.cell.2013.10.028 . ПМИД 24209613 .
- ^ Фустин Дж.М., Йе С., Рейкерс С., Канеко К., Фукумото К., Ямано М. и др. (май 2020 г.). «Дефицит метилирования нарушает биологические ритмы, передаваемые от бактерий к человеку» . Коммуникационная биология . 3 (1): 211. дои : 10.1038/s42003-020-0942-0 . ПМК 7203018 . ПМИД 32376902 .
- ^ Акилжанова А, Нуркина З, Момыналиев К, Раманкулов Е, Жумадилов З, Рахыпбеков Т и др. (сентябрь 2013 г.). «Генетический профиль и детерминанты уровня гомоцистеина у казахстанских больных раком молочной железы». Противораковые исследования . 33 (9): 4049–4059. ПМИД 24023349 .
- ^ Редди С.М., Садим М., Ли Дж., Йи Н., Агарвал С., Манцорос К.С., Какламани В.Г. (август 2013 г.). «Клинические и генетические предикторы увеличения веса у пациенток с диагнозом рак молочной железы» . Британский журнал рака . 109 (4): 872–881. дои : 10.1038/bjc.2013.441 . ПМЦ 3749587 . ПМИД 23922112 .
- ^ Хейлигер К.Дж., Хесс Дж., Витальяно Д., Салерно П., Бразельманн Х., Сальваторе Г. и др. (июнь 2012 г.). «Новые гены-кандидаты опухолевого генеза щитовидной железы идентифицированы у трансгенных мышей Trk-T1» . Эндокринный рак . 19 (3): 409–421. дои : 10.1530/ERC-11-0387 . ПМИД 22454401 .
- ^ Ортега А., Никшич М., Бачи А., Вильм М., Санчес Л., Хасти Н., Валькарсель Дж. (январь 2003 г.). «Биохимическая функция женских летальных белков (2)D/Wilms', связанных с опухолевым супрессором-1, в альтернативном сплайсинге пре-мРНК» . Журнал биологической химии . 278 (5): 3040–3047. дои : 10.1074/jbc.M210737200 . hdl : 10261/162976 . ПМИД 12444081 .
- ^ Джин ДИ, Ли С.В., Хан МЭ, Ким Х.Дж., Со С.А., Хур Джи и др. (декабрь 2012 г.). «Экспрессия и роль белка, ассоциированного с опухолью Вильмса 1, при глиобластоме» . Раковая наука . 103 (12): 2102–2109. дои : 10.1111/cas.12022 . ПМЦ 7659328 . ПМИД 22957919 .
- ^ Лин Ю, Уэда Дж, Ягю К, Исии Х, Уэно М, Эгава Н и др. (июль 2013 г.). «Связь между изменениями жировой массы, генами, связанными с ожирением, и риском рака поджелудочной железы: исследование случай-контроль в Японии» . БМК Рак . 13 :337. дои : 10.1186/1471-2407-13-337 . ПМЦ 3716552 . ПМИД 23835106 .
- ^ Казаленьо-Гардуньо Р., Шмитт А., Ван Х, Сюй Х, Шмитт М. (октябрь 2010 г.). «Опухоль Вильмса 1 как новая мишень для иммунотерапии лейкемии». Процедура трансплантации . 42 (8): 3309–3311. doi : 10.1016/j.transproceed.2010.07.034 . ПМИД 20970678 .
- ^ Линнебахер М., Винк А., Бёк И., Клар Э. (18 марта 2010 г.). «Идентификация опухолеспецифического цитотоксического Т-клеточного эпитопа MSI-H, генерируемого (-1) каркасом U79260(FTO)» . Журнал биомедицины и биотехнологии . 2010 : 841451. doi : 10.1155/2010/841451 . ПМЦ 2842904 . ПМИД 20339516 .
- ^ Мачиела М.Дж., Линдстрем С., Аллен Н.Е., Хайман К.А., Альбанес Д., Баррикарт А. и др. (декабрь 2012 г.). «Связь вариантов предрасположенности к диабету 2 типа с повышенным риском рака простаты в Консорциуме когорты рака молочной железы и простаты» . Американский журнал эпидемиологии . 176 (12): 1121–1129. дои : 10.1093/aje/kws191 . ПМЦ 3571230 . ПМИД 23193118 .
- ^ Лонг Дж., Чжан Б., Синьорелло Л.Б., Цай К., Деминг-Халверсон С., Шрубсоль М.Дж. и др. (08 апреля 2013 г.). «Оценка вариантов риска рака молочной железы, выявленных в ходе полногеномного исследования ассоциаций, у афроамериканских женщин» . ПЛОС ОДИН . 8 (4): е58350. Бибкод : 2013PLoSO...858350L . дои : 10.1371/journal.pone.0058350 . ПМК 3620157 . ПМИД 23593120 .
- ^ Какламани В., Йи Н., Садим М., Сизиопику К., Чжан К., Сюй Ю. и др. (апрель 2011 г.). «Роль гена, связанного с жировой массой и ожирением (FTO), в риске рака молочной железы» . BMC Медицинская генетика . 12:52 . дои : 10.1186/1471-2350-12-52 . ПМК 3089782 . ПМИД 21489227 .
- ^ Пирс Б.Л., Остин Массачусетс, Ахсан Х. (июнь 2011 г.). «Ассоциированное исследование вариантов генетической предрасположенности к диабету 2 типа и риска рака поджелудочной железы: анализ данных PanScan-I» . Причины рака и борьба с ним . 22 (6): 877–883. дои : 10.1007/s10552-011-9760-5 . ПМК 7043136 . ПМИД 21445555 .
- ^ Бокар Дж.А. (1 января 2005 г.). «Биосинтез и функциональная роль метилированных нуклеозидов в мРНК эукариот». В Грожане Х. (ред.). Тонкая настройка функций РНК путем модификации и редактирования . Темы современной генетики. Том. 12. Шпрингер Берлин Гейдельберг. стр. 141–177. дои : 10.1007/b106365 . ISBN 9783540244950 .
- ^ Лин С., Чой Дж., Дю П., Трибуле Р., Грегори Р.И. (май 2016 г.). «Метилтрансфераза m (6)A METTL3 способствует трансляции в раковых клетках человека» . Молекулярная клетка . 62 (3): 335–345. doi : 10.1016/j.molcel.2016.03.021 . ПМК 4860043 . ПМИД 27117702 .
- ^ Чжан С., Саманта Д., Лу Х., Буллен Дж.В., Чжан Х., Чен И. и др. (апрель 2016 г.). «Гипоксия индуцирует фенотип стволовых клеток рака молочной железы посредством HIF-зависимого и ALKBH5-опосредованного m⁶A-деметилирования мРНК NANOG» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (14): E2047–E2056. Бибкод : 2016PNAS..113E2047Z . дои : 10.1073/pnas.1602883113 . ПМЦ 4833258 . ПМИД 27001847 .
- ^ Лоос Р.Дж., Йео Г.С. (январь 2014 г.). «Более полная картина FTO: первый ген ожирения, выявленный GWAS» . Обзоры природы. Эндокринология . 10 (1): 51–61. дои : 10.1038/nrendo.2013.227 . ПМЦ 4188449 . ПМИД 24247219 .
- ^ Фрейлинг Т.М., Тимпсон, Нью-Джерси, Уидон М.Н., Зеггини Э., Фрити Р.М., Линдгрен К.М. и др. (май 2007 г.). «Распространенный вариант гена FTO связан с индексом массы тела и предрасполагает к ожирению у детей и взрослых» . Наука . 316 (5826): 889–894. Бибкод : 2007Sci...316..889F . дои : 10.1126/science.1141634 . ПМК 2646098 . ПМИД 17434869 .
- ^ Ван Л., Юй Ц, Сюн Ю, Лю Л, Чжан Х, Чжан Цз и др. (2013). «Вариант rs1421085 в гене FTO способствует детскому ожирению у китайских детей в возрасте 3-6 лет». Исследования ожирения и клиническая практика . 7 (1): е14–е22. дои : 10.1016/j.orcp.2011.12.007 . ПМИД 24331679 .
- ^ Калнина И., Захаренко Л., Вайваде И., Ровите В., Никитина-Заке Л., Пекулис Р. и др. (сентябрь 2013 г.). «Полиморфизмы в FTO и рядом с TMEM18 связаны с диабетом 2 типа и предрасполагают к более молодому возрасту при диагностике диабета». Джин . 527 (2): 462–468. дои : 10.1016/j.gene.2013.06.079 . ПМИД 23860325 .
- ^ Карра Э., О'Дейли О.Г., Чоудхури А.И., Юссеиф А., Миллершип С., Нири М.Т. и др. (август 2013 г.). «Связь между FTO, грелином и нарушением чувствительности мозга к пищевым сигналам» . Журнал клинических исследований . 123 (8): 3539–3551. дои : 10.1172/jci44403 . ПМЦ 3726147 . ПМИД 23867619 .
- ^ Чжао X, Ян Y, Сунь Б.Ф., Ши Y, Ян X, Сяо W и др. (декабрь 2014 г.). «FTO-зависимое деметилирование N6-метиладенозина регулирует сплайсинг мРНК и необходимо для адипогенеза» . Клеточные исследования . 24 (12): 1403–1419. дои : 10.1038/cr.2014.151 . ПМК 4260349 . ПМИД 25412662 .
- ^ Меркештейн М., Лабер С., МакМюррей Ф., Эндрю Д., Сакс Г., Сандерсон Дж. и др. (апрель 2015 г.). «FTO влияет на адипогенез, регулируя митотическое клональное расширение» . Природные коммуникации . 6 : 6792. Бибкод : 2015NatCo...6.6792M . дои : 10.1038/ncomms7792 . ПМЦ 4410642 . ПМИД 25881961 .
- ^ Чжан М., Чжан Ю., Ма Дж., Го Ф., Цао Ц., Чжан Ю. и др. (28 июля 2015 г.). «Деметилазная активность FTO (белка, связанного с жировой массой и ожирением) необходима для дифференцировки преадипоцитов» . ПЛОС ОДИН . 10 (7): e0133788. Бибкод : 2015PLoSO..1033788Z . дои : 10.1371/journal.pone.0133788 . ПМЦ 4517749 . ПМИД 26218273 .
- ^ Хесс М.Е., Хесс С., Мейер К.Д., Верхаген Л.А., Кох Л., Брённеке Х.С. и др. (август 2013 г.). «Ген, связанный с жировой массой и ожирением (Fto), регулирует активность дофаминергической схемы среднего мозга». Природная неврология . 16 (8): 1042–1048. дои : 10.1038/nn.3449 . ПМИД 23817550 . S2CID 11452560 .
- ^ Ким Х.Дж., Ким Н.К., Ван Ю.Д., Скарборо Э.А., Мур Дж., Диас З. и др. (март 2013 г.). «Мутации в прионоподобных доменах hnRNPA2B1 и hnRNPA1 вызывают мультисистемную протеинопатию и БАС» . Природа . 495 (7442): 467–473. Бибкод : 2013Natur.495..467K . дои : 10.1038/nature11922 . ПМЦ 3756911 . ПМИД 23455423 .
- ^ Ван З.Л., Ли Б., Луо YX, Линь Q, Лю SR, Чжан XQ и др. (январь 2018 г.). «Комплексная геномная характеристика РНК-связывающих белков при раке человека» . Отчеты по ячейкам . 22 (1): 286–298. дои : 10.1016/j.celrep.2017.12.035 . ПМИД 29298429 .
- ^ Нараян П., Роттман Ф.М. (1992). «Метилирование мРНК». В Норд ФФ (ред.). Достижения энзимологии и смежных областей молекулярной биологии . Достижения в энзимологии и смежных областях молекулярной биологии. Том. 65. С. 255–285. дои : 10.1002/9780470123119.ch7 . ISBN 9780470123119 . ПМИД 1315118 .
- ^ Кеннеди Э.М., Богерд Х.П., Корнепати А.В., Канг Д., Гошал Д., Маршалл Дж.Б. и др. (май 2016 г.). «Посттранскрипционное редактирование мРНК ВИЧ-1 m(6)A усиливает экспрессию вирусных генов» . Клетка-хозяин и микроб . 19 (5): 675–685. дои : 10.1016/j.chom.2016.04.002 . ПМЦ 4867121 . ПМИД 27117054 .
- ^ Тирумуру Н., Чжао Б.С., Лу В., Лу З., Хэ С., Ву Л. (июль 2016 г.). «N (6)-метиладенозин РНК ВИЧ-1 регулирует вирусную инфекцию и экспрессию белка Gag ВИЧ-1» . электронная жизнь . 5 . дои : 10.7554/eLife.15528 . ПМЦ 4961459 . ПМИД 27371828 .
- ^ Личинчи Г., Гао С., Салеторе И., Гонсалес Г.М., Бансал В., Ван Ю. и др. (февраль 2016 г.). «Динамика метиломов человеческой и вирусной m(6)A РНК при инфицировании Т-клеток ВИЧ-1» . Природная микробиология . 1 (4): 16011. doi : 10.1038/nmicrobiol.2016.11 . ПМК 6053355 . ПМИД 27572442 .
- ^ Личинчи Г, Чжао Б.С., Ву Ю, Лу З, Цинь Ю, Хэ С, Рана ТМ (ноябрь 2016 г.). «Динамика метилирования РНК человека и вируса при инфекции вирусом Зика» . Клетка-хозяин и микроб . 20 (5): 666–673. дои : 10.1016/j.chom.2016.10.002 . ПМК 5155635 . ПМИД 27773536 .
- ^ Гохале Н.С., Макинтайр А.Б., Макфадден М.Дж., Родер А.Е., Кеннеди Э.М., Гандара Дж.А. и др. (ноябрь 2016 г.). «N6-Метиладенозин в геномах вирусной РНК Flaviviridae регулирует инфекцию» . Клетка-хозяин и микроб . 20 (5): 654–665. дои : 10.1016/j.chom.2016.09.015 . ПМК 5123813 . ПМИД 27773535 .
- ^ Jump up to: а б Мун, Джэ-Су; Ли, Усон; Чо, Ён Хи; Ким, Ёнхё; Ким, Геон Ву (28 февраля 2024 г.). «Значение метилирования N6-метиладенозиновой РНК в регуляции жизненного цикла вируса гепатита B» . Журнал микробиологии и биотехнологии . 34 (2): 233–239. дои : 10.4014/jmb.2309.09013 . ISSN 1738-8872 . ПМЦ 10940779 . ПМИД 37942519 .
- ^ О'Браун, Зак Клапхольц; Грир, Эрик Либерман (2016), Йельч, Альберт; Юрковска, Рената З. (ред.), «N6-Метиладенин: консервативная и динамическая метка ДНК» , ДНК-метилтрансферазы - роль и функция , том. 945, Чам: Springer International Publishing, стр. 213–246, номер документа : 10.1007/978-3-319-43624-1_10 , ISBN. 978-3-319-43624-1 , PMC 5291743 , PMID 27826841 , получено 7 апреля 2024 г.
- ^ Бальзароло, Мелания; Инглиш, Сандер; де Йонг, Аня Дж.; Франке, Катька; ван ден Берг, Тимо К.; Гюлен, Мухаммед Ф.; Аблассер, Андреа; Янссен, Эдит М.; ван Стинсель, Бас; Уолкерс, Моника К. (март 2021 г.). «Метилирование m6A усиливает распознавание цитозольной дцДНК специфичным для последовательности образом» . Открытая Биология . 11 (3). дои : 10.1098/rsob.210030 . ISSN 2046-2441 . ПМК 8101014 . ПМИД 33715389 .
- ^ Рагунатан, Налини; Госвами, Саянтан; Лила, Джакку К.; Пандиян, Апурата; Говришанкар, Джаяраман (2019). «Новая роль метилазы ДНК Dam Escherichia coli в предотвращении аберрантной хромосомной репликации» . Исследования нуклеиновых кислот . 47 (11): 5698–5711. дои : 10.1093/nar/gkz242 . ПМК 6582345 . ПМИД 30957852 . Проверено 7 апреля 2024 г.
- ^ Блоу, Мэтью Дж.; Кларк, Тайсон А.; Даум, Крис Г.; Дойчбауэр, Адам М.; Фоменков, Алексей; Фрис, Роксана; Фрула, Джефф; Кан, Дунван Д.; Мальмстрем, Рекс Р.; Морган, Ричард Д.; Посфаи, Янош; Сингх, Канвар; Визель, Аксель; Уэтмор, Келли; Чжао, Чжиин (12 февраля 2016 г.). «Эпигеномный ландшафт прокариотов» . ПЛОС Генетика . 12 (2): e1005854. дои : 10.1371/journal.pgen.1005854 . ISSN 1553-7404 . ПМЦ 4752239 . ПМИД 26870957 .
- ^ Лоенен, WAM; Драйден, DTF; Роли, Э.А.; Уилсон, Г.Г. (1 января 2014 г.). «Ферменты рестрикции I типа и их родственники» . Исследования нуклеиновых кислот . 42 (1): 20–44. дои : 10.1093/nar/gkt847 . ISSN 0305-1048 . ПМЦ 3874165 . ПМИД 24068554 .
- ^ Цзян, Сюлин; Не, Чжи; Сюн, Цюся; Ян, Чэнь, Юнбин (21 февраля 2021 г.) . заболеваний» . Трансдукция сигнала и таргетная терапия . 6 (1): 74. doi : /s41392-020-00450-x . ISSN 2059-3635 . PMC 7897327. 10.1038 PMID 33611339 .