Молекулярная нейробиология
Молекулярная нейробиология - это ветвь нейробиологии , которая наблюдает концепции в молекулярной биологии, применяемых к нервным системам животных. Объем этого субъекта охватывает такие темы, как молекулярная нейроанатомия , механизмы молекулярной передачи сигналов в нервной системе , влияние генетики и эпигенетики на развитие нейронов и молекулярные основы для нейропластичности и нейродегенеративных заболеваний . [ 1 ] Как и в случае с молекулярной биологией, молекулярная нейробиология является относительно новой областью, которая значительно динамична.
Расположение нейротрансмиттеров
[ редактировать ]В молекулярной биологии связь между нейронами обычно происходит путем химической передачи между пробелами между клетками, называемыми синапсами . Переданные химические вещества, известные как нейротрансмиттеры , регулируют значительную часть жизненно важных функций организма. [ 2 ] Можно анатомически местонахождение нейротрансмиттеров с помощью методов маркировки. Возможно химически идентифицировать определенные нейротрансмиттеры, такие как катехоламины, путем фиксации срезов нервной ткани с помощью формальдегида . Это может привести к флуоресценции, вызванной формальдегидом при воздействии ультрафиолетового света . Допамин , катехоламин, был идентифицирован в нематоде C. elegans с использованием этой техники. [ 3 ] Иммуноцитохимия , которая включает в себя повышение антител против целевых химических или биологических сущностей, включает в себя несколько других методов, представляющих интерес. Целевой нейротрансмиттер может быть специально помечен первичными и вторичными антителами с радиоактивной маркировкой, чтобы идентифицировать нейротрансмиттер с помощью авторадиографии . Присутствие нейротрансмиттеров (хотя и не обязательно местоположение) может наблюдаться в иммуноферментных анализах, связанных с ферментами (ELISA), в которых субстрат связывание в ферментативных анализах может индуцировать осадки , фторофоры или химиотерингингсценность . В случае, если нейротрансмиттеры не могут быть гистохимически идентифицированы, альтернативный метод заключается в том, чтобы определить их по механизмам поглощения нервного положения. [ 1 ]
Ионные каналы, управляемые напряжением
[ редактировать ]
Взволнованные клетки в живых организмах имеют ионные каналы, управляемые напряжением . Они могут наблюдаться по всей нервной системе в нейронах. Первыми ионными каналами, которые были охарактеризованы, были ионные каналы натрия и калия Аль Ходжкин и А.Ф. Хаксли в 1950 -х годах после изучения гигантского аксона рода кальмара Лолиго . Их исследование продемонстрировало селективную проницаемость клеточных мембран, зависящие от физиологических условий и электрические эффекты, которые возникают в результате этих проницаемости для создания потенциалов действия . [ 4 ]
Ионные каналы натрия
[ редактировать ]Натриевые каналы были первыми ионными каналами, управляемыми напряжением, которые были выделены в 1984 году от EEL Electrophorus Electricus Shosaku Numa . Тетродотоксин Pufferfish токсина (TTX) , блокатор натриевых каналов, использовали для изоляции белка натриевого канала путем связывания его с использованием метода колоночной хроматографии для химического разделения. Аминокислотная , последовательность белка была проанализирована с помощью деградации Эдмана , а затем использовалась для построения библиотеки кДНК которую можно было использовать для клонирования белка канала. Клонирование самого канала позволило получить такие приложения, как определение тех же каналов у других животных. [ 1 ] Натриевые каналы известны тем, что работают совместно с калиевыми каналами во время развития градуированных потенциалов и потенциалов действия. Натриевые каналы позволяют приток NA + ионы в нейрон, что приводит к деполяризации от покоящегося мембранного потенциала нейрона, чтобы привести к градуированному потенциалу или потенциалу действия, в зависимости от степени деполяризации. [ 5 ]
Калиевые ионные каналы
[ редактировать ]Калиевые каналы бывают разных форм, присутствуют в большинстве эукариотических клеток и обычно имеют тенденцию стабилизировать клеточную мембрану в потенциале равновесия калия . Как и в случае с ионами натрия, градуированные потенциалы и потенциалы действия также зависят от каналов калия. В то время как приток NA + ионы в нейрон индуцируют клеточную деполяризацию, отток k + Ионы из нейрона заставляют клетку реполяризовать в покоящуюся мембрану потенциал. Активация самих ионных каналов калия зависит от деполяризации, возникающей в результате NA + приток во время потенциала действия. [ 1 ] Как и в случае с натриевыми каналами, каналы калия имеют свои собственные токсины, которые блокируют действия белка. Примером такого токсина является большой катион, тетраэтиламмоний (чай) , но примечательно, что токсин не имеет такого же механизма действия на всех каналах калия, учитывая разнообразие типов каналов по видам. Присутствие калия было сначала идентифицировано у Drosophila melanogaster мутантов мутанта , которые неконтролируемо встряхивают на анестезию из -за проблем в клеточной реполяризации, которые привели к ненормальным нейронам и мышечной электрофизиологии. Калиевые каналы были сначала идентифицированы путем манипулирования молекулярной генетикой (из мух) вместо того, чтобы выполнять очистку белка канала, поскольку во время открытия не было известных высокоаффинных лигандов для калия (таких как чай). [ 1 ] [ 6 ]
Кальциевые ионные каналы
[ редактировать ]Кальциевые каналы важны для определенных каскадов для подписания клеток, а также для высвобождения нейротрансмиттера на терминалах аксона . Различные типы ионных каналов кальция обнаружены в возбудимых клетках. Как и в случае с ионными каналами натрия, ионные каналы кальция были выделены и клонированы методами хроматографической очистки. Примечательно, как и в случае высвобождения нейротрансмиттера, что кальциевые каналы могут взаимодействовать с внутриклеточными белками и играют сильную роль в передаче сигналов, особенно в таких местах, как саркоплазматический ретикулум мышечных клеток. [ 1 ]
Рецепторы
[ редактировать ]Различные типы рецепторов могут быть использованы для передачи сигналов и связи клеток и могут включать ионотропные рецепторы и метаботропные рецепторы. Эти типы рецепторов клеточной поверхности дифференцируются механизмом и продолжительностью действия с ионотропными рецепторами, связанными с быстрым передачей сигнала и метаботропными рецепторами, связанными с медленной передачей сигнала. Метаботропные рецепторы охватывают широкий спектр рецепторов клеточной поверхности с заметно различными сигнальными каскадами . [ 1 ] [ 5 ]
Ионотропные рецепторы
[ редактировать ]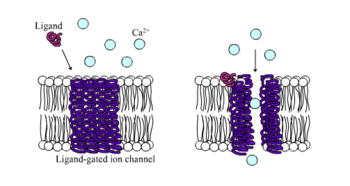
Ионотропные рецепторы , иначе известные как лиганд-управляемые ионные каналы , представляют собой быстро действующие рецепторы, которые опосредуют нервную и физиологическую функцию с помощью ионного канала потоком с лиганд-связыванием. Никотиновые, ГАМК и глутаматные рецепторы являются одними из некоторых рецепторов клеточной поверхности, регулируемых с помощью лигандского ионного канала. ГАМК является основным ингибирующим нейротрансмиттером мозга, а глутамат является основным возбуждающим нейротрансмиттером мозга. [ 1 ]
ГАМК рецепторы
[ редактировать ]Известно, что рецепторы GABA A и GABA C являются ионотропными, в то время как рецептор GABA B является метаботропным. ГАМК А. Рецепторы опосредуют быстрые ингибирующие ответы в центральной нервной системе (ЦНС) и обнаруживаются на нейронах, глиальных клетках и клетках надпочечников . Он отвечает за выведение CL − Ионовый приток в клетки, тем самым снижая вероятность того, что деполяризация мембраны произойдет при прибытии градуированного потенциала или потенциала действия. Рецепторы ГАМК также могут взаимодействовать с неэдогенными лигандами, чтобы влиять на активность. Например, составной диазепам (продаваемый как валиум) является аллостерическим агонистом, который увеличивает сродство рецептора к ГАМК. Повышенные физиологические ингибирующие эффекты, возникающие в результате увеличения связывания ГАМК, делают диазепам полезным транквилизатором или противосудорожными (противоэпилептическими препаратами). С другой стороны, рецепторы ГАМК также могут быть нацелены на уменьшение CL − Клеточный приток с эффектом конвульсантов, таких как пикротоксин . Антагонистический механизм действия для этого соединения не находится непосредственно на рецепторе ГАМК, но есть и другие соединения, которые способны к аллостерической инактивации, включая Т-бутилбициклофоротионат (TBPS) и пентлентетразол (PZT). По сравнению с ГАМК А , рецепторы ГАМК -С имеют более высокое сродство к ГАМК, они, вероятно, будут более длительными по активности, и их ответы, вероятно, будут генерироваться более низкими концентрациями ГАМК. [ 1 ]
Глутаматные рецепторы
[ редактировать ]Ионотропные глутаматные рецепторы могут включать NMDA , AMPA и каинат -рецепторы . Эти рецепторы названы в честь агонистов, которые облегчают активность глутамата. Рецепторы NMDA известны тем, что их возбуждающие механизмы влияют на нейрональную пластичность в обучении и памяти, а также нейропатологию, такие как инсульт и эпилепсия. Рецепторы NDMA имеют множественные сайты связывания, такие как ионотропные рецепторы ГАМК, и могут влиять такие коагонисты, как глициновый нейротрансмиттер или фенциклидин (PCP). Рецепторы NMDA несут ток по CA 2+ ионы и могут быть заблокированы внеклеточным Mg 2+ ионы в зависимости от напряжения и мембранного потенциала. Это ок 2+ приток увеличивается путем возбуждающих постсинаптических потенциалов (EPSP), продуцируемых рецепторами NMDA, активируя CA 2+ -Сы на основе сигнальных каскадов (такие как высвобождение нейротрансмиттера). AMPA генерирует более короткие и более крупные возбуждающие постсинаптические токи, чем другие ионотропные глутаматные рецепторы. [ 5 ]
Никотиновые рецепторы ACH
[ редактировать ]Никотиновые рецепторы связывают нейротрансмиттер ацетилхолина (ACH) с образованием не селективного катионного канала, который генерирует возбуждающие постсинаптические ответы. Рецепторная активность, на которую может влиять потребление никотина, вызывает чувство эйфории, релаксации и неизбежной зависимости на высоких уровнях. [ 5 ]
Метаботропные рецепторы
[ редактировать ]
Метаботропные рецепторы являются рецепторами медленного ответа в постсинаптических клетках. Как правило, эти медленные ответы характеризуются более сложными внутриклеточными изменениями в биохимии. Ответы поглощения нейротрансмиттера с помощью метаботропных рецепторов могут привести к активации внутриметовых ферментов и каскадов с участием вторых мессенджеров, как и в случае с G-белковыми рецепторами . Различные метаботропные рецепторы могут включать определенные глутаматные рецепторы, мускариновые рецепторы ACH, рецепторы GABA B и рецепторные тирозинкиназы .
G-белковые рецепторы
[ редактировать ]G -белок-связанный сигнальный каскад может значительно усилить сигнал конкретного нейротрансмиттера для получения сотен до тысяч вторых посланников в клетке. Механизм действия, посредством которого G-белковые рецепторы вызывают сигнальный каскад, заключается в следующем:
- Нейротрансмиттер связывается с рецептором
- Рецептор претерпевает конформационное изменение, чтобы обеспечить G-белка связывание комплекса
- ВВП обменивается GTP на GTP -комплекс GLATEN -комплекса с рецептором
- Α-субъединица комплекса G-белка связана с GTP и разделяется, чтобы связываться с целевым белком, таким как аденилатциклаза
- Связывание с целевым белком либо увеличивает, либо уменьшает скорость выработки второго мессенджера (такого как циклический AMP )
- Gtpase гидролизует α-субъединицу так, что это связано с GDP, а α-субъединица возвращается в неактивный комплекс G-белка.
Высвобождение нейротрансмиттера
[ редактировать ]
Нейротрансмиттеры высвобождаются в дискретных пакетах, известных как Quanta из терминала аксона одного нейрона до дендритов другого через синапс . Эти кванты были идентифицированы с помощью электронной микроскопии как синаптические пузырьки . Два типа везикул-это небольшие синаптические везикулы (SSV), которые имеют диаметр около 40-60 нм и большие везикулы с плотными ядрами (LDCV), электронные везикулы приблизительно 120-200 нм . диаметром [ 1 ] Первый получен из эндосом и домов нейротрансмиттеров, таких как ацетилхолин , глутамат , ГАМК и глицин . Последнее получено из аппарата Гольджи и размещает более крупные нейротрансмиттеры, такие как катехоламины и другие пептидные нейротрансмиттеры . [ 7 ] Нейротрансмиттеры высвобождаются из терминала аксона и связываются с постсинаптическими дендритами в следующем процессии: [ 5 ]
- Мобилизация/рекрутирование синаптических пузырьков из цитоскелета
- Стыковка везикула (связывание) к пресинаптической мембране
- Заполнение пузырька АТФ (относительно медленный шаг)
- Слияние припиткой везикула с пресинаптической мембраной и экзоцитозом жилищного нейротрансмиттера
- Поглощение нейротрансмиттеров в рецепторах постсинаптической клетки
- Инициирование или ингибирование потенциала действия в постсинаптических клетках в зависимости от того, являются ли нейротрансмиттеры возбуждающими или ингибирующими (возбуждающая к деполяризации постсинаптической мембраны)
Высвобождение нейротрансмиттера зависит от кальция
[ редактировать ]Высвобождение нейротрансмиттера зависит от внешнего снабжения СА 2+ управляемые напряжением ионы, которые входят в терминалы аксона через кальциевые каналы, . Везикулярное слияние с терминальной мембраной и высвобождение нейротрансмиттера вызвано генерацией СА 2+ градиенты, вызванные потенциалами входящих действий . Ca 2+ Ионы вызывают мобилизацию вновь синтезированных пузырьков из резервного пула, чтобы подвергнуться этому мембранному слиянию. Этот механизм действия был обнаружен в гигантских аксонах кальмаров. [ 8 ] Понижение внутриклеточного CA 2+ Ионы обеспечивают прямое ингибирующее влияние на высвобождение нейротрансмиттера. [ 1 ] После высвобождения нейротрансмиттера везикулярные мембраны перерабатываются до происхождения производства. Ионные каналы кальция могут варьироваться в зависимости от местоположения заболеваемости. Например, каналы в терминале аксона отличаются от типичных кальциевых каналов тела клеток (будь то нервным или нет). Даже на терминалах аксонов типы ионных каналов кальция могут варьироваться, как и в случае с кальциевыми каналами P-типа, расположенными на нервно-мышечном соединении . [ 1 ]
Экспрессия нейронального гена
[ редактировать ]Половые различия
[ редактировать ]Различия в определении пола контролируются половыми хромосомами . Половые гормональные выпуски оказывают значительное влияние на половые диморфизмы (фенотипическая дифференциация сексуальных характеристик) мозга. Недавние исследования, по -видимому, предполагают, что регулирование этих диморфизмов имеет значение для понимания нормальной и аномальной функции мозга. На сексуальные диморфизмы могут значительно повлиять экспрессию генов мозга на основе пола, которая варьируется от видов к видам.
Животные модели, такие как грызуны, Drosophila melanogaster и Caenorhabditis Elegans , использовались для наблюдения за происхождением и/или степени предвзятости полов в мозге в сравнении с гормонами, продуцирующими гонады животного. С грызунами исследования по генетическим манипуляциям с половыми хромосом привели к влиянию на один пол, который был полностью противоположным эффекту на другое пол. Например, нокаут конкретного гена привел только к тревожному эффекту у мужчин. В исследованиях D. menlanogaster было обнаружено, что большое предвзятость экспрессии в мозге происходило даже после удаления гонад, что позволяет предположить, что предвзятость пола может быть независимым от гормонального контроля в определенных аспектах. [ 9 ]
Наблюдение за генами, представленными по полу, имеет потенциал для клинического значения при наблюдении за физиологией мозга и потенциала связанных (прямо или косвенно) неврологических расстройств. Примеры Заболевания с предвзятостью пола в развитии включают болезнь Хантингтона , церебральную ишемию и болезнь Альцгеймера . [ 9 ]
Эпигенетика мозга
[ редактировать ]Многие функции мозга можно влиять на клеточном и молекулярном уровне путем вариаций и изменений в экспрессии генов без изменения последовательности ДНК в организме. В противном случае это известно как эпигенетическая регуляция. Примеры эпигенетических механизмов включают модификации гистонов и метилирование ДНК . Было обнаружено, что такие изменения сильно влияют на заболеваемость мозга, психические заболевания и зависимость. [ 10 ] Было показано, что эпигенетический контроль участвует в высоком уровне пластичности в раннем развитии, тем самым определяя его важность в критическом периоде организма. [ 11 ] Примеры того, как эпигенетические изменения могут повлиять на человеческий мозг, следующие:
- Более высокие уровни метилирования в генах рРНК в гиппокампе мозга приводят к более низкой продукции белков, и, следовательно, ограниченная функция гиппокампа может привести к обучению и нарушениям памяти и результирующим суицидальным тенденциям. [ 12 ]
- В исследовании, сравнивающем генетические различия между здоровыми людьми и психиатрическими пациентами, было обнаружено 60 различных эпигенетических маркеров, связанных с передачей сигналов клеток мозга. [ 12 ]
- Факторы окружающей среды, такие как злоупотребление детьми, по -видимому, вызывают экспрессию эпигенетической метки на рецепторах глюкокортикоидов (связанных со стрессовыми реакциями), которые не были обнаружены у жертв самоубийства. [ 12 ] Это пример зависимой от опыта пластичности.
- Обогащение окружающей среды у людей связано с повышенным ацетилированием гена гена гиппокампа и, следовательно, улучшением консолидации памяти (особенно пространственной памяти ). [ 11 ]
Молекулярные механизмы нейродегенеративных заболеваний
[ редактировать ]Экситотоксичность и глутаматные рецепторы
[ редактировать ]Экситотоксичность - это феномен, при котором глутаматные рецепторы не соответствующим образом активируются. Это может быть вызвано длительной возбуждающей синаптической передачей, при которой высокие уровни нейротрансмиттера глутамата вызывают чрезмерную активацию в постсинаптическом нейроне, который может привести к гибели постсинаптического нейрона. После травмы головного мозга (например, от ишемии ) было обнаружено, что экситотоксичность является значительной причиной повреждения нейронов. Это может быть понятно в случае, когда внезапная перфузия крови после снижения кровотока в мозг может привести к чрезмерной синаптической активности, вызванной наличием повышенного глутамата и аспартата в период ишемии. [ 5 ] [ 13 ]
Болезнь Альцгеймера
[ редактировать ]Болезнь Альцгеймера является наиболее распространенным нейродегенеративным заболеванием и является наиболее распространенной формой деменции у пожилых людей. Расстройство характеризуется прогрессивной потерей памяти и различными когнитивными функциями. Предполагается , что осаждение амилоид-β-пептида (40-42 аминокислотных остатков) в мозге является неотъемлемой частью заболеваемости болезнью Альцгеймера. Накопление предполагается, чтобы блокировать гиппокампа долгосрочное потенцирование . Также возможно, что рецептор для амилоид-β-олигомеров может быть прионным белком. [ 14 ]
Болезнь Паркинсона
[ редактировать ]Болезнь Паркинсона является вторым наиболее распространенным нейродегенеративным заболеванием после болезни Альцгеймера. Это гипокинетическое движение базального заболевания ганглиев , вызванное потерей дофаминергических нейронов в черной субстанции человеческого мозга. Таким образом, ингибирующий отток базальных ганглиев не уменьшается, и поэтому верхние моторные нейроны , опосредованные таламусом , не активируются своевременно. Конкретные симптомы включают жесткость, постуральные проблемы, медленные движения и тремор. Блокирование рецептора ГАМК ввода из средних колючих нейронов в клетки ретикулаты вызывает ингибирование верхних моторных нейронов, сходных с ингибированием, которое возникает при болезни Паркинсона. [ 5 ]
Болезнь Хантингтона
[ редактировать ]Болезнь Хантингтона представляет собой гиперкинетическое движение базального заболевания ганглиев , вызванное отсутствием нормальных ингибирующих входов средних колючих нейронов базальных ганглиев. Это создает противоположные эффекты тех, кто связан с болезнью Паркинсона, включая неуместную активацию верхних моторных нейронов . Как и в случае с ГАМКергическими механизмами, наблюдаемыми в связи с болезнью Паркинсона, агонист ГАМК, введенный в субстанцию Nigra Pars reticulata, уменьшает ингибирование верхних моторных нейронов, что приводит к баллистическим непроизвольным моторным движениям, сходным с симптомами болезни Хантингтона. [ 5 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л Лонгстафф, Алан; Revest, Patricia (1998). Молекулярная нейробиология . Гарлендская наука. ISBN 978-1859962503 .
- ^ "Что такое нейротрансмиттеры?" Полем Архивировано с оригинала 25 сентября 2019 года . Получено 1 ноября 2013 года .
- ^ Риддл, Дональд (1998). C. Elegans II . Нью -Йорк: Cold Spring Harbor Laboratory Press. ISBN 978-0879695323 .
- ^ Ходжкин, Аллан Л.; Эндрю Ф. Хаксли (1952). «Двойное влияние мембранного потенциала на проводимость натрия в гигантском аксоне Лолиго» . Журнал физиологии . 116 (4): 497–506. doi : 10.1113/jphysiol.1952.sp004719 . PMC 1392212 . PMID 14946715 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Purves, Dale (2012). Нейробиология (5 -е изд.). Массачусетс, США: Sinauer Associates, Inc. с. 80. ISBN 978-0-87893-695-3 .
- ^ Камб, Александр; Линда Э. Айверсон; Марк А. Тануи (31 июля 1987 г.). «Молекулярная характеристика шейкера, гена дрозофилы, который кодирует канал калия». Клетка . 50 (3): 405–413. doi : 10.1016/0092-8674 (87) 90494-6 . PMID 2440582 . S2CID 31247228 .
- ^ Дэвис, Р. Уэйн; Брайан Дж. Моррис (1997). Молекулярная биология нейрона . Оксфорд, Великобритания: Bios Scientific Publishers Ltd. ISBN 978-1859962404 .
- ^ Dipolo, R.; C. caputo; Ф. Безанилла (март 1983 г.). «Зависимый от напряжения кальциевый канал в аксоне кальмара» . Proc Natl Acad Sci USA . 80 (6): 1743–1745. Bibcode : 1983pnas ... 80.1743d . doi : 10.1073/pnas.80.6.1743 . PMC 393680 . PMID 6300873 .
- ^ Jump up to: а беременный Jazin, E.; Cahill, L. (январь 2010 г.). «Половые различия в молекулярной нейробиологии: от фруктовых мух до людей». Nature Reports Neuroscience . 11 (1): 9–17. doi : 10.1038/nrn2754 . PMID 20019686 . S2CID 2545405 .
- ^ «Эпигенетика и человеческий мозг» . Генетическая наука и учебный центр в Университете Юты . Получено 10 ноября 2013 года .
- ^ Jump up to: а беременный Фагиолини, Микела; Кэтрин Л. Дженсен; Фрэнсис А. Шампанское (2009). «Эпигенетические влияния на развитие мозга и пластичность» (PDF) . Современное мнение о нейробиологии . 19 (2): 1–6. doi : 10.1016/j.conb.2009.05.009 . PMC 2745597 . PMID 19545993 . Архивировано из оригинала (PDF) 22 июня 2010 года . Получено 14 ноября 2013 года .
- ^ Jump up to: а беременный в Цанкова, Надия; Рентхал, Уильям; Кумар, Арвинд; Nestler, Eric J. (2007). «Эпигенетическая регуляция при психиатрических расстройствах». Nature Reports Neuroscience . 8 (5): 355–367. doi : 10.1038/nrn2132 . PMID 17453016 . S2CID 34125955 .
- ^ Лау, А.; М. Тамански (2010). «Рецепторы глутамата, нейротоксичность и нейродегенерация». Pflügers Arch . 460 (2): 525–542. doi : 10.1007/s00424-010-0809-1 . PMID 20229265 . S2CID 12421120 .
- ^ Ларен, Юха; Дэвид А. Гимбел; Хаакон Б. Нигаард; Джон У. Гилберт (февраль 2009 г.). «Клеточный прионный белок опосредует нарушение синаптической пластичности амилоид-β олигомерами» . Природа . 457 (7233): 1128–1132. Bibcode : 2009natur.457.1128L . doi : 10.1038/nature07761 . PMC 2748841 . PMID 19242475 .
