Омадациклин
 | |
| Клинические данные | |
|---|---|
| Произношение | ох, черт возьми, ты, Клин |
| Торговые названия | Это ушло |
| Другие имена | ПТК-0796, [1] ЗАЛИВ 73-6944 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а618066 |
| Данные лицензии |
|
| Маршруты администрация | Внутрь , внутривенно |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЕМБЛ | |
| Химические и физические данные | |
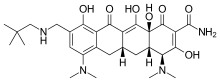
| Формула | С 29 Н 40 Н 4 О 7 |
| Молярная масса | 556.660 g·mol −1 |
| 3D model ( JSmol ) | |
Омадациклин , продаваемый под торговой маркой Нузира , представляет собой антибиотик широкого спектра действия, принадлежащий к подклассу аминометилциклинов. [3] ряда антибиотиков тетрациклинового . В США он был одобрен в октябре 2018 года для лечения внебольничной бактериальной пневмонии и острых инфекций кожи и структур кожи . [2] [4]
Механизм действия
[ редактировать ]Механизм действия омадациклина аналогичен механизму действия других тетрациклинов – ингибирование синтеза бактериального белка . Омадациклин активен против бактериальных штаммов, проявляющих две основные формы устойчивости к тетрациклину ( эффлюкс и рибосомальная защита). [5]
История
[ редактировать ]Омадациклин был изобретен в Медицинской школе Университета Тафтса исследовательской группой под руководством Марка Л. Нельсона вместе с Мохамедом Исмаилом в Тафтсе и Кваси Охеменге и Лорой Ханиман в Paratek Pharmaceuticals, Бостон. Команда, применив свои химические методы к каркасам тетрациклина, создала более 3000 новых производных, что привело к созданию новых соединений третьего поколения омадациклина и сарециклина . [6]
in vitro Исследования
[ редактировать ]Исследования in vitro показали, что омадациклин обладает активностью против широкого спектра грамположительных и некоторых грамотрицательных патогенов. [7] Омадациклин обладает мощной активностью in vitro против грамположительных аэробных бактерий, включая метициллин-резистентный Staphylococcus aureus (MRSA), пенициллин-резистентный и полирезистентный Streptococcus pneumoniae и ванкомицин-резистентный Enterococcus . Омадациклин также обладает противомикробной активностью в отношении распространенных грамотрицательных аэробов, некоторых анаэробов и атипичных бактерий, таких как легионелла и хламидии . [8] Эта активность привела к высокой эффективности омадациклина в модели системной инфекции in vivo у мышей. [9]
Дополнительные исследования метаболизма, распределения и лекарственного взаимодействия омадациклина in vitro и in vivo показывают, что омадациклин метаболически стабилен (т. е. не подвергается значительной биотрансформации), не ингибирует и не взаимодействует с метаболизирующими ферментами или переносчиками. [10]
Клинические испытания
[ редактировать ]Было проведено исследование фазы II, сравнивающее безопасность и эффективность омадациклина с линезолидом для лечения сложных инфекций кожи и структур кожи. Пациенты были рандомизированы в 11 центрах США для получения либо омадациклина по 100 мг внутривенно один раз в день с возможностью перехода на 200 мг перорально один раз в день, либо линезолида по 600 мг внутривенно два раза в день с возможностью перехода на дозу 600 мг перорально два раза в день. Результаты показали, что омадациклин хорошо переносится и может стать эффективным средством лечения пациентов с осложненными инфекциями кожи и структур кожи. [11]
В июне 2013 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США ( FDA ) определило формы омадациклина для внутривенного и перорального применения в качестве квалифицированного препарата для лечения инфекционных заболеваний при лечении острых бактериальных инфекций кожи и структур кожи , а также внебольничной бактериальной пневмонии . [12]
Регистрационное исследование III фазы с участием 650 пациентов, сравнивающее омадациклин с линезолидом для лечения острых бактериальных инфекций кожи и структур кожи, началось в июне 2015 года. [13] [14] Омадациклин достиг первичной конечной точки эффективности - раннего клинического ответа со статистической не меньшей эффективностью (10%) по сравнению с линезолидом и в целом был безопасен и хорошо переносился. Наиболее частыми нежелательными явлениями, возникшими во время лечения, были побочные эффекты со стороны желудочно-кишечного тракта (18,0% для омадациклина против 15,8% для линезолида). [15]
Исследование III фазы с участием 750 пациентов, сравнивающее омадациклин с моксифлоксацином для лечения внебольничной бактериальной пневмонии, началось в ноябре 2015 года. [16] Омадациклин статистически не уступал моксифлоксацину при раннем клиническом ответе, через 72–120 часов после начала терапии. [17]
В мае 2016 года было начато исследование фазы Ib омадациклина при инфекциях мочевыводящих путей . [18]
В августе 2016 года было начато второе исследование III фазы омадациклина у пациентов с острыми бактериальными инфекциями кожи и структур кожи, в ходе которого сравнивалась эффективность и безопасность перорального приема омадациклина один раз в день с эффективностью и безопасностью перорального линезолида два раза в день. [19] В июле 2017 года анализ данных показал, что все первичные и вторичные конечные точки, необходимые для подачи в FDA и EMA, были достигнуты. Это было третье регистрационное исследование 3 фазы омадациклина с положительными результатами. [20]
Ссылки
[ редактировать ]- ^ Боггс Дж. «Антибиотическая фирма «Паратек» присоединяется к очереди на IPO; нацеливается на 92 миллиона долларов» . bioworld.com . Разъяснение аналитики. Архивировано из оригинала 18 октября 2017 года . Проверено 17 октября 2017 г.
- ^ Jump up to: а б «Нузыра-омадациклин для инъекций, порошок лиофилизированный для приготовления раствора; Нузира-омадациклин таблетки, покрытые пленочной оболочкой» . ДейлиМед . 3 июня 2021 г. Проверено 1 января 2024 г.
- ^ Ханиман Л., Исмаил М., Нельсон М.Л., Бхатия Б., Баузер Т.Э., Чен Дж. и др. (ноябрь 2015 г.). «Взаимосвязь структура-активность аминометилциклинов и открытие омадациклина» . Антимикробные средства и химиотерапия . 59 (11): 7044–53. дои : 10.1128/AAC.01536-15 . ПМК 4604364 . ПМИД 26349824 .
- ^ «Разрешительный пакет препарата: Нузыра» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 ноября 2018 года . Проверено 1 января 2024 г.
- ^ Дрейпер М.П., Вейр С., Маконе А., Донателли Дж., Трибер К.А., Танака С.К. и др. (март 2014 г.). «Механизм действия нового аминометилциклинового антибиотика омадациклина» . Антимикробные средства и химиотерапия . 58 (3): 1279–83. дои : 10.1128/AAC.01066-13 . ПМЦ 3957880 . ПМИД 24041885 .
- ^ US 7056902 , Nelson ML, Ohemeng K, «Соединения 4-дедиметиламинотетрациклина», опубликованный 6 июня 2006 г., передан Paratek Pharmaceuticals Inc.
- ^ Танака СК, Виллано С (сентябрь 2016 г.). «Оценка сердечно-сосудистых эффектов омадациклина in vitro и in vivo» . Антимикробные средства и химиотерапия . 60 (9): 5247–53. дои : 10.1128/AAC.00320-16 . ПМЦ 4997885 . ПМИД 27324778 .
- ^ Виллано С., Стинберген Дж., Ло Э. (октябрь 2016 г.). «Омадациклин: разработка нового аминометилциклинового антибиотика для лечения устойчивых к лекарствам бактериальных инфекций» . Будущая микробиология . 11 (11): 1421–1434. дои : 10.2217/fmb-2016-0100 . ПМИД 27539442 .
- ^ Маконе А.Б., Карузо Б.К., Лихи Р.Г., Донателли Дж., Вейр С., Дрейпер М.П. и др. (февраль 2014 г.). «Антибактериальная активность омадациклина, нового аминометилциклина, in vitro и in vivo» . Антимикробные средства и химиотерапия . 58 (2): 1127–35. дои : 10.1128/AAC.01242-13 . ПМЦ 3910882 . ПМИД 24295985 .
- ^ Фларакос Дж., Ду Ю., Гу Х., Ван Л., Эйнольф Х.Дж., Чун Д.Ю. и др. (август 2017 г.). «Клиническая картина, метаболизм и свойства омадациклина при лекарственном взаимодействии in vitro» . Ксенобиотика; Судьба чужеродных соединений в биологических системах . 47 (8): 682–696. дои : 10.1080/00498254.2016.1213465 . ПМИД 27499331 .
- ^ Ноэль Дж.Дж., член парламента от Дрейпера, Хаит Х., Танака С.К., Арбайт Р.Д. (ноябрь 2012 г.). «Рандомизированное слепое исследование фазы 2, сравнивающее безопасность и эффективность омадациклина с таковыми линезолида для лечения сложных инфекций кожи и структур кожи» . Антимикробные средства и химиотерапия . 56 (11): 5650–4. дои : 10.1128/AAC.00948-12 . ПМЦ 3486554 . ПМИД 22908151 .
- ^ «Paratek Pharmaceuticals объявляет о предоставлении FDA статуса квалифицированного продукта для лечения инфекционных заболеваний (QIDP) для своего ведущего кандидата на продукт, омадациклина» (пресс-релиз). Фармацевтическая компания Паратек. 3 января 2013 года . Проверено 17 октября 2017 г. - через PR Newswire.
- ^ Зейферт Д. (2015). «Паратек представляет новые данные испытаний антибиотиков, поскольку исследования на поздних стадиях продолжаются» . bizjournals.com . Американские городские деловые журналы . Проверено 17 октября 2017 г.
- ^ Номер клинического исследования NCT02378480 «Омадациклин по сравнению с линезолидом для лечения ABSSSI (EudraCT № 2013-003644-23)» на ClinicalTrials.gov.
- ^ «Паратек объявляет, что омадациклин достиг всех первичных и вторичных результатов эффективности, установленных FDA и EMA в исследовании фазы 3 острых бактериальных инфекций кожи; омадациклин в целом безопасен и хорошо переносится» (пресс-релиз). Фармацевтическая компания Паратек. 16 июня 2016 года . Проверено 3 июля 2016 г. - через GlobeNewswire.
- ^ Номер клинического исследования NCT02531438 «Омадациклин по сравнению с моксифлоксацином для лечения CABP (EudraCT № 2013-004071-13)» на ClinicalTrials.gov.
- ^ «Паратек объявляет о положительном результате исследования 3 фазы омадациклина при внебольничной бактериальной пневмонии» (пресс-релиз). Фармацевтическая компания Паратек. 3 апреля 2017 года . Проверено 16 мая 2017 г. - через GlobeNewswire.
- ^ «Паратек начинает фазу 1b исследования омадациклина при инфекциях мочевыводящих путей» (пресс-релиз). Фармацевтическая компания Паратек. 2 мая 2016 года . Проверено 3 июля 2016 г. - через GlobeNewswire.
- ^ «Паратек начинает третью фазу исследования омадациклина для перорального применения при АБССИ» (пресс-релиз). Фармацевтическая компания Паратек. 15 августа 2016 года . Проверено 15 августа 2016 г. - через GlobeNewswire.
- ^ «Паратек объявляет о третьей фазе исследования перорального приема омадациклина, отвечающего всем первичным и вторичным конечным точкам эффективности FDA и EMA при острых бактериальных инфекциях кожи» (пресс-релиз). Фармацевтическая компания Паратек. 17 июля 2017 года . Проверено 19 июля 2017 г. - через GlobeNewswire.
Внешние ссылки
[ редактировать ]- «Омадациклин для инъекций» . МедлайнПлюс .