Эравациклин
Эту статью необходимо обновить . ( ноябрь 2018 г. ) |
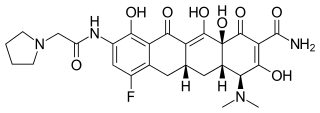 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (4 S ,4a S ,5a R ,12a S )-4-(Диметиламино)-7-фтор-3,10,12,12a-тетрагидрокси-1,11-диоксо-9-[2-(пирролидин-1-) ил)ацетамидо]-1,4,4а,5,5а,6,11,12а-октагидротетрацен-2-карбоксамид | |
| Другие имена Херава | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Характеристики | |
| С 27 Ч 31 ФН 4 О 8 | |
| Молярная масса | 558.555 |
| Фармакология | |
| J01AA13 ( ВОЗ ) | |
| Юридический статус |
|
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Эравациклин (TP-434, Ксерава ) представляет собой синтетический галогенированный тетрациклинов класса антибиотик от компании Tetraphase Pharmaceuticals. Он тесно связан с тигециклином . Он имеет широкий спектр действия, включая многие с множественной лекарственной устойчивостью штаммы бактерий . Исследования фазы III при осложненных интраабдоминальных инфекциях (оИАИ) [2] и осложненные инфекции мочевыводящих путей (оИМП) [3] были недавно завершены со смешанными результатами. Эравациклин получил ускоренный статус от FDA [4] и в настоящее время доступен в США.
Медицинское использование
[ редактировать ]Эравациклин продемонстрировал широкий спектр активности против различных грамположительных и грамотрицательных бактерий, включая штаммы с множественной лекарственной устойчивостью, такие как метициллин-резистентный Staphylococcus aureus (MRSA) и карбапенем-резистентные Enterobacteriaceae . [5] В настоящее время разрабатывается его формула для внутривенного и перорального введения. [ нужна ссылка ]
Спектр деятельности [5] [6] [7] [8]
[ редактировать ]Грамположительные организмы
[ редактировать ]- Staphylococcus aureus (как метициллин-резистентные, так и чувствительные штаммы)
- Стрептококк пневмонии
- Энтерококк фекалис
- Enterococcus faecium (включая штаммы , устойчивые к ванкомицину )
Грамотрицательные организмы
[ редактировать ]- Ацинетобактер Бауманни
- Стенотрофомонас мальтофилия
- Гемофильная инфекция
- Моракселла катаралис
- Нейссерия гонорея
- Энтеробактерии
- Escherichia coli (включая ESBL ) штаммы, продуцирующие
- Klebsiella pneumoniae (включая штаммы, устойчивые к карбапенемам)
- Клебсиелла окситока
- энтеробактерий Виды
- цитробактеров Виды
- Протей мирабилис
- Серратия марцеценс
Подобно другим производным тетрациклина, эравациклин малоактивен в отношении Pseudomonas aeruginosa с МПК 90 = 16 мкг/мл (диапазон 0,06–64 мкг/мл) . Эравациклин сохраняет in vitro активность в отношении Enterobacteriaceae, несущих ген mcr-1, ответственный за устойчивость к полимиксину b / колистину . [9]
Клинические испытания
[ редактировать ]Информация о текущих и прошлых клинических исследованиях: [1]
Испытания фазы 3
[ редактировать ]Осложненные интраабдоминальные инфекции (IGNITE 1) [2]
[ редактировать ]В исследовании IGNITE 1 сравнивали внутривенное введение эравациклина два раза в день с эртапенемом, вводимым один раз в день, для лечения ХИАИ. Всего был включен 541 пациент, и эравациклин не уступал эртапенему. Дополнительное ключевое исследование фазы 3 (IGNITE 4) [10] запланирован на конец 2016 года, а первоначальные результаты, вероятно, будут известны в четвертом квартале 2017 года. [11]
Осложненные интраабдоминальные инфекции (IGNITE 4)
[ редактировать ]IGNITE 4 оценивал внутривенное введение эравациклина два раза в день (1,0 мг/кг каждые 12 часов) по сравнению с теми, кто получал меропенем (1 г каждые 8 часов). В исследовании приняли участие 500 взрослых пациентов, при этом первичной конечной точкой был клинический ответ при посещении для проверки излечения, которое наступает через 25–31 день после первоначального приема дозы. Первичный анализ эффективности проводился с использованием границы не меньшей эффективности 12,5% в микробиологической популяции, готовящейся к лечению (микро-ИТТ). [12] [13]
В июле 2017 года компания Tetraphase Pharmaceuticals опубликовала в прессе данные о выручке, показывающие, что показатели клинического излечения в популяции микро-ИТТ составляют 90,8% и 91,2% для эравациклина (n=195) и меропенема (n=205) соответственно (95% ДИ: -6,3%,5,3%). Первичный анализ проводился с использованием 12,5% границы не меньшей эффективности для модифицированных популяций пациентов, получающих лечение (MITT) и подлежащих клинической оценке (CE). Показатель клинического излечения в популяции MITT составил 92,4% и 91,6% для эравациклина (n=250) и меропенема (n=249) соответственно (95% ДИ: -4,1%,5,8%). Показатель клинического излечения в популяции CE составил 96,9% и 96,1% для эравациклина (n=225) и меропенема (n=231) соответственно (95% ДИ: -2,9%,4,5%). Эравациклин соответствовал основным конечным точкам эффективности в соответствии с рекомендациями FDA и EMA. Вторичные анализы соответствовали первичному результату по Тетрафазе и поддерживали его. [12] В ходе исследования не было зарегистрировано серьезных нежелательных явлений (СНЯ), связанных с лечением. Частота нежелательных явлений, возникших во время лечения (TEAE), была одинаковой в обеих группах лечения, причем наиболее часто сообщаемыми нежелательными явлениями, связанными с приемом препарата (AE) для эравациклина, были реакции в месте инфузии, тошнота и рвота, каждое из которых возникало с частотой менее 5%. Наиболее распространенными грамотрицательными возбудителями в исследовании были Escherichia coli , Klebsiella pneumoniae , Pseudomonas и Bacteroides . Полные данные IGNITE4 станут доступны по мере того, как компания готовится подать заявку на новое лекарство (NDA) в первом квартале 2018 года для лечения эравациклином осложненных внутрибрюшных инфекций. [12] [13]
Осложненные инфекции мочевыводящих путей (IGNITE 2) [3]
[ редактировать ]В исследовании IGNITE 2 сравнивали 7-дневное внутривенное введение эравациклина и внутривенное введение левофлоксацина с возможностью перевода пациентов в любой группе на пероральную терапию через 3 дня по поводу оИМП. В целом эравацилин уступал левофлоксацину по частоте ответа (60,4 против 66,9%); однако было отмечено, что пациенты, завершившие терапию внутривенным препаратом, имели более высокий уровень ответа, что указывает на проблемы с препаратом при пероральном варианте. [14] В связи с эффективностью препарата для внутривенного введения запланировано дополнительное исследование фазы 3 для подтверждения дополнительного соглашения о неразглашении для показаний к ИМП. [11]
Осложненные инфекции мочевыводящих путей (IGNITE 3) [15] [16]
[ редактировать ]IGNITE3 в настоящее время продолжается, начиная с января 2017 года, с ожидаемым завершением в декабре 2018 года. Это исследование оценивает внутривенное введение эравациклина (1,5 мг/кг каждые 24 часа) в сравнении с эртапенемом (1 г каждые 24 часа) для лечения оИМП. В настоящее время IGNITE3 набирает около 1000 пациентов, которые будут рандомизированы 1:1 для внутривенного введения эравациклина или эртапенема в течение как минимум 5 дней, а затем будут иметь право на переход на пероральный левофлоксацин . [16] Первичными конечными точками являются доля участников в микробиологической популяции, готовой к лечению (микро-ITT), демонстрирующая клиническое излечение и микробиологический успех в конце внутривенного (EOI) визита [Временные рамки: визит EOI (в течение 1 дня после завершения внутривенное лечение исследуемыми лекарственными средствами)] и доля участников в популяции микро-ИТТ, демонстрирующих клиническое излечение и микробиологический успех при посещении с проверкой излечения (ТОС) [Временные рамки: посещение ТОС (14–17 дней после рандомизации)]. С тестированием вторичных конечных точек (результатов) Доля участников в микробиологической модифицированной популяции, предназначенной для лечения (микро-MITT), и в популяции, поддающейся микробиологической оценке (ME), демонстрирующей микробиологический успех во время визита TOC [ Временные рамки: визит TOC (14–17) дней после рандомизации) ] [15]
Коммерческая информация
[ редактировать ]Эравациклин разрабатывается компанией Tetraphase Pharmaceuticals Inc. В США он продается под торговым названием Xerava. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ «Ксерава ЭПАР» . Европейское агентство по лекарственным средствам . 8 октября 2018 года . Проверено 29 июня 2024 г.
- ^ Jump up to: а б Соломкин Дж., Эванс Д., Слепавичус А., Ли П., Марш А., Цай Л. и др. (16 ноября 2016 г.). «Оценка эффективности и безопасности эравациклина по сравнению с эртапенемом при осложненных интраабдоминальных инфекциях в исследовании грамотрицательных инфекций, лечившихся эравациклином (IGNITE 1): рандомизированное клиническое исследование». JAMA Хирургия . 152 (3): 224–232. дои : 10.1001/jamasurg.2016.4237 . ISSN 2168-6262 . ПМИД 27851857 . S2CID 42977246 .
- ^ Jump up to: а б «Tetraphase объявляет о лучших результатах 3-й фазы клинического исследования эравациклина IGNITE2 при ОИМП (NASDAQ:TTPH)» . ir.tphase.com . Архивировано из оригинала 21 ноября 2016 года . Проверено 20 ноября 2016 г. .
- ^ «FDA предоставило статус QIDP эравациклину, ведущему кандидату на антибиотик от компании Tetraphase | Business Wire» . businesswire.com . 15 июля 2013 года . Проверено 20 ноября 2016 г. .
- ^ Jump up to: а б Жанель Г.Г., Чунг Д., Адам Х., Зеленицкий С., Голден А., Швейцер Ф. и др. (1 апреля 2016 г.). «Обзор эравациклина, нового фторциклинового антибактериального средства». Наркотики . 76 (5): 567–588. дои : 10.1007/s40265-016-0545-8 . ISSN 1179-1950 . ПМИД 26863149 . S2CID 36285428 .
- ^ Сатклифф Дж. А., О'Брайен В., Файф К., Гроссман Т.Х. (1 ноября 2013 г.). «Антибактериальная активность эравациклина (TP-434), нового фторциклина, против больничных и общественных патогенов» . Антимикробные средства и химиотерапия . 57 (11): 5548–5558. дои : 10.1128/AAC.01288-13 . ISSN 1098-6596 . ПМЦ 3811277 . ПМИД 23979750 .
- ^ Соломкин Дж.С., Рамеш М.К., Чеснаускас Г., Новиков Н., Стефанова П., Сатклифф Дж.А. и др. (1 января 2014 г.). «Фаза 2, рандомизированное двойное слепое исследование эффективности и безопасности двух режимов дозирования эравациклина по сравнению с эртапенемом при внебольничных осложненных внутрибрюшных инфекциях у взрослых» . Антимикробные средства и химиотерапия . 58 (4): 1847–1854. дои : 10.1128/AAC.01614-13 . ISSN 1098-6596 . ПМК 4023720 . ПМИД 24342651 .
- ^ Абдаллах М., Олафисое О., Кортес С., Урбан С., Ландман Д., Куале Дж. (1 марта 2015 г.). «Активность эравациклина против Enterobacteriaceae и Acinetobacter baumannii, включая изоляты с множественной лекарственной устойчивостью, из Нью-Йорка» . Антимикробные средства и химиотерапия . 59 (3): 1802–1805. дои : 10.1128/AAC.04809-14 . ISSN 1098-6596 . ПМЦ 4325809 . ПМИД 25534744 .
- ^ Файф С, Леблан Дж, Клоуз Б, Нордманн П, Дюма Дж, Гроссман Т.Д. (22 августа 2016 г.). «Эравациклин активен в отношении бактериальных изолятов, экспрессирующих ген устойчивости к полимиксину mcr-1» (PDF) . Антимикробные средства и химиотерапия . 60 (11): 6989–6990. дои : 10.1128/AAC.01646-16 . ISSN 0066-4804 . ПМК 5075126 . ПМИД 27550359 .
- ^ «Исследование IGNITE4 фазы 3 для изучения безопасности и эффективности внутривенного введения эравациклина при КИА» . Хелио . 19 октября 2016 г. Проверено 16 января 2023 г.
- ^ Jump up to: а б «Tetraphase Pharmaceuticals предоставляет обновленную информацию о статусе регулирования и разработки эравациклина (NASDAQ:TTPH)» . ir.tphase.com . Архивировано из оригинала 21 ноября 2016 года . Проверено 20 ноября 2016 г. .
- ^ Jump up to: а б с «Tetraphase объявляет о положительных результатах клинического исследования IGNITE4 фазы 3 при осложненных внутрибрюшных инфекциях (NASDAQ:TTPH)» . ir.tphase.com . Архивировано из оригинала 1 августа 2017 года . Проверено 27 июля 2017 г.
- ^ Jump up to: а б «Исследование эффективности и безопасности эравациклина по сравнению с меропенемом при осложненных внутрибрюшных инфекциях - полнотекстовый просмотр - ClinicalTrials.gov» . www.clinicaltrials.gov . Проверено 27 июля 2017 г.
- ^ «IGNITE2: эравациклин уступает левофлоксацину, но внутривенный препарат дает многообещающие результаты» . Хелио . 8 июля 2016 года . Проверено 16 января 2023 г.
- ^ Jump up to: а б «Исследование эффективности и безопасности эравациклина по сравнению с эртапенемом у участников с осложненными инфекциями мочевыводящих путей - полнотекстовый просмотр - ClinicalTrials.gov» . www.clinicaltrials.gov . Проверено 27 июля 2017 г.
- ^ Jump up to: а б «Tetraphase Pharmaceuticals вводит дозы первому пациенту в клиническом исследовании фазы 3 IGNITE3 по внутривенному введению эравациклина при оИМП (NASDAQ:TTPH)» . ir.tphase.com . Архивировано из оригинала 7 августа 2017 года . Проверено 27 июля 2017 г.