Клеточная адгезия
Эта статья нуждается в дополнительных цитатах для проверки . ( сентябрь 2014 г. ) |
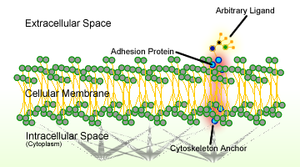
Клеточная адгезия — это процесс, посредством которого клетки взаимодействуют и прикрепляются к соседним клеткам через специализированные молекулы клеточной поверхности. Этот процесс может происходить либо через прямой контакт между поверхностями клеток, например, через клеточные соединения , либо через непрямое взаимодействие, при котором клетки прикрепляются к окружающему внеклеточному матриксу — гелеобразной структуре, содержащей молекулы, высвобождаемые клетками в пространство между ними. [1] Адгезия клеток происходит в результате взаимодействия между молекулами клеточной адгезии (CAM). [2] трансмембранные белки, расположенные на поверхности клетки. Клеточная адгезия связывает клетки по-разному и может участвовать в передаче сигналов , позволяющих клеткам обнаруживать изменения в окружающей среде и реагировать на них. [1] [3] Другие клеточные процессы, регулируемые клеточной адгезией, включают миграцию клеток и развитие тканей в многоклеточных организмах . [4] Изменения в клеточной адгезии могут нарушить важные клеточные процессы и привести к различным заболеваниям, включая рак. [5] [6] и артрит . [7] Адгезия клеток также важна для того, чтобы инфекционные организмы, такие как бактерии или вирусы , вызывали заболевания . [8] [9]
Общий механизм
[ редактировать ]
САМ подразделяются на четыре основных семейства: интегрины , суперсемейство иммуноглобулинов (Ig) , кадгерины и селектины . [2] Кадгерины и IgSF представляют собой гомофильные САМ, поскольку они напрямую связываются с САМ того же типа на другой клетке, тогда как интегрины и селектины представляют собой гетерофильные САМ, которые связываются с разными типами САМ. [2] [ нужна ссылка ] Каждая из этих молекул адгезии выполняет разные функции и распознает разные лиганды . Дефекты клеточной адгезии обычно связаны с дефектами экспрессии CAM.
В многоклеточных организмах связи между САМ позволяют клеткам прилипать друг к другу и создают структуры, называемые клеточными соединениями . По своим функциям клеточные соединения можно разделить на: [1]
- Закрепляющие соединения ( адгезивные соединения , десмосомы и гемидесмосомы ), которые удерживают клетки вместе и укрепляют контакт между клетками.
- Окклюзионные соединения ( плотные соединения ), которые запечатывают промежутки между клетками посредством межклеточного контакта, создавая непроницаемый барьер для диффузии.
- Каналообразующие соединения ( щелевые соединения ), которые связывают цитоплазму соседних клеток, позволяя транспортировать молекулы между клетками.
- Соединения передачи сигналов, которые могут быть синапсами в нервной системе.
С другой стороны, клеточные соединения можно разделить на два основных типа в зависимости от того, что взаимодействует с клеткой: межклеточные соединения, в основном опосредованные кадгеринами, и соединения клетка-матрикс, в основном опосредованные интегринами.
Межклеточные соединения
[ редактировать ]Межклеточные соединения могут возникать в разных формах. В якорных соединениях между клетками, таких как слипчивые соединения и десмосомы, основными присутствующими САМ являются кадгерины. Это семейство CAM представляет собой мембранные белки, которые опосредуют межклеточную адгезию через внеклеточные домены и требуют внеклеточного кальция. 2+ ионы для правильной работы. [2] Кадгерины образуют гомофильное соединение между собой, что приводит к слипанию клеток одного типа и может привести к избирательной адгезии клеток, позволяя клеткам позвоночных собираться в организованные ткани. [1] Кадгерины необходимы для межклеточной адгезии и передачи сигналов между клетками у многоклеточных животных, и их можно разделить на два типа: классические кадгерины и неклассические кадгерины. [2]
Прилегающие соединения
[ редактировать ]
Адгерентные соединения в основном служат для поддержания формы тканей и удержания клеток вместе. В слипчивых соединениях кадгерины между соседними клетками взаимодействуют через свои внеклеточные домены, которые имеют общую консервативную чувствительную к кальцию область в своих внеклеточных доменах. Когда эта область вступает в контакт с Ca 2+ ионов внеклеточные домены кадгеринов претерпевают конформационные изменения от неактивной гибкой конформации к более жесткой конформации, чтобы подвергнуться гомофильному связыванию. Внутриклеточные домены кадгеринов также высоко консервативны, поскольку они связываются с белками, называемыми катенинами , образуя комплексы катенин-кадгерин. Эти белковые комплексы связывают кадгерины с актиновыми нитями . Эта ассоциация с актиновыми нитями необходима для адгезионных соединений и стабилизации межклеточной адгезии. [10] [11] [12] Взаимодействие с актиновыми нитями может также способствовать кластеризации кадгеринов, которые участвуют в сборке слипчивых соединений. Это связано с тем, что кластеры кадгерина способствуют актиновых нитей полимеризации , что, в свою очередь, способствует сборке слипчивых соединений путем связывания с комплексами кадгерин-катенин, которые затем образуются в месте соединения. [ нужна ссылка ]
Десмосомы
[ редактировать ]Десмосомы структурно аналогичны слипчивым соединениям, но состоят из разных компонентов. Вместо классических кадгеринов неклассические кадгерины, такие как десмоглеины и десмоколлины, действуют как молекулы адгезии и связаны с промежуточными нитями, а не с актиновыми нитями. [13] В десмосомах катенин отсутствует, поскольку внутриклеточные домены десмосомальных кадгеринов взаимодействуют с белками десмосомальных бляшек, которые образуют толстые цитоплазматические бляшки в десмосомах и связывают кадгерины с промежуточными филаментами. [14] Десмосомы обеспечивают прочность и устойчивость к механическому стрессу за счет разгрузки сил на гибкие, но упругие промежуточные филаменты, чего не может произойти с жесткими актиновыми филаментами. [13] Это делает десмосомы важными в тканях, которые подвергаются высоким уровням механического напряжения, таких как сердечная мышца и эпителий , и объясняет, почему они часто появляются в этих типах тканей.
Плотные соединения
[ редактировать ]Плотные соединения обычно присутствуют в эпителиальных и эндотелиальных тканях, где они закрывают разрывы и регулируют парацеллюлярный транспорт растворенных веществ и внеклеточных жидкостей в этих тканях, которые действуют как барьеры. [15] Плотное соединение образовано трансмембранными белками, включая клаудины , окклюдины и трицеллюлины, которые гомофильно связываются друг с другом на соседних мембранах. [1] Подобно якорным соединениям, внутриклеточные домены этих белков плотных соединений связаны с каркасными белками , которые удерживают эти белки в кластерах и связывают их с актиновыми нитями, чтобы поддерживать структуру плотного соединения. [16] Клаудины, необходимые для образования плотных контактов, образуют парацеллюлярные поры, которые обеспечивают избирательное прохождение определенных ионов через плотные контакты, делая барьер избирательно проницаемым. [15]
Щелевые соединения
[ редактировать ]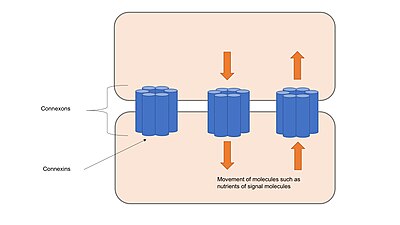
Щелевые соединения состоят из каналов, называемых коннексонами , которые состоят из трансмембранных белков, называемых коннексинами, сгруппированных в группы по шесть штук. [17] Коннексоны соседних клеток образуют непрерывные каналы, когда они соприкасаются и выравниваются друг с другом. Эти каналы позволяют транспортировать ионы и небольшие молекулы между цитоплазмой двух соседних клеток, а также удерживают клетки вместе и обеспечивают структурную стабильность, например, закрепление соединений или плотных соединений. [1] Каналы щелевых соединений избирательно проницаемы для конкретных ионов в зависимости от того, какие коннексины образуют коннексоны, что позволяет щелевым контактам участвовать в передаче сигналов в клетках путем регуляции переноса молекул, участвующих в сигнальных каскадах . [18] Каналы могут реагировать на множество различных стимулов и динамически регулируются либо с помощью быстрых механизмов, таких как стробирование напряжения , либо с помощью медленных механизмов, таких как изменение количества каналов, присутствующих в щелевых переходах. [17]
Адгезия, опосредованная селектинами
[ редактировать ]Селектины представляют собой семейство специализированных САМ, участвующих в временной межклеточной адгезии, происходящей в системе кровообращения. В основном они опосредуют движение лейкоцитов (лейкоцитов) в кровотоке, позволяя лейкоцитам «катиться» по эндотелиальным клеткам посредством обратимого связывания выделений. [19] Селектины подвергаются гетерофильному связыванию, поскольку его внеклеточный домен связывается с углеводами соседних клеток вместо других селектинов, а также требует Ca 2+ ионы функционируют так же, как кадгерины. [1] Межклеточная адгезия лейкоцитов к эндотелиальным клеткам важна для иммунных реакций , поскольку с помощью этого механизма лейкоциты могут перемещаться к местам инфекции или повреждения. [20] В этих местах интегрины катящихся лейкоцитов активируются и прочно связываются с местными эндотелиальными клетками, позволяя лейкоцитам прекратить миграцию и пройти через эндотелиальный барьер. [20]
Адгезия, опосредованная членами суперсемейства иммуноглобулинов
[ редактировать ]Суперсемейство иммуноглобулинов (IgSF) является одним из крупнейших суперсемейств белков в организме и содержит множество разнообразных САМ, участвующих в различных функциях. Эти трансмембранные белки имеют один или несколько иммуноглобулиноподобных доменов во внеклеточных доменах и подвергаются кальций-независимому связыванию с лигандами на соседних клетках. [21] Некоторые CAM IgSF, такие как молекулы адгезии нервных клеток (NCAM), могут осуществлять гомофильное связывание, в то время как другие, такие как молекулы межклеточной клеточной адгезии (ICAM) или молекулы адгезии сосудистых клеток (VCAM), подвергаются гетерофильному связыванию с такими молекулами, как углеводы или интегрины. [22] И ICAM, и VCAM экспрессируются на эндотелиальных клетках сосудов и взаимодействуют с интегринами на лейкоцитах, способствуя прикреплению лейкоцитов и их перемещению через эндотелиальный барьер. [22]
Соединения клетка-матрикс
[ редактировать ]Клетки создают внеклеточный матрикс, высвобождая молекулы в окружающее их внеклеточное пространство. Клетки имеют специфические САМ, которые связываются с молекулами внеклеточного матрикса и связывают матрикс с внутриклеточным цитоскелетом . [1] Внеклеточный матрикс может выступать в качестве поддержки при организации клеток в ткани, а также может участвовать в передаче сигналов клетками, активируя внутриклеточные пути при связывании с CAM. [2] Соединения клетка-матрикс в основном опосредуются интегринами, которые также группируются, подобно кадгеринам, образуя прочные адгезии. Интегрины представляют собой трансмембранные гетеродимеры, образованные разными субъединицами α и β, причем обе субъединицы имеют разную доменную структуру. [23] Интегрины могут передавать сигналы в обоих направлениях: передача сигналов изнутри наружу, внутриклеточные сигналы, модифицирующие внутриклеточные домены, могут регулировать сродство интегринов к их лигандам, тогда как передача сигналов снаружи внутрь, внеклеточные лиганды, связывающиеся с внеклеточными доменами, могут вызывать конформационные изменения в интегринах и инициировать передачу сигналов. каскады. [23] Внеклеточные домены интегринов могут связываться с различными лигандами посредством гетерофильного связывания, тогда как внутриклеточные домены могут быть связаны либо с промежуточными филаментами, образуя гемидесмосомы, либо с актиновыми нитями, образуя фокальные спайки . [24]

полудесмосомы
[ редактировать ]В полудесмосомах интегрины прикрепляются к белкам внеклеточного матрикса, называемым ламининами , в базальной пластинке , которая представляет собой внеклеточный матрикс, секретируемый эпителиальными клетками. [1] Интегрины связывают внеклеточный матрикс с промежуточными нитями кератина , которые взаимодействуют с внутриклеточным доменом интегринов через адаптерные белки, такие как плектины и BP230. [25] Гемидесмосомы играют важную роль в поддержании структурной стабильности эпителиальных клеток, связывая их вместе косвенно через внеклеточный матрикс.
Очаговые спайки
[ редактировать ]При фокальных спайках интегрины присоединяют фибронектин , компонент внеклеточного матрикса, к актиновым нитям внутри клеток. [24] Белки-адаптеры, такие как талины , винкулины , α-актинины и филамины , образуют комплекс во внутриклеточном домене интегринов и связываются с актиновыми нитями. [26] Этот мультибелковый комплекс, связывающий интегрины с актиновыми нитями, важен для сборки сигнальных комплексов, которые действуют как сигналы для клеточного роста и подвижности клеток. [26]
Другие организмы
[ редактировать ]Эукариоты
[ редактировать ]Клетки растений тесно прилегают друг к другу и соединяются посредством плазмодесм — каналов, которые пересекают стенки растительных клеток и соединяют цитоплазмы соседних растительных клеток. [27] Молекулы, которые являются либо питательными веществами, либо сигналами, необходимыми для роста, переносятся пассивно или выборочно между растительными клетками через плазмодесмы. [27]
Простейшие экспрессируют множество молекул адгезии с различной специфичностью, которые связываются с углеводами, расположенными на поверхности клеток-хозяев. [28] Межклеточная адгезия является ключом к прикреплению патогенных простейших и проникновению в клетки-хозяева. Примером патогенного простейшего является малярийный паразит ( Plasmodium falciparum ), который использует одну молекулу адгезии, называемую белком циркумспорозоита, для связывания с клетками печени. [29] и еще одна молекула адгезии, называемая поверхностным белком мерозоита, связывающая эритроциты . [30]
Патогенные грибы используют молекулы адгезии, присутствующие на клеточной стенке, для прикрепления к клеткам-хозяевам посредством белок-белковых или белково-углеводных взаимодействий. [31] или фибронектинами во внеклеточном матриксе. [32]
Прокариоты
[ редактировать ]У прокариотов на поверхности клеток имеются молекулы адгезии, называемые бактериальными адгезинами , помимо использования пилей ( бабочек ) и жгутиков для клеточной адгезии. [8] Прокариоты могут иметь один или несколько жгутиков, расположенных как в одном, так и в нескольких местах поверхности клетки. Патогенные виды, такие как Escherichia coli и Vibrio cholera, обладают жгутиками, облегчающими адгезию. [33]
Адгезины могут распознавать различные лиганды, присутствующие на поверхности клеток-хозяев, а также компоненты внеклеточного матрикса. Эти молекулы также контролируют специфичность хозяина и регулируют тропизм (ткане- или клеточно-специфическое взаимодействие) посредством взаимодействия со своими лигандами. [34]
Вирусы
[ редактировать ]Вирусы также имеют молекулы адгезии, необходимые для связывания вируса с клетками-хозяевами. Например, вирус гриппа имеет на своей поверхности гемагглютинин , который необходим для распознавания сахара сиаловой кислоты на молекулах поверхности клетки-хозяина. [35] ВИЧ имеет молекулу адгезии, называемую gp120 , которая связывается со своим лигандом CD4 , который экспрессируется на лимфоцитах . [36] Вирусы также могут нацеливаться на компоненты клеточных соединений, чтобы проникнуть в клетки-хозяева, что и происходит, когда вирус гепатита С нацелен на окклюдины и клаудины в плотных соединениях, чтобы проникнуть в клетки печени. [9]
Клинические последствия
[ редактировать ]Дисфункция клеточной адгезии возникает при метастазировании рака . Потеря межклеточной адгезии в метастатических опухолевых клетках позволяет им покинуть место своего происхождения и распространиться по кровеносной системе. [5] Одним из примеров дерегуляции CAM при раке являются кадгерины, которые инактивируются либо генетическими мутациями, либо другими онкогенными сигнальными молекулами, что позволяет раковым клеткам мигрировать и быть более инвазивными. [6] Другие CAM, такие как селектины и интегрины, могут способствовать метастазированию, опосредуя межклеточные взаимодействия между мигрирующими метастатическими опухолевыми клетками в системе кровообращения с эндотелиальными клетками других отдаленных тканей. [37] Благодаря связи между САМ и метастазами рака эти молекулы могут быть потенциальными терапевтическими мишенями для лечения рака.
Существуют также другие генетические заболевания человека, вызванные неспособностью экспрессировать специфические молекулы адгезии. Примером является дефицит адгезии лейкоцитов -I (LAD-I), при котором экспрессия субъединицы интегрина β снижается или теряется. [38] Это приводит к снижению экспрессии гетеродимеров интегрина β2 , которые необходимы для прочного прикрепления лейкоцитов к эндотелиальной стенке в местах воспаления для борьбы с инфекциями. [39] Лейкоциты пациентов с LAD-I не способны прикрепляться к эндотелиальным клеткам, и у пациентов наблюдаются серьезные эпизоды инфекции , которые могут быть опасными для жизни.
Аутоиммунное заболевание , называемое пузырчаткой, также вызвано потерей клеточной адгезии, поскольку оно возникает в результате воздействия аутоантител на собственные десмосомальные кадгерины человека, что приводит к отслоению эпидермальных клеток друг от друга и образованию волдырей на коже. [40]
Патогенные микроорганизмы, включая бактерии, вирусы и простейшие, должны сначала прикрепиться к клеткам-хозяевам, чтобы заразить и вызвать заболевания. Антиспаечная терапия может использоваться для предотвращения инфекции путем нацеливания молекул адгезии либо на патоген, либо на клетку-хозяина. [41] Помимо изменения выработки молекул адгезии, также можно использовать конкурентные ингибиторы, которые связываются с молекулами адгезии для предотвращения связывания между клетками, действуя как антиадгезивные агенты. [42]
См. также
[ редактировать ]- Сотовая связь (биология)
- Эпителий
- Цитоскелет
- Гипотеза дифференциальной адгезии
- Роль клеточных спаек в развитии нейронов
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Морган, Дэвид; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2014). Молекулярная биология клетки (6-е изд.). Гирляндная наука. ISBN 9780815344322 .
- ^ Jump up to: а б с д и ж Лодиш, Харви; Берк, Арнольд; Мацудайра, Пол; Кайзер, Крис А.; Кригер, Монти; Скотт, Мэтью П.; Зипурский, Лоуренс; Дарнелл, Джеймс (2003). Молекулярно-клеточная биология (5-е изд.). У. Х. Фриман. ISBN 978-0716743668 .
- ^ Гамбинер, Барри М. (1996). «Клеточная адгезия: молекулярная основа тканевой архитектуры и морфогенеза» . Клетка . 84 (3): 345–357. дои : 10.1016/S0092-8674(00)81279-9 . ПМИД 8608588 . S2CID 13443584 .
- ^ Сумигрей, Кэлин Д.; Лехлер, Терри (2015). Адгезия клеток в развитии эпидермиса и формировании барьера . Том. 112. стр. 383–414. дои : 10.1016/bs.ctdb.2014.11.027 . ISBN 9780124077584 . ПМЦ 4737682 . ПМИД 25733147 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Jump up to: а б Окегава, Т; Понг, Колорадо; Ли, Ю; Се, JT (2004). «Роль молекулы клеточной адгезии в прогрессировании рака и ее применение в терапии рака» . Акта Биохимика Полоника . 51 (2): 445–57. дои : 10.18388/abp.2004_3583 . ПМИД 15218541 .
- ^ Jump up to: а б Хирохаси, Сэцуо; Канаи, Яэ (2003). «Система клеточной адгезии и морфогенез рака человека» . Раковая наука . 94 (7): 575–581. дои : 10.1111/j.1349-7006.2003.tb01485.x . ПМЦ 11160151 . ПМИД 12841864 . S2CID 22154824 .
- ^ Секанеч, Золтан; Кох, Алиса Э (2000). «Клеточно-клеточные взаимодействия при синовите: эндотелиальные клетки и миграция иммунных клеток» . Исследования артрита . 2 (5): 368–373. дои : 10.1186/ar114 . ПМК 130138 . ПМИД 11094450 .
- ^ Jump up to: а б Писарро-Серда, Хавьер; Коссар, Паскаль (2006). «Бактериальная адгезия и проникновение в клетки-хозяева» . Клетка . 124 (4): 715–727. дои : 10.1016/j.cell.2006.02.012 . ПМИД 16497583 . S2CID 5769387 .
- ^ Jump up to: а б Матео, М.; Щедрый, А.; Синн, Польша; Каттанео, Р. (2015). «Связи имеют значение: как вирусы используют компоненты клеточной адгезии» . Журнал клеточной науки . 128 (3): 431–439. дои : 10.1242/jcs.159400 . ПМК 4311127 . ПМИД 26046138 .
- ^ Мэн, В.; Такеичи, М. (2009). «Соединение приверженцев: молекулярная архитектура и регуляция» . Перспективы Колд-Спринг-Харбор в биологии . 1 (6): а002899. doi : 10.1101/cshperspect.a002899 . ПМЦ 2882120 . ПМИД 20457565 .
- ^ Николл И.Д., Мацуи Т., Вайс Т.М., Стэнли CB, Хеллер В.Т., Мартел А., Фараго Б., Callaway DJ, Bu Z (21 августа 2018 г.). «Структура альфа-катенина и наномасштабная динамика в растворе и в комплексе с F-актином» . Биофизический журнал . 115 (4): 642–654. Бибкод : 2018BpJ...115..642N . дои : 10.1016/j.bpj.2018.07.005 . ПМК 6104293 . ПМИД 30037495 .
- ^ Харрис, Тони Джей Си; Тепасс, Ульрих (2010). «Адгерентные соединения: от молекул к морфогенезу». Nature Reviews Молекулярно-клеточная биология . 11 (7): 502–514. дои : 10.1038/nrm2927 . ПМИД 20571587 . S2CID 13638902 .
- ^ Jump up to: а б Джонсон, Дж.Л.; Найор, Северная Каролина; Грин, К.Дж. (2014). «Десмосомы: регуляторы клеточной передачи сигналов и адгезии в эпидермальном здоровье и заболеваниях» . Перспективы Колд-Спринг-Харбора в медицине . 4 (11): а015297. doi : 10.1101/cshperspect.a015297 . ПМК 4208714 . ПМИД 25368015 .
- ^ Дельва, Э.; Такер, ДК; Ковальчик, АП (2009). «Десмосома» . Перспективы Колд-Спринг-Харбор в биологии . 1 (2): а002543. doi : 10.1101/cshperspect.a002543 . ПМК 2742091 . ПМИД 20066089 .
- ^ Jump up to: а б Стид, Эмили; Балда, Мария С.; Материя, Карл (2010). «Динамика и функции плотных соединений». Тенденции в клеточной биологии . 20 (3): 142–149. дои : 10.1016/j.tcb.2009.12.002 . ПМИД 20061152 .
- ^ Ниссен, Кариен М. (2007). «Плотные соединения/адгерентные соединения: основная структура и функция» . Журнал исследовательской дерматологии . 127 (11): 2525–2532. дои : 10.1038/sj.jid.5700865 . ПМИД 17934504 .
- ^ Jump up to: а б Гуденаф, окружной прокурор; Пол, Д.Л. (2009). «Разрывные соединения» . Перспективы Колд-Спринг-Харбор в биологии . 1 (1): а002576. doi : 10.1101/cshperspect.a002576 . ПМК 2742079 . ПМИД 20066080 .
- ^ Меше, Гюлистан; Ричард, Габриэле; Уайт, Томас В. (2007). «Щелевые соединения: основная структура и функция» . Журнал исследовательской дерматологии . 127 (11): 2516–2524. дои : 10.1038/sj.jid.5700770 . ПМИД 17934503 .
- ^ МакЭвер, Роджер П. (2015). «Селектины: инициаторы адгезии лейкоцитов и передачи сигналов на сосудистой стенке» . Сердечно-сосудистые исследования . 107 (3): 331–339. дои : 10.1093/cvr/cvv154 . ПМЦ 4592324 . ПМИД 25994174 .
- ^ Jump up to: а б Бартель, Стивен Р.; Гавино, Жасилн Д; Дешени, Лейла; Димитрофф, Чарльз Дж (2007). «Нацеливание на селектины и лиганды селектина при воспалении и раке» . Мнение экспертов о терапевтических целях . 11 (11): 1473–1491. дои : 10.1517/14728222.11.11.1473 . ПМК 2559865 . ПМИД 18028011 .
- ^ Вонг, Чи Вай; Дай, Даниэль Э.; Кумб, Дейдра Р. (2012). «Роль молекул адгезии клеток суперсемейства иммуноглобулинов в метастазах рака» . Международный журнал клеточной биологии . 2012 : 340296. doi : 10.1155/2012/340296 . ПМЦ 3261479 . ПМИД 22272201 .
- ^ Jump up to: а б Арическу, А. Раду; Джонс, Э. Ивонн (2007). «Молекулы клеточной адгезии суперсемейства иммуноглобулинов: молнии и сигналы». Современное мнение в области клеточной биологии . 19 (5): 543–550. дои : 10.1016/j.ceb.2007.09.010 . ПМИД 17935964 .
- ^ Jump up to: а б Такада, Ёсиказу; Йе, Сяоцзин; Саймон, Скотт (2007). «Интегрины» . Геномная биология . 8 (5): 215. doi : 10.1186/gb-2007-8-5-215 . ЧВК 1929136 . ПМИД 17543136 .
- ^ Jump up to: а б Лодиш, Харви; Берк, Арнольд; Зипурски, С. Лоуренс; Мацудайра, Пол; Балтимор, Дэвид; Дарнелл, Джеймс (2000). Молекулярно-клеточная биология (4-е изд.). У. Х. Фриман. ISBN 978-0-7167-3136-8 .
- ^ Боррадори, Лука; Зонненберг, Арну (1999). «Структура и функция гемидесмосом: больше, чем простые адгезионные комплексы» . Журнал исследовательской дерматологии . 112 (4): 411–418. дои : 10.1046/j.1523-1747.1999.00546.x . ПМИД 10201522 .
- ^ Jump up to: а б Кричли, Дэвид Р. (2000). «Фокальные спайки – цитоскелетная связь». Современное мнение в области клеточной биологии . 12 (1): 133–139. дои : 10.1016/S0955-0674(99)00067-8 . ПМИД 10679361 .
- ^ Jump up to: а б Силия, Мишель Линн; Джексон, Дэвид (2004). «Форма и функция плазмодесм». Современное мнение в области клеточной биологии . 16 (5): 500–506. дои : 10.1016/j.ceb.2004.08.002 . ПМИД 15363799 .
- ^ Сингх, Рам Саруп; Валия, Амандип Каур; Канвар, Джагат Ракеш (2016). «Лектины простейших и их роль во взаимодействии хозяин-патоген». Достижения биотехнологии . 34 (5): 1018–1029. doi : 10.1016/j.biotechadv.2016.06.002 . ПМИД 27268207 .
- ^ Ратор, Дхармендар; Сакчи, Джон Б.; де ла Вега, Патрисия; Маккатчан, Томас Ф. (2002). «Связывание и инвазия спорозоитов в клетки печени» . Журнал биологической химии . 277 (9): 7092–7098. дои : 10.1074/jbc.M106862200 . ПМИД 11751898 .
- ^ Кадекоппала, Мадхусудан; Холдер, Энтони А. (2010). «Поверхностные белки мерозоитов малярийного паразита: комплекс MSP1 и семейство MSP7». Международный журнал паразитологии . 40 (10): 1155–1161. дои : 10.1016/j.ijpara.2010.04.008 . ПМИД 20451527 .
- ^ Трончин, Гай; Пиет, Марк; Лопес-Безерра, Лейла М.; Бушара, Жан-Филипп (2008). «Механизмы адгезии патогенных грибов человека» . Медицинская микология . 46 (8): 749–772. дои : 10.1080/13693780802206435 . ПМИД 18651303 .
- ^ Лима, ОК; Фигейредо, CC; Превиато, Джо; Мендонка-Превиато, Л.; Моранди, В.; Лопес Безерра, LM (2001). «Участие компонентов клеточной стенки грибов в адгезии Sporothrix schenckii к фибронектину человека» . Инфекция и иммунитет . 69 (11): 6874–6880. дои : 10.1128/IAI.69.11.6874-6880.2001 . ПМК 100066 . ПМИД 11598061 .
- ^ Магистр наук, Майкл Гринвуд (04 октября 2021 г.). «Роль жгутиков в адгезии и вирулентности» . Новости-Медицинские . Проверено 18 января 2024 г.
- ^ Клемм, Пер; Шембри, Марк А. (2000). «Бактериальные адгезины: функции и строение». Международный журнал медицинской микробиологии . 290 (1): 27–35. дои : 10.1016/S1438-4221(00)80102-2 . ПМИД 11043979 .
- ^ Гарман, ЭФ (2015). «Молекулярные механизмы противовирусной адгезии при гриппе: навязчивая идея У. Г. Лейвера на всю жизнь» . Философские труды Королевского общества B: Биологические науки . 370 (1661): 20140034. doi : 10.1098/rstb.2014.0034 . ПМЦ 4275904 . ПМИД 25533092 .
- ^ Капон, диджей; Уорд, RHR (1991). «Взаимодействие CD4-gpl20 и патогенез СПИДа». Ежегодный обзор иммунологии . 9 (1): 649–678. дои : 10.1146/annurev.iy.09.040191.003245 . ПМИД 1910691 .
- ^ Бендас, Герд; Борсиг, Любор (2012). «Адгезия раковых клеток и метастазирование: селектины, интегрины и ингибирующий потенциал гепаринов» . Международный журнал клеточной биологии . 2012 : 676731. doi : 10.1155/2012/676731 . ПМК 3296185 . ПМИД 22505933 .
- ^ Харрис, Эстель С.; Вейрих, Эндрю С.; Циммерман, Гай А. (2012). «Уроки редких заболеваний: синдромы дефицита адгезии лейкоцитов» . Современное мнение в гематологии . 20 (1): 16–25. дои : 10.1097/MOH.0b013e32835a0091 . ПМЦ 3564641 . ПМИД 23207660 .
- ^ Ханна, Сухейр; Эциони, Амос (2012). «Дефицит адгезии лейкоцитов». Анналы Нью-Йоркской академии наук . 1250 (1): 50–55. Бибкод : 2012NYASA1250...50H . дои : 10.1111/j.1749-6632.2011.06389.x . ПМИД 22276660 . S2CID 33727687 .
- ^ Тамгадж, Сандхья; Бхатт, ДайватМ; Перейра, Тревиль; Тамгадж, Авинаш; Бхалерао, Судхир (2011). «Пемфигус обыкновенный» . Современная клиническая стоматология . 2 (2): 134–7. дои : 10.4103/0976-237X.83074 . ПМК 3180831 . ПМИД 21957393 .
- ^ Крахлер, Энн Мари; Орт, Ким (2014). «Нацеливание на интерфейс бактерия-хозяин» . Вирулентность . 4 (4): 284–294. дои : 10.4161/viru.24606 . ПМЦ 3710331 . ПМИД 23799663 .
- ^ Офек, Ицхак; Хэсти, Дэвид Л; Шэрон, Натан (2003). «Антиспаечная терапия бактериальных заболеваний: перспективы и проблемы». FEMS Иммунология и медицинская микробиология . 38 (3): 181–191. CiteSeerX 10.1.1.320.1480 . дои : 10.1016/S0928-8244(03)00228-1 . ПМИД 14522453 .
Внешние ссылки
[ редактировать ]- «Клетка » Дж. Купера (онлайн-учебник)
- Молекулярно-клеточная биология Лодиша и др. (онлайн-учебник)
- Молекулярная биология клетки Альбертса и др. (онлайн-учебник)
- Клеточная адгезия и внеклеточный матрикс - Виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии