Коннексин
| Коннексин | |||
|---|---|---|---|
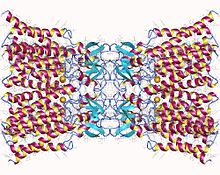 Додекамер Коннексин-26. Щелевое соединение, состоящее из двенадцати идентичных белков коннексина, по шесть в мембране каждой клетки. Каждая из этих шести единиц представляет собой один полипептид, который проходит через мембрану четыре раза (так называемые трансмембранные белки с четырьмя проходами). | |||
| Идентификаторы | |||
| Символ | Коннексин | ||
| Пфам | PF00029 | ||
| ИнтерПро | ИПР013092 | ||
| PROSITE | PDOC00341 | ||
| TCDB | 1.А.24 | ||
| Суперсемейство OPM | 194 | ||
| белок OPM | 2zw3 | ||
| |||
Коннексины ( Cx ) ( TC# 1.A.24 ), или щелевых соединений белки , представляют собой структурно родственные трансмембранные белки, которые собираются с образованием щелевых соединений позвоночных. Совершенно другое семейство белков, иннексины , образует щелевые контакты у беспозвоночных . [ 1 ] Каждое щелевое соединение состоит из двух полуканалов, или коннексонов , которые состоят из гомо- или гетерогексамерных массивов коннексинов, причем коннексон в одной плазматической мембране стыкуется конец в конец с коннексоном в мембране близко расположенной клетки. Полуканал состоит из шести субъединиц коннексина, каждая из которых состоит из четырех трансмембранных сегментов. Щелевые соединения необходимы для многих физиологических процессов, таких как скоординированная деполяризация сердечной мышцы , правильное эмбриональное развитие и кондуктивный ответ в микроциркуляторном русле. Коннексины также обладают независимыми от канала функциями, связанными с цитоскелетом и миграцией клеток. [ 2 ] По этим причинам мутации в генах, кодирующих коннексин, могут привести к функциональным аномалиям и аномалиям развития.
Номенклатура
[ редактировать ]Коннексины обычно называют в соответствии с их молекулярной массой, например Cx26 представляет собой белок коннексина массой 26 кДа. Конкурирующей номенклатурой является система белков щелевых соединений , в которой коннексины сортируются по их формам α (GJA) и β (GJB), при этом дополнительные коннексины сгруппированы в группы C, D и E, за которыми следует идентификационный номер, например, GJA1 соответствует Сх43. После голосования на конференции Gap Junction Conference (2007 г.) в Эльсиноре сообщество согласилось использовать систему номенклатуры GJ для генов, кодирующих коннексины, но пожелало сохранить номенклатуру коннексинов для кодируемых белков, используя для нумерации вес человеческого белка. ортологичных белков.
Структура
[ редактировать ]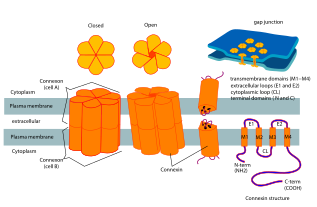
Коннексины содержат четыре высокоупорядоченных трансмембранных сегмента (TMS), в основном неструктурированные C и N цитоплазматические концы, цитоплазматическую петлю (CL) и две внеклеточные петли (EL-1) и (EL-2). Коннексины собираются в группы по шесть штук, образуя полуканалы или коннексоны, а затем два полуканала объединяются, образуя щелевой контакт.
Доступна кристаллическая структура канала щелевого соединения, образованного человеческим Cx26 (также известным как GJB2) с разрешением 3,5 Å. [ 3 ] Карта плотности показала два трансмембранных полуканала и расположение четырех ТМС шести протомеров, образующих каждый полуканал. Полуканалы имеют положительно заряженный цитоплазматический вход, воронку, отрицательно заряженный трансмембранный путь и внеклеточную полость. Пора сужена в воронке, которая образована шестью аминоконцевыми спиралями, выстилающими стенку канала, что, таким образом, определяет ограничение размера молекул на входе в канал.
Семейство генов коннексина разнообразно: двадцать один идентифицированный член в секвенированном геноме человека и двадцать в мышином (девятнадцать из которых являются ортологичными парами). Обычно они весят от 25 до 60 кДа и имеют среднюю длину 380 аминокислот. Было обнаружено, что различные коннексины объединяются как в гомомерные, так и в гетеромерные щелевые соединения, каждый из которых может проявлять различные функциональные свойства, включая проводимость пор, селективность по размеру, селективность по заряду, стробирование по напряжению и химическое стробирование. [ 4 ]
Биосинтез и интернализация
[ редактировать ]Замечательным аспектом коннексинов является то, что они имеют относительно короткий период полураспада – всего несколько часов. [ 5 ] Результатом является наличие динамического цикла, в ходе которого коннексины синтезируются и заменяются. Было высказано предположение, что такая короткая продолжительность жизни позволяет осуществлять более тонко регулируемые физиологические процессы, например, в миометрии .
От ядра к мембране
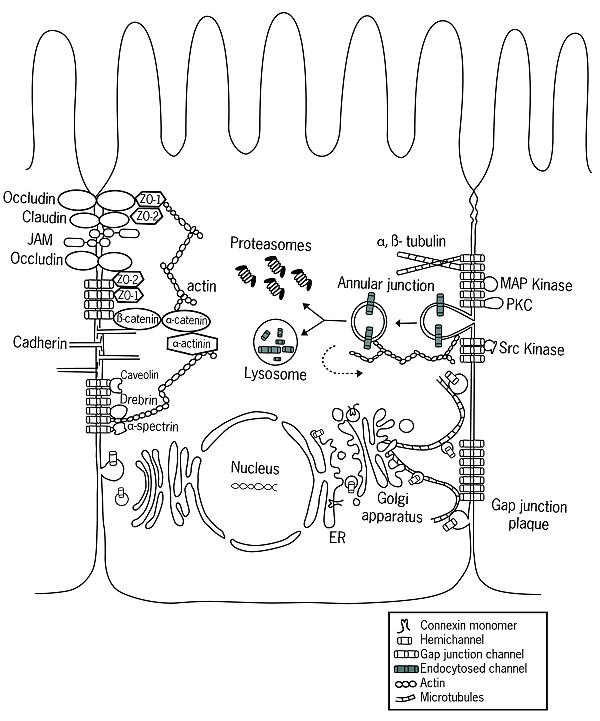
[ редактировать ]Когда они транслируются рибосомами, коннексины встраиваются в мембрану эндоплазматического ретикулума (ЭР). [ 6 ] Именно в ЭР коннексины правильно сворачиваются, образуя две внеклеточные петли, EL-1 и EL-2. Также в ER начинается олигомеризация молекул коннексина в полуканалы, процесс, который может продолжаться и в промежуточном компартменте UR-Гольджи. [ 5 ] Расположение этих полуканалов может быть гомотипическим, гетеротипическим и комбинированным гетеротипическим/гетеромерным. После выхода из ER и прохождения через ERGIC свернутые коннексины обычно попадают в цис -сеть Гольджи. [ 7 ] Однако некоторые коннексины, такие как Cx26, могут транспортироваться независимо от аппарата Гольджи. [ 8 ] [ 9 ] [ 10 ] [ 11 ] [ 12 ]
Сборка щелевого соединения
[ редактировать ]После внедрения в плазматическую мембрану клетки полуканалы свободно диффундируют внутри липидного бислоя. [ 13 ] С помощью специфических белков, главным образом кадгеринов , полуканалы способны стыковаться с полуканалами соседних клеток, образуя щелевые соединения. [ 14 ] Недавние исследования показали существование связи между слипчивыми и щелевыми соединениями. [ 15 ] предполагая более высокий уровень координации, чем считалось ранее.
Функция
[ редактировать ]Щелевые соединения коннексинов обнаружены только у позвоночных , в то время как функционально аналогичная (но генетически неродственная) группа белков, иннексины , ответственна за щелевые соединения у беспозвоночных . Ортологи иннексина также были идентифицированы у хордовых , но они больше не способны образовывать щелевые контакты. Вместо этого каналы, образованные этими белками (называемыми паннексинами ), действуют как очень большие трансмембранные поры, соединяющие внутри- и внеклеточные компартменты.
Внутри ЦНС щелевые контакты обеспечивают электрическую связь между клетками-предшественниками, нейронами и глиальными клетками. коннексина Исследования на мышах с нокаутом показали, что соединение клеток необходимо для передачи визуальных сигналов. В сетчатке уровни окружающего освещения влияют на связь клеток, обеспечиваемую каналами щелевых соединений, адаптируя зрительную функцию к различным условиям освещения. Соединение клеток регулируется несколькими механизмами, включая экспрессию коннексина. [ 17 ]
Дерок и др. . обсудили многоуровневую платформу, с помощью которой коннексины и паннексины могут влиять на следующие клеточные функции в ткани: (1) каналы щелевых соединений коннексина (GJC) обеспечивают прямую межклеточную связь малых молекул, (2) полуканалы коннексина и каналы паннексина могут способствовать к аутокринным / паракринным сигнальным путям, и (3) различные структурные домены этих белков обеспечивают независимые от каналов функции, такие как межклеточная адгезия , взаимодействие с цитоскелет . и активация внутриклеточных сигнальных путей [ 18 ] Таким образом, коннексины и паннексины вносят многогранный вклад в развитие мозга и специфические процессы в нейро-глио-сосудистой единице, включая синаптическую передачу и пластичность, передачу сигналов глии, вазомоторный контроль, движение клеток и целостность гематоэнцефалического барьера в зрелой ЦНС. [ 18 ] [ 2 ]
Специфичность субстрата
[ редактировать ]Различные коннексины могут проявлять разную специфичность в отношении растворенных веществ. Например, аденозин проходит примерно в 12 раз лучше через каналы, образованные Cx32, тогда как AMP и ADP проходят примерно в 8 раз лучше, а АТФ более чем в 300 раз лучше через каналы, образованные Cx43. Таким образом, добавление фосфата к аденозину, по-видимому, смещает его относительную проницаемость с каналов, образованных Cx32, на каналы, образованные Cx43. Это может иметь функциональные последствия, поскольку энергетический статус клетки можно контролировать посредством экспрессии коннексина и образования каналов. [ 19 ]
Транспортная реакция
[ редактировать ]Транспортная реакция, катализируемая щелевыми контактами коннексина:
- Малые молекулы (цитоплазма клетки 1) ⇌ малые молекулы (цитоплазма клетки 2)
Человеческие коннексины и клиническое значение
[ редактировать ]| Коннексин | Ген | Расположение и функции |
|---|---|---|
| Cx43 | ТЕМА 1 | Экспрессируется на поверхности сосудов с атеросклеротическими бляшками и активируется при атеросклерозе у мышей. Может иметь патологические последствия. Также экспрессируется между гранулезными клетками , что необходимо для пролиферации. В норме экспрессируется в астроцитах, также обнаруживается в большинстве астроцитом человека и в астроглиальном компоненте глионейрональных опухолей. [ 20 ] Это также основной сердечный коннексин, обнаруживаемый главным образом в миокарде желудочков. [ 21 ] Ассоциируется с окулоденто-цифровой дисплазией . |
| Cx46 | GJA3 | |
| Cx37 | ВЕЩЬ 4 | Индуцируется в гладких мышцах сосудов во время коронарного артериогенеза. Мутации Cx37 не смертельны. Образует щелевые соединения между ооцитами и гранулезными клетками и необходим для выживания ооцитов. |
| Cx40 | GJA5 | Экспрессируется избирательно в миоцитах предсердий. Отвечает за скоординированную электрическую активацию предсердий. [ 22 ] |
| Cx33 | ВЕЩЬ 6 (ГДЖА6П) |
Псевдоген у человека |
| Cx50 | ВЕЩЬ 8 | Щелевые соединения между горизонтальными клетками А-типа в сетчатке мыши и кролика [ 23 ] |
| Cx59 | ВЕЩЬ 10 | |
| Cx62 | ВЕЩЬ 10 | Человеческий Cx62 соответствует Cx57 (мышь). Расположение в горизонтальной клетке B-типа, несущей аксоны, в сетчатке кролика. [ 24 ] |
| Cx32 | GJB1 | Основной компонент периферического миелина. Мутации в человеческом гене вызывают Х-сцепленную болезнь Шарко-Мари-Тута — наследственную нейропатию. В нормальном мозге человека CX32 экспрессируется в нейронах и олигодендроцитах. [ 20 ] |
| Cx26 | GJB2 | Мутация при синдроме Вохвинкеля [ 25 ] а также синдром кератита-ихтиоза-глухоты (KID) . [ 25 ] |
| Cx31 | GJB3 | Может быть связано с изменчивой эритрокератодермией . |
| Cx30.3 | GJB4 | Фонсека и др. подтвердили экспрессию Cx30.3 в тимоцитах . [ 26 ] Может быть связано с изменчивой эритрокератодермией. |
| Cx31.1 | GJB5 | |
| Cx30 | GJB6 | Мутирует в синдром Клаустона (гидротическая эктодермальная дисплазия) [ 25 ] |
| Cx25 | GJB7 | |
| Cx45 | GJC1 / GJA7 | Эпителиальные клетки протоков поджелудочной железы человека. [ 27 ] Атриовентрикулярный узел. |
| Cx47 | GJC2 / GJA12 | Экспрессируется в щелевых соединениях олигодендроцитов. [ 28 ] |
| Cx31.3 | GJC3 | Человеческий ортолог мышиного Cx29. Не известно, что он образует щелевые соединения. [ 29 ] |
| Cx36 | GJD2 /GJA9 | Функция бета-клеток поджелудочной железы, опосредующая высвобождение инсулина. Нейроны по всей центральной нервной системе синхронизируют нервную активность. [ 30 ] |
| Cx31.9 | GJD3 /GJC1 | |
| Cx39 | ГЖД4 | |
| Сх40.1 | ГЖД4 | |
| Cx23 | GJE1 |
Щелевые соединения необходимы для многих физиологических процессов, таких как скоординированная деполяризация сердечной мышцы , правильное эмбриональное развитие и кондуктивный ответ в микроциркуляторном русле. По этой причине делеция или мутация различных изоформ коннексина приводит к появлению отличительных фенотипов и патологий. [ 31 ] В то время как мутации Cx43 в основном связаны с окулоденто-пальцевой дисплазией, мутации Cx47 связаны с Пелицеуса-Мерцбахера болезнью и лимфедемой. Мутации Cx40 в основном связаны с фибрилляцией предсердий. Мутации Cx37 еще не описаны, но полиморфизмы гена Cx37 вовлечены в развитие артериальных заболеваний. [ 32 ] [ 33 ]
Ссылки
[ редактировать ]- ^ Лодиш Х.Ф., Берк А., Мацудайра П., Кайзер К.А., Кригер М., Скотт М.П., Зипурски С.Л., Дарнелл Дж. (2004). Молекулярно-клеточная биология (5-е изд.). Нью-Йорк: WH Freeman and Company. стр. 230–31. ISBN 0-7167-4366-3 .
- ^ Перейти обратно: а б Мацуучи Л., Наус CC (январь 2013 г.). «Белки щелевых соединений в движении: коннексины, цитоскелет и миграция» . Биохим Биофиз Акта . 1828 (1): 94–108. дои : 10.1016/j.bbamem.2012.05.014 . ПМИД 22613178 .
- ^ Маэда С., Накагава С., Суга М., Ямашита Э., Осима А., Фудзиеси Ю., Цукихара Т. (апрель 2009 г.). «Структура канала щелевого соединения коннексина 26 при разрешении 3,5 А». Природа . 458 (7238): 597–602. Бибкод : 2009Natur.458..597M . дои : 10.1038/nature07869 . ISSN 1476-4687 . ПМИД 19340074 . S2CID 4431769 .
- ^ Аяд В.А., Локк Д., Корин IV, Харрис А.Л. (июнь 2006 г.). «Гетеромерные, но не гомомерные каналы коннексина избирательно проницаемы для инозитолфосфатов» . Ж. Биол. Хим . 281 (24): 16727–39. дои : 10.1074/jbc.M600136200 . ISSN 0021-9258 . ПМИД 16601118 .
- ^ Перейти обратно: а б Лэрд Д.В. (март 2006 г.). «Жизненный цикл коннексинов в здоровье и болезни» . Биохим. Дж . 394 (Часть 3): 527–43. дои : 10.1042/BJ20051922 . ПМК 1383703 . ПМИД 16492141 .
- ^ Беннетт М.В., Зукин Р.С. (февраль 2004 г.). «Электрическая связь и синхронизация нейронов в мозгу млекопитающих» . Нейрон . 41 (4): 495–511. дои : 10.1016/s0896-6273(04)00043-1 . ПМИД 14980200 . S2CID 18566176 .
- ^ Мусил Л.С., Гуденаф Д.А. (сентябрь 1993 г.). «Мультисубъединичная сборка интегрального белка канала плазматической мембраны, коннексина щелевого соединения 43, происходит после выхода из ЭР». Клетка . 74 (6): 1065–77. дои : 10.1016/0092-8674(93)90728-9 . ПМИД 7691412 . S2CID 12169415 .
- ^ Эванс В.Х., Ахмад С., Диз Дж., Джордж Ч.С., Кендалл Дж.М., Мартин П.Е. (1999). «Пути торговли людьми, ведущие к образованию щелевых соединений». Симпозиум 219 Фонда Novartis — Межклеточная передача сигналов, опосредованная щелевыми соединениями, в здоровье и заболеваниях . Симпозиумы Фонда Новартис. Том. 219. стр. 44–54, обсуждение 54–9. дои : 10.1002/9780470515587.ch4 . ISBN 9780470515587 . ПМИД 10207897 .
- ^ Джордж Ч., Кендалл Дж. М., Эванс У. Х. (март 1999 г.). «Пути внутриклеточного транспорта при сборке коннексинов в щелевые соединения» . Ж. Биол. Хим . 274 (13): 8678–85. дои : 10.1074/jbc.274.13.8678 . ПМИД 10085106 .
- ^ Джордж Ч., Кендалл Дж. М., Кэмпбелл А. К., Эванс У. Х. (ноябрь 1998 г.). «Химеры коннексин-экворин сообщают о цитоплазматической среде кальция по путям транспортировки, ведущим к биогенезу щелевых соединений в живых клетках COS-7» . Ж. Биол. Хим . 273 (45): 29822–9. дои : 10.1074/jbc.273.45.29822 . ПМИД 9792698 .
- ^ Мартин П.Е., Джордж Ч.Х., Кастро С., Кендалл Дж.М., Кэпел Дж., Кэмпбелл А.К., Ревилла А., Баррио Л.К., Эванс У.Х. (январь 1998 г.). «Сборка химерных белков коннексин-экворин в функциональные каналы щелевых соединений. Отчет о внутриклеточной и плазматической мембранной среде кальция» . Ж. Биол. Хим . 273 (3): 1719–26. дои : 10.1074/jbc.273.3.1719 . ПМИД 9430718 .
- ^ Мартин П.Е., Эррингтон Р.Дж., Эванс У.Х. (2001). «Сборка щелевых соединений: несколько флуорофоров коннексина идентифицируют сложные пути транспортировки» . Сотовая коммуникация. Клеи . 8 (4–6): 243–8. дои : 10.3109/15419060109080731 . ПМИД 12064596 . S2CID 3029281 .
- ^ Томас Т., Джордан К., Симек Дж., Шао К., Джедеско С., Уолтон П., Лэрд Д.В. (октябрь 2005 г.). «Механизмы транспорта Cx43 и Cx26 к плазматической мембране и регенерации щелевых контактов». Дж. Клеточная наука . 118 (Часть 19): 4451–62. дои : 10.1242/jcs.02569 . ПМИД 16159960 . S2CID 13486416 .
- ^ Йонген В.М., Фицджеральд Д.Д., Асамото М., Пикколи С., Слага Т.Дж., Грос Д., Такеичи М., Ямасаки Х. (август 1991 г.). «Регуляция межклеточной коммуникации через щелевые соединения, опосредованной коннексином 43, с помощью Ca2+ в эпидермальных клетках мыши контролируется E-кадгерином» . Дж. Клеточная Биол . 114 (3): 545–55. дои : 10.1083/jcb.114.3.545 . ПМК 2289094 . ПМИД 1650371 .
- ^ Вэй CJ, Фрэнсис Р., Сюй X, Ло CW (май 2005 г.). «Коннексин43, связанный с мультибелковым комплексом, содержащим N-кадгерин, необходим для образования щелевых соединений в клетках NIH3T3» (PDF) . Ж. Биол. Хим . 280 (20): 19925–36. дои : 10.1074/jbc.M412921200 . ПМИД 15741167 . S2CID 770387 .
- ^ Дбук Х.А., Мру Р.М., Эль-Саббан М.Э., Талхук Р.С. (март 2009 г.). «Коннексины: множество функций, выходящих за рамки сборки каналов щелевых соединений» . Сигнал сотовой связи . 7 :4. дои : 10.1186/1478-811X-7-4 . ПМК 2660342 . ПМИД 19284610 .
- ^ Кихара А.Х., де Кастро Л.М., Мориско А.С., Хамассаки Д.Э. (май 2006 г.). «Длительная темновая адаптация меняет экспрессию коннексина в сетчатке мыши». J Neurosci Res . 83 (7): 1331–41. дои : 10.1002/мл.20815 . ПМИД 16496335 . S2CID 2919282 .
- ^ Перейти обратно: а б Декрок Э., Де Бок М., Ван Н., Бултынк Г., Джауме С., Наус CC, Грин С.Р., Лейберт Л. (август 2015 г.). «Сигнальные пути коннексина и паннексина: архитектурный проект физиологии и патологии ЦНС?» . Клетка. Мол. Наука о жизни . 72 (15): 2823–51. дои : 10.1007/s00018-015-1962-7 . ISSN 1420-9071 . ПМЦ 11113968 . ПМИД 26118660 . S2CID 17170098 .
- ^ Гольдберг Г.С., Морено А.П., Лампе П.Д. (сентябрь 2002 г.). «Щелевые соединения между клетками, экспрессирующими коннексин 43 или 32, демонстрируют обратную селективность по отношению к аденозину и АТФ» . Ж. Биол. Хим . 277 (39): 36725–30. дои : 10.1074/jbc.M109797200 . ISSN 0021-9258 . ПМИД 12119284 .
- ^ Перейти обратно: а б Ароника Э., Гортер Дж.А., Янсен Г.Х., Леенстра С., Янкая Б., Трост Д. (май 2001 г.). «Экспрессия белков щелевых соединений коннексина 43 и коннексина 32 в опухолях головного мозга, связанных с эпилепсией, и в эпилептической коре головного мозга, связанной с эпилепсией». Акта Нейропатол . 101 (5): 449–59. дои : 10.1007/s004010000305 . ПМИД 11484816 . S2CID 6738913 .
- ^ Верхёле С., ван Кемпен М.Дж., Те Вельшер П.Х., Квак Б.Р., Йонгсма Х.Дж. (май 1997 г.). «Характеристика каналов щелевых соединений в миокарде предсердий и желудочков взрослого кролика». Цирк. Рез . 80 (5): 673–81. дои : 10.1161/01.res.80.5.673 . ПМИД 9130448 .
- ^ [Бесплатная статья PMC] [PubMed] Голлоб М.Х., Джонс Д.Л., Кран А.Д., Дэнис Л., Гонг XQ, Шао К. и др. (июнь 2006 г.). «Соматические мутации гена коннексина 40 (GJA5) при фибрилляции предсердий» . Н. англ. Дж . Мед 354 (25): 2677–88. doi : 10.1056/NEJMoa052800 . ПМИД 16790700 .
- ^ Мэсси, Стивен (16 января 2009 г.). Коннексины: Руководство (1-е изд.). Спрингер-Верлаг Гмбх. стр. 3–?. ISBN 978-1-934115-46-6 .
- ^ Бейер, Эрик С.; Бертаунд, Вивиана М. (16 января 2009 г.). Коннексины: Руководство (1-е изд.). Спрингер-Верлаг Гмбх. стр. 387–417. ISBN 978-1-934115-46-6 .
- ^ Перейти обратно: а б с Авшалумова Л., Фабрикант Дж., Кориакос А. (февраль 2014 г.). «Обзор кожных заболеваний, связанных с мутациями гена коннексина». Инт Дж Дерматол . 53 (2): 192–205. дои : 10.1111/ijd.12062 . ПМИД 23675785 . S2CID 205187359 .
- ^ Фонсека ПК, Нихеи ОК, Урбан-Мальдонадо М, Абреу С, де Карвалью АС, Спрей ДК, Савино В, Алвес Л.А. (июнь 2004 г.). «Характеристика коннексинов 30.3 и 43 в тимоцитах». Иммунол. Летт . 94 (1–2): 65–75. дои : 10.1016/j.imlet.2004.03.019 . ПМИД 15234537 .
- ^ Тай М.Х., Олсон Л.К., Мадукар Б.В., Линнинг К.Д., Ван Кэмп Л., Цао М.С., Троско Дж.Е. (январь 2003 г.). «Характеристика межклеточной коммуникации щелевых соединений в иммортализованных эпителиальных клетках протоков поджелудочной железы человека с характеристиками стволовых клеток». Поджелудочная железа . 26 (1): е18–26. дои : 10.1097/00006676-200301000-00025 . ПМИД 12499933 . S2CID 34571252 .
- ^ Камасава Н., Сик А., Морита М., Ясумура Т., Дэвидсон К.Г., Надь Дж.И., Раш Дж.Е. (2005). «Коннексин-47 и коннексин-32 в щелевых соединениях сомат олигодендроцитов, миелиновых оболочках, паранодальных петлях и инцурах Шмидта-Лантермана: значение для ионного гомеостаза и откачивания калия» . Нейронаука . 136 (1): 65–86. doi : 10.1016/j.neuroscience.2005.08.027 . ПМК 1550704 . ПМИД 16203097 .
- ^ Саргианниду И, Ан М, Энрикес А.Д., Пейнадо А., Рейнольдс Р., Абрамс С., Шерер С.С., Клеопа К.А. (май 2008 г.). «Человеческие олигодендроциты экспрессируют Cx31.3: функция и взаимодействие с мутантами Cx32» . Нейробиол. Дис . 30 (2): 221–33. дои : 10.1016/j.nbd.2008.01.009 . ПМК 2704064 . ПМИД 18353664 .
- ^ Коннорс Б.В., Лонг, Массачусетс (2004). «Электрические синапсы в мозге млекопитающих» . Анну. Преподобный Нейроски . 27 : 393–418. дои : 10.1146/annurev.neuro.26.041002.131128 . ПМИД 15217338 .
- ^ Пфеннигер А., Вольвенд А., Квак Б.Р. (январь 2011 г.). «Мутации в генах коннексина и болезни» . Евро. Дж. Клин. Инвестируйте . 41 (1): 103–16. дои : 10.1111/j.1365-2362.2010.02378.x . ISSN 1365-2362 . ПМИД 20840374 . S2CID 24404442 .
- ^ Фанг Дж.С., Берт Дж.М. (сентябрь 2022 г.). «Коннексин37 регулирует клеточный цикл в сосудистой сети» . Дж. Васк Рес . 60 (2): 73–86. дои : 10.1159/000525619 . ПМИД 36067749 .
- ^ Молика Ф., Минс М.Дж., Морел С., Квак Б.Р. (сентябрь 2014 г.). «Мутации в генах сердечно-сосудистых коннексинов». Биология клетки . 106 (9): 269–93. дои : 10.1111/boc.201400038 . ПМИД 24966059 . S2CID 10070999 .
Источники
[ редактировать ]- На момент редактирования в этой статье используется контент из «1.A.24 The Gap Junction-forming Connexin (Connexin) Family» , который лицензируется таким образом, что разрешается повторное использование в соответствии с непортированной лицензией Creative Commons Attribution-ShareAlike 3.0 , но не в рамках ГФДЛ . Все соответствующие условия должны быть соблюдены.
Внешние ссылки
[ редактировать ] СМИ, связанные с коннексинами, на Викискладе?
СМИ, связанные с коннексинами, на Викискладе? - Коннексины Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)