Электрофильное фторирование
Электрофильное фторирование представляет собой комбинацию углеродцентрированного нуклеофила с электрофильным источником фтора с образованием фторорганических соединений . Хотя для этой цели можно использовать элементарный фтор и реагенты, включающие связь кислород-фтор, они в значительной степени заменены реагентами, содержащими связь азот-фтор. [1]
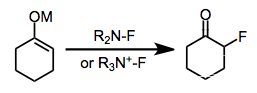
Электрофильное фторирование предлагает альтернативу методам нуклеофильного фторирования с использованием фторидов щелочных металлов или аммония и методам с использованием фторидов серы для получения фторорганических соединений. Разработка реагентов для электрофильного фторирования всегда была направлена на удаление электронной плотности из атома, присоединенного к фтору; однако соединения, содержащие связи азот-фтор, оказались наиболее экономичными, стабильными и безопасными электрофильными фторирующими агентами. Электрофильные реагенты NF бывают нейтральными или катионными и могут обладать либо sp 2 - или сп 3 -гибридизированный азот. высокоэффективные и стереоселективные Хотя точный механизм электрофильного фторирования в настоящее время неясен, разработаны методы.
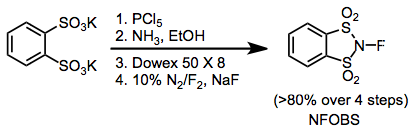
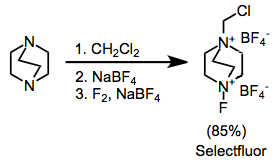
Некоторыми распространенными фторирующими агентами, используемыми в органическом синтезе, являются N- фтор- о -бензолдисульфонимид (NFOBS), N -фторбензолсульфонимид (NFSI) и Selectfluor . [1]
Механизм и стереохимия
[ редактировать ]Преобладающий механизм
[ редактировать ]Механизм электрофильного фторирования остается спорным. Вопрос заключается в том, протекает ли реакция посредством процесса S N 2 или одноэлектронного переноса (SET). В подтверждение механизма S N 2 арильные реагенты Гриньяра и ариллитий дают сходные выходы фторбензола в сочетании с N -фтор- о -бензолдисульфонимидом (NFOBS), хотя склонность этих реагентов к участию в процессах SET существенно различается. [2] Кроме того, эксперименты с радикальными зондами с эфирами 5-гексенила и циклопропиленола не дали никаких продуктов перегруппировки. [3] Совсем недавно кинетические исследования электрофильного фторирования ряда 1,3-дикарбонильных производных рядом реагентов NF показали, что механизм S N 2 более вероятен благодаря исследованиям Эйринга и Хэммета . [4]
С другой стороны, согласно прогнозам, время жизни радикалов в процессе SET будет на четыре порядка короче, чем предел обнаружения даже самых чувствительных радикальных зондов. Было высказано предположение, что после переноса электрона происходит немедленная рекомбинация радикала фтора с алкильным радикалом. [5]
Стереоселективные варианты
[ редактировать ]Стереоселективное фторирование может быть диастереоселективным или энантиоселективным. Диастереоселективные методы сосредоточены на использовании хиральных вспомогательных веществ на нуклеофильном субстрате. Для фторирования карбонильных соединений хиральные оксазолидиноны . с успехом используются [6]
Тандемное присоединение конъюгата, включающее хиральный нуклеофил, использовалось для синтеза β-амино-α-фторэфиров в хиральной, нерацемической форме.
Энантиоселективные методы используют стехиометрические количества хиральных фторирующих агентов. N -фтораммониевые соли алкалоидов хинного дерева представляют собой современное состояние реакций такого типа. Кроме того, эти реагенты легко синтезируются из Selectfluor и исходных алкалоидов. [7]
Область применения и ограничения
[ редактировать ]Фторирующие реагенты
[ редактировать ]Электрофильные фторирующие реагенты NF включают электроноакцепторные группы, присоединенные к азоту, для снижения электронной плотности на фторе. Хотя N -фторсульфонамиды являются довольно слабыми фторирующими реагентами, N - фторсульфонимиды , такие как N -фторбензолсульфонимид (NFSI), очень эффективны и широко используются. N- фтор-о-бензолдисульфонимид (НФОБС) синтезируют из дисульфоновой кислоты. [2]
Использование солей катионного азота увеличивает скорости и выходы электрофильного фторирования, поскольку катионный азот снижает электронную плотность у фтора. Ионы N-фторпиридиния и ионы иминия также можно использовать в качестве электрофильных фторирующих реагентов. Противоанионы этих солей, хотя и не участвуют непосредственно в переносе фтора к субстрату, тонко влияют на реакционную способность и могут регулироваться различными методами. [8]
Наиболее синтетически полезными солями аммония являются замещенные ионы бис(аммония) DABCO, включая Selectfluor . [9] Их можно легко синтезировать путем алкилирования с последующим фторированием. Дифтор-версия, которая на первый взгляд может показаться более полезной, содержит только один атом фтора.
Более специализированные электрофильные фторирующие реагенты, такие как нейтральные гетероциклы, содержащие связи N–F, [10] полезны для фторирования ограниченного круга субстратов.
Нуклеофильные субстраты
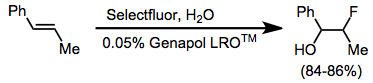
[ редактировать ]Простое фторирование алкенов часто приводит к образованию сложных смесей продуктов. Однако софторирование в присутствии нуклеофила протекает чисто с образованием вицинальных алкоксифторидов. [11] Алкины не фторируются реагентами НФ. анионное поверхностно-активное вещество Для облегчения контакта между водным раствором Selectfluor и алкеном использовали .
Фторирование богатых электронами ароматических соединений дает арилфториды. Двумя наиболее распространенными проблемами в этом классе реакций являются низкая орто / параселективность и деароматизация (последняя является особенно существенной проблемой для фенолов). [12]
Эфиры енолов и гликали достаточно нуклеофильны, чтобы их можно было фторировать с помощью Selectfluor. [13] Подобно другим алкенам, когалогенирование может быть осуществлено либо путем выделения промежуточного аддукта и реакции с нуклеофилом, либо путем прямого замещения DABCO in situ . Енолы можно фторировать энантиоселективно (см. выше) в присутствии хирального фторирующего агента.
Еноляты металлов совместимы со многими фторирующими реагентами, включая NFSI, NFOBS и сульфаниламиды. Однако специализированный реагент 2-фтор-3,3-диметил-2,3-дигидробензо[ d ]изотиазол-1,1-диоксид стабильно дает лучшие выходы монофторированных карбонильных соединений в реакциях с енолятами лития. Еноляты других металлов давали большие количества дифторированных продуктов. [14]
Сравнение с другими методами
[ редактировать ]Хотя использование молекулярного фтора в качестве электрофильного источника фтора зачастую является самым дешевым и прямым методом, F 2 часто образует радикалы и реагирует со связями CH без избирательности. Для подавления образования радикалов необходимы источники протонов или кислоты Льюиса, и даже когда эти реагенты присутствуют, только определенные субстраты реагируют с высокой селективностью. [15] Обращение с газообразным F 2 требует чрезвычайно специализированного и дорогостоящего оборудования.
Реагенты, содержащие связи OF, такие как CF 3 OF, имеют тенденцию быть более селективными для монофторирования, чем реагенты NF. [16] Однако трудности, связанные с обращением, и их чрезвычайная окислительная способность привели к их замене реагентами NF.
Ди-, тетра- и гексафторид ксенона являются селективными монофторирующими реагентами. Однако их нестабильность и высокая стоимость сделали их менее популярными, чем азотистые фторирующие агенты. [17]
Типичные условия
[ редактировать ]Хотя при фторировании с использованием реагентов NF не используется непосредственно молекулярный фтор, его почти всегда получают из F 2 . Правильное обращение с F 2 требует большой осторожности и специального оборудования. [18] Реакционные сосуды из поли(тетрафторэтилена) ( ПТФЭ , также известного как тефлон) используются вместо нержавеющей стали или стекла для реакций с участием молекулярного фтора. Смеси F 2 с N 2 или He коммерчески доступны и помогают контролировать скорость доставки фтора. Температуру следует поддерживать низкой, а введение фтора - медленным, чтобы предотвратить свободнорадикальные реакции.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Боду, Жером; Каар, Доминик (2008). «Электрофильное фторирование с реагентами <SCP>N</SCP> – <SCP>F</SCP>». Органические реакции . стр. 1–326. дои : 10.1002/0471264180.или069.02 . ISBN 978-0-471-26418-7 .
- ^ Jump up to: а б Дэвис, ФА; Хан, В.; Мерфи, CK J. Org. хим. 1995 , 60 , 4730.
- ^ Диффердинг, Э.; Рюгг, GM Tetrahedron Lett. 1991 , 32 , 3815.
- ^ Розатян, Нешат; Эшворт, Ян В.; Сэндфорд, Грэм; Ходжсон, Дэвид Р.В. (2018). «Количественная шкала реакционной способности электрофильных фторирующих реагентов» . Химическая наука . 9 (46): 8692–8702. дои : 10.1039/C8SC03596B . ПМК 6263395 . ПМИД 30595834 .
- ^ Пиана, С.; Девиллерс, И.; Тони, А.; Ротлисбергер, У. Ангью. хим. Межд. Эд. англ. 2002 , 41 , 979.
- ^ Дэвис, ФА; Кейс, PVN Tetrahedron Lett. 1998 , 39 , 6135.
- ^ Сибата, Н.; Сузуки, Э.; Асахи, Т.; Широ, MJ Am. хим. Соц. 2001 , 123 , 7001.
- ^ Умемото, Т.; Харасава, К.; Томизава, Г.; Кавада, К.; Томита, К. Булл. хим. Соц. Япония. 1991 , 64 , 1081.
- ^ Ставбер, С.; Зупан, М.; Посс, Эй Джей; Шиит, Г. А. Тетраэдр Летт. 1995 , 36 , 6769.
- ^ Лаали, КК; Танака, М.; Форохар, Ф.; Ченг, М.; Fetzer, JC J. Fluorine Chem. 1998 , 91 , 185.
- ^ Лал, GS (1993). «Сайт-селективное фторирование органических соединений с использованием солей 1-алкил-4-фтор-1,4-диазабицикло[2.2.2]октана (реагенты Selectfluor)» . Дж. Орг. Хим . 58 (10): 2791. doi : 10.1021/jo00062a023 .
- ^ Зупан, М.; Искра, Ж .; Ставбер, С. (1995). «Химия органогалогенных молекул. 140. Роль структуры реагента в превращениях гидроксизамещенных органических молекул N-фторкласса фторирующих реагентов» . Бык. хим. Соц. Япония . 68 (6): 1655. doi : 10.1246/bcsj.68.1655 .
- ^ Альберт, М.; Дакс, К.; Ортнер, Дж. Тетраэдр 1998 , 54 , 4839.
- ^ Диффердинг, Э.; Ланг, Р.В. Хелв. Сказать. Минуты. 1989 , 72 , 1248.
- ^ Чемберс, РД; Хатчинсон, Дж.; Сэндфорд, GJ Fluorine Chem. 1999 , 100 , 63.
- ^ Rozen, S. Chem. Rev. 1996 , 96 , 1717.
- ^ Рамсден, Калифорния; Смит, Р.Г. Дж. Ам. хим. Соц. 1998 , 120 , 6842.
- ^ Umemoto, T.; Nagayoshi, M. Bull. Chem. Soc. Jpn. 1996 , 69 , 2287.