Общий синтез осельтамивира

Общий синтез осельтамивира касается полного синтеза противогриппозного препарата осельтамивира. [1] продается компанией Hoffmann-La Roche под торговым названием Тамифлю . Его коммерческое производство начинается с биомолекулы шикимовой кислоты, полученной из китайского звездчатого аниса и рекомбинантной кишечной палочки . [2] [3] Важен контроль стереохимии: молекула имеет три стереоцентра и искомый изомер — только 1 из 8 стереоизомеров. [ нужна ссылка ]
Коммерческое производство
[ редактировать ]Текущий метод производства основан на первом масштабируемом синтезе, разработанном компанией Gilead Sciences. [4] начиная с встречающейся в природе хинной кислоты или шикимовой кислоты . Из-за более низких выходов и необходимости дополнительных стадий (из-за дополнительной дегидратации) от метода хинной кислоты отказались в пользу метода, основанного на шикимовой кислоте, который получил дальнейшие улучшения от Hoffmann-La Roche . [5] [6] Текущий промышленный синтез кратко описан ниже:
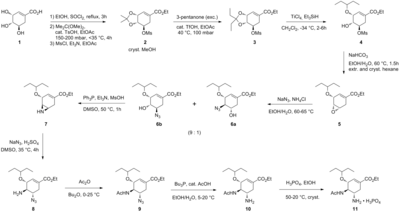
Синтез Карпфа/Труссарди
[ редактировать ]Современный метод производства включает две стадии реакции с потенциально опасными азидами . Сообщенный о безазидном синтезе тамифлю компании «Рош» графически представлен ниже: [7]
Синтез начинается с естественно доступной (-)- шикимовой кислоты . 3,4-пентилиденацеталь мезилат получают в три стадии этерификацию этанолом ; и тионилхлоридом : кетализация и п -толуолсульфоновой кислотой 3 -пентаноном ; и мезилирование триэтиламином и метансульфонилхлоридом . Восстановительное открытие кеталя в модифицированных условиях Хантера. [8] в дихлорметане дает неразделимую смесь изомерных мезилатов. Соответствующий эпоксид образуется в основных условиях с бикарбонатом калия . Использование недорогого диэтилэфирата бромида магния кислоты Льюиса (обычно получаемого в свежем виде путем добавления магния) .превращается в 1,2-дибромэтан в бензоле : диэтиловом эфире ), эпоксид раскрывается аллиламином с получением соответствующего 1,2-аминоспирта. несмешивающиеся с водой растворители метил-трет-бутиловый эфир и ацетонитрил. используются Для упрощения процедуры обработки, которая включала перемешивание с 1 М водным раствором сульфата аммония , Восстановление палладия , усиленное этаноламином , с последующей кислотной обработкой привело к снятию защиты 1,2-аминоспирта. в соответствующий аллилдиамин в интересной каскадной последовательности, которая начинается с неселективного иминирования бензальдегида Аминоспирт превращался непосредственно с азеотропным удалением воды в метил-трет-бутиловом эфире. Мезилирование с последующим удалением твердого побочного продукта триэтиламина гидрохлорид приводит к образованию промежуточного продукта, который готов подвергнуться азиридинированию при трансиминации с другим эквивалентом аллиламина. С либрированной метансульфоновой кислотой азиридин полностью открывается с образованием диамина, который немедленно подвергается второй трансиминации. Затем кислотный гидролиз удалил имин . Селективное ацилирование уксусным ангидридом (в буферных условиях 5-аминогруппа протонируется из -за значительной разницы в , pKa 4,2 против 7,9, что предотвращает ацетилирование ) дает желаемый N -ацетилированный продукт в кристаллической форме при экстракционной обработке. Наконец, деаллилирование, как указано выше, привело к получению свободного основания осельтамивира, которое было превращено в желаемый фосфат осельтамивира путем обработки фосфорной кислотой . Конечный продукт получают с высокой чистотой (99,7%) и общим выходом 17-22% из (-)-шикимовой кислоты. Отмечено, что в синтезе не используются потенциально взрывоопасные азидные реагенты и полупродукты; однако в синтезе, который фактически использует компания «Рош», используются азиды. У «Рош» есть и другие маршрутыосельтамивира, которые не включают использование (-)-шикимовой кислоты в качестве исходного материала хирального пула, например путь Дильса-Альдера, включающий фуран и этилакрилат или путь изофталевой кислоты , который включает каталитическое гидрирование и ферментативную десимметризацию. [ нужна ссылка ]
Синтез Кори
[ редактировать ]В 2006 году группа Э. Дж. Кори опубликовала новый способ обхода шикимовой кислоты, начиная с бутадиена и акриловой кислоты . [9] Изобретатели решили не патентовать эту процедуру, которая описана ниже.

Бутадиен 1 реагирует в асимметричной реакции Дильса-Альдера с этерификации продуктом акриловой кислоты и 2,2,2-трифторэтанолом 2, катализируемой катализатором CBS . Эфир , 3 превращается в амид в 4 реакцией с аммиаком а следующей стадией лактама 5 является йодолактамизация йодом . инициируемая триметилсилилтрифлатом , Амидная группа снабжается BOC-защитной группой по реакции с Boc-ангидридом в 6 , а йодный заместитель удаляется в реакции элиминирования с DBU до алкена 7 . Бром вводится в 8 путем аллильного бромирования NBS и отщепляется амидная группа этанолом и карбонатом цезия с отщеплением бромида до диенэтилового эфира 9 . Вновь образованная двойная связь функционализируется N -бромацетамидом 10 , катализируемым бромид олова(IV) с полным контролем стереохимии . На следующем этапе атом брома в 11 замещается , который , атомом азота в амидной группе с сильным основанием ХМДС на азиридин 12 в свою очередь, открывается реакцией с 3-пентанолом. 13 в эфир 14 . На заключительном этапе BOC-группа удаляется фосфорной кислотой фосфат осельтамивира 15 и образуется .
Синтез Шибасаки
[ редактировать ]Также в 2006 году группа Масакацу Сибасаки из Токийского университета опубликовала синтез, снова минуя шикимовую кислоту. [10] [11]

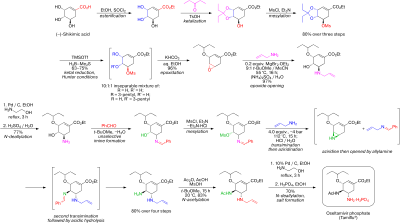
Усовершенствованный метод, опубликованный в 2007 году, начинается с 1 с помощью энантиоселективной десимметризации азиридина триметилсилилазида ( TMSN 3 ) и хирального катализатора до азида 2 . Амидная Boc группа защищается как BOC-группа с помощью -ангидрида и DMAP в 3 , а йодолактамизация с помощью йода и карбоната калия сначала дает нестабильное промежуточное соединение 4 , а затем стабильный циклический карбамат 5 после отщепления йодистого водорода с помощью DBU .
Амидная группа повторно защищается как BOC 6 , а азидная группа превращается в амид 7 путем восстановительного ацилирования тиоуксусной кислотой и 2,6-лутидином . Карбонат цезия осуществляет гидролиз карбаматной группы до спирта 8, который впоследствии окисляется до кетона 9 периодинаном Десса -Мартина . Цианофосфорилирование диэтилфосфороцианидатом (DEPC) модифицирует кетоновую группу до цианофосфата 10, открывая путь для внутримолекулярной аллильной перегруппировки в нестабильный β-аллилфосфат 11 ( толуол, запечатанная пробирка), который гидролизуется до спирта 12 хлоридом аммония . Эта гидроксильная группа имеет неправильную стереохимию и поэтому инвертируется в реакции Мицунобу с п-нитробензойной кислотой с последующим гидролизом п-нитробензоата до 13 .
Вторая реакция Мицунобу затем образует азиридин 14, доступный для реакции раскрытия цикла с 3-пентанолом , катализируемой трифторидом бора, до эфира 15 . На заключительном этапе удаляется BOC-группа (HCl) и добавляется фосфорная кислота к цели 16 .
Синтез Фукуямы
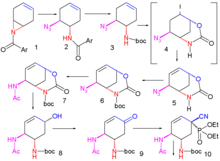
[ редактировать ]Подход, опубликованный в 2007 году. [12] как Кори начинает с асимметричной реакции Дильса-Альдера, на этот раз с исходными веществами пиридином и акролеином .


Пиридин ( 1 ) восстанавливают борогидридом натрия в присутствии бензилхлорформиата до Cbz - защищенного дигидропиридина 2 . Асимметричную реакцию Дильса-Альдера с акролеином 3 проводят на катализаторе Макмиллана до альдегида 4 как эндоизомера , который окисляется до карбоновой кислоты 5 хлоритом натрия , монокалийфосфатом и 2-метил-2-бутеном . При добавлении брома образуется галолактонизации продукт 6 , а после замены защитной группы Cbz на BOC- защитную группу в 7 ( гидрогенолиз в присутствии ди- трет -бутилдикарбоната ) карбонильная вводится в интермедиат 8 группа каталитическим оксидом рутения(IV). и жертвенный катализатор периодат натрия . Добавление аммиака расщепляет сложноэфирную группу с образованием амида 9, группа спиртовая которого мезилируется до соединения 10 . На следующем этапе йодбензолдиацетат добавляют , превращая амид в результате перегруппировки Гофмана в аллилкарбамат 12 после захвата промежуточного изоцианата аллиловым спиртом 11 . При добавлении В этилате натрия в этаноле одновременно протекают три реакции: расщепление амида с образованием новой этилэфирной группы , замещение мезильной группы новообразованным Вос-защищенным амином на азиридиновую группу и реакция отщепления с образованием алкеновой группы в 13 с высвобождением ХБр. На последних двух стадиях азиридиновое кольцо открывается 3-пентанолом 14 и трифторидом бора до аминоэфира 15 с заменой BOC-группы ацильной группой и удалением другой аминозащитной группы ( Pd/C , Ph 3 P и 1) . ,3-диметилбарбитуровая кислота в этаноле) и добавлением фосфорной кислоты осельтамивир 16 получают .
Синтез троста
[ редактировать ]
В 2008 году группа Барри М. Троста из Стэнфордского университета опубликовала самый короткий на сегодняшний день синтетический маршрут. [13]
Синтез Хаяши
[ редактировать ]В 2009 году Хаяши и др. успешно разработал эффективный и недорогой синтетический путь получения (-)-осельтамивира ( 1 ). Их целью было разработать процедуру, подходящую для крупномасштабного производства. Принимая во внимание стоимость, выход и количество стадий синтеза, энантиоселективный полный синтез ( 1 ) был осуществлен посредством трех операций в одном реакторе. [14] [5] Использование Хаяши и др. операций в одном реакторе позволило им выполнить несколько этапов реакции в одном реакторе, что в конечном итоге свело к минимуму количество необходимых этапов очистки, отходов и сэкономило время.

В первой операции с одним горшком Hayashi et al. начинается с использования силилового эфира дифенилпролинола ( 4 ) [6] в качестве органокатализатора , наряду с алкоксиальдегидом ( 2 ) и нитроалкеном ( 3 ) для проведения асимметричной реакции Михаэля , давая энантиоселективный аддукт Михаэля . При добавлении производного диэтилвинилфосфата ( 5 Михаэля ) к аддукту происходит реакция домино- Майкла и реакция Хорнера-Уодсворта-Эммонса из-за фосфонатной группы, полученной из ( 5 ), с образованием производного этилциклогексенкарбоксилата вместе с двумя нежелательными побочными продуктами. . Для превращения нежелательных побочных продуктов в желаемое производное этилциклогексенкарбоксилата смесь продукта и побочных продуктов обрабатывали Cs 2 CO 3 в этаноле. Это вызывало ретро-реакцию Михаэля для одного побочного продукта и ретро- альдольную реакцию, сопровождавшуюся реакцией Хорнера-Уодсворта-Эммонса для другого. Оба побочных продукта были успешно преобразованы в желаемое производное. Наконец, добавление п -толуолтиола к Cs 2 CO 3 дает ( 6 ) с выходом 70% после очистки колоночной хроматографией с преобладанием желаемого изомера. [14]

Во второй однореакторной операции сначала трифторуксусную кислоту используют для снятия защиты с трет- бутилового эфира ( 6 ); любой избыток реагента удаляли выпариванием. Карбоновую кислоту, полученную в результате снятия защиты, затем превращали в ацилхлорид с помощью оксалилхлорида и каталитического количества ДМФ . Наконец, добавление азида натрия в последней реакции второго однореакторного процесса приводит к образованию ацилазида ( 7 ) без какой-либо очистки. [14]
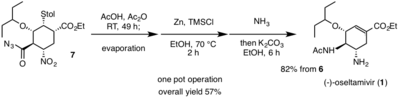
Последняя однореакторная операция начинается с перегруппировки Курциуса ацилазида ( 7 ) с образованием изоцианатной функциональной группы при комнатной температуре. Производное изоцианата 1 затем реагирует с уксусной кислотой с получением желаемого ацетиламиногруппы, обнаруженной в ( ) . Эта домино перегруппировка Курциуса и образование амида происходят в отсутствие тепла, что чрезвычайно полезно для снижения любой возможной опасности. Нитрогруппа ( 7 ) восстанавливается до желаемого амина, наблюдаемого в ( 1 ), с помощью Zn/HCl. Из-за суровых условий нитровосстановления для нейтрализации реакции использовали аммиак. карбонат калия Затем добавляли с получением ( 1 ) посредством реакции ретро-Майкла с тиолом . ( 1 ) затем очищали кислотно-основной экстракцией. Общий выход общего синтеза (-)-осельтамивира составляет 57%. [14] Хаяши и др. Использование недорогих, неопасных реагентов позволило разработать эффективный и высокопроизводительный путь синтеза, который может позволить производить огромное количество новых производных в надежде бороться с вирусами, устойчивыми к (-)-осельтамивиру.
Ссылки
[ редактировать ]- ^ Классика в Total Synthesis III: Дальнейшие цели, стратегии, методы К.К. Николау, Джейсон С. Чен ISBN 978-3-527-32957-1 2011 г.
- ^ Фарина В., Браун JD (ноябрь 2006 г.). «Тамифлю: проблема поставок». Ангеванде Хеми . 45 (44): 7330–4. дои : 10.1002/anie.200602623 . ПМИД 17051628 .
- ^ Рават Дж., Трипати П., Саксена Р.К. (май 2013 г.). «Расширение горизонтов шикимовой кислоты. Последние достижения в производстве и ее бесконечные границы применения и рыночные тенденции» . Прикладная микробиология и биотехнология . 97 (10): 4277–87. дои : 10.1007/s00253-013-4840-y . ПМИД 23553030 . S2CID 17660413 .
- ^ Ролофф Джон К.; Кент Кеннет М.; Постич Майкл Дж.; Беккер Марк В.; Чепмен Харлан Х.; Келли Дафна Э.; Лью Уиллард; Луи Майкл С.; МакГи Лоуренс Р.; и др. (1998). «Практический тотальный синтез противогриппозного препарата GS-4104». Дж. Орг. хим. 63 (13): 4545–4550. дои : 10.1021/jo980330q .
- ^ Jump up to: а б Лаборда, Педро; Ван, Су-Янь; Фогльмейр, Йозеф (11 ноября 2016 г.). «Ингибиторы нейраминидазы гриппа: синтетические подходы, производные и биологическая активность» . Молекулы . 21 (11): 1513. doi : 10,3390/molecules21111513 . ПМК 6274581 . ПМИД 27845731 .
- ^ Jump up to: а б Хаяси, Юджиро; Гото, Хироаки; Хаяси, Такааки; Сёдзи, Мицуру (4 июля 2005 г.). «Силиловые эфиры дифенилпролинола как эффективные органоктализаторы асимметричной реакции Михаэля альдегидов и нитроалкенов». Angewandte Chemie, международное издание . 44 (27): 4212–4215. дои : 10.1002/anie.200500599 . ISSN 1521-3773 . ПМИД 15929151 .
- ^ Карпф, М; Труссарди, Р. (март 2001 г.). «Новая безазидная трансформация эпоксидов в 1,2-диаминосоединения: синтез противогриппозного ингибитора нейраминидазы осельтамивира фосфата (Тамифлю)». Дж. Орг. Хим . 66 (6): 2044–51. дои : 10.1021/jo005702l . ПМИД 11300898 . .
- ^ Биргит Бартельс; Роджер Хантер (1993). «Исследование селективности восстановления активированных кеталей борандиметилсульфидом». Дж. Орг. хим. 58 (24): 6756–6765. дои : 10.1021/jo00076a041 .
- ^ Юнг, Ин-Юнг; Хон, Сону; Кори, Э.Дж. (2006). «Короткий энантиоселективный путь синтеза противогриппозного ингибитора нейрамидазы осельтамивира из 1,3-бутадиена и акриловой кислоты». Дж. Ам. хим. Соц. 128 (19): 6310–6311. дои : 10.1021/ja0616433 . ПМИД 16683783 . S2CID 20852603 .
- ^ Фукута, Юхэй (2006). «Синтез Тамифлю De Novo посредством каталитического асимметричного раскрытия кольца мезо-азиридинов с TMSN 3». Журнал Американского химического общества . 128 (19): 6312–6313. дои : 10.1021/ja061696k . ПМИД 16683784 .
- ^ Мита, Цуёси (2007). «Каталитический асимметричный синтез тамифлю второго поколения: путь аллильного замещения». Органические письма . 9 (2): 259–262. дои : 10.1021/ol062663c . ПМИД 17217279 .
- ^ Сато, Нобухиро (2007). «Практический синтез (-)-осельтамивира» . Angewandte Chemie, международное издание . 46 (30): 5734–5736. дои : 10.1002/anie.200701754 . ПМИД 17594704 .
- ^ Трост, Барри М. (2008). «Краткий синтез (-)-осельтамивира». Angewandte Chemie, международное издание . 47 (20): 3759–3761. дои : 10.1002/anie.200800282 . ПМИД 18399551 .
- ^ Jump up to: а б с д Исикава, Хаято; Сузуки, Такаки; Хаяси, Юдзиро (2 февраля 2009 г.). «Высокопродуктивный синтез противогриппозного ингибитора нейрамидазы (-)-осельтамивира с помощью трех операций в одном горшке». Angewandte Chemie, международное издание . 48 (7): 1304–1307. дои : 10.1002/anie.200804883 . ISSN 1521-3773 . ПМИД 19123206 .