Хлоридный комплекс переходных металлов

В химии хлоридный комплекс переходного металла представляет собой координационный комплекс , состоящий из переходного металла , координированного с одним или несколькими хлоридными лигандами . Класс комплексов обширен. [1]
Склеивание
[ редактировать ]X-типа Галогениды — это лиганды в координационной химии . Они являются как σ-, так и π-донорами. Хлорид обычно встречается как в качестве концевого лиганда, так и в качестве мостикового лиганда . Галогенидные лиганды являются лигандами слабого поля . Из-за меньшей энергии расщепления кристаллического поля все гомолептические галогенидные комплексы первой переходной серии являются высокоспиновыми. Только [CrCl 6 ] 3− обменно инертен.
Известны гомолептические металлогалогенидные комплексы нескольких стехиометрий, но основными из них являются гексагалогенметаллаты и тетрагалогенметаллаты. Гексагалогениды имеют октаэдрическую координационную геометрию , тогда как тетрагалогениды обычно являются тетраэдрическими. Квадратные плоские тетрагалогениды известны для Pd(II), Pt(II) и Au(III). Примеры с 2- и 3-координацией являются общими для Au(I), Cu(I) и Ag(I).
Благодаря наличию заполненных p- π- орбиталей галогенидные лиганды переходных металлов способны усиливать π-основную связь с π-кислотой. Известно также, что они лабилизируют цис -лиганды. [2] [3]
Гомолептические комплексы
[ редактировать ]Гомолептические комплексы (комплексы только с хлоридными лигандами) часто являются обычными реагентами. Почти все примеры являются анионами .
1-й ряд
[ редактировать ]| Сложный | цвет | электронная конфигурация. | структура | геометрия | комментарии |
|---|---|---|---|---|---|
| ТиСl 4 | бесцветный | (т 2г ) 0 | четырехгранный | ||
| [ Ti2Cl9 9] − | белый/бесцветный | д 0 д 0 | биооктаэдр с общими гранями | Ti-Cl (конец) = 2,23 Å, 2,45 (конец) (Н(PCl 3 ) 2 ) + соль) [4] | |
| [ Ti2Cl9 9] 3- | апельсин | (т 2г ) 1 (т 2г ) 1 | биооктаэдр с общими гранями | Ти-Ти =3,22 Å Ti-C1(концевой) = 2,32-2,35 Å, Ti-Cl(мостик) = 2,42-2,55 Å ((NEt 4 + ) 3 ) 3 соли ) [5] | |
| [Ти 2 Cl 10 ] 2− | бесцветный | д 0 д 0 | 
|
биооктаэдрический | |
| [Ti 3 Cl 12 ] 3- | зеленый | (т 2г ) 1 (т 2г ) 1 (т 2г ) 1 | триоктаэдр с общими гранями | Ti-Ti = 3,19, 3,10 Å (терминал) Ti-C1(терминал) = 2,36 Å (терминал), Ti-Cl(мостик) = 2,50 Å ((ЧФ 4 + ) 3 ) 3 соли ) [6] | |
| [TiCl 6 ] 2− | желтый | д 0 | 
|
октаэдрический | ПКФ 4 + соль Ti-Cl = 2,33 Å [7] |
| ВКл 4 | красный | (т 2г ) 1 | четырехгранный | V1-Cl = 2,29 Å | |
| В 2 Кл 10 | фиолетовый | (т 2г ) 0 | 
|
биооктаэдр с общими ребрами | V1-Cl(мостиковое соединение) = 2,48 Å V1-Cl(терминал) = 2,16-2,21 Å [8] |
| [ВКл 6 ] 2- | красный | (т 2г ) 1 | 
|
октаэдрический | V1-Cl = 2,29 Å [9] |
| [CrCl 6 ] 3− | розовый [3] | (т 2г ) 3 | 
|
октаэдрический [10] [3] | |
| [Cr 2 Cl 9 ] 3− | красный | (д 3 ) 2 | биооктаэдр с общими гранями | Cr-Cl(конец) = 2,31 Å, 2,42 (конец) (Et 2 NH 2 + соль) [11] | |
| [MnCl 4 ] 2− [12] | бледно-розовый, пока | (например, г ) 2 (т 2г ) 3 | четырехгранный | Длина связи Mn-Cl = 2,3731-2,3830 Å. [13] | |
| [MnCl 6 ] 2− | темно-красный | (т 2г ) 3 (например, г ) 1 | 
|
октаэдрический | Расстояние Mn-Cl = 2,28 Å К + соль [14] ) соль изоструктурна K 2 PtCl 6 |
| [MnCl 6 ] 3− | коричневый [3] | (т 2г ) 3 (например, г ) 1 | 
|
октаэдрический [10] [3] | |
| [Mn 2 Cl 6 ] 2− | желто-зеленый | (например, г ) 2 (т 2г ) 3 | 
|
биттетраэдрический | Длина связи Mn-Cl (концевая) = 2,24 Å. Длина связи Mn-Cl (концевая) = 2,39 Å. [15] (ППН + ) 2 соли |
| [Mn 3 Cl 12 ] 6− | розовый | (т 2г ) 3 (например, г ) 2 | кофациальный триоктаэдр | Расстояние Mn-Cl = --- Å [(С(NH 2 ) 3 ] + 6 соль [16] | |
| [FeCl 4 ] 2− [12] | крем | (например, г ) 3 (т 2г ) 3 | тетраэдрический((Et 4 N + ) 2 соли) [12] | ||
| [FeCl 4 ] − | (например, г ) 2 (т 2г ) 3 | четырехгранный | Длина связи Fe-Cl = 2,19 Å [17] | ||
| [FeCl 6 ] 3− | апельсин | (т 2г ) 3 (например, г ) 2 | 
|
октаэдрический [3] | |
| [ Fe2Cl6 6] 2− | бледно-желтый | (например, г ) 2 (т 2г ) 3 | 
|
биттетраэдрический | Длина связи Fe-Cl (концевая) = 2,24 Å. Длина связи Fe-Cl (концевая) = 2,39 Å. [15] (ППН + ) 2 соли |
| [CoCl 4 ] 2− [12] | синий [12] | (например, г ) 4 (т 2г ) 3 | четырехгранный | ||
| [ Co2Cl6 6] 2− | синий [15] | (например, г ) 4 (т 2г ) 3 | 
|
биттетраэдрический | Длина связи Mn-Cl (концевая) = 2,24 Å. Длина связи Co-Cl (концевая) = 2,35 Å. [15] (ППН + ) 2 соли |
| [NiCl 4 ] 2− [12] | синий [12] | (например, г ) 4 (т 2г ) 4 | четырехгранный | Длина связи Ni-Cl = 2,28 Å. (Эт 4 Н + ) 2 соли [18] | |
| [Ни 3 Cl 12 ] 6− | апельсин [19] | (т 2г ) 6 (например, г ) 2 | конфациальный триоктаэдрический | ((Me 2 NH 2 + ) 2 ) 8 соли двойная соль с двумя Cl − Длина связи Ni-Cl = 2,36-2,38 Å. [19] | |
| [СuCl 4 ] 2− [12] | апельсин [20] желтый (сплющенный четырехгранник) [21] зеленый (плоский квадрат) [22] |
(т 2г ) 6 (например, г ) 3 | сплющенный тетраэдр или квадратный плоский [23] [24] |
Длина связи Cu-Cl = 2,24 Å. | |
| [Cu 2 Cl 6 ] 2− | красный | [(т 2г ) 6 (например, г ) 3 ] 2 | bis с общим краем (плоский квадрат) [25] | Cu-Cl(терминал) = 2,24 Å Cu-Cl(мостиковое соединение) = 2,31 Å | |
| [ZnCl 4 ] 2− | белый/бесцветный | д 10 | четырехгранный |
2-й ряд
[ редактировать ]Некоторые гомолептические комплексы переходных металлов второго ряда содержат связи металл-металл.
| Сложный | цвет | электронная конфигурация. | структура | геометрия | комментарии |
|---|---|---|---|---|---|
| [ZrCl 6 ] 2− | желтый | д 0 | 
|
октаэдрический | Расстояние Zr-Cl = 2460 Å (Я 4 Н + ) 2 соли [27] |
| [Zr 2 Cl 10 ] 2− | бесцветный | (д 0 ) 2 | 
|
биооктаэдрический с общими ребрами | Zr-Cl = 2,36 Å (концевой), 2,43 Å (мостиковый) Н(PCl 3 ) 2 ) + соль [4] |
| Нб 2 Кл 10 | желтый | (д 0 ) 2 | 
|
биооктаэдрический с общими ребрами [Nb 2 Cl 10 ] | 3,99 Å [28] |
| [NbCl 6 ] − | желтый | д 0 | 
|
октаэдрический | Nb-Cl = 2,34 Å Н(PCl 3 ) 2 ) + соль [4] |
| [Nb 6 Cl 18 ] 2− | черный | (д 2 ) 4 (д 3 ) 2 (14 кластерных электронов) | 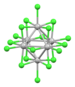
|
кластер Nb --- Nb связь | Nb-Cl = 2,92 Å (К + )2 соли [29] |
| МоСl 6 | черный | д 0 | 
|
октаэдр | Mo-Cl = 2,28 -2,31 Å [8] |
| [МоСl 6 ] 2− | желтый | (т 2г ) 2 | 
|
октаэдр | Mo-Cl = 2,37, 2,38, 2,27 Å [30] |
| [МоСl 6 ] 3− | розовый | (т 2г ) 3 | 
|
октаэдрический | |
| [Мо 2 Cl 8 ] 4− | фиолетовый [31] | 2(д 4 ) | 
|
Четверная связь Мо-Мо | |
| [ Mo2Cl9 9] 3− | 2(д 3 ) | биооктаэдрический с общими гранями | Длина (тройной) связи In-Mo = 2,65 Å. В Cl (концевая) длина связи = 2,38 Å. Длина связи Mo-Cl (мостиковая) = 2,49 Å. [32] [33] | ||
| Мо 2 Cl 10 | зеленый | (д 1 ) 2 | 
|
биооктаэдры с общими ребрами [34] | |
| [Мо 2 Cl 10 ] 2− | (д 2 ) 2 | 
|
биооктаэдры с общими ребрами [35] | ||
| [Мо 5 Cl 13 ] 2− | коричневый [31] | д 2 д 2 д 2 д 2 д 3 | 
|
неполный октаэдр [36] | |
| [Мо 6 Cl 14 ] 2− | желтый | д 4 | 
|
октаэдрический кластер | ( 4-ХОПyH + ) 2 соли [37] |
| [ТсСl 6 ] 2− | желтый | (т 2г ) 3 | 
|
октаэдр | Tc-Cl = 2,35 Å для As(C 6 H 5 ) 4 + соль [38] |
| [Тс 2 Cl 8 ] 2− | зеленый | (т 2г ) 4 | 
|
Четверная связь Tc-Tc | Tc-Tc = 2,16, Tc-Cl = 2,34 Å для NBu 4 + соль [39] |
| [РуСл 6 ] 2− | коричневый | (т 2г ) 4 | 
|
октаэдрический | (ЭтФФ 3 + ) 2 соли [40] |
| [ Ru2Cl9 9] 3− | красный | [(т 2г ) 5 ] 2 | кофациальный биооктаэдрический | Длина связи Ru-Ru = 2,71 Å; Ru-Cl(концевой) = 2,35 Å, Ru-Cl(мостиковый) = 2,36 Å ((Et 4 N) + ) 3 соли [41] | |
| [Ру 3 Кл 12 ] 4− | зеленый | (д 5 ) 2 (д 6 ) | кофациальный триоктаэдрический | Длина связи Ru-Ru = 2,86 Å. Длина связи Ru-Cl = 2,37-2,39 Å. (Эт 4 Н + ) 2 ( OH7O3 + ) 2 соли [42] | |
| [RhCl 6 ] 3− | красный | (т 2г ) 6 | 
|
октаэдрический | Ч 2 Н + (СН 2 СН 2 NH 3 + ) 2 соли) [43] |
| [Rh 2 Cl 9 ] 3− | красно-коричневый | (т 2г ) 6 | октаэдрический | Rh-Cl(терминал) = 2,30 Å, Rh-Cl(терминал) = 2,40 Å ((Me 3 CH 2 Ph) + ) 3 соли ) [32] | |
| [PdCl 4 ] 2− | коричневый | д 8 | плоский квадратный | ||
| [Pd 2 Cl 6 ] 2− [44] | красный ((Et 4 N + ) 2 соли) | д 8 | плоский квадратный | ||
| [Pd 3 Cl 8 ] 2− [45] | оранжево-коричневый ((Bu 4 N + ) 2 соли) | д 8 | плоский квадратный | ||
| [PdCl 6 ] 2− | коричневый | д 6 | 
|
октаэдрический | палладий(IV) |
| [Pd 6 Cl 12 ] | желто-коричневый | д 8 | 
|
плоский квадратный [46] | |
| [AgCl 2 ] − | белый/бесцветный | д 10 | линейный | соль [K(2.2.2-крипт)] + [47] | |
| [CdCl 4 ] 2− | белый/бесцветный | д 10 | четырехгранный | Эт 4 Н + соль, расстояние Cd-Cl составляет 2,43 Å. [26] | |
| [Cd 2 Cl 6 ] 2− | белый/бесцветный | д 10 | 
|
битетраэдр с общими ребрами | (С 6 Н 3 (4-С 5 Н 4 Н) 3 3+ соль [48] |
| [Cd 3 Cl 12 ] 6− | белый/бесцветный | д 10 | октаэдрический (центральный Cd) пентакоордината (терминал Cd) кофациальный триоктаэдрический |
(С 6 Н 3 (4-С 5 Н 4 Н) 3 3+ соль [48] (3,8-Диаммоний-6-фенилфенантридин 3+ ) 2 [49] | |
| [Cd 6 Cl 19 ] 7− | белый/бесцветный | д 10 | 
|
октаэдр из октаэдров | 4,4'-(C 6 H 3 (2-Et)NH 3 + ) 2 соли [50] |
3-й ряд
[ редактировать ]| Сложный | цвет | электронная конфигурация. | структура | геометрия | комментарии |
|---|---|---|---|---|---|
| [HfCl 6 ] 2− | белый | д 0 | 
|
октаэдрический | Расстояние Hf-Cl = 2,448 А ((Ме 4 Н + ) 2 соли) [27] |
| [Hf 2 Cl 10 ] 2− | бесцветный/белый | д 0 | 
|
биооктаэдрический с общими ребрами [51] | |
| [ Hf2Cl9 9] − | бесцветный/белый | (д 0 ) 2 | биооктаэдрический с общими гранями [52] | ||
| [ТаСl 5 ] | белый | д 0 | 
|
биооктаэдрический с общими ребрами | |
| [ТаСl 6 ] − | белый/бесцветный | д 0 | 
|
октаэдрический | Та-Cl = 2,34 Å (Н(PCl 3 ) 2 ) + соль) [4] |
| [Та 6 Кл 18 ] 2- | зеленый | д 0 | 
|
октаэдрический | Та-Та = 2,34 Å (ЧАС + 2 соли гексагидрат [53] |
| ВК 6 | синий | д 0 | 
|
октаэдрический | 2,24–2,26 Å [54] |
| [WCl 6 ] 2− | (т 2г ) 2 | 
|
октаэдрический | Расстояния W-Cl варьируются от 2,34 до 2,37 Å. (ППФ 4 + соль) [55] | |
| [WCl 6 ] − | (т 2г ) 1 | 
|
октаэдрический | Расстояние W-Cl = 2,32 Å (Эт 4 Н + соль) [56] | |
| В 2 кл 10 | черный [57] | (т 2г 1 ) 2 | 
|
биооктаэдрический | Расстояние WW = 3,814 Å [58] |
| [W 2 Cl 8 ] 4− | синий | 2(д 4 ) | 
|
Четверная облигация WW | dW-W = 2,259 Å [Na(tmeda) + ] 4 соли [59] |
| [W 2 Cl 9 ] 2− | д 3 д 2 | биооктаэдрический с общими гранями | Расстояние WW = 2,54 Å W-Cl(терминал) = 2,36 Å, W-Cl(мостик) = 2,45 Å ((ППН + ) 2 соли) [60] | ||
| [W 2 Cl 9 ] 3− | д 3 д 3 | октаэдрический | Расстояние W-Cl = 2,32 Å (Эт 4 Н + соль) [60] | ||
| [W 3 Cl 13 ] 3− | д 3 ,д 3 ,д 4 | 
|
[W 3 (μ 3 -Cl)(μ-Cl) 3 Cl 9 ] 3- | WW расстояния = 2,84 Å [61] | |
| [W 3 Cl 13 ] 2− | д 3 ,д 4 ,д 4 | 
|
[W 3 (μ 3 -Cl)(μ-Cl) 3 Cl 9 ] 2- [61] | Расстояния WW = 2,78 Å [61] | |
| [W 6 Cl 14 ] 2- | желтый [62] | (д 4 ) 6 | 
|
см. Mo 6 Cl 12 | |
| [ReCl 6 ] − | красно-коричневый | (т 2г ) 2 | 
|
октаэдрический | Расстояние Re-Cl = 2,24-2,31 Å (ППФ 4 + соль) [63] |
| [ReCl 6 ] | (т 2г ) 1 | 
|
октаэдрический | Расстояние Re-Cl = 226,3(6) Å [8] | |
| [ReCl 6 ] 2− | зеленый | (т 2г ) 3 | 
|
октаэдрический | Расстояние Re-Cl = 2,35-2,38 Å ((ППН + ) 2 соли) [64] |
| [Относительно 2 Cl 9 ] 2− | (т 2г ) 3 (т 2г ) 4 | биооктаэдрический с общими гранями | Расстояние Re-Re = 2,48 Å Расстояния Re-Cl = 2,42 Å (мостик), 2,33 Å (терминал) ((Et 4 N + ) 2 соли) [65] | ||
| [Относительно 2 Cl 9 ] − | ((т 2г ) 3 ) 2 | биооктаэдрический с общими гранями | Расстояние Re-Re = 2,70 Å Расстояния Re-Cl = 2,41 (мостик), 2,28 Å (терминал) (Бу 4 Н + соль) [65] | ||
| [OsCl 6 ] − | темно-зеленый | (т 2г ) 3 | 
|
октаэдрический | d Os-Cl = 2,30 Å для Et 4 N + [66] и Ф 4 П + [67] соли |
| [OsCl 6 ] 2− | желто-оранжевый | (т 2г ) 4 | 
|
октаэдрический [67] | Расстояние Os-Cl 2,33 Å |
| [Ос 2 Cl 8 ] 2− | зеленый | (д 5 ) 2 | 
|
квадратная антипризма | d Os-Os = 2,182 Å, d Os-Cl = 2,32 Å (Bu 4 N + ) 2 соли [68] |
| [Ос 2 Cl 10 ] 2− | зеленый | (д 4 ) 2 | 
|
октаэдрический | d Os-Cl(терминал) = 2,30 Å d Os-Cl(мостиковое соединение) = 2,42 Å (Et 4 N + ) 2 соли [66] |
| [IrCl 6 ] 3− | красный | (т 2г ) 6 | 
|
октаэдрический | Ir-Cl = 2,36 Å [69] |
| [IrCl 6 ] 2− | коричневый | (т 2г ) 5 | 
|
октаэдрический | Ir-Cl = 2,33 Å [70] |
| [Ир 2 Кл 9 ] 3− | - | ((т 2г ) 6 ) 2 | биоктаэдрический [71] | ||
| [PtCl 4 ] 2− | розовый | д 8 | плоский квадратный | ||
| [PtCl 6 ] 2− | желтый | д 6 | 
|
октаэдрический | Расстояние Pt-Cl = 2,32 Å Эт 4 Н + соль, ((Me 4 N + ) 2 соли) [27] |
| [Часть 2 Cl 9 ] − | красный (Bu 4 N + соль) | ((т 2г ) 6 ) 2 | октаэдрический | Pt-Cl t Pt-Cl и мостик = 2,25, 2,38 Å [72] | |
| [Часть 2 Кл 10 ] 2− | желто-коричневый (ППН + соль) | ((т 2г ) 6 ) 2 | 
|
биооктаэдрический с общими ребрами | Pt-Cl t и мостик Pt-Cl = 2,27, 2,37 Å [72] |
| [Часть 6 Кл 12 ] | желто-коричневый | (д 8 ) 6 | 
|
плоский квадратный | Pt-Cl = 2,31 [73] |
| [AuCl 2 ] − | белый/бесцветный | д 10 | линейный | Расстояния Au-Cl 2,28 Å NEt 4 + соль [74] | |
| Au 4 Cl 8 | черный | (д 10 ) 2 (д 8 ) 2 | 
|
линейный и квадратный плоский | редкий пример смешанной валентности, молекулярный хлорид [75] |
| [AuCl 4 ] − | желтый | д 8 | плоский квадратный | Расстояния Au-Cl 2,26 Å НБу 4 + соль [76] | |
| [HgCl 4 ] 2− | белый/бесцветный | д 10 | четырехгранный | Расстояние Hg-Cl составляет 2,46 Å. [26] Эт 4 Н + соль | |
| [Hg 2 Cl 6 ] 2− | белый/бесцветный | д 10 | 
|
битетраэдр с общими ребрами | Расстояние Hg-Cl составляет 2,46 Å. [77] Бу 4 Н + соль |
Гетеролептические комплексы
[ редактировать ]Гетеролептические комплексы, содержащие хлорид, многочисленны. Большинство гидратированных галогенидов металлов относятся к этому классу. Хлорид гексамминкобальта(III) и цисплатин ( цис -Pt(NH 3 ) 2 Cl 2 ) являются яркими примерами хлоридов металлов.
Гидраты
[ редактировать ]
Как указано в таблице ниже, многие гидраты хлоридов металлов представляют собой молекулярные комплексы. [78] [79] Эти соединения часто являются важными коммерческими источниками хлоридов переходных металлов. Некоторые гидратированные хлориды металлов не являются молекулярными и поэтому не включены в данную таблицу. Например, дигидраты хлорида марганца(II) , хлорида никеля(II) , хлорида меди(II) , хлорида железа(II) и хлорида кобальта(II) являются координационными полимерами .
| Формула гидратированные галогениды металлов |
Координация сфера из металла |
|---|---|
| TiCl 3 (H 2 O) 6 | транс- [TiCl 2 (H 2 O) 4 ] + [80] |
| VCl 3 (H 2 O) 6 | транс- [VCl 2 (H 2 O) 4 ] + [80] |
| CrCl 3 (H 2 O) 6 | транс- [CrCl 2 (H 2 O) 4 ] + |
| CrCl 3 (H 2 O) 6 | [CrCl(H 2 O) 5 ] 2+ |
| CrCl 2 (H 2 O) 4 | транс- [CrCl 2 (H 2 O) 4 ] |
| CrCl 3 (H 2 O) 6 | [Cr(H 2 O) 6 ] 3+ [81] |
| MnCl 2 (H 2 O) 6 | транс- [MnCl 2 (H 2 O) 4 ] |
| MnCl 2 (H 2 O) 4 | цис- [MnCl 2 (H 2 O) 4 ] [82] |
| FeCl 2 (H 2 O) 6 | транс- [FeCl 2 (H 2 O) 4 ] |
| FeCl 2 (H 2 O) 4 | транс- [FeCl 2 (H 2 O) 4 ] |
| FeCl 3 (H 2 O) 6 | один из четырех гидратов хлорида железа , [83] |
| FeCl 3 (H 2 O) 2,5 | цис- [FeCl 2 (H 2 O) 4 ] + [84] |
| CoCl 2 (H 2 O) 6 | транс- [CoCl 2 (H 2 O) 4 ] |
| CoCl 2 (H 2 O) 4 | цис- [CoCl 2 (H 2 O) 4 ] |
| NiCl 2 (H 2 O) 6 | транс- [NiCl 2 (H 2 O) 4 ] |
| NiCl 2 (H 2 O) 4 | цис- [NiCl 2 (H 2 O) 4 ] |
Аддукты
[ редактировать ]Хлориды металлов образуют аддукты с эфирами, образуя эфирные комплексы переходных металлов .
Ссылки
[ редактировать ]- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Дж. Ф. Хартвиг (2009). «4: Ковалентные лиганды (X-типа), связанные связями металл-гетероатом». Химия органопереходных металлов . Университетские научные книги. ISBN 978-1-891389-53-5 .
- ^ Jump up to: а б с д и ж Хэтфилд, Уильям Э.; Фэй, Роберт С.; Пфлюгер, CE; Пайпер, Т.С. (1963). «Гексахлорметаллаты трехвалентного хрома, марганца и железа». Журнал Американского химического общества . 85 (3): 265–269. дои : 10.1021/ja00886a003 .
- ^ Jump up to: а б с д Ривард, Эрик; Маквильямс, Эндрю Р.; Лох, Алан Дж.; Маннерс, Ян (2002). «Соли бис(трихлорфосфин)иминия, [Cl 3 P=N=PCl 3 ] + , с противоионами галогенидов переходных металлов» . Acta Crystallographica Раздел C. 58 ( 9): i114–i118. doi : 10.1107/S0108270102012532 . PMID 12205363 .
- ^ Кастро, Стефани Л.; Стрейб, Уильям Э.; Хаффманн, Джон К.; Кристу, Джордж (1996). «Смешанная валентность (Ti III Из IV ) Карбоксилатный комплекс: кристаллические структуры и свойства [Ti 2 OCl 3 (O 2 CPh) 2 (THF) 3 ] и [NEt 4 ]3[Ti 2 Cl 9 ]». Chemical Communications (18): 2177. doi : 10.1039. /CC9960002177 .
- ^ Чен, Линьфэн; Коттон, Ф. Альберт (1998). «Синтез, реакционная способность и рентгеновские структуры комплексов Ti (III) с общими гранями; новый трехъядерный ион, [Ti 3 Cl 12 ]3-». Многогранник . 17 (21): 3727–3734. дои : 10.1016/S0277-5387(98)00171-5 .
- ^ Чен, Линьфэн; Коттон, ФА (1998). «Частичный гидролиз хлоридов Ti(III) и Ti(IV) в присутствии [PPh 4 ]Cl». Неорганическая химия Acta . 267 (2): 271–279. дои : 10.1016/S0020-1693(97) 05766-6
- ^ Jump up to: а б с Тамадон, Фархад; Зеппельт, К. (2012). «Неуловимые галогениды VCl 5 , MoCl 6 и ReCl 6 ». Angewandte Chemie, международное издание . 52 (2): 767–769. дои : 10.1002/anie.201207552 . ПМИД 23172658 .
- ^ Хэйтон, Тревор В.; Патрик, Брайан О.; Легздиньш, Питер (2004). «Новые подробности о реакциях оксида азота с тетрахлоридом ванадия». Неорганическая химия . 43 (22): 7227–7233. дои : 10.1021/ic0491534 . ПМИД 15500362 .
- ^ Jump up to: а б O. S. Filipenko, D. D. Makitova, O. N. Krasochka, V. I. Ponomarev, L. O. Atovmyan (1987). Koord. Khim . 13 : 669.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Дайер, Филип В.; Гибсон, Вернон К.; Джеффри, Джон К. (1995). «Неожиданный синтез биядерной соли хрома (III), проявляющей NH. … Взаимодействия с водородными связями Cl». Polyhedron . 14 (20–21): 3095–3098. doi : 10.1016/0277-5387(95)00089-B .
- ^ Jump up to: а б с д и ж г час Гилл, Н.С.; Тейлор, ФБ (1967). Тетрагалокомплексы диположительных металлов первого переходного ряда . Неорганические синтезы . Том. 9. стр. 136–142. дои : 10.1002/9780470132401.ch37 . ISBN 978-0-470-13240-1 .
- ^ Чанг, Джуй-Ченг; Хо, Вэнь-Юэ; Солнце, И-Вэнь; Чжоу, Ю-Кай; Се, Синь-Сю; Ву, Ци-И (2011). «Синтез и свойства новых анионных солей тетрахлоркобальтата (II) и тетрахлорманганата (II) с дикатионными противоионами». Многогранник . 30 (3): 497–507. дои : 10.1016/j.poly.2010.11.009 .
- ^ Моьюс, ПК (1966). «Кристаллическая структура, видимые и ультрафиолетовые спектры гексахлорманганата калия (IV)». Неорганическая химия . 5 : 5–8. дои : 10.1021/ic50035a002 .
- ^ Jump up to: а б с д Вс, Джуй-Суй; Чжао, Ханьхуа; Оуян, Сян; Клерак, Родольф; Смит, Дженнифер А.; Клементе-Хуан, Хуан М.; Гомес-Гарсия, Карлос; Коронадо, Эухенио; Данбар, Ким Р. (1999). «Структура, магнитные свойства и исследования реакционной способности солей, содержащих биядерный анион [M2Cl6]2-(M = Mn, Fe, Co)». Неорганическая химия . 38 (25): 5841–5855. дои : 10.1021/ic990525w .
- ^ Сен, Абхиджит; Суэйн, Диптиканта; Гуру Роу, Таюр Н.; Сундаресан, А. (2019). «Беспрецедентный гистерезис 30 К переключаемых диэлектрических и магнитных свойств в ярком люминесцентном органо-неорганическом галогениде (CH 6 N 3 ) 2 MnCl 4 » (PDF) . Журнал химии материалов C. 7 (16): 4838–4845. дои : 10.1039/C9TC00663J . S2CID 141394650 .
- ^ Лутц, Мартин; Хуан, Юйсин; Море, Марк-Этьен; Кляйн Геббинк, Робертус Дж. М. (2014). «Фазовые переходы и двойниковые низкотемпературные структуры тетрахлороферрата (III) тетраэтиламмония». Acta Crystallographica Раздел C. 70 (5): 470–476. дои : 10.1107/S2053229614007955 . hdl : 1874/307900 . ПМИД 24816016 .
- ^ Стаки, Грузия; Фолкерс, Дж.Б.; Кистенмахер, Ти Джей (1967). «Кристаллическая и молекулярная структура тетрахлорникелата тетраэтиламмония (II)». Акта Кристаллографика . 23 (6): 1064–1070. дои : 10.1107/S0365110X67004268 .
- ^ Jump up to: а б Гердес, Эллисон; Бонд, Маркус Р. (2009). «Дихлорид октакиса (диметиламмония) гекса-μ2-хлоридо-гексахлоротриникелата (II): линейный комплекс триникеля с асимметричными мостиками». Acta Crystallographica Раздел C. 65 (10): м398–м400. дои : 10.1107/S0108270109036853 . ПМИД 19805875 .
- ^ Махуи, А.; Лапассе, Дж.; Морет, Дж.; Сен-Грегуар, П. (1996). «Тетраэтиламмоний Тетраметиламмоний Тетрахлоркупрат(II), [(C 2 H 5 ) 4 N] [(CH 3 ) 4 N] [CuCl 4 ]». Acta Crystallographica Раздел C. 52 (11): 2674–2676. дои : 10.1107/S0108270196009031 .
- ^ Гильермо Мингес Эспалларгас; Ли Браммер; Жакко ван де Стрик; Кеннет Шенкленд; Аластер Дж. Флоренс; Гарри Адамс (2006). «Обратимая экструзия и поглощение молекул HCl кристаллическими твердыми телами, включающая разрыв и образование координационных связей». Дж. Ам. хим. Соц. 128 (30): 9584–9585. дои : 10.1021/ja0625733 . ПМИД 16866484 .
- ^ Келли, А.; Налла, С.; Бонд, MR (2015). «От квадратно-плоского к сплюснутому тетраэдру CuX 4 2- ( X = Cl, Br) Структурный фазовый переход в солях 1,2,6-триметилпиридиния». Acta Crystallographica Раздел B. 71 ( Pt 1): 48–60. doi : 10.1107/S205252061402664X . PMID 25643715 .
- ^ Халкроу, Малкольм А. (2013). «Искажения Ян-Теллера в соединениях переходных металлов и их значение для функциональных молекулярных и неорганических материалов» (PDF) . Обзоры химического общества . 42 (4): 1784–1795. дои : 10.1039/C2CS35253B . ПМИД 22968285 .
- ^ Рейнен, Дирк (2014). «Новый подход к лечению вибронной связи под напряжением - вызванное деформацией усиление или подавление ян-теллеровских искажений в тетраэдрической меди». II Cl 4 -Комплексы и переход к октаэдрическим структурам». Обзоры координационной химии . 272 : 30–47. doi : 10.1016/j.ccr.2014.03.004 .
- ^ Уиллетт, Роджер Д.; Мясник, Роберт Э.; Ланди, Кристофер П.; Твэмли, Брендан (2006). «Обмен двух галогенидов в димерах галогенидов меди (II): (4,4'-бипиридиний) Cu 2 Cl 6-x BRX ». Многогранник . 25 (10): 2093–2100. дои : 10.1016/j.poly.2006.01.005 .
- ^ Jump up to: а б с Махуи, А.; Лапассе, Дж.; Морет, Дж.; Сен-Грегуар, П. (1996). «Бис(тетраэтиламмоний)тетрахлорметаллаты, [(C 2 H 5 ) 4 N] 2 [MCl 4 ], где M = Hg, Cd, Zn». Acta Crystallographica Раздел C. 52 (11): 2671–2674. дои : 10.1107/S010827019600666X .
- ^ Jump up to: а б с Аутильо, Матье; Уилсон, Ричард Э. (2017). «Фазовые переходы в соединениях гексахлорметаллата тетраметиламмония (ТМА) 2 MCl 6 (M = U, Np, Pt, Sn, Hf, Zr)» . Европейский журнал неорганической химии . 2017 (41): 4834–4839. дои : 10.1002/ejic.201700764 .
- ^ Коттон, Ф.А., П.А. Кибала, М. Матуш и РБВ Сандор (1991). «Структура второго полиморфа пентахлорида ниобия». Акта Кристаллогр. С. 47 (11): 2435–2437. дои : 10.1107/S0108270191000239 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Саймон, Арндт; фон Шнеринг, Ханс-Георг; Шефер, Харальд (1968). «Вклад в химию элементов ниобия и тантала. LXIX K 4 Nb 6 Cl 18 представление, свойства и структура». Журнал неорганической и общей химии . 361 (5–6): 235–248. дои : 10.1002/zaac.19683610503 .
- ^ Рабе, Сюзанна; Бубенхайм, Вильфрид; Мюллер, Ульрих (2004). «Кристаллические структуры ацетонитрильных сольватов бис(тетрафенилфосфоний)тетрахлороксованадата(IV), гексахлорстанната(IV) и -молибдата(IV), [P(C 6 H 5 ) 4 ]2[VOCl 4 ] · 4CH 3 CN, [P( C 6 H 5 ) 4 ]2[MCl 6 ]·4CH 3 CN (M = Sn, Mo)" . Журнал кристаллографии - Новые кристаллические структуры . 219 (2): 101–105. дои : 10.1524/ncrs.2004.219.2.101 . S2CID 201122319 .
- ^ Jump up to: а б Бриньоль, AB; Коттон, ФА; Дори, З. (1972). «Соединения рения и молибдена, содержащие четверные связи». Неорг. Синтез. 13 : 81–89. дои : 10.1002/9780470132449.ch15 . ISBN 978-0-470-13244-9 .
- ^ Jump up to: а б Коттон, ФА; Уко, Дэвид А. (1972). «Структура нонахлордиродата (III) триметилфениламмония и обзор взаимодействий металл-металл в конфациальных биооктаэдрах». Неорганика Химика Акта . 6 : 161–172. дои : 10.1016/S0020-1693(00)91778-X .
- ^ РЭД Вентворт, Р. Саиллант, Р.Б. Джексон, В.Е. Стрейб, К. Фолтинг (1971). «Кристаллические структуры Cs 3 Cr 2 Br 9 , Cs 3 Mo 2 Cl 9 и Cs 3 Mo 2 Br 9 ». Неорг. Хим . 10 (7): 1453–1457. дои : 10.1021/ic50101a027 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бек, Дж.; Вольф, Ф. (1997). «Три новые полиморфные формы пентахлорида молибдена» . Акта Кристаллогр . Б53 (6): 895–903. дои : 10.1107/S0108768197008331 . S2CID 95489209 .
- ^ Привет, Э.; Веллер, Ф.; Денике, К. (1984). «Синтез и кристаллическая структура ( ) 2 [ Mo2Cl10 ] » PPh4 . Журнал неорганической и общей химии . 508 : 86–92. дои : 10.1002/zaac.19845080113 .
- ^ Ахмед, Эджаз; Рак, Майкл (2011). «Химия полиядерных комплексов переходных металлов в ионных жидкостях» . Транзакции Далтона . 40 (37): 9347–57. дои : 10.1039/c1dt10829h . ПМИД 21743925 .
- ^ Кей Инумару, Такаши Кикудоме, Хироши Фукуока, Сёдзи Яманака (2008). «Обратимое возникновение самоорганизующейся слоистой структуры из трехмерного изотропного ионного кристалла кластерного соединения (4-HNC 5 H 4 OH) 2 Mo 6 Cl 14 под действием поглощения воды и спиртов». Дж. Ам. хим. Соц. 130 (31): 10038–10039. дои : 10.1021/ja802752y . ПМИД 18613684 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Балдас, Дж.; Бонниман, Дж.; Сэмюэлс, Д.Л.; Уильямс, Джорджия (1984). «Структурные исследования комплексов технеция. VII. Структура гексахлортехнетата(IV) тетрафениларсония, [As(C 6 H 5 ) 4 ]2[TcCl 6 ]». Acta Crystallographica Раздел C. Связь с кристаллической структурой . 40 (8): 1343–1346. дои : 10.1107/S0108270184007903 .
- ^ Пуано, Фредерик; Джонстон, Эрик В.; Форстер, Пол М.; Ма, Лунзоу; Саттельбергер, Альфред П.; Червински, Кеннет Р. (2012). «Исследование наличия множественных связей металл-металл в хлоридах технеция с помощью рентгеновской абсорбционной спектроскопии: значение для синтетической химии». Неорганическая химия . 51 (17): 9563–9570. дои : 10.1021/ic3014859 . ПМИД 22906536 .
- ^ Шарутин В.В.; Шарутина, ОК; Сенчурин В.С.; Андреев П.В. (2018). «Синтез и строение рутениевых комплексов [ к.ф.
3 PR ]+2[ RuCl
6 ]2− (R = C
22Ч
5 , СН= СНСН
3 , СН
2 СН = СНСН
3 , СН
2 ОЧ
3 ) и [ Фл.
3 ПЧ
2CH 2ЧЧЧ
2 часа в час
3 ]2+2[ Ру
2 кл.
10 O ]4− · 4H2O». Российский журнал неорганической химии . 63 (9): 1178–1185. doi : 10.1134/S0036023618090188 . S2CID 105746627 . - ^ I. A. Efimenko, T. A. Balakaeva, A. P. Kurbakova, A. S. Kanishcheva, A. V. Chuvaev, V. M. Stepanovich, Yu. N. Mikhailov (1992). Zh. Neorg. Khim. (Russ. J. Inorg. Chem.) . 37 : 1312.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бино, Ави; Коттон, Ф. Альберт (1980). «Линейный трехъядерный хлоркомплекс рутения со смешанной валентностью [Ru 3 Cl 12 ] 4- ". Журнал Американского химического общества . 102 (2): 608–611. doi : 10.1021/ja00522a027 .
- ^ Фрэнк, Уолтер; Рейсс, Гвидо Дж.; Кляйнвехтер, Инго (1996). «Специальные гексахлорметаллаты алкиламмония. I. Кристаллизация и кристаллическая структура гексахлорородата диэтилентриаммония, [H 3 N(CH 2 ) 2 NH 2 (CH 2 ) 2 NH 3 ] [RhCl 6 ]». Журнал неорганической и общей химии . 622 (4): 729–733. дои : 10.1002/zaac.19966220428 .
- ^ Блэк, Саймон; Стреле, Иоахим; Вайссер, Ульрика (2002). «Синтез и строение комплексов [(n-Bu) 4 N] 2 [{(THF)Cl 4 Re≡N} 2 PdCl 2 ], [Ph 4 P]2[(THF)Cl 4 Re≡N-Pd Cl (μ-Cl)] 2 [(n-Bu) ] 2 [ Pd3Cl8 ] и 4N ». Журнал неорганической и общей химии . 628 (11): 2495–2499. doi : 10.1002/1521-3749(200211)628:11<2495::AID-ZAAC2495>3.0.CO;2-G .
- ^ Фабри, Ян; Душек, Михал; Фейфарова, Карла; Крупкова, Радмила; Ванек, Пржемысл; Герман, Иван (2004). «Две фазы бис (тетраэтиламмония) ди-мю-хлор-бис [дихлорпалладия (II)]». Acta Crystallographica Раздел C. Связь с кристаллической структурой . 60 (9): м426–м430. дои : 10.1107/S0108270104016725 . ПМИД 15345822 .
- ^ Делл'Амико, Даниэла Белли; Кальдераццо, Фаусто; Маркетти, Фабио; Рамелло, Стефано (1996). «Молекулярная структура [Pd 6 Cl 12 ] в монокристаллах, химически выращенных при комнатной температуре». Angewandte Chemie International Edition на английском языке . 35 (12): 1331–1333. дои : 10.1002/anie.199613311 .
- ^ Хельгессон, Геран; Ягнер, Сьюзен (1991). «Галогеноаргентат (I) с необычной координационной геометрией. Синтез и структура калийных солей хлор-, бром- и йодоаргентатов (I), включая первый пример двухкоординированного хлораргентата (I) в твердом состоянии». Неорганическая химия . 30 (11): 2574–2577. дои : 10.1021/ic00011a024 .
- ^ Jump up to: а б , Цзюньцзюй, Юньлун (2019) Го, Чунью ; Хао, Пэнфэй ; Шен . 6− Кластеры и протонированные трипиридил-триазины». Dalton Transactions . 48 (44): 16497–16501. : 10.1039 /C9DT03494C . PMID 31559400. . S2CID 203568412 doi
- ^ Костин-Хоган, Кристина Э.; Чен, Чун-Лонг; Хьюз, Эмма; Пикетт, Остин; Валенсия, Ричард; Рат, Нигам П.; Битти, Алисия М. (2008). « «Обратная» инженерия: к 0-D кластерам галогенида кадмия». CrystEngComm . 10 (12): 1910. doi : 10.1039/b812504j .
- ^ Чен, Чун-Лонг; Битти, Алисия М. (2007). «От кристаллической инженерии к кластерной инженерии: как преобразовать хлорид кадмия из 2D в 0D». Химические коммуникации (1): 76–78. дои : 10.1039/B613761J . ПМИД 17279266 .
- ^ Ноймюллер, Бернхард; Денике, Курт (2004). ( ) 2 [ HfCl6 ] 2CH2Cl2 и CH2Cl2 Ph4P ( Hf2Cl10 ) 2 [ » « структуры ] Кристаллические . Ph4P Журнал неорганической и общей химии . 630 (15): 2576–2578. дои : 10.1002/zaac.200400370 .
- ^ Дёттерль, Матиас; Хаас, Изабель; Альт, Хельмут Г. (2011). «Поведение растворимости TiCl 4 , ZrCl 4 и HfCl 4 в хлоралюминатных ионных жидкостях». Журнал неорганической и общей химии . 637 (11): 1502–1506. дои : 10.1002/zaac.201100244 .
- ^ Джейкобсон, Роберт А.; Такстон, Чарльз Б. (1971). «Кристаллическая структура H2[Ta6Cl18].6H2O». Неорганическая химия . 10 (7): 1460–1463. дои : 10.1021/ic50101a029 .
- ^ Джей Си Тейлор; П.В. Уилсон (1974). «Структура гексахлорида β-вольфрама по данным порошковых нейтронов и дифракции рентгеновских лучей» . Акта Кристаллографика . Б30 (5): 1216–1220. дои : 10.1107/S0567740874004572 .
- ^ Лау, К.; Дитрих, А.; Плейт, М.; Диркс, П.; Ноймюллер, Б.; Вокадло, С.; Масса, В.; Хармс, К.; Денике, К. (2003). «Кристаллические структуры гексахлорметаллатов NH 4 [SbCl 6 ], NH 4 [WCl 6 ], [K(18-краун-6)(CH 2 Cl 2 )] 2 [WCl 6 ]·6CH 2 Cl 2 и (PPh 4 ) 2 [WCl 6 ]·4CH 3 CN». Журнал неорганической и общей химии . 629 (3): 473–478. дои : 10.1002/zaac.200390078 .
- ^ Эйхлер, В.; Зайферт, Х.-Й. (1977). «Структурные и магнитные исследования гексахлорвольфраматов(V)». Журнал неорганической и общей химии . 431 : 123–133. дои : 10.1002/zaac.19774310112 .
- ^ Макканн, III, EL; Браун, ТМ (1972). Хлорид вольфрама(V) . Неорганические синтезы. Том. XIII. стр. 150–154. дои : 10.1002/9780470132449.ch29 .
- ^ Коттон, ФА; Райс, CE (1978). «Пентахлорид вольфрама». Акта Кристаллогр . Б34 (9): 2833–2834. дои : 10.1107/S0567740878009322 .
- ^ Коттон, Ф. Альберт; Мотт, Грэм Н.; Шрок, Ричард Р.; Стерджофф, Линда Г. (1982). «Получение и характеристика соединения, содержащего ион октахлордивольфрамата (четверная связь вольфрам-вольфрам), [W 2 Cl 8 ] 4- ". Журнал Американского химического общества . 104 (24): 6781–6782. doi : 10.1021/ja00388a050 .
- ^ Jump up to: а б Коттон, Ф. Альберт; Фалвелло, Ларри Р.; Мотт, Грэм Н.; Шрок, Ричард Р.; Стерджофф, Линда Г. (1983). «Структурная характеристика иона нонахлордивольфрама (II, III)». Неорганическая химия . 22 (18): 2621–2623. дои : 10.1021/ic00160a031 .
- ^ Jump up to: а б с Колесниченко Владимир; Люси, Джеффри Дж.; Свенсон, Дейл К.; Мессерль, Луи (1998). «W3(μ3-Cl)(μ-Cl)3Cl9n-(n = 2, 3), дискретные моношапочные кластеры тривольфрама, полученные из нового бинарного хлорида вольфрама, W3Cl10: влияние количества электронов на связь в изоструктурных треугольных M 3 X 131 кластерах » ". Журнал Американского химического общества . 120 (50): 13260–13261. дои : 10.1021/ja9831958 .
- ^ Колесниченко Владимир; Мессерль, Луи (1998). «Легкое восстановление галогенидов вольфрама нетрадиционными мягкими восстановителями. 2. Четыре удобных высокопроизводительных твердотельных синтеза кластера додекахлорида гексавольфрама W 6 Cl 12 и кластерной кислоты (H 3 O) 2 [W 6 (μ 3 -Cl ) ) 8 Cl 6 ](OH 2 ) x , включая новые тройные пути с участием катионов». Неорганическая химия . 37 (15): 3660–3663. дои : 10.1021/ic980232n . ПМИД 11670462 .
- ^ Арп, О.; Притц, В. (1994). «Представление, колебательные спектры и нормальный координатный анализ гексахлоррената (V) и кристаллической структуры [P(C 6 H 5 ) 4 ] [ReCl 6 ]». Журнал неорганической и общей химии . 620 (8): 1391–1396. дои : 10.1002/zaac.19946200811 .
- ^ Чау, Китай-Северная Каролина; Уордл, RWM; Иберс, Дж. А. (1988). «Структура ди[бис(трифенилфосфин)иминия] гексахлоррената (IV)». Acta Crystallographica Раздел C. 44 (4): 751–753. дои : 10.1107/S0108270187011910 .
- ^ Jump up to: а б Хит, Грэм А.; МакГрэйди, Джон Э.; Раптис, Рафаэль Г.; Уиллис, Энтони К. (1996). «Валентно-зависимая связь металл-металл и оптические спектры в конфациальном биооктаэдре [Re 2 Cl 9 ] С- (з= 1, 2, 3). Кристаллографическая и расчетная характеристика [Re 2 Cl 9 ] − и [Re 2 Cl 9 ] 2- ". Неорганическая химия . 35 (23): 6838–6843. doi : 10.1021/ic951604k . PMID 11666851 .
- ^ Jump up to: а б Кребс, Б.; Хенкель, Г.; Дартманн, М.; Притц, В.; Брунс, М. (1984). и строения [(C2H5 4N Os2Cl10 ] ) [ OsCl6 nC4H9 ( » « Реакции ) 4N ] 2 [ и [ ] ] . З. Натуралист . 39 (7): 843. doi : 10.1515/znb-1984-0701 . S2CID 95254820 .
- ^ Jump up to: а б Ким, Юнис Э.; Эрикс, Клаас; Магнусон, Рой (1984). «Кристаллические структуры тетрафенилфосфониевых солей гексахлоросмата (V) и гексахлоросмата (IV), [(C 6 H 5 ) 4 P] OsCl 6 и [(C 6 H 5 ) 4 P] 2 OsCl 6 ». Неорганическая химия . 23 (4): 393–397. дои : 10.1021/ic00172a003 .
- ^ Агаскар, Прадьот А.; Коттон, Ф. Альберт; Данбар, Ким Р.; Фалвелло, Ларри Р.; Тетрик, Стивен М.; Уолтон, Ричард А. (1986). «Множественно связанные анионы октагалодиосмата (III). 2. Структура и связь». Журнал Американского химического общества . 108 (16): 4850–4855. дои : 10.1021/ja00276a024 .
- ^ Рэнкин, Д.А.; Пенфолд, BR; Фергюссон, Дж. Э. (1983). «Хлор- и бромкомплексы иридия(III) и иридия(IV). II. Структурная химия иридия. III Комплексы». Австралийский химический журнал . 36 (5): 871. doi : 10.1071/CH9830871 .
- ^ Санчис-Перучо, Адриан; Мартинес-Лилло, Хосе (2019). «Ферромагнитное обменное взаимодействие в новой цепи Ir(IV)–Cu(II) на основе аниона гексахлориридата(IV)». Транзакции Далтона . 48 (37): 13925–13930. дои : 10.1039/C9DT02884F . ПМИД 31411207 . S2CID 199574461 .
- ^ Йеллолис, Л.; Эллиот, М.; Парсонс, С.; Мессенджер, Д. «МАСНЯ». Кембриджская кристаллографическая база данных CCDC 278284 .
- ^ Jump up to: а б Белли Делл'Амико, Даниэла; Кальдераццо, Фаусто; Маркетти, Фабио; Рамелло, Стефано; Самаритани, Симона (2008). «Простые препараты Pd6Cl12, Pt6Cl12 и Qn[Pt2Cl8+n],n= 1, 2 (Q = TBA+, PPN+) и структурная характеристика [TBA] [Pt 2 Cl 9 ] и [PPN] 2 [Pt 2 Cl 10 ]·С 7 Н 8 ". Неорганическая химия . 47 (3): 1237–1242. дои : 10.1021/ic701932u . ПМИД 18166044 .
- ^ фон Шнеринг, Ганс Георг; Чанг, Джен Хуэй; Петерс, Карл; Петерс, Ева-Мария; Вагнер, Фрэнк Р.; Гринь, Юрий; Тиле, Герхард (2003). «Структура и связь гексамерного дихлорида платины (II), Pt 6 Cl 12 (β-PtCl 2 )». Журнал неорганической и общей химии . 629 (3): 516–522. дои : 10.1002/zaac.200390084 .
- ^ Хельгессон, Йоран; Ягнер, Сьюзен; Вичентини, Дж.; Роделлас, К.; Ниинистё, Л. (1987). «Кристаллические структуры дихлораурата тетраэтиламмония (I) и дииоддоаурата тетраэтиламмония (I)» . Acta Chemica Scandinavica . 41а : 556–561. doi : 10.3891/acta.chem.scand.41a-0556 .
- ^ Делл'Амико, Даниэла Белли; Кальдераццо, Фаусто; Маркетти, Фабио; Мерлино, Стефано; Перего, Джованни (1977). «Рентгеновская кристаллическая и молекулярная структура Au 4 Cl 8 , продукта восстановления Au 2 Cl 6 Au(CO)Cl». Журнал Химического общества, Химические коммуникации (1): 31. doi : 10.1039/C39770000031 .
- ^ Бакли, Робби В.; Хили, Питер С.; Лафлин, Венди А. (1997). «Восстановление [NBu 4 ] [AuCl 4 ] до [NBu 4 ] [AuCl 2 ] ацетилацетонатом натрия». Австралийский химический журнал . 50 (7): 775. дои : 10.1071/C97029 .
- ^ Гоггин, Питер Л.; Кинг, Пол; Макьюэн, Дэвид М.; Тейлор, Грэм Э.; Вудворд, Питер; Сандстрем, Магнус (1982). «Колебательные спектроскопические исследования тригалогеномеркуратов тетра-н-бутиламмония; кристаллические структуры [NBu] н 4 ](HgCl 3 ) и [NBu н 4 (HgI 3 )». Журнал Химического общества, Dalton Transactions (5): 875–882. doi : 10.1039/dt9820000875 .
- ^ Вайзуми, К.; Масуда, Х.; Отаки, Х. (1992). FeBr2 NiCl2 · 4H2O 4H2O CoBr2 , 4H2O · . · « Рентгеноструктурные 4H2O и исследования CuBr2 · , / цис транс-селективность в тетрагидрате дигалогенида (II)». Неорганическая химия Acta . 192 : 173–181. дои : 10.1016/S0020-1693(00) 80756-2
- ^ Моросин, Б. (1967). «Рентгеноструктурное исследование дигидрата хлорида никеля (II)». Акта Кристаллографика . 23 (4): 630–634. дои : 10.1107/S0365110X67003305 .
- ^ Jump up to: а б Донован, Уильям Ф.; Смит, Питер В. (1975). «Кристаллическая и молекулярная структура комплексов аквагалогенованадия(III). Часть I. Рентгеноструктурная структура дигидрата транс -тетракисаквадибромванадия(III) бромида и изоморфного хлорсоединения». Журнал Химического общества, Dalton Transactions (10): 894. doi : 10.1039/DT9750000894 .
- ^ Андресс, КР; Карпентер, К. «Кристаллические гидраты. II. Структура хлорида хрома и гексагидрата хлорида алюминия» Журнал кристаллографии, геометрии кристаллов, физики кристаллов, химии кристаллов, 1934, том 87, стр. 446-стр. 463.
- ^ Залкин, Аллан; Форрестер, доктор юридических наук; Темплтон, Дэвид Х. (1964). «Кристаллическая структура тетрагидрата дихлорида марганца» . Неорганическая химия . 3 (4): 529–33. дои : 10.1021/ic50014a017 .
- ^ Линд, доктор медицины (1967). «Кристаллическая структура гексагидрата хлорида железа» . Журнал химической физики . 47 (3): 990–993. Бибкод : 1967ЖЧФ..47..990Л . дои : 10.1063/1.1712067 .
- ^ Саймон А. Коттон (2018). «Хлорид железа (III) и его координационная химия». Журнал координационной химии . 71 (21): 3415–3443. дои : 10.1080/00958972.2018.1519188 . S2CID 105925459 .