Хлороплатиновая кислота
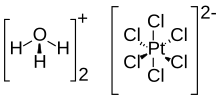 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гексахлорплатинат дигидрония (2–) | |
| Другие имена Гексахлорплатиновая кислота Гексахлороплатинат(IV) гидроксония | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.037.267 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 2507 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| H 6 Cl 6 Pt | |
| Молярная масса | 409.81 g/mol |
| Появление | Красновато-коричневое твердое вещество |
| Плотность | 2,431 г/см 3 |
| Температура плавления | 60 ° С (140 ° F; 333 К) |
| Точка кипения | разлагается |
| хорошо растворимый | |
| Структура | |
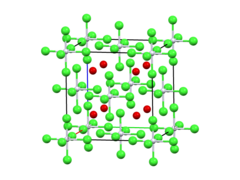
| Антифлюорит. | |
| октаэдрический | |
| 0 Д | |
| Опасности | |
| СГС Маркировка : | |
    | |
| Опасность | |
| Х301 , Х314 , Х317 , Х334 | |
| P260 , P261 , P264 , P270 , P272 , P280 , P285 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P304+P341 , P305+ П351+П338 , П310 , П321 , П330 , П333+П313 , П342+П311 , П363 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Другие анионы | Гексахлорпалладовая кислота |
Другие катионы | гексахлорплатинат калия , гексахлороплатинат аммония , гексахлорплатинат рубидия, Гексахлорплатинат цезия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Платинохлористоводородная кислота (также известная как платинохлористоводородная кислота ) представляет собой неорганическое соединение с формулой [H 3 O] 2 [PtCl 6 ](H 2 O) x (0 ≤ x ≤ 6). Красное твердое вещество является важным коммерческим источником платины , обычно в виде водного раствора. Хотя его часто записывают сокращенно как H 2 PtCl 6 , на самом деле это гидроксоний (H 3 O + ) соль гексахлорплатинат-аниона ( PtCl 2−
6 ). [1] [2] [3] Гексахлорплатиновая кислота очень гигроскопична .
Производство
[ редактировать ]
Гексахлорплатиновую кислоту можно получить различными методами. Самый распространенный из этих методов предполагает растворение платины в царской водке . Другие методы включают воздействие на водную суспензию частиц платины газообразного хлора или электролиз.
Считается, что при производстве царской водки гексахлорплатиновая кислота образуется по следующему уравнению: [4] [5]
Полученный оранжево-красный раствор можно выпарить с получением коричневато-красных кристаллов. Некоторые авторы предполагают, что платинохлористоводородная кислота, полученная этим методом, загрязнена гексахлорплатинатом нитрозония. В новой литературе указывается, что это не так и что после удаления азотной кислоты образцы, приготовленные этим методом, не содержат обнаруживаемого азота.
Были исследованы и описаны альтернативные методы, часто мотивированные предотвращением загрязнения азотом. [6]
Реакции
[ редактировать ]Платинохлористоводородная кислота при нагревании разлагается до хлорида платины(IV) . [1]
Приложения
[ редактировать ]Определение калия
[ редактировать ]Хлороплатиновая кислота была популяризирована для количественного анализа калия. Калий избирательно осаждается из раствора в виде гексахлорплатината калия. Определения проводили в 85%-ных (по объему) спиртовых растворах с избытком платинат-ионов, выпавший продукт взвешивали. Калий можно обнаружить в разбавленных растворах от 0,02 до 0,2% (масс./об.). [7]
Этот метод определения калия имел преимущества по сравнению с применявшимся ранее методом кобальтинитрита натрия , поскольку требовал однократной реакции осаждения . [7] Гравиметрический анализ осажденных продуктов был вытеснен современными инструментальными методами анализа, такими как ионоселективные электроды , пламенная фотометрия , ИСП-АЭС или ИСП-МС .
Очистка платины
[ редактировать ]При обработке солью аммония, такой как хлорид аммония , платинохлористоводородная кислота превращается в гексахлорплатинат аммония , который выпадает в осадок в виде твердого вещества. [4] При нагревании в атмосфере водорода соль аммония превращается в элементарную платину. С помощью этого метода платину часто выделяют из руд или перерабатывают из остатков. [8]
Катализ
[ редактировать ]Как и многие соединения платины, платинохлористоводородная кислота является катализатором (или предкатализатором) гидрирования и связанных с ним реакций. Как впервые сообщили Джон Спейер и его коллеги из Dow Corning , он катализирует присоединение гидросиланов к олефинам, т.е. гидросилилирование . В ранних демонстрационных реакциях использовались изопропанольные растворы трихлорсилана (SiHCl 3 ) с пентенами . Предыдущие работы по присоединению силанов к алкенам требовали радикальных реакций, которые были неэффективны. [9] [10] Так же, как и катализатор Карстедта , широкое применение для гидросилилирования находит катализатор Шпейера, основным недостатком которого являются свойства разжижения катализатора. [11]
Принято считать, что платинохлористоводородная кислота является предшественником реального катализатора. возможная роль коллоидной платины или нуль-валентных комплексов. Также рассматривалась [12]
Родственные соединения
[ редактировать ]хлороплатиновая кислота, полученная из царской водки, Предполагается, что содержит гексахлорплатинат нитрозония (NO) 2 PtCl 6 . Гексахлорплатинат нитрозония получают реакцией нитрозилхлорида ( NOCl) и металлической платины. [13] Было обнаружено, что гексахлорплатинат нитрозония бурно реагирует с водой и соляной кислотой, что делает маловероятным загрязнение платинохлористоводородной кислоты, приготовленной на царской водке, гексахлорплатинатом нитрозония. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Швейцер, А.Е.; Керр, GT (1978). «Термическое разложение гексахлорплатиновой кислоты». Неорг. хим. 17 (8): 2326–2327. дои : 10.1021/ic50186a067 .
- ^ Холлеман; Виберг (2001). Неорганическая химия (Первое изд.). Нью-Йорк: Академическая пресса. ISBN 0-12-352651-5 .
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (второе изд.). Нью-Йорк: Эльзевир Баттерворт-Хайнеманн. ISBN 978-0-7506-3365-9 .
- ^ Перейти обратно: а б Кауфман, Джордж Б. (1967). «Гексахлорплатинат (IV) аммония». Неорганические синтезы . Неорганические синтезы . Том. 9. стр. 182–185. дои : 10.1002/9780470132401.ch51 . ISBN 9780470132401 .
- ^ Грубе, Х. (1963). «Гексахлорплатиновая(IV) кислота». В Брауэр, Г. (ред.). Справочник по препаративной неорганической химии . Том. 2 (2-е изд.). Нью-Йорк: Академическая пресса. п. 1569.
- ^ Рудник, Пол; Кук, Р.Д. (1917). «Получение платинохлористоводородной кислоты перекисью водорода» . Дж. Ам. хим. Соц. 39 (4): 633–635. дои : 10.1021/ja02249a011 .
- ^ Перейти обратно: а б Смит, Г. Фредерик; Гринг, Дж.Л. (1933). «Разделение и определение щелочных металлов с использованием хлорной кислоты. V. Хлорная кислота и платинохлористоводородная кислота при определении небольших количеств калия в присутствии больших количеств натрия». Дж. Ам. хим. Соц. 55 (10): 3957–3961. дои : 10.1021/ja01337a007 .
- ^ Коттон, ЮАР (1997). Химия драгоценных металлов . Лондон: Чепмен и Холл. ISBN 0-7514-0413-6 .
- ^ Шпейер, Дж.Л.; Вебстер, Дж.А.; Барнс, GH (1957). «Присоединение гидридов кремния к двойным олефиновым связям. Часть II. Использование катализаторов на основе металлов VIII группы». Дж. Ам. хим. Соц. 79 (4): 974–979. дои : 10.1021/ja01561a054 .
- ^ Саам, Джон К.; Спейер, Джон Л. (1958). «Присоединение гидридов кремния к двойным олефиновым связям. Часть III. Присоединение к неконцевым олефинам в присутствии хлороплатиновой кислоты». Дж. Ам. хим. Соц. 80 (15): 4104–4106. дои : 10.1021/ja01548a073 .
- ^ Сиби, Мукунд П. (2001). «Гексахлорплатинат(IV) водорода». Энциклопедия реагентов для органического синтеза . Джон Уайли и сыновья. дои : 10.1002/047084289X.rh038 . ISBN 0471936235 .
- ^ Льюис, Л.Н.; Сы, КГ; Брайант, ГЛ; Донахью, ЧП (1991). «Платинокатализируемое гидросилилирование алкинов». Металлоорганические соединения . 10 (10): 3750–3759. дои : 10.1021/om00056a055 .
- ^ Моравек, RT; Кауфман, Великобритания; Махмуд, Т. (1967). Нитрозилгексахлорплатинат(IV) . Неорганические синтезы . Том. 9. С. 217–220. дои : 10.1002/9780470132555.ch63 . ISBN 9780470132555 .
